树突状细胞来源外泌体通过NF-κB通路影响内皮细胞致促炎因子的变化*
何洋,安天志,李成,周石,谢坪,段庆红**
(1.贵州医科大学 影像学院,贵州 贵阳 550004;2.四川省人民医院 介入科,四川 成都 610000)
动脉粥样硬化斑块属于血管炎性疾病的一种,主要原因是脂质聚集、免疫细胞浸润、或者纤维帽形成导致动脉管壁增厚。[1],亦认为树突状细胞(dendritic cells,DCs)也存在于血管壁炎性病灶中、并促进动脉粥样硬化斑块形成[2-3]。外泌体(Exosome)是一种极微小的囊泡结构,它的直径只有30~150 nm,并且能由机体内大多数细胞分泌,已知的膜蛋白、脂类、RNA以及DNA等在细胞生理活动过程中均可分泌外泌体[4-5]。研究表明成熟的DCs分泌的外泌体能促进血管内皮细胞的炎症反应,单核细胞来源的外泌体作为DCs的前体,可诱导细胞因子和黏附分子的分泌及表达[6]。综上所述,DCs可分泌外泌体和其它细胞沟通,例如通过外泌体调节血管内皮细胞、从而影响动脉粥样硬化疾病的进展。核转录因子Kappa B(nuclear factor kappa B,NF-κB)是蛋白质中的一种重要的转录调节因子,通过刺激因子的激活诱导各种基因的表达、并分泌多种细胞因子来参与调节机体的炎症反应[7]。研究表明动脉粥样硬化和纤维斑块中NF-κB的活性升高,但无动脉粥样硬化的病变血管内NF-κB几乎不表达[8-9]。因此,本研究从小鼠中分离骨髓DCs并培养获得外泌体,用分离得到的外泌体处理细胞,使用ELISA、PCR及Western blot方法检测相关蛋白的表达情况及外泌体的摄取,探讨DCs来源的外泌体对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的作用和机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 均选于健康雄性8周龄的C57BL/6J小鼠,体质量范围在22~24 g,由贵州医科大学动物实验中心提供,于无菌、恒温及明暗交替的清洁级环境中适应性喂养7 d,术前禁食12 h,实验获得医院动物伦理委员会批准(1900921)。
1.1.2实验试剂 实验试剂 75%乙醇及三氯甲烷(重庆源邦医药有限公司,中国),牛血清白蛋白及胎牛血清(FBS)、RPMI1640、RIPA裂解液、双抗、HBSS/PBS缓冲液(Gibco公司,美国),无菌EDTA抗凝采血管、96孔培养板(BD公司,美国)、Tris-base、Glycine、30%Acr-Bis(29 ∶1)、APS、TEMED、蛋白酶抑制剂、磷酸酶抑制剂、Phalloidin、DAPI(Sigma公司,美国),蛋白浓度检测试剂盒(上海碧云天,中国),Anti-β-actin、Anti-p-p100、p105(CST公司,美国),Anti-CD63、Anti-TSG101(Santa Curz公司,美国),肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素-6(interleukin,IL-6)的ELISA试剂盒(R &D Systems,美国),慢病毒转染质粒psPAX2、pMD2.G(Addgene公司,美国),CD63-GFP慢病毒载体(广州锐博,中国)。
1.2 研究方法
1.2.1骨髓树突状细胞(bone marrow dendritic cells,BMDCs)分离与培养 C57BL/6J小鼠颈椎脱臼处死,从骨关节处剪断并分离大、小腿骨,生理盐水清洁洗净分离好的腿骨、置于冰上,并转移到生物安全柜内操作;将腿骨两端剪断,用1640培养基冲洗骨髓,收集液体后以1 000 r/min离心5 min,弃去上清液,用含GM-CSF等因子的RPMI 1640+30%AG8653细胞培养液重悬沉淀细胞,加红细胞裂解液裂解2 min,再离心后弃去细胞上清溶液,重新悬浮细胞后行细胞计数,以5×106/皿将细胞铺于细胞培养皿、培育箱中培育,观察细胞生长的情况;BMDCs为半贴壁细胞,待培育后第7天,用枪吹下细胞并收取待后续实验用。
1.2.2BMDCs外泌体分离提取和鉴定 收集BMDCs细胞,放入离心机内,以1 000 r/min 条件离心10 min,取上清液;再用6 000 r/min 离心10 min后,取上清液,后15 000 r/min离心70 min后取得沉淀,添加PBS重悬,再15 000 r/min离心70 min后的沉淀便是外泌体;然后再次添加少量PBS重悬,于-80 ℃冰箱中保存。在外泌体内添加RIPA裂解液,通过WB操作步骤观察标志物CD63和TSG101的表达情况;将外泌体在PBS中重悬,瞬时离心后,取50 μL涂在碳涂层网格中,滤纸吸干过量的液体,用0.75%的甲酸铀酰染色30 s,最后再用电子显微镜数字化的扫描网格来观察外泌体。
1.2.3CD63-GFP慢病毒质粒构建和转染 培养皿中以2×106/皿将293T细胞铺满,第2天时等到细胞生长密度达到80%时便开始质粒转染。转染体系为:EP管1中加入psPAX27.5 g、pMD2.G 2.5 g+180lpti-MEM、CD63-GFP质粒10 g;EP管2中加入Fugene 660l+740l Opti-MEM。将BMDCs铺在用高聚赖氨酸(PDL)包被的培养皿中,加细胞3×106/皿中置于-80 ℃度冰箱中冷藏,第2天取出病毒液并溶化,在2 mL病毒液中加入polybrene(8 g/L)3 μL和RPMI1640完全培养基1 mL,将病毒液加入到有BMDCs细胞的培养皿中,置于37 ℃培育箱中培养12 h后丢弃病毒液、再于10 mL完全培养基中培养,48 h后,加入嘌呤霉素筛选;于倒置荧光显微镜下检测GFP阳性细胞的比例,等待细胞筛选结果平稳后留待后续实验。
1.2.4BMDCs与HUVEC共培养 取transwell小室及配套的6孔板,以1×106/孔将HUVEC细胞铺于孔板内,以1×106/孔将BMDCs细胞铺于小室内(图1)。分别标注单纯HUVEC培养组(Ⅰ组)、BMDC+HUVEC共培养组(Ⅱ组)和BMDC(加外泌体抑制剂GW4869)+HUVEC共培养组(Ⅲ组)。
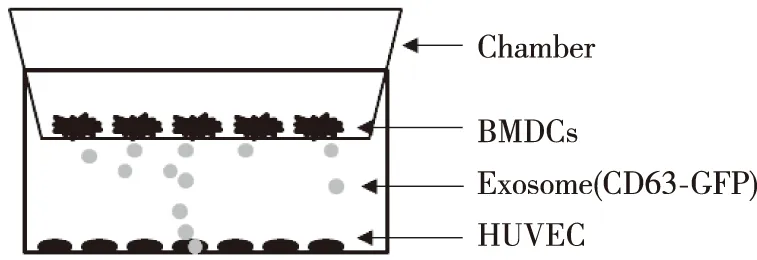
图1 BMDCs与HUVEC共培养Fig.1 Indication of co-culture BMDCs and HUVEC
1.2.5细胞免疫荧光检测外泌体分布 HUVEC细胞与BMDCs细胞共培养48 h,移除transwell小室、弃掉培养基、PBS清洗、固定,每孔加入0.05% TritonX 孵育15 min破膜、清洗,2% BSA 2 mL封闭1 h,滴加稀释的phalloidin 80 μL于石蜡纸上,盖上湿盒盖子室温孵育30 min,清洗、DAPI染色1 min,清洗、盖玻片滴加约80 μL防荧光猝灭保护液,中性树胶固定,风干后在共聚焦显微镜下观察并拍照。
1.2.6p105和p100的蛋白表达 收集DCs细胞消化后的细胞沉淀,用RIPA裂解,4 ℃、12 000 r/min离心10 min后,取上清液于-80 ℃冰箱中保存,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS- PAGE)将蛋白质分离,转移到PVDF膜上,加入相应抗体4 ℃孵育24 h、TBST洗膜3次、辣根过氧化物酶(HRP)二抗室温孵育1 h,用增强型化学发光试剂盒处理 PVDF 膜,QualityOne 软件进行分析。
1.2.7检测TNF-α、IL-6的mRNA表达 采用QIAGEN的RNA提取试剂盒,用去离子水50μL将RNA溶解,15 ℃水浴10 min,紫外分光光度计测定RNA的纯度后,将RNA反转录为cDNA。qRT-PCR反应条件:95 ℃、2 min进行预反应,95 ℃变性,扩增40个循环,60 ℃退火、延伸。引物序列见表1,比较循环阈值(Ct)法计算基因相对表达量ΔCt=(Ct mRNA-Ct mRNA对照)和倍数变化。

表1 内参、IL-6及TNF-α引物序列Tab.1 Internal reference,IL-6,and TNF-α primer sequence
1.2.8检测TNF-α和IL-6表达 根据试剂盒说明书,使用酶联免疫吸附剂(ELISA)试剂盒测定样品的TNF-α、IL-6蛋白表达,根据相应样品的OD值和标准曲线计算样品实验浓度。
1.3 统计学分析
2 结果
2.1 BMDCs外泌体的鉴定
外泌体在电镜下显示为圆形或类圆形结构、直径约100 nm(图2A),WB检测示外泌体标志物CD63和TSG101为阳性(图2B),表明使用梯度离心法分离得到的为外泌体。
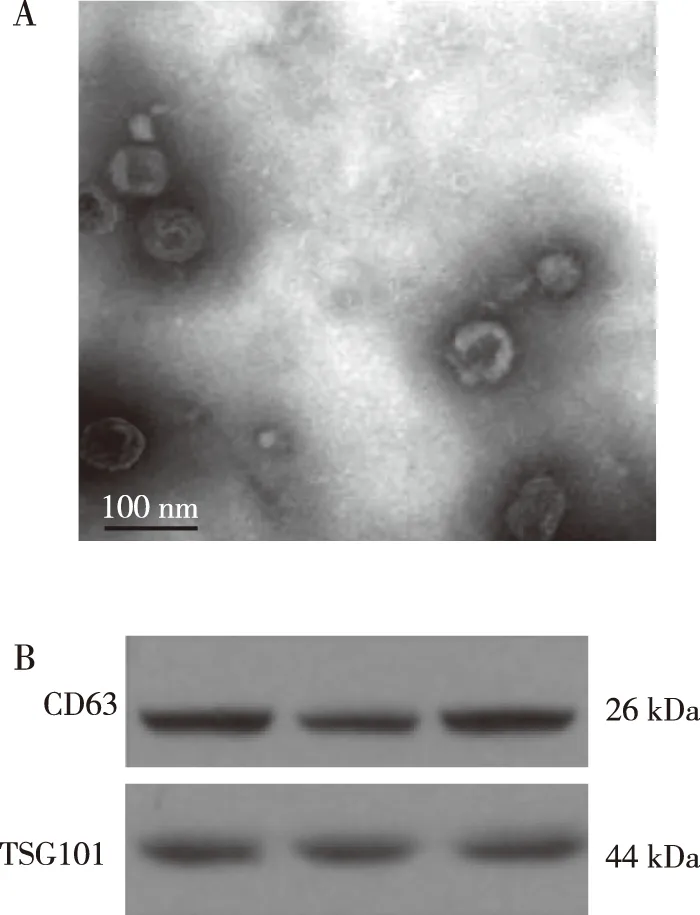
注:A图为透视电镜下观察外泌体,B图Western blot检测CD63和TSG101表达。图2 BMDCs的外泌体形态及标志蛋白表达(200×)Fig.2 Identification of exosomes and marker protein expression of BMDCs(200×)
2.2 BMDCs的外泌体被HUVEC摄取
Ⅰ、Ⅱ、Ⅲ组分别培养48 h后于免疫荧光染色下检测相关抗原,激光扫描共聚焦显微镜下观察可见:在Ⅱ组中,HUVEC可以摄取来自于BMDC的外泌体,但增加外泌体抑制剂GW4869之后,被摄取的外泌体数量减少,结果说明来源于BMDC的外泌体能被HUVEC摄取。见图3。

注:白色箭头指BMDC的外泌体被HUVEC摄取。图3 BMDC来源的外泌体被HUVEC摄取Fig.3 BMDC-derived exosomes absorbed by HUVEC
2.3 BMDCs外泌体对HUVEC炎症因子 TNF-α和IL-6的影响
比较LPS诱导的成熟BMDCs(mBMDCs)和未成熟的BMDCs(imBMDCs)细胞培养上清液中的表达情况,结果表明其中TNF-α和IL-6的表达无统计学差异。(图4A)。共培养实验表明,BMDC+HUVEC共培养组中HUVEC培养上清液内的IL-6和TNF-α的表达水平均升高,而BMDC(加外泌体抑制剂GW4869)+HUVEC共培养组中IL-6和TNF-α表达下降(图4B)。从BMDCs直接分离获得的外泌体处理HUVEC模型实验显示,外泌体处理组HUVEC细胞培养上清液中TNF-α和IL-6浓度和Contorl组相比明显升高(图4C)。

注:(1)与HUVEC组比较,P<0.05;(2)与H+imB或H+mB组比较,P<0.05;(3)与Contorl组比较,P<0.05。图4 BMDCs外泌体对HUVEC细胞炎症因子 TNF-α和IL-6的影响Fig.4 BMDCs exosomes promote HUVEC inflammatory response
2.4 BMDCs外泌体激活HUVEC内NF-κB信号通路
HUVEC与BMDCs共培养组实验证明,p105和p100的磷酸化水平在共培养组中比单纯HUVEC组更高,且成熟BMDCs共培养组中升高更明显,但HUVEC中p105和p100的磷酸化水平在用外泌体抑制剂GW4869处理BMDCs后有明显下降(图5A、B);直接用从BMDC分离获取的外泌体处理HUVEC后,显示其p105和p100的磷酸化水平均升高,抑制剂处理的结果同样升高(图5C、D)。
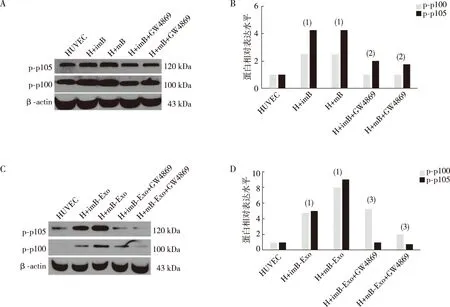
注: A、C图为Western blot实验结果,B、D图为蛋白表达直条图;(1)与HUVEC组比较,P<0.05;(2)与H+imB或H+mB组比较,P<0.05;(3)与H+imB-Exo或H+mB-Exo比较,P<0.05。图5 BMDCs外泌体对p105和p100的磷酸化水平的影响Fig.5 BMDCs exosomes activate phosphorylation of p105 and p100
2.5 HUVEC摄取BMDCs外泌体对炎症因子 TNF-α和IL-6的影响
为了再次验证以上结论,用NF-κB通路抑制剂BAY11-7082将HUVEC中NF-κB通路抑制,表明与单纯的外泌体处理组比较,外泌体+抑制剂组中p105和p100的磷酸化水平降低(图6A、B),且HUVEC细胞中TNF-α和IL-6的表达也降低(图6C、D),提示来源于BMDCs的外泌体可能通过NF-κB通路增加炎症因子TNF-α和IL-6的表达。
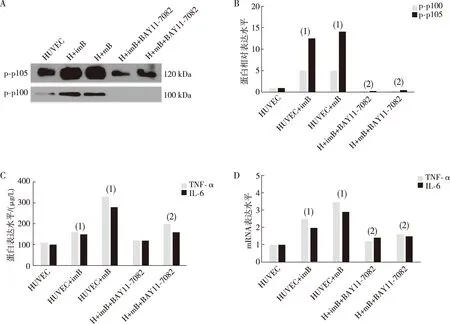
注:A图为Western blot验结果,B、C图为蛋白表达直条图,D图为mRNA表达直条图;(1)与HUVEC组比较,P<0.05;(2)与HUVEC+imB或HUVEC+mB比较,P<0.05。图6 BMDCs外泌体被HUVEC摄取并通过NF-κB通路促炎症应答Fig.6 BMDCs exosomes wereabsorbed by HUVEC and promote inflammatory response via the NF-κB signal pathway
3 讨论
DCs在动脉粥样硬化过程调节中有着重要的作用,一般考虑有以下几点因素:(1)在小鼠被基因敲除CX3CR1、CCR2、CCR5等因子后,其动脉粥样硬化被抑制;(2)DC对胆固醇稳态的影响;(3)DC迁移的小分子和涉及抗原提呈因子被删除后也会抑制动脉粥样硬化[10-11]。由于DCs在动脉粥样硬化过程中有着重要的影响作用,为了更深入讨论DC在动脉粥样硬化疾病过程中的影响机理,本研究通过观察DC来源的外泌体被HUVEC摄取并影响内皮细胞的生理过程,从C57BL/6J小鼠中分离并扩大培养骨髓巨噬细胞,后将巨噬细胞中基因转入CD63-GFP质粒中并示踪外泌体,最后将HUVEC细胞与巨噬细胞共培养,结果表明HUVEC可以摄取来自于巨噬细胞分泌的外泌体,由于外泌体是极微小的囊泡结构并能被机体内大多数细胞分泌,其内有许多如DNA、RNA和蛋白等成分[4-5],HUVEC摄取来源于巨噬细胞的外泌体后,外泌体中的成分也会进入HUVEC细胞中,并对HUVEC细胞内的生理过程产生影响。
有研究表明使用经LPS诱导过的单核细胞处理HUVEC,CCL2和ICAM-1表达会升高,表明人单核细胞外泌体可能会经NF-κB通路和内皮细胞中Toll样受体干扰内皮功能[12]。本研究发现BMDC分泌的外泌体能够被HUVEC摄取,并通过共培养模型和直接分离提取BMDC的外泌体处理HUVEC细胞的实验表明,共培养模型和外泌体处理模型中HUVEC细胞中p105和p100的磷酸化水平均上升,即NF-κB通路激活。
近些研究发现NF-κB的激活可分为两个相互独立的部分,一是由微生物或促炎因子(如IL-1、TNF-α)等诱导的具有RelA、cRel-的复合体激活[13],亦或是具有BAFF、RANKL、TNFSF3、CD40L、等诱导的RelB/P52复合体激活[14]。NF-κB的激活对关节炎、动脉粥样硬化、慢性肺阻塞性疾病、哮喘、炎症性肠炎等在内的多种炎性疾病有调节作用;所以NF-κB通路也被广泛认可为以上疾病的潜在治疗靶点[15-16]。非经典的NF-κB通路有IKKα诱导激活p100磷酸化升高的特点[17];广泛的IBs家族也包括p50的前体形式p105,和p52的前体p100[18]。本研究发现来源于BMDC的外泌体可以促进p100和p105的磷酸化水平,即NF-κB通路非经典途径的激活,为了探讨该途径在内皮细胞中炎症反应的激活与应答影响,本研究还测定了在内皮细胞中TNF-α和IL-6的表达和分泌,发现内皮细胞中的NF-κB通路经非经典途径激活后,促炎因子IL-6和TNF-α的表达和分泌水平均升高,表明NF-κB通路非经典途径激活对炎症有促进作用。为了更深入讨论NF-κB通路的激活对促炎因子IL-6和TNF-α的影响,本研究在共培养的基础上添加抑制剂来抑制内皮细胞中NF-κB通路的激活,发现与无抑制剂组相比较,内皮细胞中p100和p105的磷酸化水平降低,同时,IL-6和TNF-α的表达和分泌也均有降低,这也更加表明HUVEC细胞摄取BMDC的外泌体来激活NF-κB通路并影响致炎因子IL-6和TNF-α的释放,即提高了炎症反应。
综上所述,本研究通过体外实验研究发现BMDCs来源外泌体可以通过激活内皮细胞NF-κB信号通路增加促炎因子的表达和分泌,提示DCs可能通过外泌体参与动脉粥样硬化疾病,有待体内实验研究进一步证实。

