糖通饮含药血清对高糖环境下HBZY-1细胞增殖的影响及其作用机制*
伏红颖,潘艳伶,陈俞如,陈洪民
(1.贵州医科大学 临床医学院 中医学教研室,贵州 贵阳 550000;2.贵州医科大学附属医院 中医科,贵州 贵阳 550000)
糖尿病(diabetic mellitus,DM)是一种以高血糖为特征的慢性代谢性疾病[1]。根据国际糖尿病联盟发布的第9版《IDF全球糖尿病概览》显示,预计到2045年,中国糖尿病患者数量将达到1.164亿人[2]。糖尿病肾病(diabetic kidney disease,DKD)患者最主要的病理改变之一是肾纤维化[3-4]。肾小球系膜细胞是肾小球的固有细胞之一,其增殖是导致DKD肾纤维化的重要因素[5]。近年来,有研究发现,转化生长因子-β1(transforming growth factor-beta1,TGF-β1)/Smad信号通路被公认为在DKD的肾纤维化进程中起着重要作用,DKD发生发展时,TGF-β1/Smad信号通路被过度激活,进而引起肾小球系膜细胞增殖,细胞外基质(extracelluar matrix,ECM)的合成降解失衡,促进肾脏纤维化[6-8]。在TGF-β1/Smad信号通路中,TGF-β1被认为是肾小球硬化和肾小管间质纤维化机制中最关键的细胞因子,Smad2和Smad3则是促进TGF-β1介导组织纤维化的两个主要下游调节因子[9-11],因此,研究寻找抑制肾小球系膜细胞增殖以及TGF-β1/Smad信号通路过度激活的有效药物,对DKD的防治具有重要意义。本课题组前期动物及临床实验研究发现,临床经验方糖通饮可抑制DKD大鼠肾组织TGF-β1/Smad 信号通路的激活;改善早期DKD患者尿微量白蛋白、空腹血糖、血脂及糖化血红蛋白,从而达到预防肾纤维化、延缓DKD发展为终末期肾病的效果[12-13]。本研究拟观察在高糖环境下,糖通饮含药血清对大鼠肾小球系膜细胞(HBZY-1)增殖和TGF-β1/Smad信号通路的影响,探寻糖通饮体外细胞层面的分子作用机制,完善糖通饮防治DKD的作用机制,为糖通饮的临床使用提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物及细胞 30只SPF级SD雄性大鼠,体质量(180±20) g,购自辽宁长生生物技术股份有限公司,动物生产许可证号SCXK(辽)2020-0001;大鼠肾小球系膜细胞株HBZY-1,购自深圳Otwo Biotech公司。
1.1.2药物 糖通饮颗粒剂,由广东一方制药有限公司提供,规格21 g/袋,组成药物为生地、山药、山茱萸、茯苓、泽泻、丹皮、黄芪、丹参、地骨皮、草决明。药材质量标准:生地(TS-QM-C094)、山药(TS-QM-C347)、山茱萸(TS-QM-C350)、茯苓(TS-QM-C117)、泽泻(TS-QM-C460)、丹皮(TS-QM-C-275)、黄芪(TS-QM-0179)、丹参(TS-QM-C085)、地骨皮(TS-QM-C093)、草决明(TS-QM-C215)。
1.1.3试剂 胰酶细胞消化液、DMEM正常糖培养基、Opti-MEM Reduced Serum Medium由GIBCO公司提供,青链霉素双抗由HyClone公司提供,Western blot一抗稀释液、RIPA裂解液、脱脂奶粉由Solarbio公司提供,特级胎牛血清(南美)由BI公司提供,RNA提取用Trizol购自thermo公司,细胞RNA提取试剂盒、cDNA逆转录试剂盒购自上海翊圣生物科技有限公司,PVDF膜和Whatman滤纸购自Millipore公司,GAPDH抗体购自proteintech公司,TGF-β1一抗、Smad3一抗、Smad2一抗购自abcam公司,Phospho-Smad2一抗、Phospho-Smad3一抗均购自Cell Signaling Technology公司,山羊抗兔IgG-HRP二抗购自proteintech公司。
1.2 研究方法
1.2.1细胞的传代和培养 大鼠肾小球系膜HBZY-1细胞鉴定后,选取第3~15代细胞培养在含有10%FBS的DMEM正常糖培养基中,置于37 ℃、5%CO2的培养箱,待细胞融合度达80%~90%时吸去瓶内培养基,PBS洗涤细胞3次,吸除废液,用0.1%胰蛋白酶(1 mL)消化收集细胞1 min,10%培养基2 mL终止消化反应,用移液枪轻轻吹打细胞悬液,混匀后吸入新的培养瓶,置于37 ℃、5%CO2的细胞培养箱中常规培养。
1.2.2含药血清的制备 30只SPF级雄性SD大鼠,随机分为空白对照组和糖通饮含药血清组,每组15只;灌胃前将糖通饮颗粒剂按1 g/L的生药浓度充分溶于双蒸水中,以12.4 g/(kg·d)灌胃糖通饮含药血清组大鼠(按照人体-大鼠体表面积比值换算),空白对照组给予等体积的双蒸水,连续给药7 d。末次给药1 h后,经股动脉取血,血样静置2 h,4 ℃,3 000 r/min离心20 min,分离血清,60 ℃水浴30 min灭活补体,过滤除菌,-80 ℃冻存。
1.2.3含大鼠血清的DMEM培养基配制 以高糖+10%糖通饮含药血清组培养基(30 mmol/L葡萄糖,50 mL)配制方法为例:称取 0.220 7 g葡萄糖充分溶于 正常糖培养液45 mL 中,在超净工作台用过滤器过滤后,加入糖通饮含药血清5 mL,颠倒混匀后分装入5 mL离心管中,充分混匀后于-20 ℃或4 ℃储存。
1.2.4实验分组 收集到的大鼠肾小球系膜HBZY-1细胞共分为正常糖+空白血清组(5.5 mmol/L葡萄糖+10%空白对照组大鼠血清)、高糖+空白血清组(30 mmol/L葡萄糖+10%空白对照组大鼠血清)以及高糖+糖通饮含药血清组(30mmol/L葡萄糖+10%糖通饮含药血清组大鼠血清)[14],共3组。
1.2.5糖通饮含药血清干预 选取第3~15代大鼠肾小球系膜HBZY-1细胞,以2×105个/孔的密度接种于6孔板内,每孔细胞悬液2 mL,待细胞贴壁后,将培养基换成含有相应大鼠血清的DMEM培养基。
1.2.6CCK-8法检测细胞的增殖情况 系膜细胞以3×104/mL接种于96孔板中,每孔体积100 μL,细胞贴壁后将培养基换成含有相应大鼠血清的培养基,将培养板置于37 ℃、5%CO2的培养箱中培养48 h后,每孔加入0.5%的CCK-8溶液10 μL,继续培养4 h后,在摇床上温柔的摇匀,用酶标仪检测各孔在波长450 nm处吸光值,每组同时设置调零孔和对照孔。计算细胞增殖率,细胞增殖率=[(实验组吸光值-空白组吸光值)/(对照组吸光值-空白组吸光值)]×100%。
1.2.7实时荧光定量PCR法检测TGF-β1、Smad2、Smad3的mRNA表达 收集培养的各组细胞,按Trizol说明书提取细胞总RNA,根据上海翊圣公司反转录试剂盒操作说明书将RNA逆转录为cDNA,按荧光定量PCR试剂盒检测TGF-β1、Smad2、Smad3 mRNA表达,以GAPDH作为内参,引物见表1,2-ΔΔCT计算各组基因相对表达量,进行统计分析。

表1 引物序列及目的片段大小Tab.1 Primer sequence and target fragment size
1.2.8Western blot法检测TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3蛋白表达 将培养结束的六孔板拿出,吸去培养基,用含PMSF的裂解液提取上清液,BCA蛋白定量分析;4 ∶1加蛋白上样缓冲液,100 ℃变性10 min。SDS-PAGE蛋白凝胶电泳:制胶、上样、电泳、PVDF转膜,5%脱脂牛奶室温封闭2 h,一抗TGF-β1、Smad2、p-Smad2、Smad3、p-Smad3 4 ℃孵育过夜;二抗常温下孵育1 h,超敏发光液显色,凝胶成像分析系统检测蛋白条带,软件ImageJ计算灰度值。
1.3 统计学分析
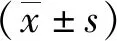
2 结果
2.1 HBZY-1细胞的增殖情况
与正常糖+空白血清组相比,高糖+空白血清组大鼠肾小球系膜HBZY-1细胞增殖率升高,差异有统计学意义(P<0.05);与高糖+空白血清组相比较,高糖+糖通饮含药血清组细胞增殖率降低,差异具有统计学意义(P<0.05)。见图1。
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图1 各组HBZY-1细胞的增殖情况(n=3)Fig.1 Proliferation of HBZY-1 cells in each group(n=3)
2.2 HBZY-1细胞TGF-β1 mRNA表达
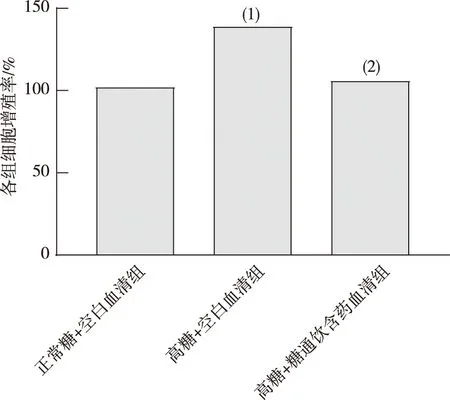
与正常糖+空白血清组相比,高糖+空白血清组TGF-β1 mRNA表达增多,差异具有统计学意义(P<0.05);与高糖+空白血清组相比,高糖+糖通饮含药血清组细胞TGF-β1 mRNA表达减少,差异具有统计学意义(P<0.05)。见图2。
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图2 各组HBZY-1细胞TGF-β1 mRNA表达(n=3)Fig.2 Expression of TGF-β1 mRNA in HBZY-1 cells in each group(n=3)
2.3 HBZY-1细胞Smad2 mRNA表达
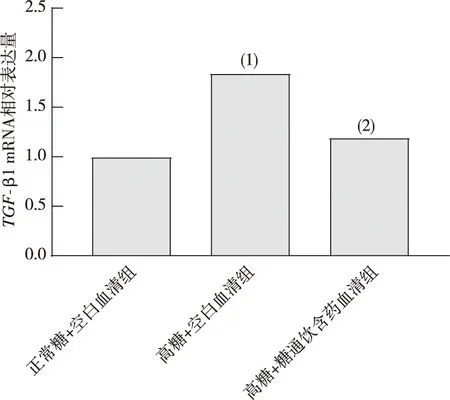
与正常糖+空白血清组相比,高糖+空白血清组Smad2 mRNA表达增多,差异具有统计学意义(P<0.05);与高糖+空白血清组相比,高糖+糖通饮含药血清组细胞Smad2 mRNA表达减少,差异具有统计学意义(P<0.05)。见图3。
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图3 各组HBZY-1细胞Smad2 mRNA表达(n=3)Fig.3 Expression of Smad2 mRNA in HBZY-1 cells in each group(n=3)
2.4 HBZY-1细胞Smad3 mRNA表达
与正常糖+空白血清组相比,高糖+空白血清组Smad3 mRNA表达增多,差异具有统计学意义(P<0.05);与高糖+空白血清组相比,高糖+糖通饮含药血清组细胞Smad3 mRNA表达减少,差异具有统计学意义(P<0.05)。见图4。
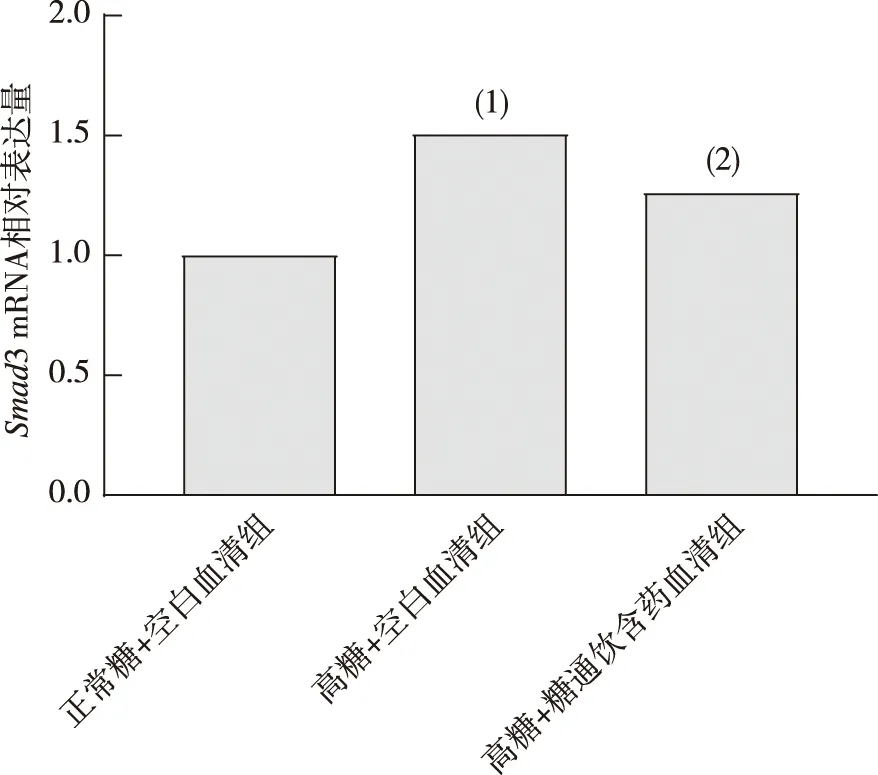
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图4 各组HBZY-1细胞Smad3 mRNA表达(n=3)Fig.4 Expression of Smad3 mRNA in HBZY-1 cells in each group(n=3)
2.5 HBZY-1细胞TGF-β1蛋白表达
与正常糖+空白血清组相比,高糖+空白血清组细胞 TGF-β1蛋白表达增加,差异具有统计学意义(P<0.05);与高糖+空白血清组相比,高糖+糖通饮含药血清组细胞TGF-β1蛋白表达降低,差异具有统计学意义(P<0.05)。见图5。
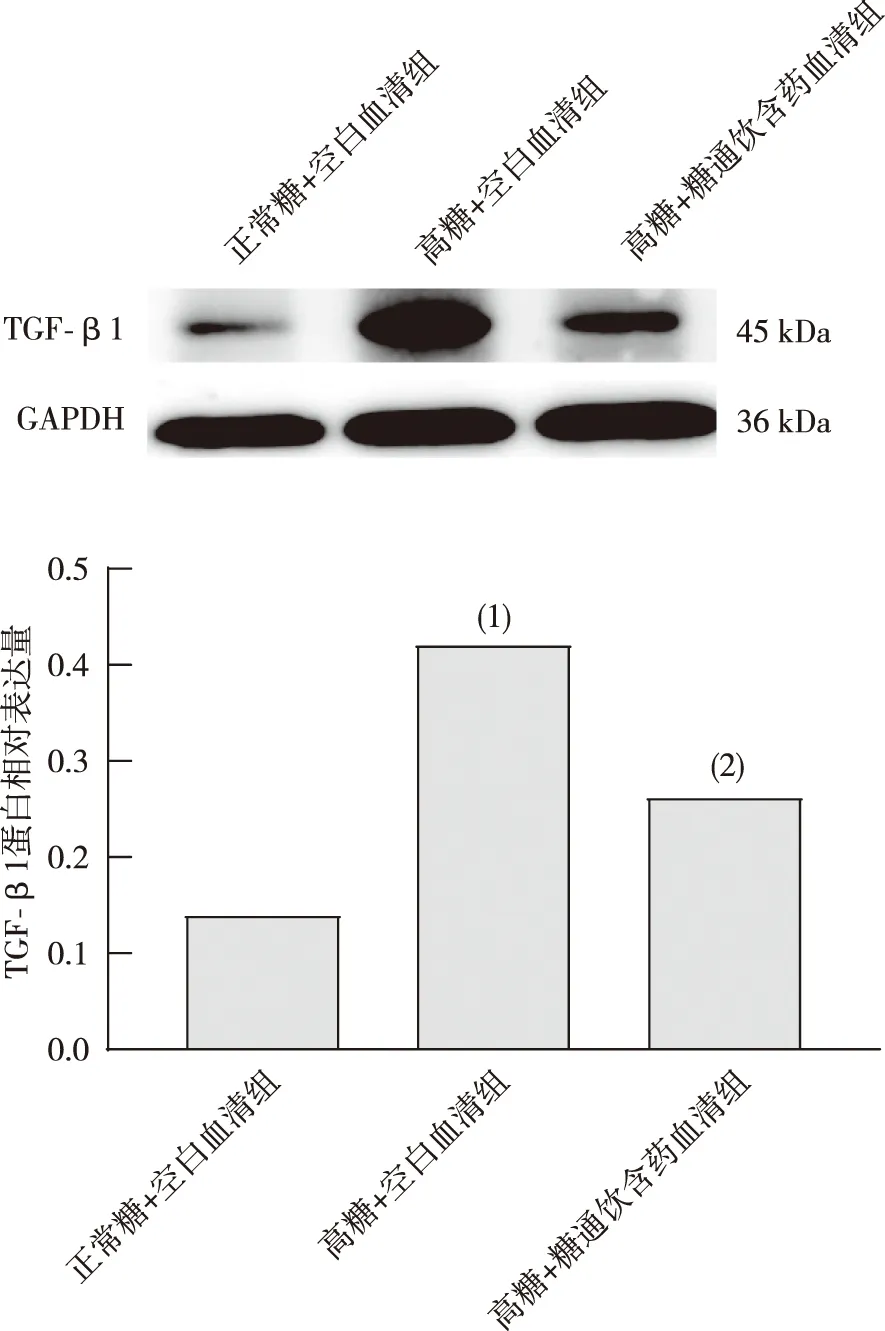
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图5 各组HBZY-1细胞TGF-β1蛋白表达(n=3)Fig.5 Expression of TGF-β1 proteins in HBZY-1 cells in each group(n=3)
2.6 HBZY-1细胞p-Smad2/Smad2蛋白表达
与正常糖+空白血清组相比,高糖+空白血清组细胞p-Smad2/Smad2蛋白表达增加,差异具有统计学意义(P<0.05);与高糖+空白血清组相比,高糖+糖通饮含药血清组细胞p-Smad2/Smad2蛋白表达降低,差异具有统计学意义(P<0.05)。见图6。
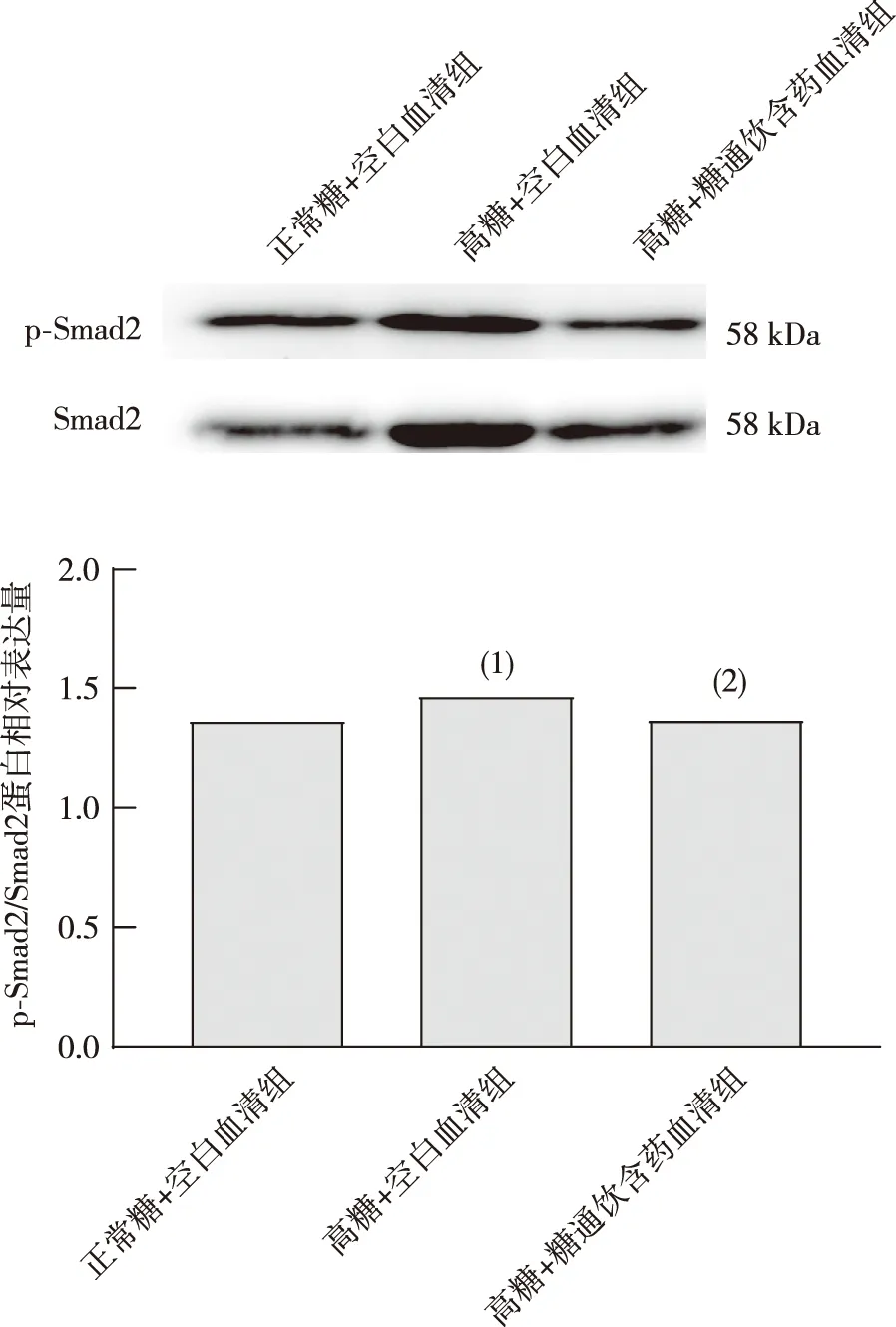
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图6 各组细胞p-Smad2/Smad2蛋白表达(n=3)Fig.6 Expression of p-Smad2/Smad2 proteins in HBZY-1 cells in each group(n=3)
2.7 HBZY-1细胞p-Smad3/Smad3蛋白表达
与正常糖+空白血清组比较,高糖+空白血清组细胞p-Smad3/Smad3蛋白表达增加,差异具有统计学意义(P<0.05);与高糖+空白血清组相比,高糖+糖通饮含药血清组细胞p-Smad3/Smad3蛋白表达降低,差异具有统计学意义(P<0.05)。见图7。
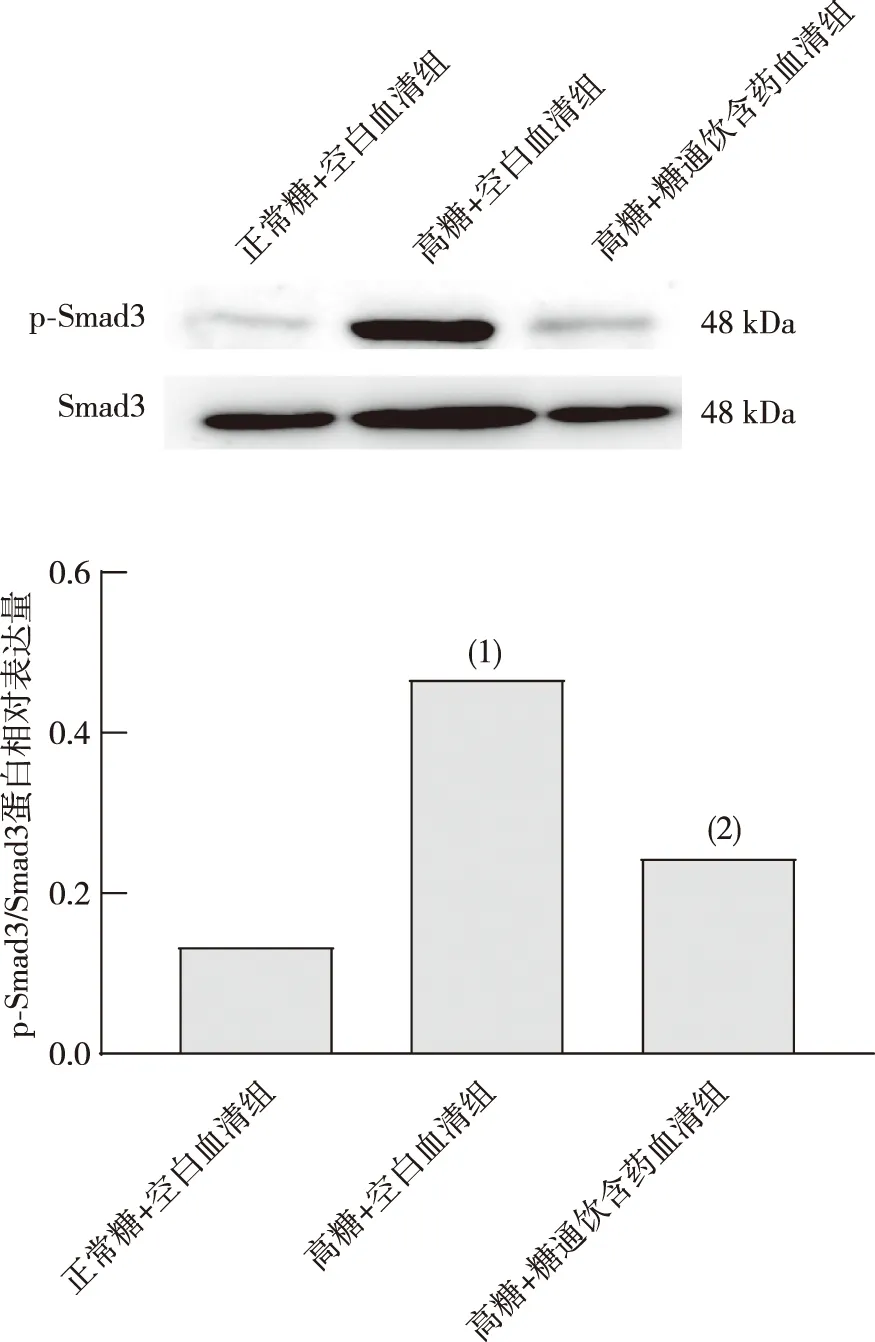
注:(1)与正常糖+空白血清组比较,P<0.05;(2)与高糖+空白血清组比较,P<0.05。图7 各组HBZY-1细胞p-Smad3/Smad3蛋白表达(n=3)Fig.7 Expression of p-Smad3/Smad3 proteins in HBZY-1 cells in each group(n=3)
3 讨论
研究表明,系膜细胞增殖在DKD的发生发展中起着重要作用,过度增殖的系膜细胞可通过多种途径影响肾脏功能且与肾纤维化密切相关[15]。TGF-β1/Smad作为DKD发生发展最主要的信号通路,它的激活对DKD肾间质纤维化起着重要的促进作用[16]。该通路中的TGF-β1是DKD发病过程的中心环节,处于DKD相关生长因子网络中心地位[17],在DKD发生发展过程中,TGF-β1通过刺激系膜细胞活化增殖,分泌大量的Ⅰ、Ⅲ和Ⅳ型胶原及纤连蛋白等细胞外基质(ECM)成分,导致ECM的堆积。此外,TGF-β1的过度表达,还可刺激金属蛋白抑制剂产生,抑制胶原酶的合成,从而使ECM降解减少,有利于ECM在肾脏的积聚,促进DKD的发生发展[18-19]。Smads蛋白是介导TGF-β信号转导的蛋白,分为受体激酶、通用型和抑制型三种。Smad2和Smad3属于受体激酶,是促进TGF-β1介导组织纤维化的2个主要下游调节因子,当DKD发生发展时,TGF-β1先与Ⅱ型受体(TβRⅡ)结合,磷酸化Ⅰ型受体(TβRI),进一步激活下游Smad3信号,促进Smad复合物产生,入核并干扰相关基因的表达,比如ECM成分纤连蛋白(FN1)和胶原蛋白等,从而进一步加重DKD肾纤维化程度[20]。本实验结果发现,HBZY-1细胞在高糖刺激下明显增殖,且细胞中TGF-β1、Smad2、Smad3 mRNA表达升高,TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3蛋白表达升高,提示TGF-β1/Smad通路的激活参与了高糖环境对HBZY-1细胞的损害。
中医学中无DKD这一病名,但按其临床表现当隶属于消渴病并虚劳、肾劳、水肿等范畴,消渴病的基本病机为阴虚燥热,发展日久则气阴两虚、瘀血内生,且阴虚日久、阴损及阳、阴阳俱虚,导致脏腑功能受损而致浊毒内停[21],最终形成DKD气阴两虚为本、痰瘀浊毒阻络为标的基本病机特点。有研究指出,根据DKD这一基本病机特点创制了中药复方糖通饮,该方是在六味地黄丸的基础上易熟地黄为生地黄,伍入黄芪、丹参、地骨皮、草决明而成[22]。本研究所采用的糖通饮是以黄芪为君,生地黄、山药、山茱萸为臣,培补肝肾、调养气阴以固本虚;佐以茯苓、牡丹皮、泽泻、丹参、地骨皮、草决明,除标实之痰浊,通肾络之瘀阻;诸药合用,标本兼治,益气养阴保肾,活血化瘀通络。现代药理学研究表明,黄芪中的黄芪甲甙及黄芪多糖两种主要活性成分,具有降低血糖、减轻蛋白尿以及保护肾脏功能的作用[23];丹参中的酚酸类和二萜醌类成分可以抑制肾纤维化和炎症,减轻临床患者的尿蛋白排泄率[24];地骨皮、草决明可降糖降脂[25]。糖通饮已在临床使用多年,并且取得了较为肯定的疗效[26],但其作用机制仍不十分明确。本研究结果显示,与高糖+空白血清组比较,高糖+糖通饮含药血清组细胞增殖被抑制,HBZY-1细胞中TGF-β1、Smad2、Smad3 mRNA表达降低,TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3蛋白表达均有不同程度的降低,说明该方可缓解高糖环境对HBZY-1细胞的损害,并抑制TGF-β1/Smad通路的激活。
综上,本实验首次采用中药血清药理学方法,从细胞层面证实了糖通饮可以抑制高糖状态下大鼠肾小球系膜细胞增殖,其作用机制可能与抑制TGF-β1/Smad信号通路的过度激活有关。

