生脉注射液对心肌缺血再灌注损伤大鼠线粒体融合素2的影响及保护作用
张 婷,马 喆,赵久丽,金秋硕,娄利霞
心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)简称I/R损伤,是指在心肌供血中断一定时间后恢复供血,原缺血心肌发生较供血恢复前更严重的损伤[1]。随着急性心肌梗死(acute myocardial infarction,AMI)发病率的逐年增加,及时、充分、持续地开通梗死相关动脉,实现有效再灌注是急性心肌梗死治疗的关键[2]。缺血心肌得到再灌注确能改善心功能,但同时又不可避免地造成缺血再灌注损伤。临床研究表明,缺血后再灌注在改善心肌供血的同时伴随着一系列病理生理过程,包括氧化应激、炎症、线粒体损伤等,最后出现不可逆的细胞焦亡、细胞凋亡和坏死,使心肌损伤范围进一步加重[3]。因此,心肌缺血再灌注损伤的预防和治疗方法的研究非常必要。
研究表明,线粒体融合素2(mitochondrial fusin 2,Mfn2)对维持正常心肌细胞生理功能具有重要意义。Mfn2在调节细胞功能方面具有多重作用,参与细胞增殖、凋亡、自噬、氧化应激损伤和线粒体融合,是缺血再灌注损伤的关键因子[4]。在小鼠心肌缺血再灌注模型中下调Mfn2的表达,会导致心肌细胞凋亡[5]。Mfn2作为线粒体外膜的重要组成部分,参与线粒体结构功能稳态的维持[6]。研究提示,Mfn2的表达调节是心肌缺血再灌注损伤的新的关键因子,通过对线粒体融合的调节可以介导心脏对急性缺血再灌注损伤的保护[7],而其缺失则会导致线粒体结构损伤,进而导致心肌细胞功能障碍[8]。已有研究表明,发生在24 h内的凋亡会导致心肌组织发生大面积或者广泛性的损伤,更易发生心肌功能障碍[9]。因此,如果心肌细胞凋亡能被有效抑制,那么心肌梗死导致的心脏病理生理变化及功能障碍以及缺血再灌注损伤就会相应减少。
心肌缺血再灌注损伤在中医证型中多属于气阴两虚证,心肌缺血再灌注损伤后,心肌收缩功能障碍,导致左室射血分数(left ventricular ejection fraction,LVEF)降低[10]。生脉注射液(Shengmai Injection,SMI)处方来源于古方生脉散,是从红参、麦冬、5味子中提取有效成分制成的中药注射剂[11]。生脉注射液临床应用于冠心病、心肌梗死、心力衰竭、休克等治疗,具有益气养阴、复脉固脱的功效。研究表明,生脉注射液可以明显提高心肌氧化物歧化酶(SOD)水平、减少丙二醛(MDA)的产生,减轻心肌细胞缺血再灌注过程中氧化应激损伤,具有保护心功能的作用[12]。本研究拟在大鼠心肌缺血再灌注损伤模型上,通过检测心肌细胞凋亡、心肌组织总SOD、总MDA水平,及Mfn2 mRNA及蛋白表达情况,探讨生脉注射液减轻心脏缺血再灌注损伤的可能机制。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级雄性SD大鼠18只,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。饲养条件:动物饲养于北京中医药大学东直门医院中医内科学教育部和北京市重点实验室屏障级实验动物房。相关动物实验操作按照实验室实验动物操作规程进行,符合动物伦理审查要求。
1.2 主要试剂与仪器
1.2.1 主要试剂 生脉注射液(国药准字040827)购自江苏苏中药业集团生物制药有限公司;总SOD活性检测试剂盒WST-8法(S0101S)、MDA检测试剂盒(S0131S)购自上海碧云天生物技术有限公司;末端脱氧核苷酸转移酶介导的缺口末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)检测试剂盒(G3250)购自普洛麦格(北京)生物技术有限公司;Mfn2 antibody(12186-1-Ap)购自美国Proteintech公司;动物组织RNA提取试剂盒(DP431)、反转录试剂盒(KR118-02)、扩增试剂盒(FP205-02)购自北京天根生化科技有限公司;Mfn2、磷酸甘油脱氢酶(GAPDH)引物购自北京诺赛基因组研究中心有限公司。
1.2.2 主要仪器 ALC-V8动物呼吸机(上海奥尔科特生物科技有限公司);Vevo高分辨率小动物超声影像系统,TM2100型(加拿大Visual Sonics公司);Applied Biosystems实时荧光定量聚合酶链式反应(PCR)仪,Mx3000P(美国安捷伦科技公司);荧光显微镜,Scope.A1(德国Zeiss公司)。
1.3 实验方法
1.3.1 动物分组及给药 根据随机数字表法将大鼠分为假手术组、模型组、生脉注射液组,每组6只。手术前7 d,生脉注射液组开始腹腔注射生脉注射液每天12 mL/kg,假手术组和模型组分别腹腔注射相应体积的生理盐水。连续给药7 d后进行心肌缺血再灌注损伤模型制备。
1.3.2 大鼠心肌缺血再灌注损伤模型制备 大鼠实验前禁食12 h,腹腔内注射1%戊巴比妥钠(50 mg/kg)进行麻醉,仰卧位固定四肢及头部,胸前手术备皮。记录Ⅱ导联心电图。在胸骨左缘0.5 cm处,自胸骨左缘第4肋间开胸,逐层钝性分离皮下组织、肌肉,分离肌层,剪断第4肋骨,开胸,用小拉钩牵拉胸壁,撕开心包膜,充分暴露心底部。在左心耳与肺动脉圆锥之间找到冠状动脉左前降支,用结扎线(穿5/0缝线)在左心耳根部下方2 mm处,以深1.5~2.0 mm、宽2.0~3.0 mm
穿过心肌表层,结扎冠状动脉左前降支。线结下置入一个直径约1 mm乳胶管,系紧结扎线,阻断前降支血流。结扎后,迅速将心脏送回胸腔,并挤出胸腔内的空气,关闭胸腔。阻断左冠状动脉30 min后,打开胸腔剪断缝线,抽出乳胶管再灌注2 h,造成心肌缺血再灌注损伤模型,再灌注后再次记录心电图。模型成功标准:结扎线远端心尖部颜色发绀,心电图表现ST段抬高超过0.2 mV,QRS增高增宽。再灌注后抬高的ST段下降50%以上。假手术组只进行分离,不进行结扎。
1.4 观察指标检测
1.4.1 大鼠超声心动图检测 大鼠心肌缺血再灌注术后进行超声心动图检测。将大鼠仰卧位固定于鼠板,左胸部广泛备皮,应用超声诊断仪和高频线阵探头,取胸骨旁左室长轴切面,由二维超声引导M型曲线检测心脏结构和功能。每组原始数据均选取连续3个心动周期测量值的平均值。超声检测的操作采用单盲法。测量参数包括:LVEF、左室短轴缩短率(LVFS)、左室后壁舒张末厚度(LVPWTd)、左室后壁收缩末厚度(LVPWTs)、左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)。
1.4.2 TUNEL检测心肌细胞凋亡 按照试剂盒说明书,大鼠心肌组织石蜡切片用多聚甲醛室温固定30 min后用磷酸缓冲盐溶液(PBS)洗涤3次,每次5 min;每个样本滴加蛋白酶K工作液100 μL,室温孵育10 min后用PBS洗涤5 min;再以多聚甲醛室温固定5 min后用PBS洗涤5 min;每个样本滴加Equilibration Buffer 100 μL,室温避光孵育10 min;每个样本滴加DNA荧光染料溶液rTdT Incubation Buffer 100 μL,37 ℃避光孵育60 min;室温浸泡所有样本片于2X SSC溶液内10 min,重复1次后以PBS洗涤3次,每次5 min;用含4′,6-二脒基-2-苯基吲哚(DAPI)的封片液封片,避光保存。每个样本取5个视野荧光显微镜拍照。结果用Image J软件进行统计分析。
1.4.3 心肌组织总SOD活性检测 取20 mg心肌组织样品加入200 μL SOD样品制备液冰浴下匀浆,12 000 g 4 ℃离心5 min,取上清检测。按照说明书用96孔板设置样品孔及空白对照孔,按照反应体系依次加入SOD检测缓冲液、WST-8/酶工作液、反应启动工作液,37 ℃孵育30 min,用酶标仪在450 nm测定吸光度,记录数值并计算抑制百分率,待测样品中SOD酶活力单位即检测体系中SOD酶活力单位。
1.4.4 心肌组织总MDA含量检测 取20 mg心肌组织样品加入200 μL裂解液冰浴下匀浆,12 000 g 4 ℃离心10 min,取上清检测,另取2 μL上清稀释后用2,2联喹啉-4,4-二甲酸二钠(BCA)蛋白浓度测定试剂盒检测蛋白浓度并记录数值。按照说明书取适量标准品用去离子水稀释至1 μmol/L、2 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L浓度,加入0.1 mL上述不同浓度标准品用于制作标准曲线,加入0.1 mL样品用于测定;随后加入0.2 mL MDA检测工作液,混匀后,100 ℃或沸水浴加热15 min,然后水浴冷却至室温。1 000 g室温离心10 min,取200 μL上清加入到96孔板中,用酶标仪在532 nm测定吸光度,记录数值进行MDA含量计算,即单位质量的蛋白含量(μmol/mg蛋白)。
1.4.5 逆转录聚合酶链式反应(RT-PCR)法检测大鼠心肌组织Mfn2 mRNA水平的表达 剪取大鼠心肌组织在冰上匀浆后,用柱式离心法提取总RNA(参考天根动物组织RNA提取试剂盒DP431说明书),紫外分光光度计测定OD260和OD280,并计算总RNA浓度及纯度;配制20 μL反应体系逆转录2 μg总RNA(参考天根反转录试剂盒KR118-02说明书),最终得到cDNA链,反转录条件:65 ℃ 5 min,42 ℃ 30 min,95 ℃ 3 min。以cDNA为模板,采用RT-PCR法检测目的基因的相对表达量(参考天根扩增试剂盒FP205-02说明书),扩增条件:95 ℃ 15 min预变性,之后进行40个扩增循环:95 ℃ 10 s变性,55 ℃ 20 s退火,72 ℃ 20 s延伸。以GAPDH为内参基因,按照2-△△ct法计算基因相对表达量。引物序列见表1。

表1 引物序列(5′- 3′)
1.4.6 蛋白免疫印迹(Western Blot)法检测大鼠心肌组织Mfn2、Caspase-3蛋白的表达 提取大鼠心肌组织蛋白;BCA法进行蛋白定量;配制10%聚丙烯酰胺凝胶,将蛋白样品经煮沸10 min后,各样品每孔按照50 μg蛋白上样。将蛋白转至NC膜,5%脱脂奶粉封闭液室温封闭1 h,加一抗Mfn2(1∶1 000)、Caspase-3(1∶1 000)、GAPDH(1∶10 000),4 ℃冰箱孵育过夜。特异性种属二抗(1∶5 000),室温孵育1 h后洗膜,ECL超敏发光液显色,Tanon 4600凝胶成像仪进行图像扫描。Image J软件进行条带灰度值分析,以GAPDH作为内参进行数据分析。

2 结 果
2.1 3组大鼠超声心动图检测结果比较 在冠状动脉结扎30 min后灌流2 h,与假手术组比较,模型组LVEF、LVFS、LVPWTd、LVPWTs均明显降低,差异均有统计学意义(P<0.01),LVEDV、LVESV明显升高,差异均有统计学意义(P<0.01),提示模型组出现心功能不全;与模型组比较,生脉注射液组大鼠LVEF、LVFS、LVPWTd、LVPWTs均明显升高,差异均有统计学意义(P<0.01),LVEDV、LVESV明显降低,差异均有统计学意义(P<0.05)。详见表2。

表2 3组大鼠超声心动图检测结果比较(±s)
2.2 3组大鼠心肌细胞凋亡检测比较 本研究通过TUNEL和Caspase-3蛋白活化片段检测大鼠心肌组织细胞凋亡。TUNEL检测结果发现,与假手术组比较,模型组大鼠心肌细胞凋亡比率明显增加,差异有统计学意义(P<0.01),提示大鼠心肌缺血再灌注损伤发生时心肌细胞凋亡增加;与模型组大鼠比较,生脉注射液组心肌细胞凋亡率明显降低,差异有统计学意义(P<0.05),表明生脉注射液可通过抑制心肌细胞凋亡发挥心肌保护作用,减轻心肌缺血再灌注损伤。详见图1、表3。
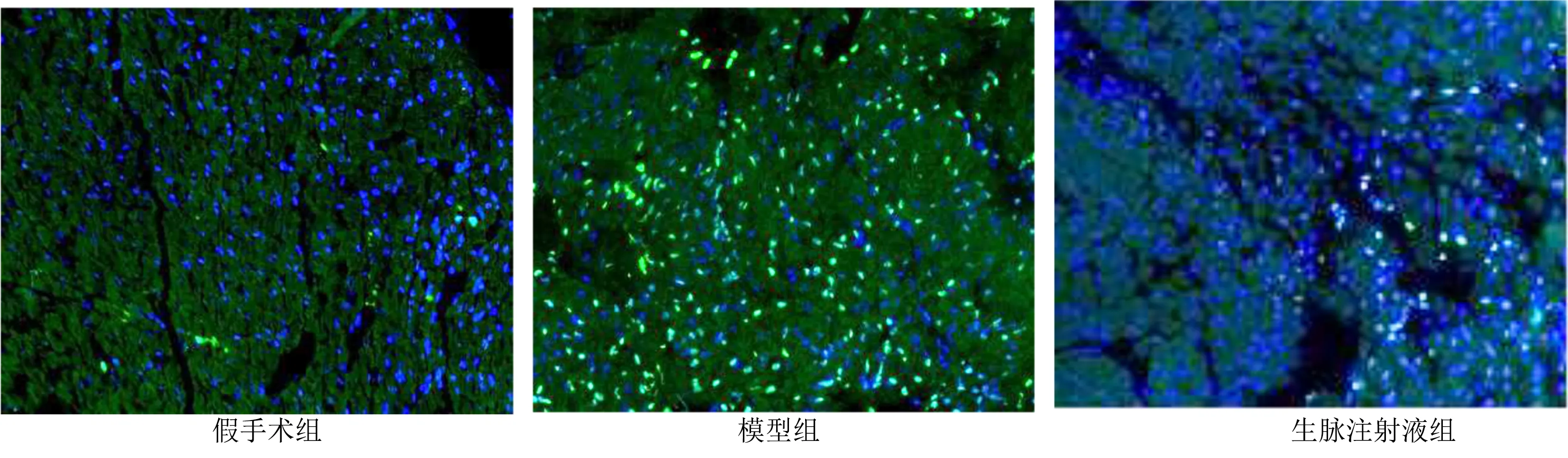
图1 TUNEL法检测3组大鼠心肌细胞凋亡图 (×20)(蓝色为染色细胞核DAPI;绿色为TUNEL阳性反应)

表3 3组大鼠心肌缺血再灌注损伤后心肌细胞凋亡率比较(±s)
Western Blot检测结果发现,与假手术组比较,模型组大鼠心肌组织Caspase-3蛋白活化片段表达明显增高,差异有统计学意义(P<0.01);与模型组比较,生脉注射液组大鼠心肌Caspase-3蛋白活化片段表达明显降低,差异有统计学意义(P<0.05),表明生脉注射液可以有效预防和减轻心肌组织缺血再灌注损伤。详见图2。

与假手术组比较,* P<0.01;与模型组比较,# P<0.05。图2 3组大鼠缺血再灌注心肌组织Caspase-3蛋白表达比较(A为电泳图;B为柱状图)
2.3 3组大鼠心肌组织SOD活力、MDA含量比较 与假手术组比较,模型组大鼠的心肌组织总SOD活力明显降低,总MDA含量明显增加,差异均有统计学意义(P<0.01),提示大鼠心肌组织缺血再灌注后,心肌细胞抗氧化能力降低,出现广泛的氧化应激损伤;与模型组大鼠比较,生脉注射液组大鼠心肌组织总SOD活力明显升高、总MDA含量明显降低,差异均有统计学意义(P<0.01),表明生脉注射液对心肌组织的氧化应激损伤具有抑制作用,可以有效提高心肌细胞对氧化应激损伤的抵抗能力。详见图3。

与假手术组比较,* P<0.05,# P<0.01;与模型组比较,△ P<0.01。图3 3组大鼠心肌组织SOD活力、MDA含量比较(n=6) (A为SOD活力变化;B为MDA含量变化)
2.4 3组大鼠心肌组织Mfn2 mRNA及蛋白表达比较 与假手术组比较,模型组大鼠心肌组织缺血再灌注手术后Mfn2 mRNA及蛋白表达含量明显降低,差异有统计学意义(P<0.01);与模型组大鼠比较,生脉注射液组大鼠心肌组织Mfn2 mRNA和蛋白表达含量明显增高,差异有统计学意义(P<0.01)。详见图4。
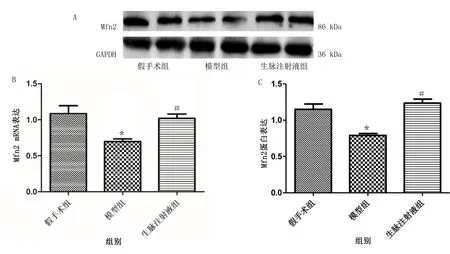
与假手术组比较,* P<0.01;与模型组比较,# P<0.01。图4 3组大鼠Mfn2 mRNA及蛋白水平表达比较(n=6)(A为电泳图;B为Mfn2 mRNA表达;C为Mfn2蛋白表达)
3 讨 论
Mfn2是一种线粒体外膜蛋白,作为参与线粒体融合的关键分子,可以通过调节线粒体融合来保护心肌细胞对抗缺血再灌注损伤。研究显示,Mfn2基因敲除小鼠由于缺乏线粒体融合作用导致线粒体网络的碎片化,无法对抗由于心肌细胞线粒体通透性转换孔的开放和心肌细胞的坏死,进而引发心肌细胞代谢异常,从而使心肌细胞在缺血再灌注时更易发生损伤[13-15]。研究表明,在小鼠心肌细胞缺血再灌注损伤模型中下调Mfn2的表达,会导致心肌细胞凋亡[16]。本研究结果发现,在心肌缺血再灌注损伤发生时,大鼠心肌组织内Mfn2在基因水平和蛋白表达水平较假手术组均明显降低,而提前给予生脉注射液干预可以显著提高大鼠心肌组织内Mfn2含量。同时发现,缺血再灌注大鼠心肌组织TUNEL检测心肌细胞凋亡发生及Caspase-3表达较假手术组明显升高,而生脉注射液则可显著降低这些指标。当心肌缺血再灌注损伤发生时会发生广泛的Caspase依赖性凋亡[17],这与本实验研究结果相符。
盐酸戊乙奎醚(penehyclidine hydrochlorid,PHC)是一种新型抗胆碱脂能药,多用于有机磷农药中毒及麻醉术前给药治疗。研究表明,在缺血再灌注损伤大鼠模型中,由于氧化应激产生的大量活性氧作用于多种蛋白和脂类受体从而启动了心肌细胞凋亡,PHC可以有效阻断这些受体与活性氧结合来间接抑制细胞凋亡,例如其可以抑制促线粒体分裂的动力相关蛋白 1(dynamin-related protein 1,Drp1)和促进Mfn2的表达,同时发挥胆碱能抗炎通路来减少氧化应激和炎症反应,通过减轻心肌细胞凋亡来保护心肌不受缺血再灌注损伤[18-22]。大鼠心肌组织总SOD活力及总MDA含量是反映心肌细胞氧化应激反应的重要指标,本实验结果表明,缺血再灌注大鼠心肌组织内的总SOD活力较假手术组大鼠明显降低,总MDA含量明显增加,这与已有研究结论相符。生脉注射液干预可明显改善上述指标,表明生脉注射液可以通过抑制缺血再灌注损伤时的氧化应激反应来发挥细胞保护作用。
Mfn2作为一种与动力相关的蛋白,可以有效促进线粒体融合来维持线粒体动力学的稳态,同时Mfn2也是一种多功能蛋白,参与线粒体转运、内质网或肌浆网与线粒体的相互作用,以及细胞代谢、细胞凋亡和自噬过程[23],而这些过程在缺血再灌注损伤的发生和发展进程中均扮演者重要的角色。因此,Mfn2参与缺血再灌注损伤机制仍需进一步深入的研究。
综上所述,本研究表明提前给予生脉注射液可以改善大鼠缺血再灌注心肌损伤,这种心肌保护作用与增加缺血再灌注心肌组织Mfn2表达,减轻氧化应激损伤、抑制心肌细胞凋亡有关。

