中国南海海洋链霉菌Streptomyces sp.rssa1的化学成分研究
王 蓉,郭志凯,程 芬,冯全英,詹夏菲
1海南省海洋与渔业科学院 海南省热带海水养殖技术重点实验室,海口 571126;2海南热带农业资源研究院 海南省热带农业生物资源保护与利用重点实验室;3中国热带农业科学院热带生物技术研究所 海南省热带微生物资源重点实验室,海口 571101
海洋放线菌是一类具有重要价值的药用微生物资源,它们能够产生结构类型多样的生物活性物质,如大环内酯类、生物碱类、肽类、醌类等,特别是在抗菌化合物挖掘方面具有巨大潜力。Schinke等[1]曾统计2010年~2015年间海洋细菌来源的抗菌化合物有69%来源于海洋放线菌。由于海洋环境的特殊性,海洋放线菌在生理生化特性和遗传背景特性上与陆生放线菌存在差异,使得从海洋放线菌中寻找活性分子潜力巨大。
本研究组近年来已从南海海洋生物共附生放线菌中发现了一些具有新颖结构的活性分子[2-4],最近我们从中国海南西沙群岛采集的珊瑚样品中分离筛选得到的1株具有抗菌活性的海洋链霉菌菌株Streptomycessp.rssa1,但其抗菌药效物质不清楚。为了挖掘该菌株所产生的活性成分,本文首次利用大米固体培养基对它进行了固体发酵,对其发酵产物进行系统的化学成分研究,并对其活性进行了筛选。
1 材料与方法
1.1 仪器与试剂
Bruker DPX 400 MHz和Bruker DRX 600 MHz超导核磁共振波谱仪(德国Bruker 公司,TMS为内标);Agilent 6210 TOF LC-MS质谱仪(美国Agilent公司);Waters 1525型高效液相色谱仪(美国Waters公司),配备分析型色谱柱(Waters XBridge C18,150 mm × 2.1 mm,3.5 μm)和半制备型色谱柱(Waters XBridge C18,250 mm× 10 mm,5 μm);旋转蒸发仪(N1300,上海艾朗仪器有限公司);ZQZY-CS8V恒温摇床(上海知楚公司);分析型薄层层析硅胶板(GF254)和正相层析柱硅胶(45~75 μm)(青岛海洋化工);Sephadex LH-20(瑞典Pharmacia Biotech)和ODS反相硅胶(日本Nacalai Tesque公司);色谱甲醇(康科德);实验中使用的其他试剂均为分析纯。
1.2 菌株材料
本文所研究的菌株rssa1是我们从中国南海西沙群岛采集的珊瑚样品中分离纯化获得。通过16S rRNA基因序列测定,并经BLAST比对,与菌株Streptomycessp.HBUM206419的16S rRNA序列(GenBank号为MT540570)的相似度为99.93%,结合形态学特征,将该菌株鉴定为Streptomycessp.。菌株Streptomycessp.rssa1的16S rRNA序列在GenBank中的注册号为OL314653,并保藏于中国热带农业科学院热带生物技术研究所。
1.3 培养基与菌株发酵
ISP2固体培养基:酵母浸粉 4 g/L,麦芽浸粉10 g/L,葡萄糖4 g/L,琼脂20 g/L,17.5 g/L人工海盐,去离子水1L,pH自然;麦芽提取物(ME)液体培养基:20 g/L麦芽提取物,20 g/L蔗糖,1 g/L蛋白胨,17.5 g/L人工海盐,去离子水1 L,pH值为7.0;大米固体发酵培养基:大米30 g,人工半海水(17.5 g/L)45 mL。
海洋链霉菌菌株Streptomycessp.rssa1经ISP2培养基活化,28 ℃培养5天,之后将活化后的菌株接种至装有200 mL ME液体培养基的三角瓶(1 000 mL)中,于恒温摇床上振荡培养72 h(160 r/min,28 ℃)。取10 mL的ME液体种子液接种到装有30 g大米的组培瓶中进行发酵,静置培养45天(28 ℃)。以上培养基均于高压蒸汽灭菌锅中121 ℃灭菌30 min。
1.4 提取与分离纯化
大米固体培养基培养发酵菌株Streptomycessp.rssa1 45天后,加入乙酸乙酯浸提3次,合并提取液,于45 ℃下减压浓缩得到提取物6 g。对获得的提取物进行减压正相硅胶柱层析分离,采用二氯甲烷-甲醇等度洗脱(100∶0、100∶1、100∶2、100∶4、100∶8、100∶16、100∶32、0∶100),在TLC检测下合并得到8个组分(Fr.a~Fr.h)。组分Fr.c经减压ODS反相柱层析后,将70%甲醇水部位经Sephadex LH-20凝胶柱分离纯化得到化合物3(4 mg)。组分Fr.d经ODS反相硅胶柱层析和Sephadex LH-20凝胶柱层析后,利用半制备HPLC(0~40 min,0 %~70%甲醇,40~42 min,70 %~100%甲醇,42~52 min,100%甲醇,52~53 min,100%~0%甲醇,53~58 min,0%甲醇;波长254 nm,流速为3.0 mL/min)纯化得到化合物4(8 mg,tR= 23.5 min)、5(3 mg,tR= 19.6 min)、6(5 mg,tR= 21.6 min)、7(5 mg,tR= 24.1 min)、8(4 mg,tR= 16.1 min)、9(3 mg,tR= 17.4 min)和10(6 mg,tR= 18.5 min)。组分Fr.e经ODS反相硅胶柱层析和Sephadex LH-20凝胶柱层析后,利用半制备HPLC(0~20.0 min,65%甲醇,20.1~40.0 min,70%甲醇)纯化得到化合物1(9 mg,tR= 34.6 min)和2(6 mg,tR= 20.3 min)。
1.5 活性筛选
体外抗菌活性测试采用先前报道的滤纸片法测定抑菌圈直径大小[5],供试病原细菌为溶藻弧菌(V.alginolyticus)。化合物和卡那霉素分别用DMSO配成5 mg/mL的样品溶液备用。测试抗菌活性时,以DMSO为阴性对照,以卡那霉素为样品对照,选用加人工海盐的LB培养基(胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,人工海盐25 g/L,琼脂粉20 g/L,去离子水1 L,pH 7.4)进行细菌培养和测试。用十字交叉法测定抑菌圈直径,做3次平行重复。采用已报道的方法检测了化合物对RAW 264.7细胞产生的毒性[6]和环化核苷酸磷酸二酯酶PDE4水解抑制活性[7]。
2 结果与分析
2.1 结构鉴定


化合物3棕色固体,溶于甲醇;HR-ESI-MS:m/z321.076 0[M+H]+;分子式为C19H12O5;1H NMR(400 MHz,DMSO-d6)δ:12.00(1H,s,OH-1),10.70(1H,s,OH-9),8.28(1H,br s,H-15),8.17(1H,br s,H-14),7.80(1H,br s,H-4),7.61(1H,br s,H-3),7.50(1H,br s,H-12),7.36(1H,br s,H-2),7.11(1H,br s,H-10),5.45(1H,t,J=5.6 Hz,19-OH),4.66(2H,br s,H-19);13C NMR(100 MHz,DMSO-d6)δ:160.9(C-1),123.6(C-2),137.6(C-3),119.4(C-4),146.6(C-5),186.5(C-6),133.6(C-7),119.7(C-8),155.6(C-9),113.7(C-10),135.6(C-11),116.8(C-12),136.5(C-13),121.7(C-14),135.5(C-15),138.6(C-16),187.8(C-17),115.5(C-18),62.8(C-19)。以上数据与文献[10]报道一致,故将该化合物鉴定为kanglemycin M。
化合物4黄色固体,溶于氯仿;HR-ESI-MS:m/z284.139 1[M+H]+;分子式为C16H17N3O2;1H NMR(400 MHz,CDCl3)δ:8.25(1H,br s,NH-1),7.61(1H,d,J=7.7 Hz,H-5),7.29(1H,d,J=7.7 Hz,H-8),7.15(1H,t,J=7.7 Hz,H-7),7.06(1H,t,J=7.7 Hz,H-6),7.01(1H,br s,NH-15),6.82(1H,d,J=1.7 Hz,H-2),5.44(1H,q,J=7.4 Hz,H-18),4.26(1H,dd,J=3.8,3.6 Hz,H-11),3.56(1H,dd,J=14.8,2.8 Hz,H-10a),3.26(1H,dd,J=14.8,4.8 Hz,H-10b),3.09(3H,s,H-17),0.88(3H,d,J=7.4 Hz,H-19);13C NMR(100 MHz,CDCl3)δ:124.8(C-2),107.9(C-3),127.5(C-4),118.7(C-5),119.8(C-6),122.3(C-7),110.9(C-8),136.2(C-9),27.7(C-10),63.3(C-11),166.5(C-13),126.2(C-14),160.3(C-16),32.9(C-17),112.2(C-18),9.7(C-19)。以上数据与文献[11]报道一致,故将该化合物鉴定为二酮哌嗪类化合物tryptophandehydrobutyrine diketopiperazine。
化合物5白色晶体,溶于甲醇;HR-ESI-MS:m/z175.086 9[M+H]+;分子式为C10H10N2O;1H NMR(600 MHz,DMSO-d6)δ:10.85(1H,br s,NH-1),7.55(1H,d,J=7.8 Hz,H-5),7.34(1H,t,J=7.8 Hz,H-8),7.28(1H,br s,NH),7.19(1H,d,J=1.4 Hz,H-2),7.07(1H,t,J=7.8 Hz,H-7),7.00(1H,t,J=7.8 Hz,H-6),6.82(1H,br s,NH),3.47(2H,s,H-10);13C NMR(150 MHz,DMSO-d6)δ:124.2(C-2),109.5(C-3),127.7(C-4),121.4(C-5),111.7(C-6),118.7(C-7),119.1(C-8),136.6(C-9),33.0(C-10),173.4(C-11)。以上数据与文献[12]报道一致,故将该化合物鉴定为3-吲哚乙酰胺。

化合物7无色片状晶体,溶于甲醇;HR-ESI-MS:m/z137.059 7[M+H]+;分子式为C8H8O2;1H NMR(600 MHz,DMSO-d6)δ:12.30(1H,br s,COOH),7.31(2H,d,J=7.7 Hz,H-3,H-5),7.26(2H,d,J=7.7 Hz,H-2,H-6),7.24(1H,t,J=7.0 Hz,H-4),3.56(2H,s,H-7);13C NMR(150 MHz,DMSO-d6)δ:135.6(C-1),129.8(C-2,C-6),128.7(C-3,C-5),127.0(C-4),41.3(C-7),173.2(C-8)。以上数据与文献[14]报道一致,故将该化合物鉴定为苯乙酸。
化合物8黄色油状物,溶于甲醇;HR-ESI-MS:m/z180.101 7[M+H]+;分子式为C10H13NO2;1H NMR(400 MHz,CD3OD)δ:7.03(2H,d,J=8.2 Hz,H-2,H-6),6.74(2H,d,J=8.2 Hz,H-3,H-5),3.34(2H,t,J=7.4 Hz,H-8),2.69(2H,t,J=7.4 Hz,H-7),1.92(3H,s,H-10);13C NMR(100 MHz,CD3OD)δ:155.5(C-1),114.9(C-2,C-6),129.4(C-3,C-5),129.9(C-4),34.3(C-7),41.1(C-8),171.9(C-9),21.3(C-10)。以上数据与文献[15]报道一致,故将该化合物鉴定为N-乙酰基酪胺。
化合物9无色片状晶体,溶于甲醇;HR-ESI-MS:m/z122.060 1[M+H]+;分子式为C7H7NO;1H NMR(400 MHz,DMSO-d6)δ:7.97(1H,br s,NH),7.87(2H,dd,J=7.7,1.4 Hz,H-2,H-6),7.52(1H,t,J=7.7 Hz,H-4),7.45(2H,t,J=7.7 Hz,H-3,H-5),7.35(1H,br s,NH);13C NMR(100 MHz,DMSO-d6)δ:134.7(C-1),127.9(C-2,C-6),128.7(C-3,C-5),131.7(C-4),168.4(C-7)。以上数据与文献[16]报道一致,故将该化合物鉴定为苯甲酰胺。
化合物10白色晶体,溶于甲醇;HR-ESI-MS:m/z136.075 6[M+H]+;分子式为C8H9NO;1H NMR(400 MHz,DMSO-d6)δ:7.46(1H,br s,NH2),7.30(2H,d,J=7.2 Hz,H-3,H-5),7.26(2H,d,J=7.2 Hz,H-2,H-6),7.22(1H,t,J=7.2 Hz,H-4),6.87(1H,br s,NH2),3.37(2H,s,H-7);13C NMR(100 MHz,DMSO-d6)δ:137.0(C-1),129.5(C-2,C-6),128.6(C-3,C-5),126.7(C-4),42.6(C-7),172.7(C-8)。以上数据与文献[17,18]报道一致,故将该化合物鉴定为苯乙酰胺。
化合物1~10结构见图1。
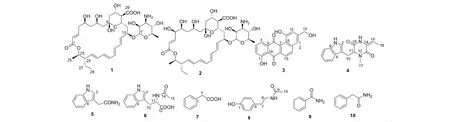
图1 化合物1~10的化学结构
2.2 活性测试结果
抗菌活性实验显示,化合物4对溶藻弧菌具有微弱的抑制活性,其抑菌圈直径为8.33±0.67 mm,显著弱于阳性对照卡那霉素的抑制效果(抑菌圈直径为26.67±0.33 mm)。针对巨噬细胞RAW 264.7的毒性筛选结果显示,化合物3在10 μmol/L浓度下,RAW 264.7细胞的存活率为(18.97±0.31)%,表明它对RAW 264.7具有细胞毒性。化合物3对环化核苷酸磷酸二酯酶PDE4的水解抑制活性筛选结果显示,它在5 μmol/L的测试浓度下无抑制活性,而阳性对照rolipram的水解抑制率为52.02%。
3 讨论与结论
放线菌是一类具有重要价值的药源微生物,目前发现的天然抗生素中近三分之二源于放线菌中,尤其是链霉菌。本文从珊瑚来源的链霉菌Streptomycessp.rssa1的代谢产物中分离鉴定出10个化合物,其中化合物1和2分别为四烯大环内酯类化合物四霉素A和四霉素B[8,9],化合物3为苯并萘醌类化合物kanglemycin M[10],活性筛选发现它对巨噬细胞RAW 264.7具有细胞毒活性,进一步丰富了我国海洋放线菌活性天然产物库。化合物4为一种二酮哌嗪类化合物tryptophandehydrobutyrine diketopiperazine。Li等[11]曾报道该化合物具有杀线虫活性,它对线虫(Panagrellusredivivus)48 h的致死率为40%,本文首次从海洋链霉菌中发现具有杀线虫活性的化合物4,预示着该菌可能在作物根结线虫病害防治中具有价值,并且发现它对溶藻弧菌具有弱抑制活性,为防治水产弧菌病害的药物研发提供线索。化合物5~10均为常见的吲哚类或含苯类简单化合物,其中Jin等[13]从植物猪毛菜中首次发现的化合物7具有较强的α淀粉酶抑制活性,在浓度0.556 mg/mL时的抑制率为44%。
多烯大环内酯类物质是一类高效广谱抗真菌抗生素,如纳他霉素能够抑制霉菌和酵母菌,并因具有良好的理化稳定性而被作为天然食品防腐剂和抗菌添加剂[8,9]。本文分离发现的化合物1和2分别被鉴定为四烯大环内酯类抗生素四霉素A和B,其结构上均有一个25个碳原子组成内酯环骨架,环上有4个共轭双键和多个羟基,并在15号位羟基通过糖苷键连接1个氨基糖。目前发现的四霉素产生菌均为链霉菌放线菌,最早是由Dornberger等[19,20]从链霉菌Streptomycesnoursei中发现,并且它们对苜蓿根腐病菌、稻瘟病菌等农业病原真菌具有较强抑制作用。然而,由于四霉素A和B的化学结构在阳光下不稳定,它们对紫外线较为敏感,因而限制了它们在农业生产上的直接应用[9]。Zhang等[9]发现四霉素A和B在较低浓度下对黄曲霉菌具有较好的杀菌效果,最低杀菌浓度分别为3.13和12.56 μg/mL。由于多烯大环内酯类化合物对哺乳动物毒性低且无副作用[21],具有成为粮食和饲料防霉剂的潜力。本文首次从南海珊瑚来源的链霉菌菌株rssa1中发现了具有强效抗真菌活性的四烯大环内酯类化合物四霉素A和四霉素B,由于许多研究表明它们在医药和农业病害防治领域具有良好的应用前景,因此该菌可能作为开发高效、低毒药物和绿色生防菌剂的一种重要菌种资源,该发现也为从我国热带海洋生物中寻找具有药用和农用价值的放线菌资源提供重要线索。

