太子参参须皂苷的免疫佐剂作用研究
曾 丽,甘思言,杜蓥蓥,乔 石,张炎达,王全溪,黄一帆*,马玉芳*
1中西兽医结合与动物保健福建省高等学校重点实验室,福州 350002;2福建农林大学兽医中药与动物保健重点实验室,福州 350002;3福建贝迪药业有限公司,宁德 355399
皂苷是一种甾体或三萜配糖类物质,广泛存在于一些植物体内,且随着研究深入,它也被作为一种植物来源佐剂应用于疫苗中[1]。研究表明,皂苷口服有一定佐剂作用,如口服藜芦皂苷能增强卵清白蛋白(ovalbumin,OVA)的免疫效果[2],灌服人参茎叶皂苷能够显著提升被注射口蹄疫疫苗小鼠血清中特异IgG及亚类滴度,且促进脾淋巴细胞增殖,上调相关基因的mRNA表达,强化应答效果[3]。太子参参须皂苷(Radix Pseudostellariae fibrous roots saponins,RPFRS)是从太子参(Pseudostellariaheterophylla)参须中提取的活性成分,具有增强机体免疫[4]、抗氧化[5]和抗应激[6]等作用。现在太子参以主根入药,根须则弃之不用,造成极大浪费,研究发现太子参参须中总皂苷平均含量是块根中的1.14倍[7]。课题组前期实验表明,以皂苷为成分之一的太子参参须提取物可增强免疫损伤小鼠的机体免疫,具有显著的调节免疫的作用[4],推测其可能具有增强机体对于抗原的免疫应答潜力。但目前关于太子参参须皂苷协助抗原免疫机体的效果鲜见报道,而常有研究利用OVA作为一种模式抗原来验证佐剂效力[8],被OVA诱导的模型抗原会产生更高的IgG反应,且小鼠脾脏细胞增殖能力、细胞因子IL-4、IL-10、IL-12和IFN-γ以及转录因子GATA-3和T-bet的mRNA表达等同样有所提高[9]。故本实验通过口服RPFRS对OVA模式抗原免疫小鼠的免疫佐剂效果,检测其相关免疫学指标,探讨RPFRS对模式抗原OVA的免疫佐剂作用及可能的机理,为进一步寻找高效、无毒、安全的中药免疫佐剂提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 太子参参须皂苷
福建贝迪药业有限公司惠柘荣县所产太子参参须,太子参参须皂苷(RPFRS)采取醇提法自行完成提取,经香草醛-冰醋酸法检测可得皂苷浓度为48.9%。
1.1.2 实验动物
清洁级雌性ICR小鼠,20±2 g,60只,福建医科大学实验动物中心购入。
1.1.3 主要试剂
金标级卵清白蛋白(上海酶联生物科技有限公司,批号:RD20C904);RPMI 1640培养基(Gibco公司,批号:AC10238685);胎牛血清(CellMax公司,批号:HQ202003);磷酸盐缓冲液(PBS,美国Hyclone公司,批号:PB20041309);红细胞裂解液、刀豆蛋白A(ConA)、脂多糖(LPS)(美国Sigma公司,批号分别为:20191108、512C0310、127M4030V);四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)(北京鼎国昌盛生物技术有限责任公司,批号分别为:1223G054、20190125);细胞因子ELISA试剂盒,特异性抗体及其亚类ELISA试剂盒(上海邦奕生物有限公司,批号为:20201108、20201104、20201101);APC Anti-Mouse CD3e、FITC Anti-Mouse CD4、PE Anti-Mouse CD8a(Tonbo Biosciences公司,批号分别为:85-17-0031-81、FMF004-1000U、CB4286178)。
1.1.4 主要仪器
V-1200可见分光光度计(上海美谱达仪器有限公司);Infinite M200 Pro多功能酶标仪(瑞士Tecan公司);恒温CO2培养箱(美国Thermo公司);PCR仪(美国BIO-RAD Thermal Cycler);Real-time PCR仪(QuanStudioTM 1 Real-Time PCR System);ACEA NovoCyteTM流式细胞仪(美国艾森公司)。
1.2 实验方法
1.2.1 实验动物分组
60只雌性ICR小鼠,适应性饲养7天后开始正式实验。随机分成对照空白组(CK)、OVA免疫对照组(OVA)、OVA+RPFRS低、中、高剂量组(50、100、200 mg/kg,即D、Z、G)。在第1~5天和第16~20天,除CK组和OVA组小鼠灌胃双蒸水之外,其他组分别灌胃对应剂量RPFRS。第6天和第21天,除CK组各只小鼠腹股沟皮下注射无菌PBS 0.2 mL外,其余各组各只小鼠腹股沟皮下注射OVA溶液0.2 mL,即其余各组每只小鼠OVA注射质量为100 μg。饲养期间各组采食、饮水自由。第36天检测各项指标,小鼠摘眼球采血,颈椎脱臼法处死,其中每组各取4只进行脾淋巴细胞增殖测定及脾脏T淋巴细胞亚群分析,剩余的细胞悬液进行脾细胞因子及转录因子mRNA相对表达量检测;4只进行脾脏自然杀伤细胞(NK)活性测定。
1.2.2 实验小鼠脾T、B淋巴细胞体外转化率测定
1.2.2.1 脾淋巴细胞悬液制备
脾淋巴细胞的制备流程参考文献[10],无菌取脾,将脾脏置于研钵中研磨,加入3.75 mL PBS缓冲液后混匀,过滤,各组清楚标记。1 500 r/min离心5 min后弃上清,加入2 mL红细胞裂解液,轻轻吹打混匀,PBS液洗涤,相同速度时间离心后,加入含10%胎牛血清的RPMI 1640完全培养液2 mL,涡旋均匀,台盼兰法计数活细胞≥95%,用RPMI 1640完全培养液调到所需浓度。
1.2.2.2 实验小鼠脾淋巴细胞增殖测定
用96孔板,除试剂空白孔(只加培养液,无细胞)外,在每个孔里添加5×106个/mL脾细胞悬液100 μL,空白组孔只加100 μL RPMI 1640完全培养液,实验孔分别加入4 μg/mL ConA稀释液、10 μg/mL LPS稀释液、10 μg/mL的OVA稀释液各100 μL,各重复3孔。于37 ℃恒温、5% CO2培育箱中44 h,各孔再分别添加5 mg/mL的MTT 20 μL,继续培养4 h,2 000 r/min离心5 min,弃上清,每孔加入150 μL 酸性DMSO,低速遮光震荡10 min,酶标仪上波长选492 nm,试剂空白孔调零后测定其余各孔的吸光度。参照文献[11]公式计算:
刺激指数SI=实验孔OD值/空白孔OD值
1.2.3 实验小鼠脾脏中NK细胞杀伤活性测定
于96孔板中加入100 μL浓度为1×107个/mL的脾细胞悬液作为效应细胞,另再取浓度为2×105个/mL YAC-1肿瘤细胞悬液(效靶比50∶1)100 μL加入上述含脾细胞的孔中,作为实验孔;另做效应细胞对照孔、靶细胞对照孔和空白对照孔。加液完毕后,于微量震荡仪上震荡片刻,置于5% CO2、37 ℃培育箱中4 h,各孔加入20 μL 5 mg/mL的MTT,继续培养4 h;2 000 r/min离心5 min,去上清,各孔再加入150 μL酸性DMSO溶液(内含4% 1N HCl),避光,于细胞板振荡器上振荡,待甲瓒结晶完全溶解后,在酶标仪492 nm处测OD值,根据公式算出NK细胞杀伤活性:
NK细胞活性=[靶细胞对照OD值-(实验组
OD值-效应细胞对照组OD值)]/靶细胞对照OD
值×100%
1.2.4 实验小鼠血清细胞因子及特异性抗体及其亚类含量检测
小鼠摘眼球取血后,室温静置2 h,3 000 r/min离心15 min,收集血清,-20 ℃保存。用ELISA法检测血清细胞因子(IL-2、IL-4、IL-10和IFN-γ)以及特异性抗体OVA-sIgG及其亚类(IgG1、IgG2a、IgG2b)含量,具体操作方法见试剂盒说明书。
1.2.5 实验小鼠脾细胞因子及转录因子的表达检测
采用qRT-PCR检测小鼠脾脏细胞因子(IL-2、IL-4、IL-10和IFN-γ)及转录因子(T-bet、GATA-3)mRNA相对表达量,具体操作及引物序列按照参考文献进行[10,11]。计算公式参照文献[12]:相对表达量=2-△△Ct,△△Ct=(Ct实验组目的基因-Ct实验组管家基因)-(Ct对照组目的基因-Ct对照组管家基因)。引物序见表1。

表1 基因及引物序列
1.2.6 实验小鼠脾脏T淋巴细胞亚群分析
采用流式细胞术检测第2次免疫后两周的小鼠脾脏中的CD3+、CD4+和CD8+T细胞的数量及CD4+/CD8+的比例。将CD3、CD4、CD8三个抗体用灭菌中性PBS稀释至0.05 μg/μL备用。而后各实验组细胞中分别加入稀释后的CD3、CD4和CD8抗体各10μL,混匀;分别设单克隆抗体单标管各1支(共3支)、1支空白管(不加染料)。4 ℃下孵育15 min(避光);各管分别加入1 mL红细胞裂解液(1×),混匀静置15 min(避光),1 500 r/min离心5 min弃上清;分别各用1 mL pH值呈中性的PBS洗涤沉淀两遍;最后用300 μL的PBS将沉淀重悬后置于冰上,立刻上流式细胞仪机器检测。
1.3 数据统计
所有数据均在SPSS 24.0软件上应用单因素方差分析(one-way ANOVA),LSD法多重比较,显著差异用P<0.05表示。
2 结果与分析
2.1 RPFRS对实验小鼠淋巴细胞增殖的影响
由表2可知,与OVA组相比,RPFRS各剂量组对T细胞和OVA的SI均差异显著(P<0.05),D组显著提高B细胞SI(P<0.05)。

表2 RPFRS对实验小鼠脾淋巴细胞增殖的影响
2.2 RPFRS对实验小鼠NK细胞杀伤活性的影响
由表3可知,RPFRS各剂量组与OVA组的NK细胞杀伤活性差异不显著(P﹥0.05),但RPFRS各剂量组均对于NK细胞的杀伤力有一定程度的提升,且以D组效果最好。

表3 RPFRS对实验小鼠NK细胞杀伤活性的影响
2.3 RPFRS对实验小鼠血清中细胞因子含量的影响
由表4可知,与OVA组相比,D组和G组IL-2、IL-4含量升高(P<0.05),G组IFN-γ含量升高(P<0.05)。

表4 RPFRS对实验小鼠血清中IL-2、IL-4、IL-10、IFN-γ含量的影响
2.4 RPFRS对实验小鼠血清中特异性抗体及其亚类含量的影响
由表5可知,与OVA组相比,各剂量RPFRS组的OVA-IgG和OVA-IgG1含量有显著提高(P<0.05),D组和G组OVA-IgG2a含量显著提高(P<0.05),D组和Z组的OVA-IgG2b含量显著提高(P<0.05)。
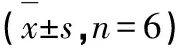
表5 RPFRS对实验小鼠血清中特异性抗体IgG及亚类IgG1、IgG2a和IgG2b含量的影响
2.5 RPFRS对实验小鼠脾脏细胞因子与转录因子表达情况的影响
RPFRS对实验小鼠脾淋巴细胞因子mRNA表达的影响如图1所示:与OVA组相比,RPFRS各剂量组IL-2 mRNA、IL-4 mRNA和IFN-γmRNA相对表达量增高(P<0.05),G组IL-10 mRNA相对表达量升高(P<0.05)(见图1A),RPFRS各剂量组对T-bet、GATA相对表达量和T-bet/GATA-3比值的提升也均不显著(P>0.05)(见图1B、1C)。

图1 RPFRS对实验小鼠细胞因子和转录因子mRNA表达量的影响
2.6 RPFRS对实验小鼠脾脏T淋巴细胞亚群影响
RPFRS对各实验组小鼠脾脏T淋巴细胞亚群的影响见图2。与CK组相比,RPFRS组的CD3+、CD4+、CD8+T细胞数均显著提升(P<0.05),OVA组的CD3+、CD4+、CD8+T细胞数量显著降低(P<0.05),D、G组及OVA组CD4+/CD8+比值显著提高(P<0.05);与OVA组相比,RPFRS组的CD3+、CD8+T细胞数和CD4+/CD8+比值显著提高(P<0.05),对CD4+T细胞的提升作用以D、Z组最为明显(P<0.05)。

图2 RPFRS对实验小鼠脾脏T淋巴细胞亚群的影响
3 讨论
T、B细胞能识别抗原,启动机体免疫,激活细胞增殖[13],而是否能诱导有效T、B淋巴细胞免疫反应的能力则可以通过刺激淋巴细胞增殖反应来显示[14]。人参茎叶皂苷能增强口蹄疫疫苗的效价,在ConA和LPS分别刺激作用下淋巴细胞的增殖[15];三七根人参皂苷可显著提升ConA、LPS和OVA各自诱导的被OVA免疫过的小鼠脾细胞增殖效果[16]。本实验结果显示,Z组能够协同ConA促进小鼠脾淋巴细胞增殖,而Z、G组能更明显地协同LPS以及OVA显著促进小鼠脾细胞的增殖,说明RPFRS能通过提升脾细胞增殖来升高体液、细胞免疫,对免疫OVA小鼠T、B细胞活力都有提高作用。
NK细胞具有天然的杀伤功能,机体固有免疫的激活能促使NK细胞的分泌,在自身免疫疾病当中起到至关重要的作用。Li等[17]发现人参皂苷Rb1能降低由于达沙替尼抑制的NK细胞杀伤作用。本实验结果表明,RPFRS组都能一定程度提高NK细胞活性,而其中低剂量RPFRS更为有效,使得YAC-1的被杀伤率更高,证明RPFRS能够提升免疫OVA小鼠机体的细胞免疫过程,增强小鼠非特异性免疫的功能。
Th细胞包括Th1细胞(产生IFN-γ、IL-2等)和Th2细胞(产生IL-4、IL-6、IL-10等),Th1可激活促炎反应,促进巨噬细胞活化、CTL细胞增殖;Th2促进B细胞的活化、增殖以及抗体的产生,Th1和Th2的平衡调节着机体的免疫反应[17]。本实验结果表明,RPFRS组IL-2、IL-4、IL-10和IFN-γ细胞因子含量升高,显示RPFRS能促进Th2型且也能促进Th1型免疫,提高细胞因子分泌程度,进而促进机体免疫。由此可知,口服RPFRS对于上述两种类型免疫都有促进作用,这可使其在临床应用方面有更广的发展空间。
机体抗体亚类的产生受不同细胞因子的影响,Th1型细胞因子促进B细胞产生IgG2a,而Th2促进机体产生IgG1[18]。Sun等[19]通过对原人参二醇和三醇皂苷联合OVA免疫小鼠后发现,二者都能提高免疫小鼠的OVA特异性抗体IgG。合欢皮总皂苷AJS75组分也被探究发现,它显著提高OVA的免疫效价,激活小鼠Th1/Th2应答[20]。本实验结果表明,各剂量RPFRS组比OVA组更能提升OVA特异性IgG抗体及其亚类含量,说明RPFRS能够促进Th1及Th2型免疫,刺激机体分泌特异性抗体,这与上述文献中的结果保持一致。
T-bet和GATA-3与Th1/Th2的分化密切相关,二者可通过调节细胞因子的分泌及mRNA的表达等进而影响Th1/Th2之间的动态平衡[21]。Su[22]的研究表明,人参皂苷Rg1和Re能通过提升IFN-γ等相关细胞因子的mRNA表达,来提高由OVA引起的小鼠免疫力。Wang等[23]在小鼠身上进行的实验表明,人参茎叶总皂苷与硒联合可通过上调T-bet/GATA-3 mRNA的表达,从而对伪狂犬病减毒疫苗的免疫应答呈佐剂作用。本实验结果表明,中剂量RPFRS能显著提高IL-4 mRNA的表达、高剂量RPFRS显著促进IL-10 mRNA的表达,且RPFRS各组均能一定程度提升T-bet、GATA-3表达及T-bet/GATA-3之比,说明RPFRS既能够通过促进有关细胞因子及转录因子mRNA的表达来促进Th1/Th2反应的产生,从而提升机体的细胞免疫作用,加强机体对OVA的应答。
T淋巴细胞亚群情况展示了机体整体的细胞免疫状态,CD3+、CD4+、CD8+T细胞的数量以及CD4+/CD8+的比例平衡可显示机体免疫状态[24,25],其中CD4+和CD8+T细胞主要由细胞免疫介导[26]。Qi等[27]发现人参皂苷Rh2及其主要代谢产物R-PHQ和S-PHQ可提高环磷酰胺诱导的免疫功能低下小鼠的免疫应答:通过阻止免疫器官萎缩,促进脾细胞增殖,恢复CD4+/CD8+比例。本实验结果表明,相对OVA组,RPFRS各组均能显著提升CD3+、CD8+T细胞数及CD4+/CD8+比值,D、Z组能明显提高CD4+T细胞数,说明RPFRS具有平衡机体,提升T细胞免疫,加大免疫应答的作用。
通过以上指标测定的结果显示,RPFRS能提升OVA免疫后的小鼠的体液、细胞免疫应答,比OVA免疫对照的小鼠更能够持久地让机体产生应答和提升小鼠免疫功能,证明RPFRS具有作为免疫佐剂的良好潜力,实验中不同剂量太子参参须皂苷作用时,三种剂量在某些指标上各有优势,因此需对最优浓度做进一步筛选,同时,太子参参须皂苷具体有效成分及作用机制尚未完全阐明,有待进一步研究。

