脾脏血管性病变与淋巴瘤CT鉴别诊断
井 勇,付文荣,李刚锋,雷学斌,袁 逍
(空军军医大学唐都医院放射科,陕西 西安 710038)
脾脏是人体最大的免疫器官,其疾病谱相当广泛,脾脏病变越来越被临床及放射科医生所关注,脾脏实性病变以血管性病变与淋巴瘤最为常见[1-2],两者临床路径截然不同,因此,本文探讨血管性病变与淋巴瘤CT表现,旨在治疗前准确评价脾脏病变。
1 材料与方法
1.1 一般资料
收集2014年5月至2019年6月经空军军医大学唐都医院病理证实的脾脏血管性病变11例,淋巴瘤9例(排除3例仅表现为巨脾病例),18例行脾脏手术切除,2例行经皮穿刺。年龄30~71岁,平均52.6岁。13例女性,7例男性。无症状者16例(80%),左腹不适者3例(15%),感乏力者1例(5%);2例(10%)伴有乙型病毒型肝炎。
1.2 检查方法
患者行腹部平扫及增强CT检查,扫描范围视个体而定,采用PHILIPS256层CT(BrillianceiCT)。CT扫描参数:管电压120 KV,管电流依个体情况而定,螺距0.984,矩阵为512×512,重建层厚和层间距均为5 mm;增强CT扫描右肘静脉以3 mL/s速率团注碘佛醇(320 mg/mL,用量1.3~1.5 mL/kg)及40 mL生理盐水后,监测腹主动脉CT值,>100 HU时采集动脉期图像,分别间隔20 s、40 s采集静脉期及延迟期图像。
在图像存档和通讯系统(PACCS)测量脾脏大小、病变大小、数目、有无液性区、钙化、平扫及增强CT值。影像评估由两名高年资医师完成,意见不统一时协商结果。①脾脏大小用脾脏指数[3]评估;②病变大小用其轴位、矢位及冠位直径的均值评估;③增强扫描感兴趣区(Regionofinterest,ROI)参照平扫画取位置、面积相近的ROI,平扫CT值<20 HU且增强后CT值变化<10 HU认定为液性成分;增强后病变CT值与平扫CT值之差为增强幅度;④病变数量≥2认为是多发;⑤本文旨在区分两组直接CT征象的差别,故未统计淋巴结肿大及邻近组织侵犯。
1.3 统计学方法
应用SPSS20进行统计分析,计量资料用均数±标准差记录,计量资料运用独立样本t检验,计数资料用Pearson卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床与病理学检查结果
11例脾脏血管性疾病包括:脾脏海绵状血管瘤(splenic cavem ous hemangioma,SCH)6例,窦岸细胞血管瘤(littoral cell angioma,LCA)3例,硬化性血管瘤样结节性转化(sclerosing angiomatoid nodular transformation,SANT)2例。9例淋巴瘤包括:非何杰金氏B细胞淋巴瘤8例,节外NK/T细胞淋巴瘤1例,其中4例无脾脏或脾门以外病变。1例血管瘤伴乙肝,1例淋巴瘤伴乙肝。
2.2 两组间基本资料与CT征象比较
脾脏血管性疾病与脾脏淋巴瘤两组性别比例差异有统计学意义,而发病年龄无统计学差异。淋巴瘤组脾脏指数大于血管性疾病组,差异具有统计学意义;两组间病变数量、有无液化、钙化、病变大小差异无统计学意义,两组间平均CT值仅动脉期强化幅度具有统计学差异(见表1)。
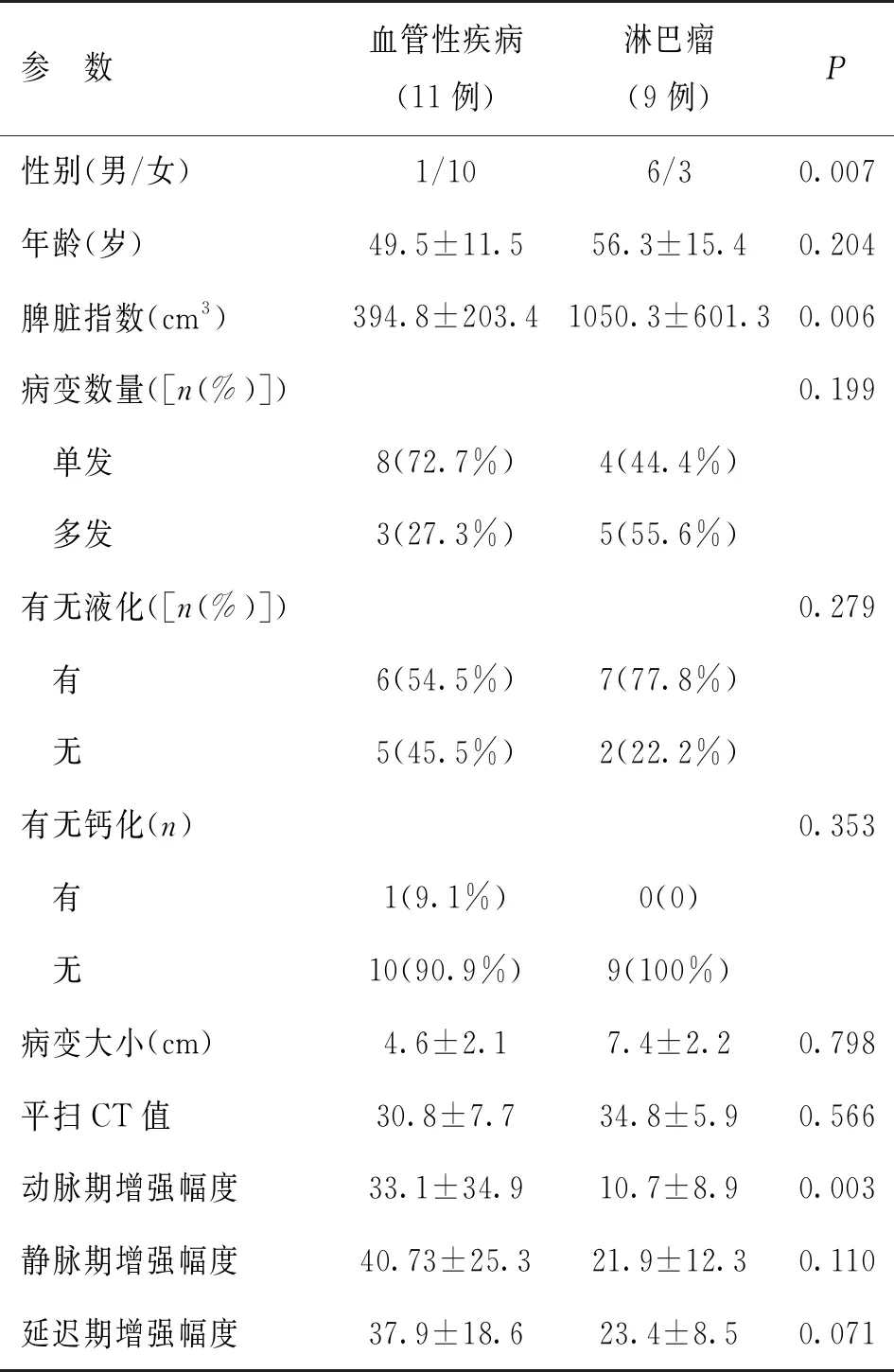
表1 两组病例间基本资料及CT征象比较
脾脏血管性病变CT强化方式多样,11例平扫均呈低密度;6例海绵状血管瘤中,3例呈分隔状强化,2例实质部分呈不均匀强化,内可见出血、囊变区(见图1-A);1例呈渐进、填充式强化,延迟期呈等密度(见图1-B)。3例窦岸细胞血管瘤1例呈“辐轮状”强化,2例呈“雀斑征”(见图1-C与图1-D)。2例SANT中1例为2个病灶;1例呈渐进性填充强化,延迟期呈等密度;1例呈“辐轮状”强化(见图1-E)。
脾脏淋巴瘤肿块CT平扫呈局限性低密度影,病变内可见液化坏死,实质部分呈中度强化且强化均匀,边界较清楚(图1-F)。

注:图A女性,56岁,术后病理脾脏海绵状血管瘤,伴出血、坏死。CT示脾脏内团块状混杂密度影,较高密度CT值约41HU,增强后病变呈不均匀性强化,三期CT值分别为55、85、85HU,边界较清楚。图B女性,35岁,术后病理脾脏海绵状血管瘤伴陈旧性出血。CT示脾脏内类圆形病变,CT值约36HU,增强后病变呈渐进性强化,延迟期呈等密度,三期CT值分别为:109、87、79HU。图C、图D女性,60岁,术后病理脾脏窦岸细胞血管瘤。增强脾脏内见多发大小不一低密度影,呈雀斑状改变。图E女性,59岁,术后病理脾脏硬化性血管瘤样结节性转化。增强脾脏病变呈辐轮状强化,三期CT值约54、71、80HU。图F男性,30岁,术后病理脾脏B细胞型非何杰金氏淋巴瘤。脾脏病变实质部分静脉期呈均匀、轻中度强化,CT值约49HU,较小病变内可见液化坏死区。
3 讨论
脾脏淋巴瘤往往会伴有真性脾脏增大,而脾脏血管性病变只引起脾脏局限性增大。但临床引起脾大的原因很多,且正常脾脏大小差异较大,脾脏大小评估较难[1,3]。本研究脾脏血管性疾病及脾脏淋巴瘤间病变数量、有无液化、钙化、病变大小无统计学差异,11例血管性疾病中,3例(23.7%)为多发,2例为窦岸细胞血管瘤,1例为SANT,与文献SANT报道略有不同[4-5],这可能与样本不同有关。虽然本组血管性疾病中仅1列(9.1%)出现钙化,但淋巴瘤组无钙化表现,因此,钙化依然可以作为两者鉴别点。两组间平扫CT均值无统计学差异,是由于CT平扫脾脏血管性疾病及淋巴瘤绝大多数表现为低密度,但也有个案报道淋巴瘤平扫表现为高密度[6];CT增强后仅动脉期强化幅度具有统计学差异,本组淋巴瘤动脉期平均增强幅度约为10.7HU,表现为无或轻度强化,而血管性病变组平均强化幅度约为33.1HU,呈中度或明显强化;本组脾脏淋巴瘤静脉期及延迟期平均强化幅度相近,分别约为21.9、23.4HU,呈中度强化,与文献报道相似[7]。淋巴瘤实质部分强化均匀,与脾脏血管性病变不同,当病变侵犯邻近结构及伴有淋巴结肿大支持淋巴瘤诊断[7-8]。脾脏海绵状血管瘤、窦岸细胞血管瘤是脾脏常见的良性肿瘤;海绵状血管瘤由于出血、钙化、囊变而影像表现多样,典型表现为渐进性、填充式强化[2,8];窦岸细胞血管瘤是脾脏特有良性肿瘤,影像表现多样,典型表现为“雀斑征”[9]。SANT是脾脏非肿瘤性血管性病变,可出现透明样变性及钙化[4],典型表现为“辐轮征”、“星芒征”[5,10]。虽然脾脏血管瘤、窦岸细胞瘤及SANT其CT表现有一定重叠,但其强化幅度、强化方式与脾脏淋巴瘤截然不同。
临床上实性病变还应与脾脏转移瘤相鉴别,但脾脏转移瘤多为恶性肿瘤终末期表现,典型病变呈环形强化[11],临床诊断不难;脾脏其他实性肿瘤罕见,影像学征象难以统计。
本研究为回顾性研究,存在以下不足:本文是单中心研究,样本量较小,且脾脏病变发病率本身较低。
综上所述,脾脏血管性疾病与脾脏淋巴瘤CT强化幅度、强化方式差别较大,CT能够较好地区分两者,给临床提供诊疗依据。

