胃食管连接部收缩指数对区分功能性烧心与难治性胃食管反流病的作用
李 福,郑冬菊
难治性胃食管反流病(refractory gastroesophageal reflux disease,RGERD)是指临床胃食管反流病患者接受8周的标准剂量质子泵抑制剂(proton pump inhibitor,PPI)治疗后,其临床症状仅部分缓解或未得到缓解[1]。RGERD患者胃内容物多次反流至食管内容易引发烧心症状,其中以非糜烂性反流病(non-erosive reflux disease,NERD)患者出现烧心症状较为常见[2]。既往临床普遍认为典型烧心属于GERD特有症状,而随着食管反流监测的深入探索,有研究指出,烧心症状并非单一疾病所特有,而是一组具有异质性的不同疾病群体的症状,例如功能性烧心(functional heartburn,FH)[3]。近年来,有研究发现,胃食管连接部收缩指数(esophagogastric junction contractile index,EGJ-CI)可对胃食管的长度、压力及呼吸变化进行反应,有助于临床分析胃食管的功能[4]。本研究对70例具有典型烧心症状患者实施EGJ-CI等参数测定,并深入解析功能参数对区分RGERD与FH的意义,现报道如下。
1 资料与方法
1.1 一般资料
选取山东单县东大医院2018年3月至2020年10月收治的70例具有典型烧心症状患者作为观察对象,根据相关检查结果分为实验A组与实验B组。两组患者性别、年龄、BMI及胃食管反流问卷(gastroesophageal reflux questionnaire,Gerd-Q)等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准同意。
纳入标准[5]:患者烧心症状持续超过6个月,且近期存在明显不适感;胃镜检查食管黏膜未受损;均知情同意加入。排除标准[6]:既往有消化道器质性疾病及腹部手术史;合并心、肝、肾等重要脏器功能障碍者;存在食管动力障碍的患者;由于各种原因无法接受胃镜检查及24 h pH-阻抗监测者;妊娠或哺乳期的妇女;精神异常、配合度差者。
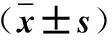
表1 两组患者一般资料比较
1.2 方案
1.2.1 24 h食管阻抗-pH监测技术①选用Ohmega动态pH-阻抗联合监测系统(荷兰MMS),阻抗导管分布金属电极环(8个),每两个相邻的阻抗电极环组成1个阻抗测量通道,二者间距2 cm,阻抗通道分别设为zl(与导管末端的距离为17 cm)、z2(15 cm)、z3(9 cm)、z4(7 cm)、z5(5 cm)及z6通道(3 cm);并将1个pH电极置于距导管末端大约5 cm处。调节采样频率为50 Hz,对6个阻抗通道信号进行记录。监测所得数据均使用便携式记录仪进行保存。②具体操作:所有受试者在检查前1周停服各种影响上消化道动力的药物(如PPI、吗丁啉等);检查前进行8 h禁食、4 h禁水保持空腹状态,利用缓冲液(pH4.0及7.0)对pH电极导管进行校准后再开展检查;患者取坐位,对导管进行定位(pH阶梯法):经鼻腔插入pH-阻抗导管至食管,再逐步插入胃内,随后进行缓慢回拉;若pH值从4以下骤升至5以上即可判定导管处于突然升到>5时判断为食管下括约肌下缘,对其至门齿的距离进行多次测量取均值;再将pH电极导管移动至LES上方5 cm的位置,6个阻抗电极导管分别置于LES上方3、5、7、9、15及17 cm部位后,妥善固定导管,运用记录仪对其24 h pH-阻抗变化情况进行监测。监测期间嘱咐患者对自身进食、烧心等反流症状进行详细记录,并告知受检者尽可能保持良好饮食及作息习惯(忌食酸性食物、忌饮咖啡及浓茶),以确保监测所得结果的真实性。24 h后将患者体内监测导管拔出,将记录仪内相关数据导入计算机系统,并采用专业软件分析数据。高分辨测压:①检查前晚禁食,借助固态测压系统(测压导管有36个通道,各通道间距为1 cm)对患者进行检测,检查前注意对导管进行预热;②具体操作:嘱患者摆放平卧位,经鼻置入导管至合适深度后进行固定;待患者适应导管后,嘱其30 s内避免做吞咽动作,快速测量记录食管基础压力水平,随后予以患者蒸馏水,再每隔30 s进行1次吞咽(每次5 mL,进行10次),并进行3次干咽动作,随后拔除导管,对测得的压力数据进行分析。
1.2.2 监测指标①酸暴露评估:酸暴露时间(acid exposure time,AET)是评价患者有无异常酸暴露的主要指标,AET指LES上方5 cm处经pH电极测得的pH低于4的时间占总监测时间的百分比,AET在4.2%以上即可判定为患者存在异常酸暴露;②症状相关性分析:针对存在烧心、反流症状患者实施监测后发现,其可分为两种情况,即与反流相关(包括酸反流与非酸反流)和与反流无关。借助症状相关指数(symptom index ,SI)及症状相关概率(symptom association probability,SAP)对患者实施评估,若SI达到并超过50%和(或)SAP超过95%可判定为阳性;③反流物类型:测定反流物的pH值,可分为酸反流、弱酸反流及弱碱反流。
1.3 观察指标
①比较两组食管胃交接部动力功能参数:EGJ-CI、胃食管收缩积分(esophagogastric junction contractile integral,EGJ-CIT)、胃食管静息压力及4 s综合松弛压(integrated relaxation pressure 4 s,IRP4s)。②统计两组患者酸暴露时间、pH<4时长占比、强酸反流次数及DeMeester积分。③通过ROC曲线分析EGJ-CI诊断RGERD的敏感度及特异性。
1.4 数据处理
2 结果
2.1 两组患者食管胃交接部动力功能参数比较
两组患者EGJ-CI、EGJ-CIT、胃食管静息压力以及IRP4s等功能参数比较,差异有统计学意义(P<0.05),见表2。
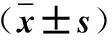
表2 两组患者食管胃交接部动力功能参数比较
2.2 两组患者胃食管反流情况比较
实验A组患者酸暴露时间、pH<4时长占比、强酸反流次数及DeMeester积分等胃食管反流参数与实验B组相比,差异有统计学意义(P<0.05)。见表3。
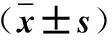
表3 两组患者胃食管反流情况比较
2.3 ROC曲线
绘制ROC曲线,分析EGJ-CI及EGJ-CIT对RCERD与FH的判定效果,结果显示,ROC曲线下面积(AUC)为0.69,EGJ-CI临界值处于10.23 mmHg·cm-1时,其区分RGERD与FH的灵敏度为81.57%,特异度为53.26%。见图1。
3 讨论
胃食管连接部解剖结构分析可发现,其通过食管括约肌、膈脚功能以及呼吸变化构成人体抗反流屏障,当抗反流屏障受各种因素影响出现功能下降的情况时,容易引发RGERD[7]。临床针对RGERD的诊断方法较多(例如24h食管阻抗-pH监测),不过这些检查费时且费力,患者接受程度低,因此,临床提出采用高分辨测压方式进行判定。有报道指出,EGJ-CI能够对RGERD患者机体抗反流屏障功能变化情况进行反映,其可作为临床疾病诊断的辅助指标,从而有助于医师准确区分GERD与FH[8]。

图1 EGJ-CI及EGJ-CIT判定RGERD的ROC曲线
既往研究指出,EGJ-CI参数对存在烧心症状患者是否发生胃食管反流情况具有较高灵敏性,用于RGERD与FH鉴别中意义重大[9]。相关报道指出,RGERD患者接受PPI治疗后其强酸反流情况显著减少,但弱酸反流比例反而增加[10]。有学者分析24 h食管阻抗-pH监测技术监测所得结果,发现RGERD中有2/3患者烧心症状的发生与弱酸反流有关[11]。上述结论均说明RGERD(食管高敏性)患者治疗后临床症状仍未能得到有效缓解的原因可能与弱酸反流密切相关。RGERD与FH患者临床表现极为相似,有研究对两种疾病患者采用Gerd-Q进行评分,结果发现,二者评分并无明显差异;因此需要敏感度更高的指标进行区分[12]。胃酸刺激可能会对抗反流屏障造成破坏,导致其功能异常。本研究结果显示,EGJ-CI数值较高的实验A组患者酸暴露时间、pH<4时长占比、强酸反流次数及DeMeester积分等胃食管反流参数均优于EGJ-CI数值偏低的实验B组,差异有统计学意义,充分说明测定EGJ-CI数值可一定程度上反映患者胃反流严重程度。FH发病机制目前临床尚未明确,但普遍认为本病发生与内脏高敏感存在一定联系。王艳等[13]研究指出,当EGJ-CI水平处于临界值时(即35.8 mmHg·cm-1),其区分RGERD与FH的灵敏度高达76.0%,特异性为62.5%,AUC为0.69(95%CI0.57~0.81)。本研究通过分析RGERD与FH患者的食管胃交接部功能,发现实验A组患者EGJ-CI水平显著高于实验B组,差异有统计学意义,进一步证实EGJ-CI指标用于RGERD与FH患者鉴别诊断中可发挥积极作用。
综上所述,EGJ-CI能够反映人体抗反流屏障功能变化情况,该参数RGERD患者与FH患者中存在一定差异,有助于临床医师区分RGERD与FH。但本研究也存在一定不足,例如研究样本数量少、未引用ROC曲线分析EGJ-CI判定RGERD患者的敏感度及特异度,故今后临床可进一步扩大研究样本数量、分析EGJ-CI等功能参数的ROC曲线,更加深入探讨EGJ-CI对临床RGERD与FH的鉴别诊断意义。

