红细胞分布宽度、中性粒细胞/淋巴细胞比值预测原发性高血压伴颈动脉粥样硬化的临床价值
郭芝姣,姚 巍
原发性高血压是由于遗传或不明原因所致的,以血压升高为主要临床表现,伴有或不伴有多种心血管危险因素的综合征,常引起心脑肾等靶器官损害。颈动脉粥样硬化(carotid atherosclerosis,CAS)常作为评估高血压危险分层的主要因素。有研究表明,机体炎症反应和免疫系统反应在高血压发病机制中发挥着重要的作用[1]。炎症、氧化应激在CAS中具有核心作用,红细胞分布宽度(red blood cell distribution width,RDW)、中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)均参与炎症反应、氧化应激,其相互影响,互为因果,相互促进,形成恶性循环,最终加重靶器官损害。颈动脉病变常表现为颈动脉内膜-中膜厚度(carotid intima-media thickness,CIMT)增厚和颈动脉粥样斑块。CIMT、斑块情况可预测全身动脉粥样硬化严重程度,其中早期CAS表现形式为CIMT增厚,动脉粥样硬化晚期表现形式是管腔狭窄[2]。CAS作为全身动脉粥样硬化中的一部分,临床常将其作为反映全身动脉粥样硬化性疾病形成和演变的指标[3]。RDW同时受到炎症和氧化应激的影响,NLR是炎症标志物,与颈动脉粥样硬化关系密切。本研究旨在分析RDW、NLR及两者联合预测原发性高血压伴CAS的临床价值。
1 资料与方法
1.1 一般资料 选取2020年6月—2021年6月山西医科大学第二医院心内科及老干科收治的原发性高血压病人99例,其中男54例,女45例,年龄(55.81±14.33)岁。根据颈动脉超声结果分为CAS组(73例)和非CAS组(26例);根据crouse斑块积分将CAS组分为内膜增厚组(20例)和斑块组(53例)。
1.2 纳入与排除标准 根据《中国高血压防治指南(2018年修订版)》[4]高血压诊断标准:未服用抗高血压药情况下,3次非同日测量,收缩压≥140mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg诊断为高血压;既往有高血压病史,现在正服用降压药,血压<140/90 mmHg,也可诊断为高血压。排除标准:继发性高血压、冠心病;急性感染性疾病;血液系统及风湿系统疾病;恶性肿瘤,近期使用影响血常规的药物;严重肝、肾功能障碍;近1个月内有手术、外伤及输血史;检查资料不完整。
1.3 检测方法 ①一般资料及血液指标,一般资料包括年龄、性别、吸烟、体质指数(BMI)等。入院后次日清晨抽取空腹静脉血,送至山西医科大学第二医院检验科,检测所有病人中性粒细胞计数、淋巴细胞计数、RDW及NLR。②CIMT,采用颈动脉彩色多普勒超声(飞利浦)行颈动脉超声检查,检查部位包括双侧颈总动脉起始段、中段及分叉部、颈内动脉颅外段。CIMT<1.0 mm且未发现颈动脉斑块为非CAS组;CIMT≥1.0 mm且无斑块形成为内膜增厚组;存在斑块纳入斑块组,采用crouse斑块积分得到斑块厚度。crouse积分[5-6]计算标准:不考虑各个斑块长度情况下,依次测量并记录双侧颈动脉内各个独立斑块厚度,双侧所有斑块最大厚度总和即为crouse积分。
1.4 观察指标 ①比较CAS组和非CAS组RDW、NLR、CIMT差异;②比较内膜增厚组和斑块组RDW、NLR差异;③分析RDW、NLR及两者联合与原发性高血压病人伴颈动脉粥样硬化的相关性,并明确预测价值。

2 结 果
2.1 CAS组和非CAS组临床资料比较 CAS组RDW、NLR、年龄均高于非CAS组(P<0.001)。详见表1。

表1 CAS组和非CAS组临床资料比较
2.2 多因素Logistic回归分析CAS发生的独立危险因素 为进一步分析CAS的独立危险因素,将单因素分析中差异有统计学意义的变量(年龄、RDW、NLR)纳入多因素Logistic回归中,因变量为是否发生CAS,自变量为年龄、RDW、NLR,结果显示:NLR、RDW、年龄是CAS的独立危险因素。NLR每升高1个单位CAS的危险增高2.233倍,RDW每升高1个单位CAS的危险增高2.140倍,年龄增加1岁CAS的危险增加1.071倍。详见表2。
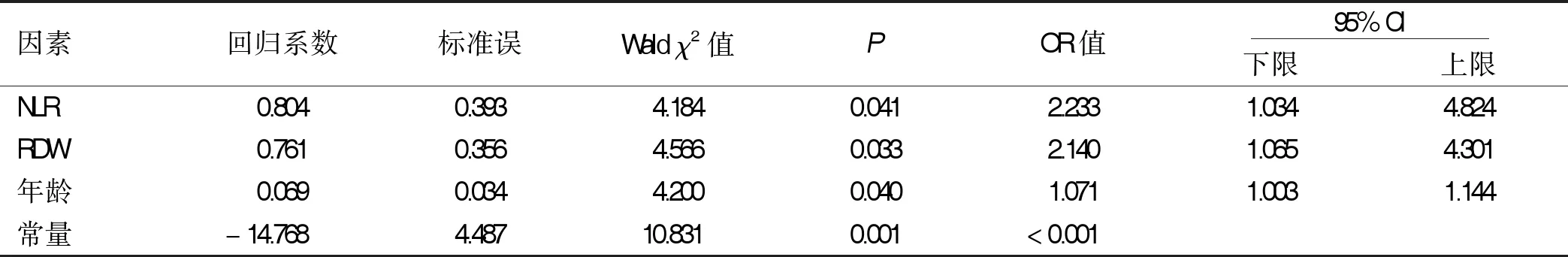
表2 多因素Logistic回归分析CAS发生的独立危险因素
2.3 内膜增厚组和斑块组临床资料比较 斑块组RDW、NLR、年龄均高于内膜增厚组(P<0.05或P<0.001)。详见表3。

表3 内膜增厚组和斑块组临床资料比较

(续表)
2.4 多因素Logistic回归分析斑块发生的独立危险因素 为进一步分析斑块发生的独立危险因素,将单因素分析中差异有统计学意义的变量(年龄、RDW、NLR)纳入多因素Logistic回归中,因变量为是否存在斑块,自变量为年龄、RDW、NLR,结果显示:NLR、RDW是斑块的独立危险因素。NLR每升高1个单位斑块的危险增高1.830倍,RDW每升高1个单位斑块的危险增高6.366倍。详见表4。

表4 多因素Logistic回归分析斑块发生的独立危险因素
2.5 RDW、NLR及联合预测原发性高血压伴CAS的临床价值 ROC曲线结果显示:RDW、NLR、RDW联合MLR预测高血压伴CAS的AUC分别是0.908,0.873,0.913;95%CI分别为[0.851,0.965]、[0.805,0.940]、[0.858,0.968];最佳截断值为12.95%、2.52;灵敏度为0.740,0.795,0.849;特异度为1.000,0.923,0.923。提示RDW、NLR、RDW及NLR联合均有一定的预测价值,两者联合预测价值更高。详见表5、图1。

表5 RDW、NLR及联合预测阵发性高血压伴CAS的临床价值

图1 RDW、NLR及联合预测原发性高血压伴CAS的ROC曲线
3 讨 论
原发性高血压是临床常见的导致心脑血管疾病因素之一,常引起心、脑、肾、血管等靶器官损害。动脉粥样硬化是高血压的常见并发症,高血压与动脉粥样硬化存在许多共同的危险因素和发病机制,且二者相互促进、互为因果,最终导致动脉粥样硬化性心脑肾血管系统疾病的发生和发展[7]。相关研究显示,动脉粥样硬化是一种慢性伴随自身免疫反应的全身炎症性疾病[8]。动脉壁内皮细胞炎症反应作为动脉粥样硬化的临床征兆[9-10],其内含有各种炎症细胞,如活化的T淋巴细胞、巨噬细胞和肥大细胞,炎症细胞募集,进而启动斑块内免疫炎症反应[11-12]。近年来NLR和RDW作为血液炎性标志物备受关注。
有研究显示,炎症和氧化应激通过损害铁代谢和缩短红细胞寿命,调节骨髓对促红细胞生成素的反应,RDW升高提示机体存在潜在的炎症过程[13]。本研究结果显示,CAS组RDW高于非CAS组,差异有统计学意义(P<0.001);斑块组RDW高于内膜增厚组,差异有统计学意义(P<0.001);RDW预测高血压伴CAS的AUC为0.908,95%CI[0.851,0.965],最佳截断值为12.95%,灵敏度为0.740,特异度为1.000,提示有一定的预测价值。吴轶等[14]研究显示,原发性高血压病人RDW与高血压靶器官损害具有相关性。CIMT与RDW呈正相关[15]。
作为免疫系统的重要元素,白细胞及其亚型中性粒细胞、淋巴细胞在炎症反应和免疫反应中发挥着重要的作用。NLR可从白细胞相关参数计算出来,将中性粒细胞的非特异性炎症和淋巴细胞的特异性免疫反应结合成一种单一的炎症生物标志物。本研究结果显示,CAS组NLR高于非CAS组,差异有统计学意义(P<0.001);斑块组NLR高于内膜增厚组,差异有统计学意义(P<0.001);NLR预测高血压伴CAS的AUC为0.873,95%CI[0.805,0.940],最佳截断值为2.52,灵敏度为0.795,特异度为0.923。结果表明原发性高血压伴CAS组中亚分类斑块组NLR高于内膜增厚组,说明动脉粥样硬化发生发展过程与NLR介导的炎症反应密切相关,且颈动脉粥样硬化程度越严重,NLR越高[16]。
RDW与NLR联合预测原发性高血压伴颈动脉粥样硬化的AUC为0.913,95%CI[0.858,0.968],灵敏度为0.849,特异度为0.923,提示两者联合诊断的预测价值更高。RDW与NLR联合在冠心病、慢性阻塞性肺疾病、风湿性关节炎等多系统疾病中的诊断价值均有相关报道,在CAS方面暂无报道,为本研究的创新之处。
综上所述,RDW、NLR作为临床上易获取、方便的血液炎性指标,有助于早识别、早干预高危病人,提供了便捷的初步筛查工具,为降低病人不良事件发生,改善预后提供了预测价值。今后在控制血压、血脂基础上通过抑制促炎细胞因子靶向对抗炎症反应过程,可能成为一种新型治疗模式。

