MicroRNA-146a 对急性胰腺炎胰腺腺泡细胞增殖及凋亡的影响及其机制研究*
王宝友,潘宏年,王修中,王凤,汪发勇
(六安市人民医院 消化内科,安徽 六安 237005)
急性胰腺炎是以胰腺局部炎症反应为主要特征的急腹症之一,具有起病急、进展快及病死率高的特点。有研究表明,胰腺腺泡细胞凋亡是急性胰腺炎发生、发展的关键[1-2],因此探寻急性胰腺炎新型生物治疗靶标有效抑制胰腺腺泡细胞凋亡已成为临床研究热点。MicroRNA(miRNAs)是一种内源性非编码小分子RNA,参与细胞增殖、凋亡等生理过程[3]。MicroRNA-146a(miR-146a)是miRNAs 家族一员。张高峰等[4]研究显示,急性重症胰腺炎患者外周血miR-146a 水平显著低于轻度胰腺炎患者,其异常低表达与病情严重程度有关。目前有关miR-146a 对急性胰腺炎胰腺腺泡细胞的生物学影响尚未见报道,因此本研究探讨miR-146a 对急性胰腺炎胰腺腺泡细胞凋亡的影响,并分析相关机制,以期为临床提高急性胰腺炎治疗效果提供一定理论基础。
1 材料与方法
1.1 细胞来源
大鼠胰腺腺泡细胞系MPC-83 细胞株购自北京百欧博伟生物技术有限公司。
1.2 主要试剂及仪器
1.2.1主要试剂胎牛血清(fetal bovine serum,FBS)、RPMI-1640 培养液(武汉纯度生物科技有限公司),雨蛙素(纯度≥98%,规格1 mg,上海恒斐生物科技有限公司),肿瘤坏死因子-α(tumor necrosis factor- α, TNF- α)、 白细胞介素 6(Interleukin-6, IL-6)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(上海广锐生物科技有限公司),LipofectamineTM2000(上海远慕生物科技有限公司),miR-146a-mimics-NC、miR-146a-mimics 序列由南通百奥迈科生物技术有限公司设计合成,凋亡双染试剂盒(上海玉博生物科技有限公司), 兔抗鼠增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein, Bax)、B 淋巴细胞瘤2(B cell lymphoma 2, Bcl-2)、核转录因子-κB p65(nuclear factor-κB p65, NF-кB p65)及内参甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)一抗、HRP 标记的山羊抗兔二抗(武汉菲恩生物科技有限公司)。
1.2.1主要仪器酶标仪(美国Thermo Fisher 公司),培养箱(日本Sanyo 公司),流式细胞仪(美国贝克曼库尔特有限公司)。
1.3 MPC-83细胞培养及急性胰腺炎模型的构建
1.3.1细胞培养将MPC-83 细胞解冻并复苏,于含10%灭活FBS、100 u/mL 青霉素、链霉素100 μg/mL的RPMI 1640 培养液,37℃、5%二氧化碳培养箱中培养,每2~3天换液1次(无菌操作),传代培养。
1.3.2急性胰腺炎模型的构建模型建立前1 天取对数生长期的MPC-83 细胞按2.5×104个/孔的密度接种于24 孔板,培养24 h 后用100 nmol/L 雨蛙素刺激6 h,继续培养12 h,收集上清液。采用ELISA检测TNF-α、IL-6 水平。本研究显示,雨蛙素处理的MPC-83 细胞TNF-α、IL-6 水平高于未经雨蛙素处理的MPC-83 细胞(P<0.05),表明急性胰腺炎模型建立成功[5],可用于后续实验。
1.4 方法
1.4.1细胞转染及分组取雨蛙素处理的细胞按2.5×104个/孔的密度接种于24 孔板,培养24 h 后更换无FBS 的培养液,随机分为两组。①阴性对照组(mimics-NC 组): 采用LipofectamineTM2000 将mimics-NC 序列转染至MPC-83 细胞;②过表达miR-146a 组(miR-146a-mimics 组) : 采 用LipofectamineTM2000 将miR-146a-mimics 序列转染至MPC-83 细胞。以未经雨蛙素处理的细胞为空白对照组(NG 组)。继续培养细胞48 h,比较3 组细胞绿色荧光强度。每组设置6 个复孔,重复3 次。
1.4.2实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测细胞miR-146a 的表达分别提取3 组MPC-83 细胞总RNA 并测浓度,以RNA 为模板逆转录为cDNA,进行qRT-PCR 反应。反应体系20 μL:ULtra SYBR mixture 10 μL、模板cDNA 2.0 μL、正反向引物各2.0 μL、去离子纯化水4.0 μL。反应条件:95℃预变性15 s,60℃变性60 s,共40 个循环;熔解曲线:60℃、95℃,每15 秒升温0.3℃。以U6 为内参,采用2-ΔΔCt法计算miR-146a 相对表达量。qRTPCR 引物由上海韵泰信息科技有限公司设计并合成,引物序列见表1。
1.4.3MTT法检测细胞增殖取3 组MPC-83 细胞胰酶消化后按2.5×104个/孔的密度接种至24 孔板,每孔加入20 μL 质量浓度为5 mg/mL 的MTT 试剂,培养2 h 后弃上清,加入150 μL DMSO,振荡,用酶标仪检测490 nm 处各孔细胞光密度(optical density, OD)值,计算细胞增殖抑制率。细胞存活率(%)=实验组OD 值/NG 组OD 值×100%。每组重复3 次。
1.4.4流式细胞仪检测细胞凋亡取3 组MPC-83细胞,参照Annexin V-FITC/PI 细胞凋亡双染试剂盒,取浓度为1×106个/mL的细胞悬液100 μL,加入5 μL Annexin V/PITC+10 μL PI(20 μg/mL),混匀,避光孵育30 min,采用流式细胞仪检测凋亡率,每组重复3 次。
1.4.5ELISA 检测细胞TNF-α、IL-6 水平收集3 组细胞上清液,采用ELISA 检测各组细胞TNF-α、IL-6 水平,严格按照试剂盒说明书进行操作。
1.4.6Western blotting 检测PCNA、Bax、Bcl-2、NFкB p65 蛋白的表达取3 组MPC-83 细胞,加入裂解液裂解30 min,离心取上清液,电泳、转模,5%脱脂牛奶封闭3 h,加入兔抗鼠PCNA、Bax、Bcl-2、NF-кB p65 及内参GAPDH 作为一抗(1∶500稀释),4℃过夜。加入HRP 标记的山羊抗兔二抗(1∶1 000 稀释)孵育1 h。显色、成像,计算蛋白相对表达量。
1.5 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 细胞转染效果比较
NG 组、mimics-NC 组、miR-146a-mimics 组miR-146a 相对表达量分别为(1.00±0.15)、(0.99±0.16)、(1.87±0.25),经方差分析,差异有统计学意义(F=408.873,P=0.000)。与mimics-NC 组比较,miR-146a-mimics 组miR-146a 相对表达量升高(P<0.05)。mimics-NC 组、miR-146a-mimics 组可见较强绿色荧光,表明细胞转染成功。见图1。

图1 细胞转染效果 (×400)
2.2 各组细胞增殖情况比较
NG 组、mimics-NC 组、miR-146a-mimics 组细胞存活率分别为(100.00±0.00)%、(99.96±0.06)%、(128.69±8.97)%,经方差分析,差异有统计学意义(F=499.735,P=0.000)。与NG 组、mimics-NC 组比较,miR-146a-mimics 组细胞存活率升高(P<0.05)。
2.3 各组细胞凋亡情况比较
NG组、mimics-NC组、miR-146a-mimics组细胞凋亡率分别为(39.11±5.86)%、(41.01±6.01)%、(18.76±2.82)%,经方差分析,差异有统计学意义(F=407.634,P=0.000)。与NG组、mimics-NC组比较,miR-146amimics 组细胞凋亡率降低(P<0.05)。见图2。

图2 各组细胞流式细胞图
2.4 各组细胞TNF-α、IL-6水平比较
NG 组、mimics-NC 组、miR-146a-mimics 组细胞TNF-α、IL-6 水平比较,经方差分析,差异有统计学意义(F=423.477 和391.410,均P=0.000)。与NG组、mimics-NC 组比较,miR-146a-mimics 组细胞TNF-α、IL-6 水平降低(P<0.05)。见表2。
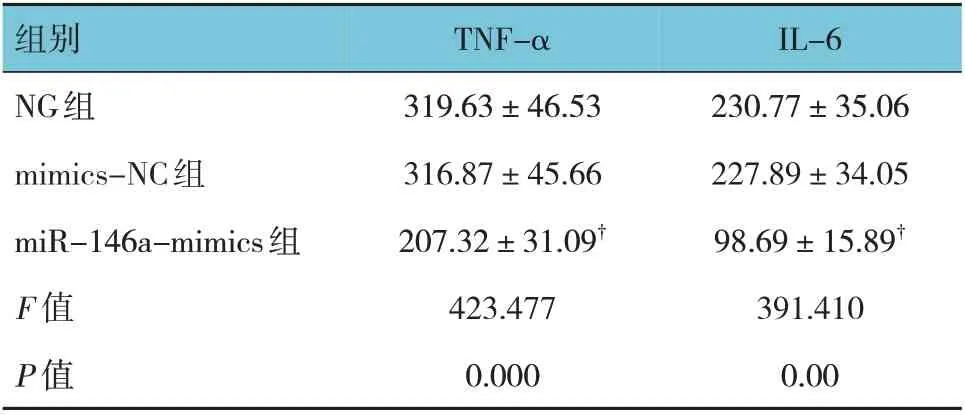
表2 各组细胞TNF-α、IL-6水平比较 (ng/L,x±s)
2.5 各组细胞PCNA、Bax、Bcl-2、NF-κB p65 蛋白相对表达量比较
NG 组、mimics-NC 组、miR-146a-mimics 组细胞PCNA、Bax、Bcl-2、NF-κB p65 蛋白相对表达量比较,差异有统计学意义(F=345.536、352.413、322.885和342.213,均P=0.000)。与NG 组、mimics-NC 组比较,miR-146a-mimics 组细胞PCNA、Bcl-2 蛋白相对表达量升高(P<0.05),Bax、NF-κB p65 蛋白相对表达量降低(P<0.05)。见图3 和表3。

图3 各组细胞PCNA、Bcl-2、Bax、NF-κB p65蛋白的表达
表3 各组细胞PCNA、Bcl-2、Bax、NF-κB p65蛋白相对表达量比较 (±s)
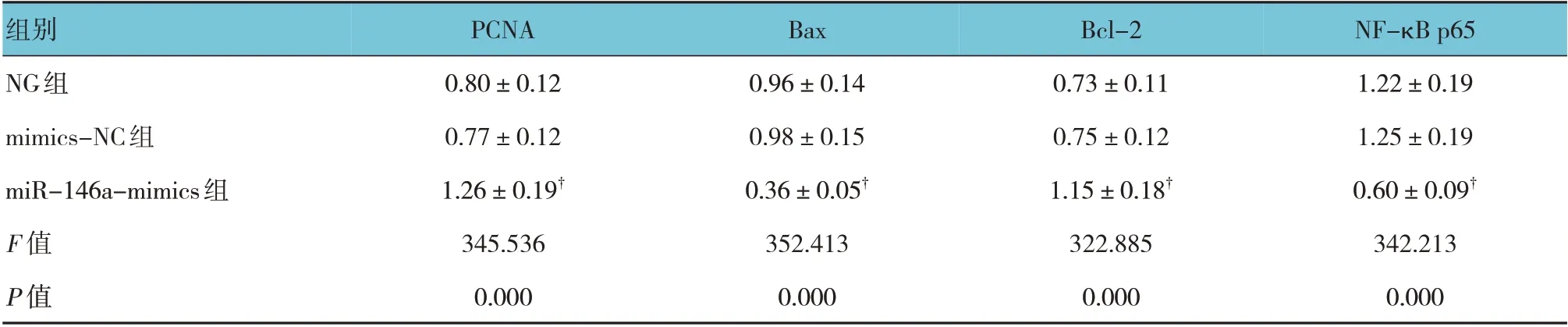
表3 各组细胞PCNA、Bcl-2、Bax、NF-κB p65蛋白相对表达量比较 (±s)
注:†与NG组、mimics-NC组比较,P <0.05。
组别NG组mimics-NC组miR-146a-mimics组F 值P 值NF-κB p65 1.22±0.19 1.25±0.19 0.60±0.09†342.213 0.000 PCNA 0.80±0.12 0.77±0.12 1.26±0.19†345.536 0.000 Bax 0.96±0.14 0.98±0.15 0.36±0.05†352.413 0.000 Bcl-2 0.73±0.11 0.75±0.12 1.15±0.18†322.885 0.000
3 讨论
急性胰腺炎是一种常见的危及生命的炎症性疾病,其发病率随人们生活水平提高呈逐年上升趋势,但临床治疗方式仍以传统支持治疗为主,没有较大改善,故病死率仍居高不下[6-7]。因此探寻新型生物治疗靶标以提高急性胰腺炎的治疗效果十分重要。
有研究表明,TNF-α 可使促炎因子IL-6 的合成和释放,导致全身炎症反应及多器官功能障碍综合征,其是急性胰腺炎发生时较早升高的主要炎症细胞因子[8-9]。既往研究表明,雨蛙素诱导的急性胰腺炎模型能很好地模拟人体急性胰腺炎发病机制,应用较多[10]。本研究采用雨蛙素诱导胰腺腺泡MPC-83 细胞的急性胰腺炎模型,结果显示,经雨蛙素诱导的MPC-83 细胞TNF-α、IL-6 水平显著高于未经雨蛙素诱导的细胞,说明急性胰腺炎细胞模型建立成功。
miRNAs 是由19~23 个核苷酸组成的单链小分子RNA,能够调控靶基因的表达,参与炎症反应、细胞增殖、凋亡等过程[11]。miR-146a 是较早证实的与炎症相关的miRNAs 家族一员。既往研究报道,抑制miR-146a 表达可促进炎症反应,进而促进小鼠糖尿病心肌病的发生、发展[12]。另有研究显示,血清miR-146a 水平异常表达参与免疫炎症疾病类风湿性关节炎的发生、发展[13]。既往研究结果显示,外周血miR-146a 异常低表达参与急性胰腺炎发生、发展,且可以评估患者病情严重程度[4]。还有研究表明,胰腺腺泡细胞增殖及凋亡失衡是急性胰腺炎发生、发展的机制之一[14]。目前有关miR-146a 对急性胰腺炎胰腺腺泡细胞生物学行为的影响尚不清楚。PCNA 是细胞增殖状态的评价指标。Bcl-2、Bax是人体最主要的抑凋亡、促凋亡基因[15]。本研究成功转染MPC-83 细胞后,结果显示,与NG 组、mimics-NC 组比较,miR-146amimics 组细胞存活率升高,凋亡率、Bax 蛋白相对表达量显著降低,PCNA、Bcl-2 蛋白相对表达量显著升高,说明上调miR-146a 表达可能抑制雨蛙素诱导的急性胰腺炎MPC-83 细胞凋亡,并促进细胞增殖。
NF-κB 是一种炎症转录因子,主要以p50/p65二聚体形式与其抑制蛋白(inhibitor kappa, I-κB)形成复合体,存在于正常细胞中。在细胞因子的刺激下,促使p50/p65 二聚体与I-κB 发生解离并转移至细胞核中,进而调控多种炎性介质(TNF-α、IL-6 等)的转录,促使大量炎症细胞(中性粒细胞等)聚集,导致细胞损伤[16]。张敏剑等[17]研究结果表明,抑制NF-κB/IκB 信号通路活化可对急性胰腺炎肺损伤发挥保护作用。陈进城等[18]研究结果表明,过表达miR-146a 可通过抑制NF-κB 信号通路活化,改善颈型颈椎病模型兔颈部炎症损伤。本研究结果显示,与NG 组、mimics-NC 组比较,miR-146a-mimics 组NF-κB p65 蛋白相对表达量,TNFα、IL-6 水平显著降低,与既往炎症性疾病中表达模式一致,说明过表达miR-146a 可能通过抑制NF-κB 通路活化,从而抑制急性胰腺炎胰腺腺泡细胞凋亡。
综上所述,上调miR-146a 表达可抑制急性胰腺炎胰腺腺泡细胞凋亡并诱导细胞增殖,其作用可能通过抑制NF-κB 通路活化来实现。本研究为探寻急性胰腺炎新型生物治疗靶标有效治疗急性胰腺炎提供了新的参考依据。

