益气活血化瘀汤对慢性肾衰竭大鼠钙磷代谢紊乱及血管钙化的影响及其机制研究*
张旭,赵芳园
(黑龙江中医药大学附属第一医院 中医内科,黑龙江 哈尔滨 150040)
慢性肾衰竭(chronic renal failure, CRF)是指在慢性肾病基础上,肾脏持续性损伤导致体内代谢产物大量滞留,电解质与酸碱失衡,机体内环境平衡被破坏并产生临床症状的过程。CRF 有多种并发症,以钙磷代谢紊乱为主,随着病程进展,还会引起动脉血管钙化、肾性骨病等,严重危害人体健康[1-2]。临床上常采用磷结合剂、钙受体激动剂和血液透析等方法治疗CRF,但由于均是单因素靶向治疗,所以常引起高磷血症,且磷结合剂价格较昂贵,患者难以接受[3-4]。中医认为肾络淤堵,脾虚风动是CRF 的主要病机,患者体内常有淤血、痰浊与湿浊滞留[5],因此本研究根据CRF 病机,结合《五十二病方》中活血化瘀方剂进行调整,将黄芪、茯苓、党参、忍冬藤、白术、泽泻、当归、红花、陈皮、黄柏、丹参配伍成益气活血化瘀汤,用于治疗CRF 模型大鼠,探究其对钙磷代谢紊乱和血管钙化的影响及机制,为中医临床治疗CRF 提供新思路。
1 材料与方法
1.1 实验动物
4 周龄健康雄性SD 大鼠50 只,购自北京维通利华实验动物技术有限公司,正常饲喂,适应性饲养1 周。实验动物生产许可证号:SCXK(京)2016-0011,实验动物使用许可证号:SYXK(京)2017-0033。
1.2 主要试剂及仪器
1.2.1试剂黄芪、茯苓、党参、忍冬藤、白术、泽泻、当归、红花、陈皮、黄柏、丹参(北京同仁堂大药房),骨化三醇胶丸(罗盖全,0.25 μg/粒,国药准字J20050021,德国罗氏制药有限公司),血钙浓度检测试剂盒、血磷浓度检测试剂盒(北京索莱宝生物科技有限公司),血尿素氮(blood urea nitrogen, BUN)试剂盒、血甲状旁腺激素(甲状旁腺激素(parathyroid hormone, PTH)检测试剂盒、成纤维细胞生长因子23(fibroblast growth factor-23,FGF-23)检测试剂盒与25-羟维生素D325(OH)D3检测试剂盒(上海酶联生物科技有限公司),尿蛋白(urinary protein,UP)检测试剂盒、血清肌酐(serum creatinine, Scr)检测试剂盒(上海纪宁实业有限公司),兔抗大鼠Wnt、β-catenin 和β-actin 一抗、HRP 标记羊抗兔二抗(北京康为试剂有限公司),MolPure®TRIeasy Plus Total RNA Kit 总RNA 提取试剂盒、Hifair®ⅢOne Step qRT-PCR SYBR Green Kit(一步法反转定量)试剂盒(上海翌圣生物科技有限公司),PCR 引物(北京擎科生物有限公司),Minute(TM)动物组织总蛋白提取试剂盒(上海西宝生物科技股份有限公司)。
1.2.2仪器SD1 全自动生化分析仪(成都斯马特科技有限公司),UV759CRT 型扫描型紫外可见分光光度计(青岛聚创环保集团有限公司),JC-MB36 酶标仪(青岛聚创嘉恒分析仪器有限公司),HOG-24组织均质器(上海辅光精密仪器有限公司),NanoDrop 2000 超微量分光光度计(美国赛默飞世尔科技有限公司)。
1.3 方法
1.3.1益气活血化瘀汤准确称取黄芪、茯苓、党参、忍冬藤、白术各12 g,泽泻、当归、红花各8 g,陈皮、黄柏各、丹参各5 g,浸泡1 h 后加水煎煮2 次,过滤后将2 次滤液混合均匀,浓缩至生药含量为62.4 g/mL 的浓缩液,置于4℃冰箱保存。
1.3.2肾衰竭模型的复制采用5/6 肾切除法复制CRF 大鼠[6]。腹腔注射2%戊巴比妥钠麻醉大鼠,固定于手术台上,使大鼠背部左肾区朝上,距左脊肋骨约1.5 cm 处做斜向外方切口,打开腹腔暴露肾脏,切除2/3 肾组织并用明胶海绵压迫止血30 s,滴加纤维蛋白原和凝血酶溶液,等待60 s 后观察切面无活动性出血后将左肾复位、缝合。大鼠恢复1 周后,打开腹腔,切除整个右肾,2 次手术共切除约80%肾脏。假手术组打开腹腔,切除肾脏周围部分脂肪组织,然后缝合伤口。
1.3.3分组与给药50 只大鼠随机分为假手术组、肾衰组、低剂量组、高剂量组、骨化三醇组,每组10 只。模型复制成功后2 周后开始给药,按照人与大鼠体表面积换算出给药剂量作为最低给药剂量。高、低剂量组大鼠分别按35.2 g/kg、8.8 g/kg 灌胃益气活血化瘀汤;骨化三醇组将骨化三醇在温水中捣碎溶成悬液,按25 ng/kg 灌胃;假手术组灌胃等体积温水,均1 次/d,连续8 周。肾衰组模型复制成功后未做任何处理。给药结束后,用代谢笼收集大鼠24 h尿液,3 000 r/min 离心10 min,取上清液于4℃待测。实验前12 h 禁水、禁食。治疗期间,观察大鼠体重、精神状态、行为、中毒及死亡情况。
1.3.4酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测血液矿物质与生化指标大鼠腹腔注射2%戊巴比妥钠溶液,麻醉后固定于手术台上,切开腹腔,腹主动脉采血5 mL,4 000 r/min 离心20 min,分离上清液,采用全自动生化分析仪检测大鼠血清钙和磷;ELISA 测定大鼠血清PTH、FGF-23、25(OH)D3。酶标仪测定各个血标本在450 nm 波长处的光密度(optical density, OD)值,以试剂盒中标准品为横坐标(X),对应OD 值为纵坐标(Y)绘制标准曲线,根据血标本的OD 值计算相应浓度。
1.3.5肾脏功能指标检测取离心后血清,采用ELISA 试剂盒检测大鼠血清Scr 含量。在氯化高铁一磷酸中加入含有BUN 的血清、二乙酰一肟和硫胺脲,加热生成红色的二嗪化合物,颜色深浅与血BUN 呈正比,取加热煮沸的混合液,待其冷却后利用分光光度计测量540 nm 处的OD 值。取离心后尿液上清,采用ELISA 试剂盒检测大鼠尿液UP 含量,按照说明书进行操作,浓度计算方法同方法1.3.4。
1.3.6主动脉茜素红法钙盐染色参照ZHANG等[7]的方法,腹主动脉采血后,剪开胸腔,剥离出胸主动脉,剪取长约5 cm 动脉,用含肝素钠的生理盐水冲洗动脉,将动脉外部和管腔中的血液完全冲除干净,浸泡于PBS 缓冲液中。①血管大体染色:随机取出5 只大鼠的主动脉,用吸水纸吸干水分,浸泡于95%乙醇12 h 脱水处理,用茜素红染料(0.004%茜素红+1%氢氧化钾)室温下染色12 h,取出动脉血管,2%氢氧化钾冲洗干净(时间不宜过长),4%多聚甲醛固定,拍照观察染色情况。②血管切片染色:将剩余5 只大鼠的主动脉取出,每根剪取1 cm,吸干水分,用4%多聚甲醛在常温下固定24 h,不同浓度乙醇梯度脱水,加入二甲苯透明处理10 min,石蜡包埋,切片厚约5 μm,放于载玻片上,60℃烘烤,二甲苯脱蜡,水中浸泡2 min,0.2% 茜素红染液染色6 min,用水洗去多余染液并加入二甲苯脱水,中性树胶封片,置于显微镜下观察血管钙化情况。
1.2.1 水资源量 2016年河套灌区各旗(县、区)水资源总量合计为46.277亿m3,其中,地表水资源量42.483亿m3,地下水资源量为16.993亿m3,地表与地下水重复计算量13.199亿m3。降水量27.794亿m3,引用黄河水量和地表水径流量分别为41.976,0.507亿m3,分别占地表水资源量的98.8%,1.2%。河套灌区地下水年平均埋深2.13 m。
1.3.7实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测Wnt/β-catenin 通路mRNA 的表达大鼠腹主动脉采血后,取出肾脏,生理盐水冲洗干净。加入适量生理盐水,用组织匀浆器研磨肾脏组织,采用TRIzol法提取RNA(总RNA 提取试剂盒),用Nano Drop 测量浓度。采用Primer 5 软件设计qRT-PCR 扩增引物(见表1)。取0.1 μg RNA,使用Hifair®ⅢOne Step qRT-PCR SYBR Green Kit(一步法反转定量)试剂盒进行逆转录和定量,40℃、10 min 将RNA 逆转录为cDNA。在ABI PRISM 7500 实时PCR 系统(ABI)中进行反应,qRT-PCR 反应条件:95℃预变性3 min,95℃变性10 s,60℃退火30 s,共38 个循环。以β-actin为内参,采用2-ΔΔCt法计算Wnt/β-catenin 通路[结肠腺瘤样息肉蛋白(adenomatous polyposis coli, APC)、T 细胞因子4(T-cell factor, TCF4)、β-catenin] mRNA相对表达量,实验重复3 次获得平均值。

表1 qRT-PCR引物序列
1.3.8Western blotting 检测Wnt/β-catenin 通路蛋白的表达取研磨好的肾脏组织匀浆液,提取总蛋白,利用BCA 试剂盒测定浓度。添加缓冲液,将蛋白质样本在95℃条件下加热10 min,10%聚丙烯酰胺凝胶电泳,电压80 V 用于浓缩,120 V 用于分离。恒压100 mV 条件下湿转移120 min,将蛋白质转移到聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)膜上。室温下将PVDF 膜置于5%牛血清白蛋白中封闭1 h,与一抗(兔抗大鼠Wnt、β-catenin 和β-actin一抗,均1∶1 000 稀释)在4℃条件下孵育一晚。TBST 冲洗膜3 次,5 min/次,加入二抗孵育1 h,TBST再洗膜3 次,5 min/次。使用发光液ECL 底物对每个条带进行可视化处理,以β-actin 为内参计算APC、TCF4、β-catenin 灰度值作为蛋白相对表达量。
1.4 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般情况
治疗期间,大鼠精神状态良好,饮食与行为正常,毛色正常,未出现中毒与死亡情况。
2.2 各组大鼠血液矿物质与生化指标比较
假手术组、肾衰组、低剂量组、高剂量组、骨化三醇组大鼠血钙、血磷、PTH、FGF-23、25(OH)D3比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:肾衰组血钙、25(OH)D3低于假手术组(P<0.05);与肾衰组比较,低剂量组、高剂量组和骨化三醇组血钙、25(OH)D3升高(P<0.05);高剂量组和骨化三醇组血钙、25(OH)D3高于低剂量组(P<0.05);骨化三醇组血钙、25(OH)D3高于高剂量组(P<0.05);肾衰组血磷、PTH、FGF-23 高于假手术组(P<0.05);与肾衰组比较,低剂量组、高剂量组和骨化三醇组血磷、PTH、FGF-23 降低(P<0.05);高剂量组和骨化三醇组血磷、PTH、FGF-23 低于低剂量组(P<0.05);骨化三醇组血磷、PTH、FGF-23 低于高剂量组(P<0.05)。见表2。
表2 各组大鼠血钙、血磷、PTH、FGF-23、25(OH)D3比较 (n=10,±s)
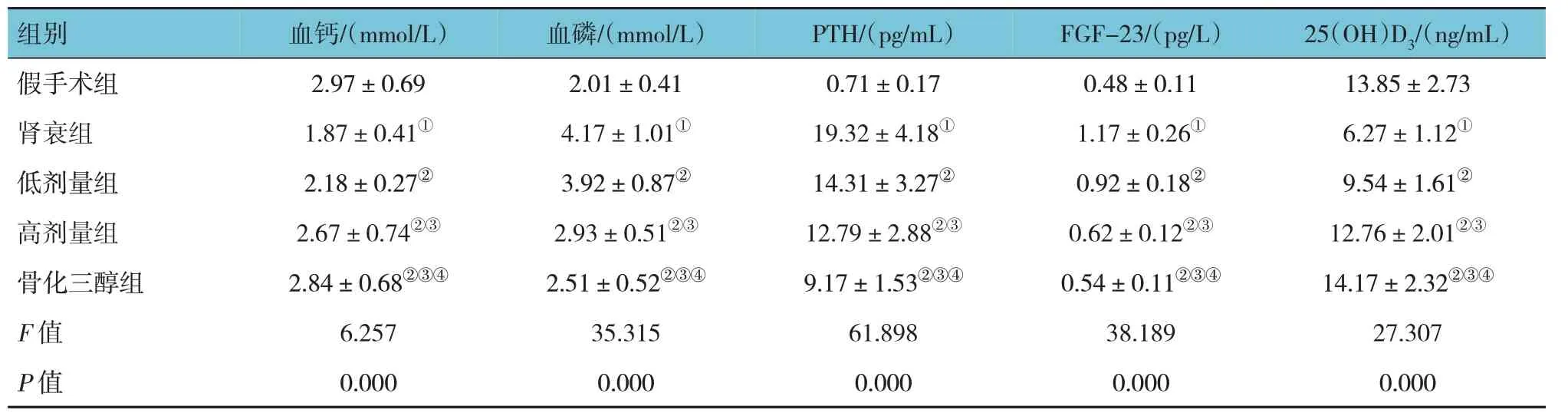
表2 各组大鼠血钙、血磷、PTH、FGF-23、25(OH)D3比较 (n=10,±s)
注:①与假手术组比较,P <0.05;②与肾衰组比较,P <0.05;③与低剂量组比较,P <0.05;④与高剂量组比较,P <0.05。
?组别25(OH)D3/(ng/mL)血钙/(mmol/L)血磷/(mmol/L)PTH/(pg/mL)FGF-23/(pg/L)假手术组肾衰组低剂量组高剂量组骨化三醇组F 值P 值13.85±2.73 6.27±1.12①9.54±1.61②12.76±2.01②③14.17±2.32②③④27.307 0.000 2.97±0.69 1.87±0.41①2.18±0.27②2.67±0.74②③2.84±0.68②③④6.257 0.000 2.01±0.41 4.17±1.01①3.92±0.87②2.93±0.51②③2.51±0.52②③④35.315 0.000 0.71±0.17 19.32±4.18①14.31±3.27②12.79±2.88②③9.17±1.53②③④61.898 0.000 0.48±0.11 1.17±0.26①0.92±0.18②0.62±0.12②③0.54±0.11②③④38.189 0.000
2.3 各组大鼠肾功能指标比较
假手术组、肾衰组、低剂量组、高剂量组和骨化三醇组大鼠BUN、Scr、24 h UP 比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:假手术组BUN、Scr、24 h UP 低于其余4 组(P<0.05);与肾衰组比较,低剂量组、高剂量组和骨化三醇组BUN、Scr、24 h UP 降低(P<0.05);高剂量组和骨化三醇组BUN、Scr、24 h UP 低于低剂量组(P<0.05);骨化三醇组BUN、Scr、24 h UP 低于高剂量组(P<0.05)。见表3。
表3 各组大鼠血清BUN、Scr、24 h UP比较(n=10,±s)
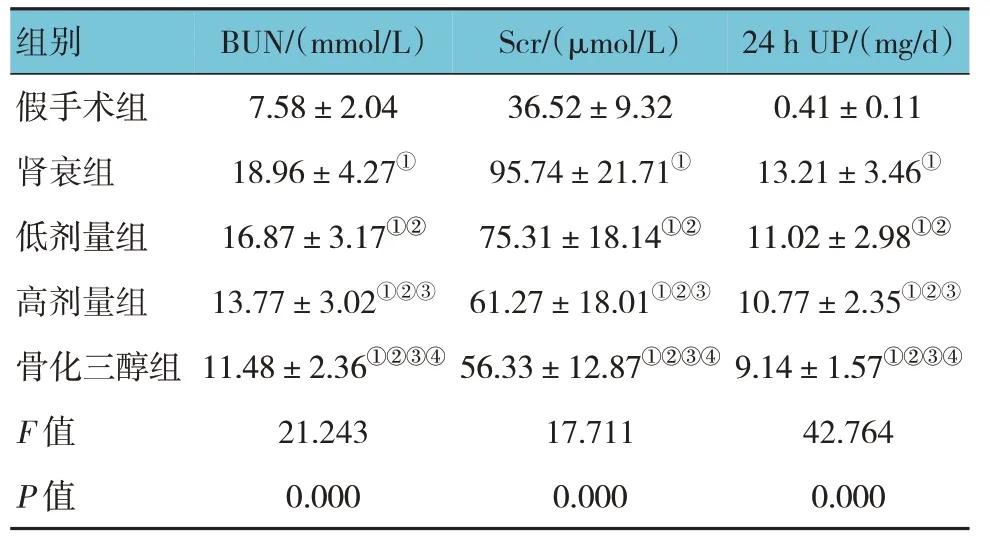
表3 各组大鼠血清BUN、Scr、24 h UP比较(n=10,±s)
注:①与假手术组比较,P <0.05;②与肾衰组比较,P <0.05;③与低剂量组比较,P <0.05;④与高剂量组比较,P <0.05。
24 h UP/(mg/d)组别BUN/(mmol/L)Scr/(μmol/L)0.41±0.11 13.21±3.46①11.02±2.98①②10.77±2.35①②③9.14±1.57①②③④42.764 0.000假手术组肾衰组低剂量组高剂量组骨化三醇组F 值P 值7.58±2.04 18.96±4.27①16.87±3.17①②13.77±3.02①②③11.48±2.36①②③④21.243 0.000 36.52±9.32 95.74±21.71①75.31±18.14①②61.27±18.01①②③56.33±12.87①②③④17.711 0.000
2.4 各组大鼠主动脉血管钙化情况
血管整体茜素红染色可见假手术组主动脉呈白色,无红色钙化点;肾衰组主动脉则钙化严重,呈红色;低剂量组主动脉呈浅红色,钙化程度略轻;高剂量组主动脉红色更淡,钙化程度缓解;骨化三醇组主动脉部分呈白色,部分呈浅红色,钙化程度减轻。
茜素红切片染色中,假手术组切片未观察到钙化点;肾衰组切片观察到大面积红色钙化点,呈弥散性分布;与肾衰组比较,可见低剂量组红色钙化点减少,高剂量组红色钙化点明显减少;骨化三醇组红色钙化点也明显减少。见图1。
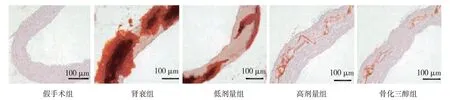
图1 大鼠主动脉截面切片 (茜素红染色×50)
2.5 各组大鼠肾脏APC、TCF4、β-catenin mRNA相对表达量比较
假手术组、肾衰组、低剂量组、高剂量组和骨化三醇组大鼠APC、TCF4、β-catenin mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:肾衰组APC mRNA 相对表达量低于假手术组(P<0.05);与肾衰组比较,低剂量组、高剂量组和骨化三醇组APC mRNA 相对表达量升高(P<0.05);高剂量组和骨化三醇组APC mRNA相对表达量高于低剂量组(P<0.05);骨化三醇组APC mRNA 相对表达量高于高剂量组(P<0.05);肾衰组TCF4、β-catenin mRNA 相对表达量高于假手术组(P<0.05);与肾衰组比较,低剂量组、高剂量组和骨化三醇组TCF4、β-catenin mRNA 相对表达量降低(P<0.05);高剂量组和骨化三醇组TCF4、β-catenin mRNA 相对表达量低于低剂量组(P<0.05);骨化三醇组TCF4、β-catenin mRNA 相对表达量低于高剂量组(P<0.05)。见表4。
表4 各组大鼠肾脏APC、TCF4、β-catenin mRNA相对表达量比较 (n=10,±s)
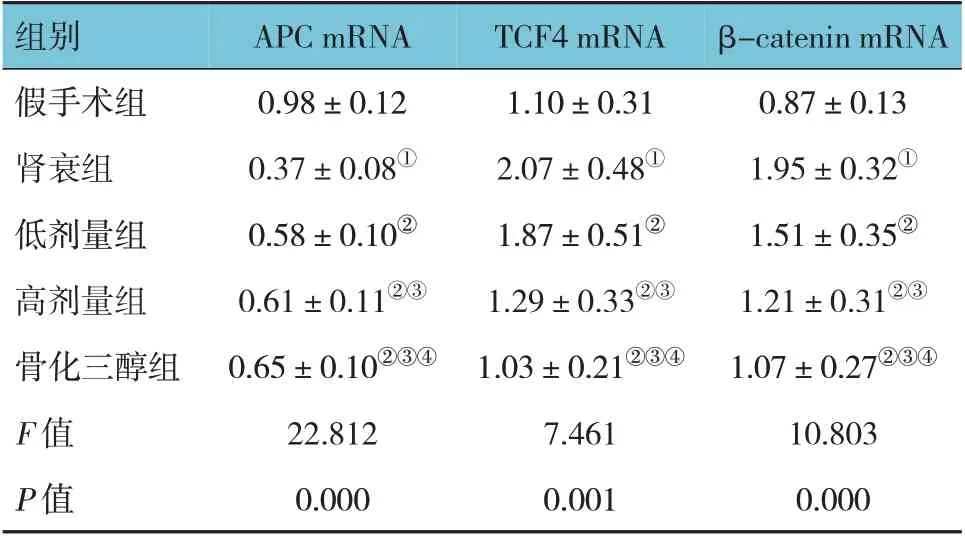
表4 各组大鼠肾脏APC、TCF4、β-catenin mRNA相对表达量比较 (n=10,±s)
注:①与假手术组比较,P <0.05;②与肾衰组比较,P <0.05;③与低剂量组比较,P <0.05;④与高剂量组比较,P <0.05。
β-catenin mRNA 0.87±0.13 1.95±0.32①1.51±0.35②1.21±0.31②③1.07±0.27②③④10.803 0.000组别假手术组肾衰组低剂量组高剂量组骨化三醇组F 值P 值APC mRNA 0.98±0.12 0.37±0.08①0.58±0.10②0.61±0.11②③0.65±0.10②③④22.812 0.000 TCF4 mRNA 1.10±0.31 2.07±0.48①1.87±0.51②1.29±0.33②③1.03±0.21②③④7.461 0.001
2.6 各组大鼠肾脏APC、TCF4、β-catenin 蛋白相对表达量比较
表5 各组大鼠肾脏APC、TCF4、β-catenin蛋白相对表达量比较 (n=10,±s)
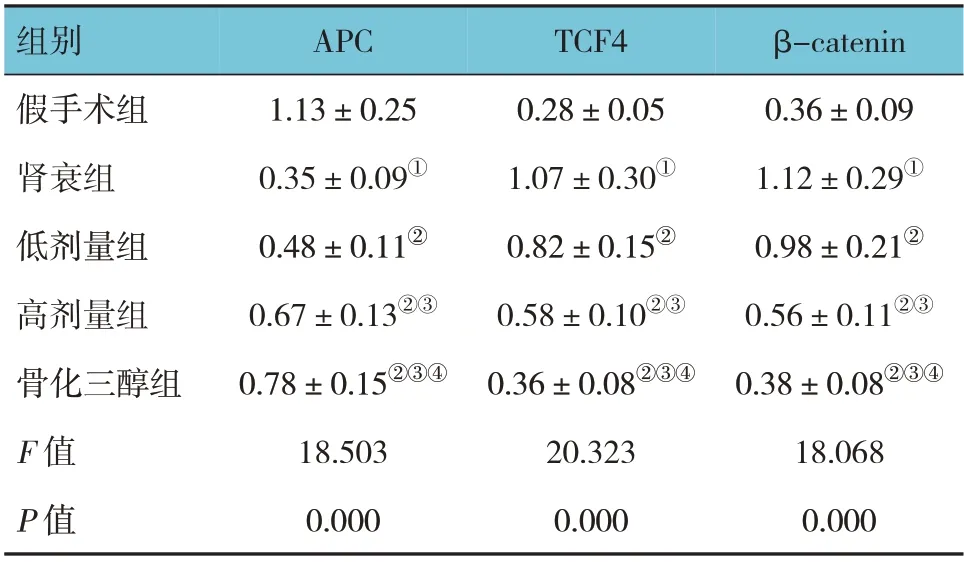
表5 各组大鼠肾脏APC、TCF4、β-catenin蛋白相对表达量比较 (n=10,±s)
注:①与假手术组比较,P <0.05;②与肾衰组比较,P <0.05;③与低剂量组比较,P <0.05;④与高剂量组比较,P <0.05。
β-catenin 0.36±0.09 1.12±0.29①0.98±0.21②0.56±0.11②③0.38±0.08②③④18.068 0.000组别假手术组肾衰组低剂量组高剂量组骨化三醇组F 值P 值APC 1.13±0.25 0.35±0.09①0.48±0.11②0.67±0.13②③0.78±0.15②③④18.503 0.000 TCF4 0.28±0.05 1.07±0.30①0.82±0.15②0.58±0.10②③0.36±0.08②③④20.323 0.000
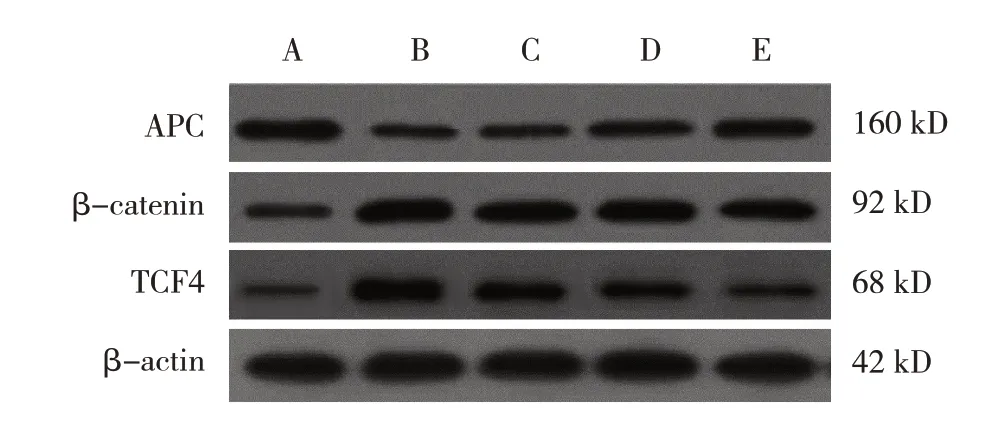
图2 各组大鼠肾脏APC、TCF4、β-catenin蛋白的表达
3 讨论
钙磷代谢紊乱是CRF 的主要并发症之一,贯穿于肾功能损坏的全过程[8]。长期钙磷代谢紊乱会导致各种组织器官发生继发性损坏,主要表现为主动脉钙化、软组织钙化和肾性骨病等,增加患心血管疾病的风险。既往研究显示,CRF 患者血钙、血磷、PTH 异常,诱发高磷血症,加快血管钙化的进展[9]。临床上主要以控制患者饮食或使用磷结合剂来降低血磷和恢复血钙浓度,目前已经研制出碳酸司维拉姆、盐酸司维拉姆等新型磷结合剂,但价格昂贵,患者接受度低[10-11]。在现代中医学中,CRF 属本虚标实症,认为肾乃“先天之本”,肾气虚弱,则阴阳失调,导致淤血、痰积、浊毒、风邪等实症。肾络淤堵,浊毒痰瘀潴留,导致钙磷代谢紊乱;痰瘀于血脉,致血管钙化,故应以补肾健脾,泄浊通腑法缓解病症。汤水福教授[12]也在其研究中阐述治疗CRF 应以通络、活血、化瘀、益气为主。
本研究中主动脉茜素红染色结果表明,肾衰组大鼠主动脉完全变成暗红色,说明血管钙化严重,而相比于肾衰组,低剂量组、高剂量组和骨化三醇组的主动脉红色依次减弱,说明益气活血化瘀汤可以有效缓解钙磷代谢紊乱,减少血管中钙磷沉积,减轻血管钙化程度。本研究结果显示,与假手术组比较,肾衰组大鼠血钙、25(OH)D3降低,血磷、PTH、FGF-23 升高。与肾衰组相比,各治疗组大鼠血钙、25(OH)D3升高,血磷、PTH、FGF-23 降低,并且高剂量组各指标的变化程度高于低剂量组,提示高剂量的益气活血化瘀汤可以更好地改善CRF 大鼠钙磷代谢紊乱。FGF-23 是调磷素之一,是调节血磷与维生素D 的主要物质。25(OH)D3是固醇类激素,与PTH、血钙、血磷的调节有关,可以间接反映机体钙磷紊乱程度。血钙、血磷、PTH 可以直接反映机体钙磷代谢紊乱程度。现代药理学研究表明,黄芪可以减缓CRF 大鼠肾损伤,调节钙磷代谢紊乱[13]。Scr、BUN 是机体代谢产物,由肾脏排除,可以间接反映肾功能。本研究结果显示,肾衰组大鼠Scr、BUN高于假手术组;而与肾衰组相比,各治疗组Scr、BUN均出现不同程度的下降。黄芪为补气的良药,补气升阳充盈脉络之气,补肾健脾化脾肾之虚,常配伍党参,达到益气固元之功效。同时有研究发现,黄芪的水提取物可以调节CRF 大鼠体内Scr、BUN 水平,对CRF 症状有缓解作用[14]。崔龙海等[15]发现党参总碱苷治疗肾损伤大鼠后,肾坏死灶减小,炎症浸润降低,对肾损伤具有保护作用。丹参具有解毒通络,活血化瘀的作用[16],忍冬藤和红花具有活血通络的作用。中医角度认为Scr、BUN 属于机体的“淤浊”,而本研究中,CRF 大鼠经益气活血化瘀汤治疗后,“淤浊”降低,提示益气活血化瘀汤具有排浊化瘀的功效。正常情况下,由于肾小球的滤过作用,尿液中的蛋白质不会随尿液排出体外,而在本研究中收集肾衰组大鼠处死前24 h 尿液发现其中含有大量UP,说明肾功能受损,经治疗后,各组尿液中UP含量出现不同程度降低。因此推测,益气活血化瘀汤具有修复受损肾脏、排浊化瘀的作用,提高治疗剂量则效果更佳。
本研究结果表明,肾衰组TCF4、β-catenin mRNA 和蛋白相对表达量高于假手术组;各治疗组大鼠肾脏TCF4、β-catenin mRNA 和蛋白相对表达量低于肾衰组。与假手术组比较,肾衰组大鼠肾脏APC mRNA 和蛋白相对表达量下调;与肾衰组相比,各治疗组大鼠肾脏APC mRNA 和蛋白相对表达量上调。说明益气活血化瘀汤可以通过调节Wnt/βcatenin 信号通路来抑制肾脏损伤,保护肾脏组织。既往研究显示,Wnt/β-catenin 信号通路在慢性肾病中发挥重要作用,其中β-catenin 是该通路的重要蛋白[17]。正常情况下,β-catenin 在细胞膜上与其他蛋白质一同维持细胞膜的完整性,当细胞受到刺激时,Wnt 激活β-catenin 进入细胞核,调节下游肾纤维化基因的表达。APC 则可以降解β-catenin 蛋白复合体,使细胞核内β-catenin 转移至细胞质,一部分APC 可以与β-catenin 结合,阻止其激活下游基因,抑制肾脏损伤的发生。β-catenin 进入细胞核后,无法直接作用于遗传物质,作为核内转录因子家族的TCF4 可以帮助β-catenin 进入细胞核,并与其结合进一步激活下游基因,引起肾脏损伤[18]。
综上所述,益气活血化瘀汤可以改善CRF 大鼠钙磷代谢紊乱,缓解血管钙化程度,适当增加益气活血化瘀汤的剂量疗效更好。其治疗作用可能是通过调节Wnt/β-catenin 信号通路来实现的。本研究为中医临床治疗CRF 提供了新思路,但益气活血化瘀汤对Wnt/β-catenin 信号通路的具体调节机制尚不明确,还需后续研究进一步阐明。

