74例急性胰腺炎后早期囊性病变的临床特征及形成危险因素分析
张泽锋,黄霖琳,王森轼
广东省人民医院(广东省医学科学院)消化内镜中心,广东 广州 510080
急性胰腺炎(acute pancreatitis,AP)是消化科的常见病、多发病,往往起病急、病情变化快,而重症胰急性腺炎(severe acute pancreatitis,SAP)更是起病凶险、病死率高、治疗病程长及治疗困难,因而早期及时、准确的临床处置可以最大程度上减少胰腺炎症对机体的损伤、缩短病程及改善预后。
对于AP和SAP,我们除了急性期和恢复期的治疗外,尚需要关注后期并发症的处理,而囊性病变的形成是其较为常见的并发症。虽然多数胰腺周围的液体积聚和坏死物积聚形成的囊性病变可以自行吸收,但直径>6 cm并有压迫症状、或直径持续增大的病变,需行内镜、介入或外科治疗。因此,本研究旨在探讨AP后早期囊性病变形成大小的相关预测因子,减少巨大囊性病变(直径>6 cm)的形成及有创治疗。
1 资料与方法
1.1 一般资料收集2017年1月至2021年6月我院确诊AP后早期囊性病变形成的74例患者纳入研究,记录所有患者的年龄、性别及疾病分型。
1.2 实验室指标与分组74例患者第1天的血红蛋白(hemoglobin,HB)、白蛋白(albumin,ALB)、钙离子(calcium,Ca2+)、葡萄糖(glucose,GLU)﹑血清淀粉酶(serum amylase,AMS)、总胆红素(total bilirubin,TBIL)、C反应蛋白(C-reactive protein,CRP)、甘油三酯(triglyceride,TG)、谷丙转氨酶(alanine aminotransferase,ALT)、血肌酐(serum creatinine,CREA)水平的平均值作为该患者的相关项目的实验室指标。74例患者在入院第7天均行胰腺CT或超声检查测量囊性病变的最大层面的直径大小,按最大直径是否>6 cm分为大囊性病变组和小囊性病变组。
2 结果
2.1 两组患者的临床特征74例患者中,大囊性病变组47例,最大病变者上缘达胃底水平,向下延伸至左侧髂窝,向右达结肠前方,测得最大层面直径为18.3 cm,最小病变者直径为6.7 cm;小囊性病变组27例,最大病变直径为5.6 cm,最小病变直径为1.3 cm。大囊性病变组在直径、SAP患者所占百分比及TG水平明显高于小囊性病变组,差异有统计学意义(P<0.05),其余实验室指标两组比较,差异均无统计学意义(P>0.05),具体如表1所示。
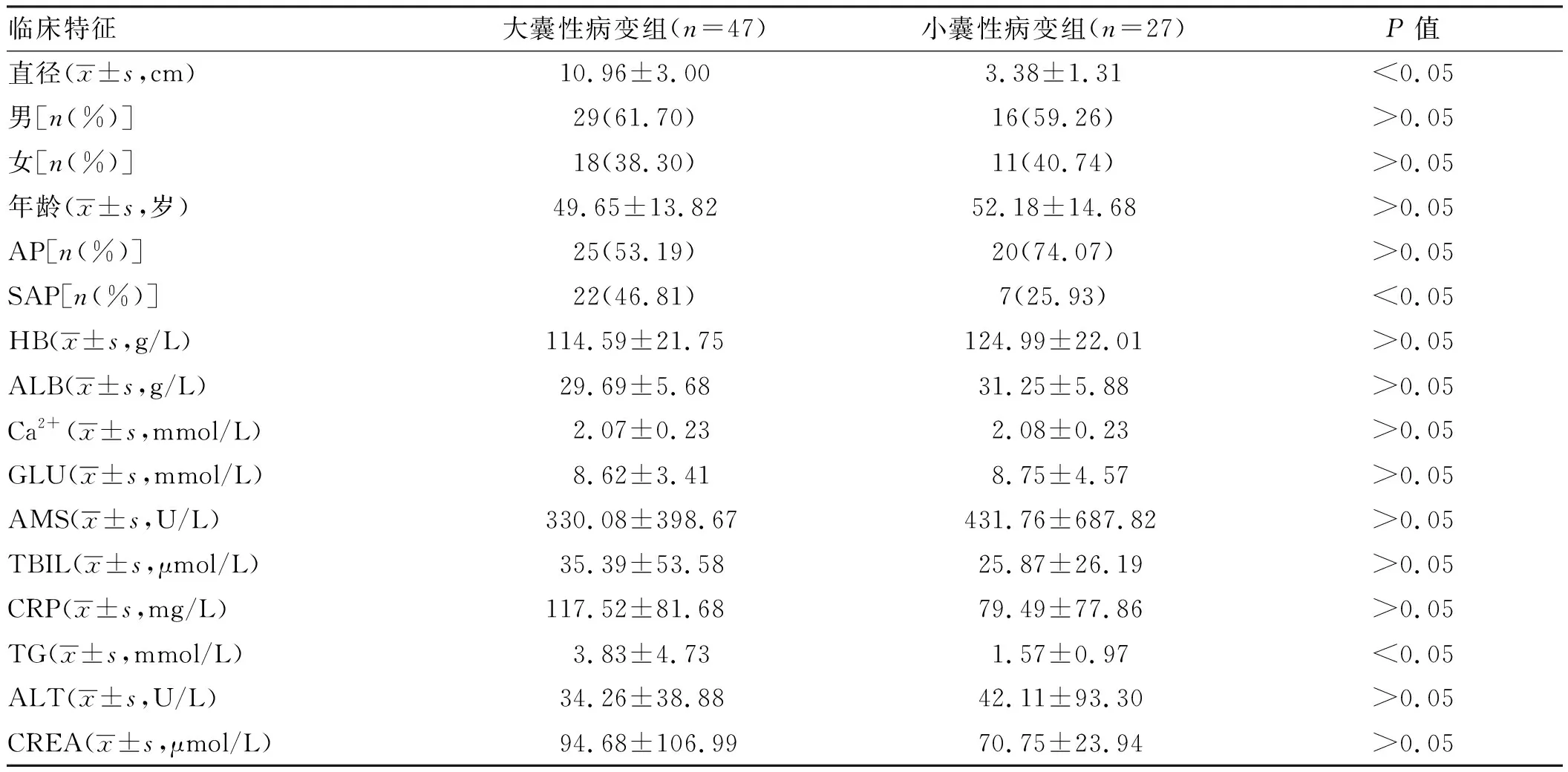
表1 AP后早期囊肿病变的临床特征分析Tab 1 Clinical characteristics of early cyst lesions after AP
2.2 AP早期囊性病变形成大小的危险因素分析我们进一步通过Logistic回归分析发现,TG是形成AP早期大囊性病变的独立危险因素,单因素分析:OR=1.84,95%CI:1.04~3.27,多因素分析:OR=2.00,95%CI:1.05~3.80,差异有统计学意义(P<0.05);而其他实验室指标比较,差异均无统计学意义(P>0.05)(见表2)。
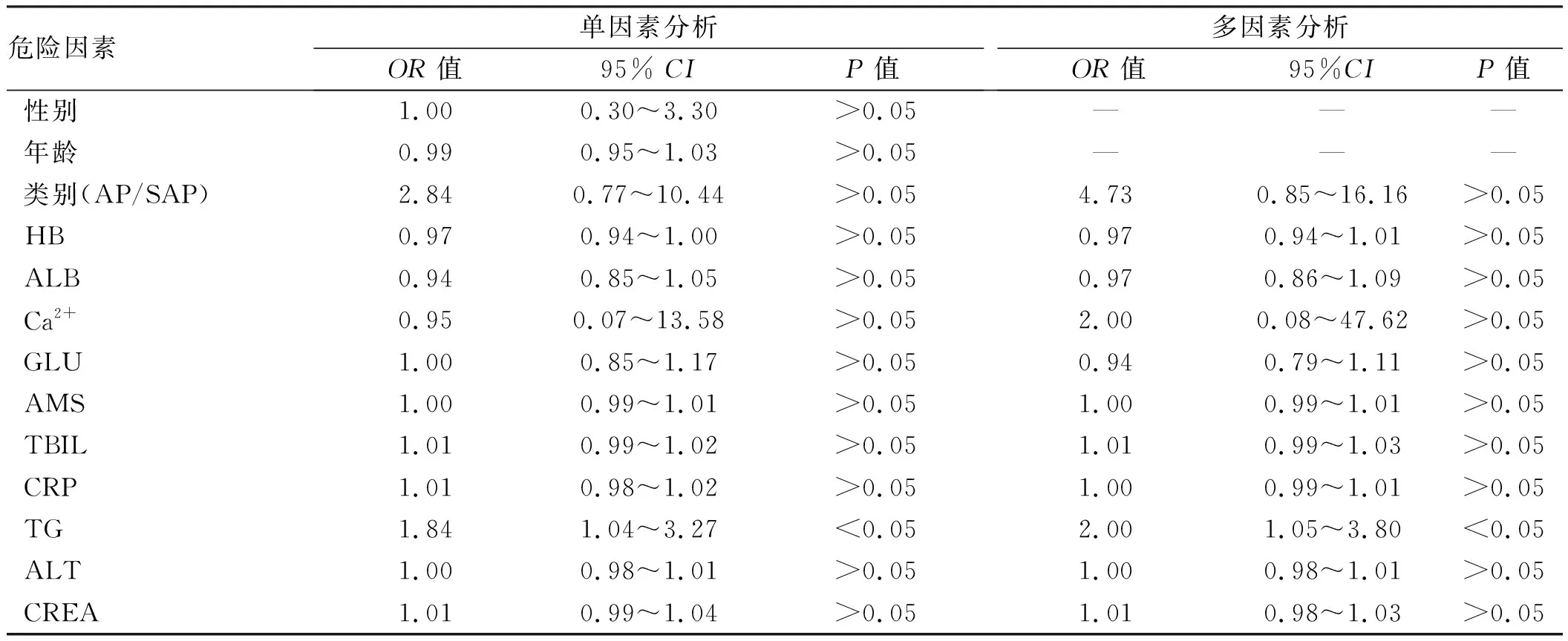
表2 AP后早期囊肿病变形成大小危险因素Logistic回归分析Tab 2 Logistic regression analysis of risk factors for the size of early cyst lesions after AP
3 讨论
胰腺假性囊肿(pancreatic pseudocyst,PPC)作为AP后最常见的并发症之一,目前认为其由完整非上皮性包膜包裹的液体积聚,内含胰腺分泌物、肉芽组织、纤维组织等,多发生于AP起病4周后。少数直径>6 cm且有压迫症状等临床表现,或持续观察见直径增大,需行微创穿刺引流术或外科手术。杨子云等[1]的回顾性研究表明,571例AP患者共有78例(13.7%)发生PPC,而BMI高、饮酒史、既往胰腺炎或糖尿病病史、D-二聚体高是AP并发PPC的独立危险因素;对存在上述因素的AP患者应密切随访。而另一项研究[2]纳入460例AP患者共有143例(31.1%)发生PPC,而AP合并PPC的独立危险因素包括男性、糖尿病史、腹水、胸腔积液、腹部可触及包块及CT炎症指数高评分。可见,在不同医疗中心,PPC的发生率和危险因素存在较大差异,但我们还是建议对所有患者进行危险分层,并对高危患者进行密切随访和监测,减少相关有创治疗,缩短住院时间和减轻患者经济负担。
本研究发现,74例AP患者1周后形成囊性病变患者中,多数为中年男性,这跟范丽玉等[2]的研究结果一致,我们推荐这可能与我国多数男性患者饮酒的生活习惯相关。本研究中,将AP患者1周后影像学发现的病变定义为囊性病变而非PPC,考虑到病变形成时间较短、传统认为PPC在4周以后形成等因素;但我们推荐更早发现囊性病变的形成、寻找危险因素、及早干预避免巨大囊性病变的形成。因此,本研究中我们通过Logistic回归分析了早期囊性病变形成的危险因素,并发现TG是其独立危险因素,目前尚未见其他文献报道。
近年来,高TG相关性胰腺炎呈明显上升趋势,且往往具有发病患者较年轻、男性居多、肥胖者多见、容易合并代谢综合征、病情更重、并发症更多及预后更差的临床特点[3];然而,高TG与AP两者的因果关系尚未明确,因为AP发生时体内儿茶酚胺、胰高血糖素、生长激素等激素水平升高,从而导致血脂水平升高。虽然目前关于高TG相关性胰腺炎的治疗无统一标准;既往研究[3]发现,降低血脂水平时可减轻高血脂对胰腺再生的影响,有助于胰腺功能的恢复。因此,我们推荐在所有AP患者中早期监测TG水平,如TG升高时尽快启动促血脂分解,包括降脂药、低分子肝素、胰岛素、血液净化等方法,有助于减少巨大囊性病变的形成及相关有创治疗。
由于PPC的病因、病程、大小、解剖部位等不同,目前治疗PPC的方法包括保守治疗、内镜下囊肿引流、腹腔镜手术引流、传统手术治疗、内镜联合腹腔镜手术治疗、经皮穿刺置管引流术(percutaneous catheter drainage,PCD)、中医药治疗等[4]。保守治疗是指对早期、病变<6 cm、无压迫症状或进行性进展的病变,在肠内外营养支持的基础上加用抑制胰酶分泌的药物,以期PPC自然吸收[5]。近年来,有学者[6]认为,PPC的自行吸收时间可以更长,建议将随访时间延长至6个月~1年。超声内镜的推广应用使得假性囊肿穿刺引流更加安全可行。FC-SEMS等新型支架的开发应用,为内镜下胰腺坏死物清除术提供了有利条件,较外科手术缩短了住院时间,降低了医疗费用,但仍存在出血、穿孔、支架移位等并发症,新型支架的应用价值值得进一步验证。也有学者认为,常规手术虽然创伤大,但却是目前对PPC引流较为彻底、恢复较完善的方法[7]。
然而,本研究还存在局限性。首先,这是一项回顾性研究,我们未能对所有患者进行病因分析;现有资料表明,47例大囊性病变和27例小囊性病变患者中,胆源性分别为12例及5例,我们未发现差异有统计学意义。其次,本研究病例数偏少,且未能对所有患者进行后续随访。后续我们将进行更深入的研究,探讨AP后囊性病变形成的机制和治疗策略。

