基于U-Net深度学习慢性萎缩性胃炎模型的应用与研究
赵曲川,池添雨
首都医科大学宣武医院消化科,北京 100053
胃癌系起源于胃黏膜上皮的恶性肿瘤,是危害我国人民健康的重大疾病之一。我国属于胃癌高发国家,其在我国的发病率占消化系统恶性肿瘤之首;每年胃癌新发病例约40万例,死亡约35万例,新发和死亡病例均占全世界胃癌病例的40%;因此,降低我国胃癌的发病率和死亡率是亟待解决的重大公共卫生问题[1]。
慢性萎缩性胃炎是胃癌公认的癌前疾病,我国慢性萎缩性胃炎的患病率也较高。研究显示,胃癌高发区慢性萎缩性胃炎的患病率高于胃癌低发区,内镜下慢性萎缩性胃炎的诊断比例为17.7%~39.8%[2-5],慢性萎缩性胃炎的“早期发现、早期诊断、早期治疗”是预防胃癌的有效手段。但以病理诊断为“金标准”,内镜下诊断萎缩的灵敏度仅为42%,特异度为91%[2]。因此,如何提高慢性萎缩性胃炎的诊断率以及内镜与病理诊断的符合率一直是临床关注的热点问题。
近年来,人工智能(artificial intelligence,AI)在图像识别领域不断取得突破,特别是深度学习(Deep Learning)的出现,使得数据特征的提取摆脱了人工提取低效和不完全的局限性[6]。深度学习中用于图像处理的典型卷积神经网络(convolutional neural network,CNN)模型由一系列卷积网络组成,其中包含一系列卷积层、池化层、全连接层。与人脑中的低级视觉处理一样,卷积网络检测提取图像特征,例如可能表示直边的线或圆(例如器官检测)或圆圈(结肠息肉检测),然后是更高阶的特征,例如局部和全局形状和纹理特征提取[6]。CNN需要获取大量的训练数据,而医学图像很难获得那么大规模的数据[7],因此,一种特别适用于生物医学图像处理任务的网络模型应运而生,它就是U-Net。2015年,Ronneberger等在MICCAI会议发表U-Net,使深度学习在医学影像分割中获得突破性进展[8]。
虽然深度学习技术与消化内镜相结合的应用已成为消化领域研究热点之一,但目前深度学习应用于慢性萎缩性胃炎的识别研究仍较少[9-10]。我们开发了基于U-Net深度学习的慢性萎缩性胃炎诊断模型,并进行了一项病例对照研究,以病理诊断为金标准,评估模型的诊断性评价指标及与病理诊断的一致性分析。
1 资料与方法
1.1 研究对象选取2019年8月1日至2020年8月1日于首都医科大学宣武医院行胃镜检查的1 711例慢性萎缩性胃炎患者的胃镜检查胃部图片39 356张,其中筛选出高质量清晰图片26 450张。利用计算机产生的随机数字方法,选取20%的图片共5 290张进入研究。本研究遵循的程序符合我院学术伦理委员会所制定的伦理学标准,得到该委员会批准(批号:XWQN-2019016)。
1.2 基于U-Net深度学习慢性萎缩性胃炎模型随着深度学习技术的快速发展,深度学习在医学影像领域的应用吸引了广泛的研究和关注,其中,如何自动识别和分割医学影像中的病灶是最受关注的问题之一。为解决这一问题,U-Net网络模型被提出,它是基于完全卷积网络(fully convolutional network,FCN)改进而成,由编码器、瓶颈(bottleneck)模块、解码器几部分组成,由于其U型结构结合上下文信息和训练速度快、使用数据量小,满足医学影像分割的诉求[6],经典图像识别深度模型需要大量的训练数据,而医学图像很难获得那么大规模的数据[7],而U-Net恰好弥补这方面不足。U-Net网络主要思想是在收缩网络的后面补充一个与前面类似的网络,其中池化运算符由上采样运算符替换,因此,这些层增加了输出的分辨率;为了定位,从收缩路径的高分辨率特征与上采样输出相结合;然后,连续卷积层可以学习基于该信息组装更精确的输出[11]。U-Net网络在被提出后,便大范围地用于医学图像的分割。U-Net已经成为大多做医疗影像语义分割任务的基线模型[12]。本研究拟通过应用U-Net网络进行基于深度学习的慢性萎缩性胃炎诊断模型的构建。
1.3 基于U-Net深度学习模型的构建、训练及测试本研究应用U-Net网络进行了基于深度学习的慢性萎缩性胃炎诊断模型的构建。经过三个步骤,首先是数据集的准备:由两名副高以上消化内镜医师(具有操作10 000例以上胃镜经验)对随机选出的5 290张高质量的内镜图片根据病理诊断进行标注,标注精确至慢性萎缩性胃炎的严重程度(轻、中、重度)。共标注慢性萎缩性胃炎图片4 175张,其中轻度萎缩性胃炎图片2 389张,中度萎缩性胃炎977张,重度萎缩性胃炎809张。另外标注慢性非萎缩性胃炎图片1 115张。数据集拆分为训练集和测试集。业界一般按比例8∶2、7∶3、6∶4分为训练集和测试集[13]。根据我们数据量规模,我们选择了7∶3的中间划分方案。根据萎缩严重程度应用分层随机法将70%的图片纳入训练集,30%的图片纳入测试集,以3 703张胃镜图片进行5折交叉验证调整模型的准确率。
其次是模型的定义:具体的模型定义如图1所示的结构。左半部分是一个编码器,首先由两个3×3的卷积层(Relu)再加上一个2×2的maxpooling层组成一个下采样的模块。共有4个下采样模块连结在一起构成编码器,编码器接到右半部分的解码器中。解码器由反卷积层+特征拼接concat+两个3×3的卷积层(Relu)反复构成。

图1 U-Net结构说明Fig 1 U-Net architecture description
然后是模型的训练:训练过程是将一个测试图片作为U-Net模型的输入,经过模型处理得到输出。输出结果和标注胃炎病灶结果进行比较,根据损失函数计算出一个当前损失值,损失沿着网络结构反向传播,在网络每一层分别计算损失值对本层参数的梯度,根据梯度对参数进行更新。这里的损失函数我们采用了BCEWithLogitsLoss函数,参数更新的算法采用自适应的优化算法RMSProp。对整个数据集分成多个批次(BATCH),每个批次分别重复上述过程更新模型参数直到收敛。当所有批次均训练完成后,得到新的模型参数就已经能够较好地拟合训练数据的特点,适用于慢性萎缩性胃炎诊断任务了。
模型训练完毕后,本研究以1 587张胃镜图片对模型进行测试,计算模型的诊断学评价指标,灵敏度=真阳性/(真阳性+假阴性);特异度=真阴性/(真阴性+假阳性);正确率=(真阳性+真阴性)/图片总数。
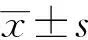
2 结果
2.1 训练集及测试集图片的基线资料训练集及测试集图片的慢性萎缩性胃炎在萎缩的严重程度(χ2=0.002,P=1.000)、萎缩病灶部位(χ2=3.558,P=0.469)及幽门螺杆菌感染情况(χ2=2.451,P=0.117)上比较,差异均无统计学意义(见表1)。

表1 训练集及测试集图片的基线资料[例数(%)]Tab 1 Baseline information of training set and test set images [n(%)]
2.2 以测试集图片评估基于U-Net深度学习的慢性萎缩性胃炎诊断模型的诊断性评价指标模型训练完毕后,我们用1 587张胃镜图片对模型进行测试,其对慢性萎缩性胃炎诊断的灵敏度、特异度、阳性预测值、阴性预测值、正确率、Youden指数、比数积、阳性似然比、阴性似然比,分别为92.73%、92.24%、97.81%、77.25%、92.63%、84.97%、151.63、11.95、0.08。
2.3 基于U-Net深度学习的慢性萎缩性胃炎诊断模型与病理诊断的一致性及其ROC曲线模型训练完毕后,我们应用1 587张胃镜图片对模型进行测试,其与病理诊断的一致性Kappa值为0.796(P<0.001),AUC为0.932(95%CI:0.916~0.948)(P<0.001)(见图2)。说明基于深度学习的慢性萎缩性胃炎诊断模型与病理诊断具有较高的一致性。
2.4 测试集基于U-Net深度学习模型错误识别情况分析U-Net深度学习模型识别图片中假阳性26张(1.6%),非萎缩性胃炎误诊为轻度萎缩性胃炎19张(73.1%),中度萎缩性胃炎5张(19.2%),重度萎缩性胃炎2张(7.7%);假阴性91张(5.7%),其中轻度萎缩性胃炎51张(56.0%),中度萎缩性胃炎27张(29.7%),重度萎缩性胃炎13张(14.3%)误诊为非萎缩性胃炎(见表2)。

表2 U-Net深度学习模型错误识别情况分析[例数(%)]Tab 2 Error recognition analysis of U-Net deep learning model [n(%)]
3 讨论
慢性萎缩性胃炎作为胃癌的癌前疾病,是内镜医师关注的重点和难点之一。慢性萎缩性胃炎的早期发现和早期诊断能够在一定程度上防止胃癌的形成,但其诊断的难度和漏诊率为内镜医师带来了很大的挑战[14]。既往研究显示,不同地域、同一地域不同医院的慢性萎缩性胃炎的内镜下诊断比例差异较大,波动于17.7%~39.8%,且目前内镜下诊断萎缩的灵敏度仅为42%[2],因此,内镜下提高慢性萎缩性胃炎的诊断率尤为重要。《慢性萎缩性胃炎中西医结合诊疗共识意见(2017年)》中指出:慢性萎缩性胃炎的内镜下表现为黏膜红白相间,以白相为主,皱襞变平甚至消失,部分黏膜血管显露;可伴有黏膜颗粒或结节状等表现[5]。然而具体到临床实践中,如何辨别萎缩主要还是依据胃镜操作医师的主观认识,依赖于其对指南的理解程度、既往的操作经验以及本医院进行的规范培训程度等多种因素,因此,具有较多的不确定性且差异较大。如何使每一位消化内镜医师标准一致的、准确地早期发现和诊断慢性萎缩性胃炎一直是临床指南努力完成、却一直无法完成的难题。
人工智能特别是深度学习的出现为这一难题提供了较好的解决方案。深度学习是当前机器学习领域一个研究热点,在图像识别等领域表现出优异的性能[15],其与消化内镜相结合的应用已成为研究热点,尤其是对上消化道疾病的诊断[16]。目前主要的研究方向是深度学习辅助检测巴雷特食管、辅助检测食管癌、辅助检测胃癌、辅助检测幽门螺杆菌感染、辅助识别解剖部位等[17],尤其是对早癌的研究较多。在上消化道内镜应用领域,单纯依靠内镜医师进行镜下诊断仍有很多局限和困难,如对早期恶性肿瘤(早期食管癌、早期胃癌等)的鉴别及诊断,约有10%的恶性病变有可能被漏诊,而计算机辅助诊断(computer aided diagnosis,CAD)可以帮助内镜医师进行早期癌变的检测及筛查。有学者将AI应用于传统内镜的研究,通过上消化道内镜图像进行机器学习后,对恶性病变的灵敏度高达98%,阴性预测值为95%,但阳性预测值仅40%,通过学习样本数量的增加有可能改善阳性预测值[18]。还有学者通过使用大量传统的内镜图像,用深度学习算法中的CNN建立了能够自动检测早期胃癌的CAD系统,它识别病变速度快,灵敏度为92%,说明以该算法为核心的CAD系统具有较强的临床诊断能力[19]。我国自主研发的上消化道癌内镜AI辅助诊断系统表现优良,进行了多中心对照试验提示该系统对上消化道癌变诊断的准确性、灵敏度及特异度均较高,其灵敏度可接近资深内镜专家的诊断水平,并已初步应用于临床内镜检查中[20]。在诸多学者将焦点聚集到上消化道早癌上时,我们的研究着眼于“早期胃癌”的前期病变——“慢性萎缩性胃炎”上,由此“关口前移”,更加有效地减少胃癌的发生、监测胃癌的发展。我国学者通过简化神经网络的众多参数,在较小数据集的训练下实现了对胃部癌前病变,如息肉、溃疡和糜烂的较高敏感度的识别,灵敏度高达88.9%[21]。而AI辅助检测慢性萎缩性胃炎的研究也在逐步开展,有研究[22-23]提示:CNN-慢性萎缩性胃炎模型在诊断萎缩性胃炎中的诊断准确性、灵敏度和特异度分别为0.942、0.945和0.940,均高于普通内镜专家,而轻度、中度和重度萎缩性胃炎的检出率分别为93%、95%和99%。我们的研究很好地对上述研究进行了延伸,并自主开发了一款可以应用于慢性萎缩性胃炎诊断的U-Net深度学习模型。
本研究以病理诊断为金标准,发现基于U-Net深度学习的慢性萎缩性胃炎诊断模型诊断评价指标以及一致性评价均优于消化内镜医师人工诊断指标[2]。本诊断模型的灵敏度为92.73%、特异度为92.24%、阳性预测值为97.81%、阴性预测值为77.25%、正确率为92.63%、Youden指数为84.97%、比数积为151.63、阳性似然比为11.95、阴性似然比为0.08、AUC(95%CI)为0.932(0.916~0.948)、Kappa值为0.796。上述指标显示,基于U-Net深度学习的慢性萎缩性胃炎诊断模型检出慢性萎缩性胃炎以及鉴别慢性非萎缩性胃炎的能力较好;其诊断为阳性者,确诊为慢性萎缩性胃炎的概率较高。其ROC曲线下面积>0.9,表示诊断的准确性较高,其Kappa值接近0.8,显示其与病理诊断具有较好的一致性。
本研究对U-Net深度学习模型错误识别情况也进行了分析。在假阳性(即被误诊为慢性萎缩性胃炎的非萎缩病变)图片(26张)中,本模型将无萎缩诊断为轻度萎缩(19张,73.1%)的比例较高,而诊断为中度萎缩(5张,19.2%)及重度萎缩(2张,7.7%)的比例较低;位置主要以胃体(10张,38.5%)、胃底(8张,30.8%)为主,幽门螺杆菌感染率高(19张,73.1%)。在假阴性(即被误诊为非萎缩的慢性萎缩性胃炎病变)图片(91张)中,本模型将轻度萎缩(51张,56.0%)诊断为无萎缩的比例较高,而中度(27张,29.7%)、重度(13张,14.3%)萎缩诊断为无萎缩的比例低,位置以胃角(28张,30.8%)、胃体(30张,33.0%)、胃底(23张,25.3%)为主,幽门螺杆菌感染率低(22张,24.2%)。造成假阳性、假阴性结果的主要原因可能是学习样本的数量和质量有限,因此,进一步积累大量高质量的内镜图像用于对算法的训练可以降低其产生错误的概率。通过分析提示,我们的模型尚需进一步改进,后期应增加无萎缩、轻度萎缩性胃炎、胃角、胃体、胃底以及合并幽门螺杆菌感染图片的训练量,并相应调整参数[6-7,11-12]。
本研究尚存在一些不足。首先,用来训练和测试模型的数据是回顾性内镜检查图像且对资料进行了人为的初步筛选,模型应用于临床实践中的效果需要进一步评估,尤其是需要进行前瞻性研究来评价模型的诊断效能。其次,研究使用的训练集和测试集来源于单中心数据,后期需通过多中心数据进一步提高模型的诊断性评价指标以及与病理诊断的一致性研究。
本研究建立了基于U-Net深度学习的慢性萎缩性胃炎诊断模型,并通过回顾性研究发现该诊断模型对慢性萎缩性胃炎的诊断性评价指标良好,并且与病理诊断有较高的一致性。我们可以在此基础上进一步进行多中心、前瞻性的研究,以改进此诊断模型,为将来的临床应用提供理论依据。深度模型设计的最终目的是实时辅助医师进行诊断,提高内镜医师对慢性萎缩性胃炎的诊断率。

