胆汁内外引流术对梗阻性黄疸小鼠肠道FXR及TLR4表达的影响
申少华, 刘迎娣, 王子恺, 李春涛, 李 闻
1.中国人民解放军总医院消化内科,北京 100853; 2.北京市顺义区医院消化内科
梗阻性黄疸(obstructive jaundice,OJ),也称梗黄,在临床上较多见,很多疾病均可引起梗黄。胆道梗阻后,因肠道失去胆汁,肠道菌群失调,肠黏膜屏障遭到破坏,易发生肠源性细菌异位,进而引起全身感染。并且此时肝脏Kupffer细胞的免疫功能受到抑制,清除内毒素的能力下降[1]。以上这些因素最终导致内毒素血症的形成。
我们的研究属于梗黄系列基础研究。目前解除胆道梗阻有胆汁内引流术和胆汁外引流术两种方法。我们之前的研究表明,胆汁内引流术优于外引流术主要在于胆汁酸可促进细胞免疫功能恢复[1]。多数学者的研究表明,胆汁内引流术效果优于外引流[2]。但胆汁内引流术解除梗黄优于外引流术的机制尚不十分清楚。胆汁内引流术与外引流术的根本区别在于胆汁是否重新进入肠道,胆汁酸在维持肠道内环境稳定中扮演重要角色[3-4],胆汁酸通过其受体分子信号传导通路介导的免疫调节作用越来越受到关注和重视。
Gadaleta等[5]研究发现,肠道炎症可能通过病原识别受体通路下游转录因子核因子κB(nuclear factor-κB,NF-κB)的作用,抑制FXR激活和表达;FXR和NF-κB之间在肠道水平存在交互调节。
病原模式识别受体(pattern recognition receptors,PRRs)在启动和调节天然免疫及诱导获得性免疫中也起到重要作用,其中TLR4是Toll样受体家族(Toll like receptors,TLRs)最早被发现的,并且近些年被大量研究,在迅速识别和对抗外界致病性病原微生物引发的免疫应答中扮演着重要的角色[6]。本研究就梗黄、内外引流术后和激动剂处理后回肠黏膜TLR4和FXR受体表达的变化,初步探讨胆汁酸受体与PRRs家族之间的免疫调控网络,为指导临床治疗提供实验依据。
1 材料与方法
1.1 实验材料实验动物:体质量25~35 g的健康雄性昆明小鼠100只购自维通利华科学院实验动物中心。小鼠在中国人民解放军总医院肝胆外科实验室动物房饲养,进食水不受限制,普通动物饲料饲养。用恰当型号灌胃针进行灌胃。收集标本时所有动物均为过量乙醚麻醉。本研究得到伦理委员会批准(批号:2016-x11-01)。
1.2 方法
1.2.1 动物模型建立:将昆明小鼠常规喂养1周后,随机分为四组:梗黄组(OJ组)、胆汁外引流组(ED组)、胆汁内引流组(ID组)和假手术组(SH组),每组15只。另外40只小鼠用同样方法分成四组,每组10只。每组再均分为激动剂组:FXR激动剂GW4064(美国Abmole Bioscience公司)和对照组:0.5%羧甲基纤维素钠CMC-Na(美国Sigma公司),每组各5只,OJ组、SH组分别在第1次手术前1 d开始灌胃,ID组和ED组分别在引流术前1 d开始灌胃,均至取标本当天结束,其他手术处理及标本制备同第一部分。所有手术过程均采用98%氧气和28%异氟烷吸入性麻醉。动物模型的建立均是在显微镜下完成。这个模型和我们之前课题组李闻等建立的梗黄内外引流大鼠模型[7]是一脉相承的,部分细节因为小鼠体型小而进行了改良(见图1)。

注:A:分离胆管;B:SH组;C:OJ组;D~E:ED组;F:ID组。
1.2.2 标本制备:SH组和OJ组在手术后第9天处死小鼠并采集标本,ID组和ED组在行引流术后第9天处死小鼠并采集标本。小鼠于取材前禁食12 h,以乙醚持续麻醉。固定小鼠于手术板,备皮后常规消毒铺巾。距回肠末端分别取2 cm、5 cm和5 cm回肠组织,其中2 cm回肠组织置入10%中性福尔马林溶液固定至少24 h,两份5 cm回肠组织用外科剪沿纵轴剪开,然后用无菌的载玻片刮取肠黏膜组织,分别置入已标记好的无菌无RNA酶的冻存管中。迅速放入液氮后,尽快转移到-80 ℃冰箱保存待用。回肠离体后应在10 min内完成标本制备。
1.2.3 检测指标:(1)SH组、OJ组称取手术前后小鼠的体质量;ID组、ED组称取二次手术前后的体质量,计算前后体质量差值。(2)肝功检测:于取标本日用1 ml注射器心脏取血,离心取上层血清约0.5 ml用来检测肝功:ALT、TBIL、DBIL、ALP。多功能酶标仪连续检测即可计算出各个值。(3)病理学检测:HE染色病理学观察分析:将制成的肝组织蜡块切成约4 μm厚度的切片,进行HE染色,光镜观察并显微照相,最终比较四组小鼠回肠黏膜炎症情况。(4)蛋白质印迹分析(Western blotting):使用RIPA裂解液及PMSF提取总的蛋白,取各组20 μg混合总蛋白以10% SDS-PAGE凝胶电泳分离。电转移蛋白至PVDF膜,质量浓度为50 g/L的脱脂奶粉封闭过夜,分别加入FXR(1∶2 000,Abcam,ab129089)、TLR4(1∶1 000,Abcam,ab22048)和β-actin一抗(1∶2 000,Abcam,ab8227)于封闭袋中4 ℃孵育过夜;二抗室温孵育1 h。最后在凝胶成像系统显影中得到蛋白条带,根据条带的灰度值,以β-actin为内参计算比较目标蛋白表达量。(5)实时荧光定量PCR(qRT-PCR):用SuperScriptTMⅢ First-Strand Synthesis System for RT-PCR(Invitrogen,cat. No: 18080-051),按产品说明书进行实验操作,取2 μg总RNA进行逆转录。引物设计来自北京赛百盛公司,Actin引物序列上游引物:5′-CAGAAGGAGATTACTGCTCTGGCT-3′,下游引物:5′-GGAGCCACCGATCCACACA-3′;FXR引物序列上游引物:5′-CGGCGGAGATTTTCAATAAG-3′,下游引物:5′-GAAACTGAACATCGGGGTTAT-3′;TLR4引物序列上游引物:5′-TTCAGAACTTCAGTGGCTGG-3′,下游引物:5′-TGTTAGTCCAGAGAAACTTCCTG-3′。Roche 480型荧光定量PCR仪(瑞士Roche),25 μl反应体系荧光染料法,95 ℃,10 min;95 ℃,15 s,60 ℃,1 min此步骤收集荧光信号,40个循环,反应完成后同在60~95 ℃进行融解曲线分析,每10 s升高1 ℃。内参和目的片段分别同批扩增,每组设置3个复孔,采用2-△△CT法进行数据的相对定量分析。
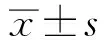
2 结果
2.1 小鼠体质量及一般情况SH组小鼠皮肤、饮食、活动量及尿、便正常,体质量增加明显,与OJ组比较,差异无统计学意义(P>0.05),但与ED组、ID组比较,差异有统计学意义(P<0.05);OJ组小鼠皮肤发黄,毛发粗乱无光泽,尿色深黄,大便干结、量少,呈现便秘状态,结肠内粪块零星分布,饮食、活动量减少,体质量略增加,与ID组比较,差异无统计学意义(P>0.05),但与ED组比较,差异有统计学意义(P<0.05)。胆汁引流术后小鼠一般状态均好转。与其他三组比较,ED组小鼠体质量明显下降。ID组与OJ组比较,实验小鼠基本状态改善,体质量略增加(见表1)。

表1 各组小鼠手术前、后体质量及二者差值结果Tab 1 Pre- and post-surgery weights and the differences between them in each group
2.2 肝功能梗黄小鼠肝功能变得很差。小鼠胆道梗阻后,肝功能指标ALT、TBIL、DBIL和ALP较SH组明显升高,行胆汁内外引流术后,ID和ED组小鼠上述各项肝功能指标显著改善,与SH组比较,差异无统计学意义(见表2)。

表2 各组小鼠手术后肝功结果Tab 2 Liver function result in each group after surgery
2.3 回肠组织病理学SH组和ID组回肠黏膜组织基本正常。胆道梗阻后,可见轻度炎细胞浸润。ED组小鼠回肠黏膜炎症情况与OJ组类似(见图2)。
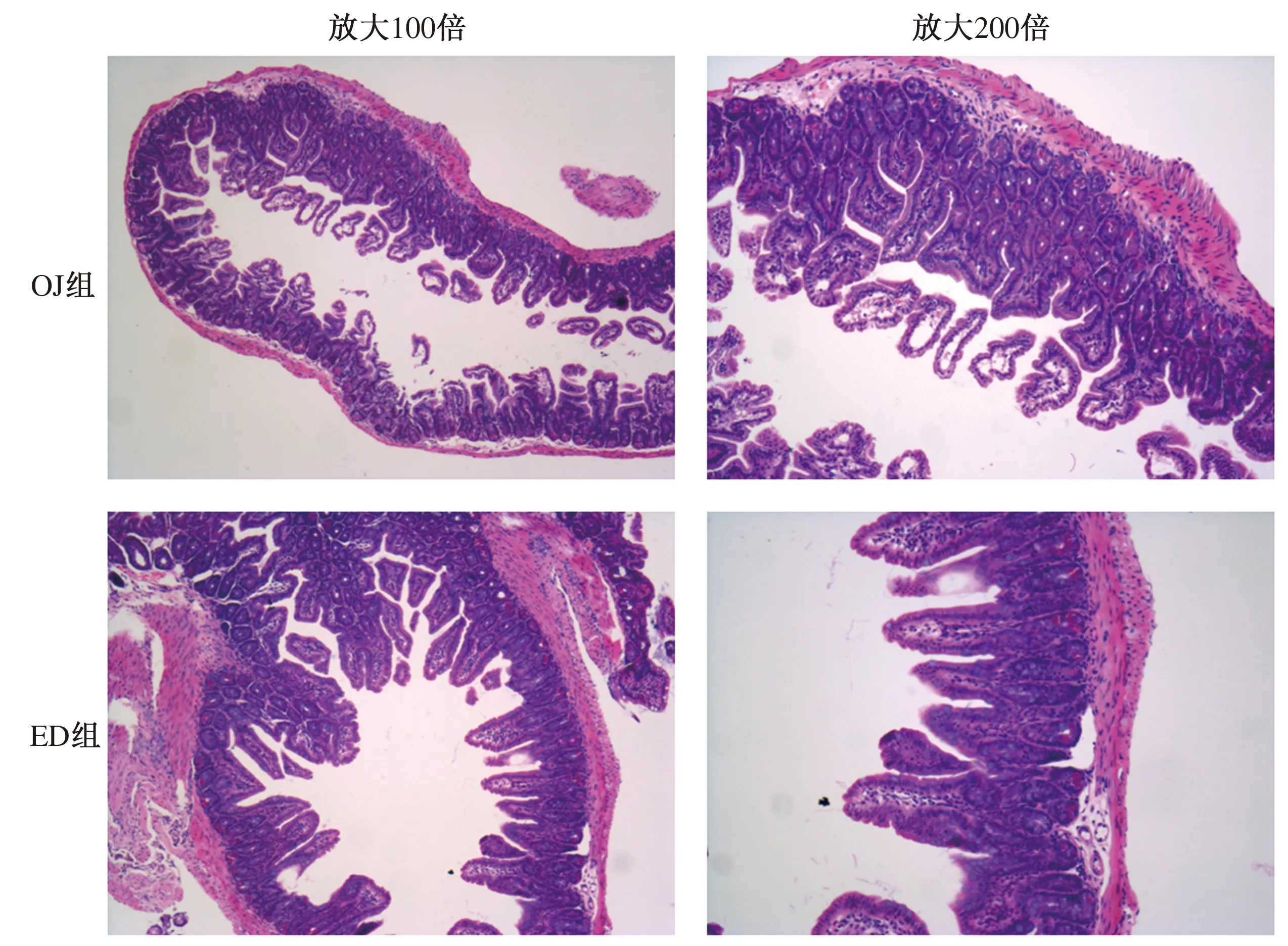
图2 四组小鼠回肠肠组织HE染色结果Fig 2 Histopathology of the terminal ileum (HE staining) in 4 groups of mice
2.4 回肠黏膜TLR4和FXR受体表达
2.4.1 四组小鼠肠黏膜FXR及TLR4蛋白及mRNA的表达水平:Western blotting方法检测肠黏膜FXR和TLR4蛋白的表达水平。小鼠胆道梗阻后,肠黏膜FXR表达较SH组明显升高(P<0.001);胆汁外引流术后,FXR表达较稍有下降(P=0.001),仍高于SH组水平(P<0.001);然而胆汁内引流术后,FXR表达明显下调(P<0.001),但尚未降到SH组水平(P=0.002),效果好于外引流(P<0.001)(见图3)。小鼠胆道梗阻后,肠黏膜TLR4表达较SH组明显降低(P<0.001);胆汁外引流术后,表达稍有增强(P=0.018),但仍低于SH组水平(P<0.001);胆汁内引流术后,TLR4表达明显上调(P<0.001),但尚未升到SH组水平(P=0.007),效果好于外引流(P=0.006)(见图4)。
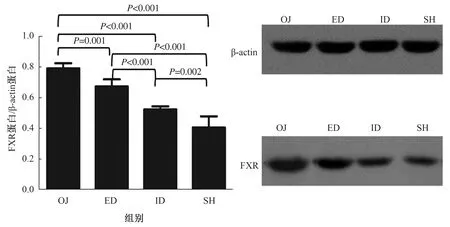
图3 四组肠黏膜组织FXR蛋白表达比较Fig 3 Comparison of FXR protein expression in ileal mucosa in the 4 groups
图4 四组肠黏膜组织TLR4蛋白表达比较Fig 4 Comparison of TLR4 protein expression in the ileal mucosa in the 4 groups
qRT-PCR法检测四组小鼠肠黏膜FXR和TLR4 mRNA的表达水平。小鼠胆道梗阻后,肠黏膜FXR mRNA水平较SH组明显升高(P<0.001);胆汁外引流术后,FXR mRNA水平稍有上升(P=0.519),仍高于SH组水平(P<0.001);然而,胆汁内引流术后,FXR mRNA水平明显下调(P=0.066),但尚未降到SH组水平(P=0.008),效果好于外引流(P=0.023)(见图5)。小鼠胆道梗阻后,肠黏膜TLR4 mRNA较SH组明显降低(P<0.001);胆汁外引流后,表达稍有增强(P=0.021),仍低于SH组水平(P<0.001);胆汁内引流术后,TLR4 mRNA表达明显上调(P<0.001),但尚未升到SH组水平(P=0.002),效果好于外引流(P<0.001)(见图6)。
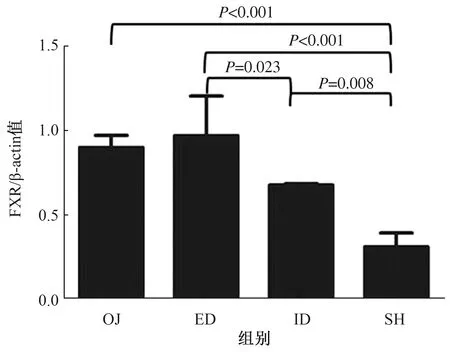
图5 四组肠黏膜FXR mRNA表达比较; 图6 四组肠黏膜TLR4 mRNA表达比较Fig 5 Comparison of FXR mRNA expression in the ileal mucosa in the 4 groups; Fig 6 Comparison of TLR4 mRNA expression in the ileal mucosa in the 4 groups
2.4.2 CMC-Na和GW4064处理小鼠后肠黏膜TLR4蛋白及mRNA表达结果:Western blotting方法检测肠黏膜TLR4蛋白的表达水平。对照组:小鼠胆道梗阻后,肠黏膜TLR4表达较SH组显著降低(P<0.001);胆汁外引流术后,表达稍有提高(P=0.083),仍低于SH组水平(P<0.001);胆汁内引流术后,TLR4表达明显升高(P=0.002),但尚未升到SH组水平(P=0.014),效果好于外引流(P=0.027)(见图7)。激动剂组:OJ组、ED组、ID组、SH组肠黏膜TLR4表达四组之间差异无统计学意义(P>0.05)(见图8)。激动剂组中OJ组的TLR4蛋白表达与对照组中OJ组的比较,差异无统计学意义(P=0.736),而激动剂组中SH组的TLR4蛋白表达与对照组中SH组的比较,差异有统计学意义(P=0.042)(见图9)。

图7 对照组中四组肠黏膜组织TLR4蛋白表达比较Fig 7 Comparison of TLR4 protein expression in the ileal mucosa in the 4 groups of the vehicle group
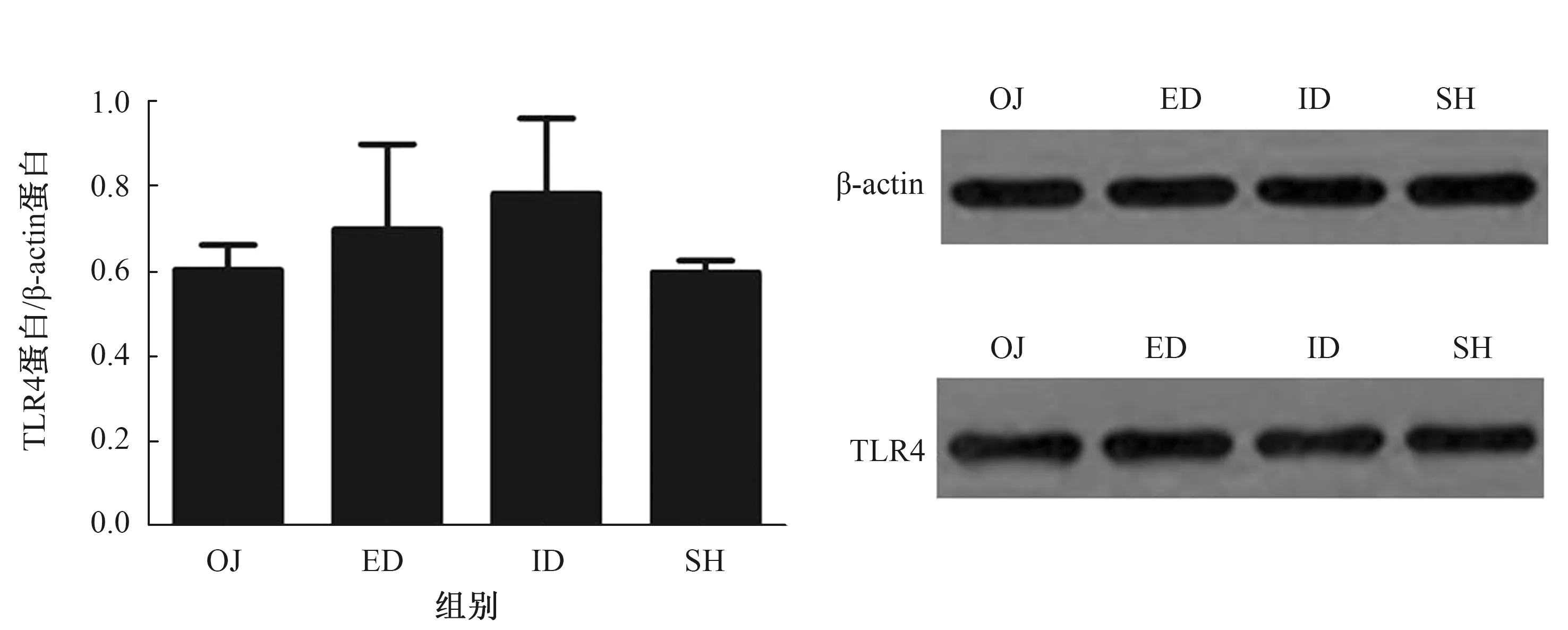
图8 激动剂组中四组肠黏膜组织TLR4蛋白表达比较Fig 8 Comparison of TLR4 protein expression in the ileal mucosa in the 4 groups of the GW4064 group

图9 分别比较OJ组和SH组中对照组和激动剂组的肠黏膜TLR4蛋白水平Fig 9 Comparison of TLR4 protein expression levels in the ileal mucosa in the vehicle and GW4064 groups of the OJ and SH groups
qRT-PCR检测肠黏膜TLR4 mRNA的表达水平。对照组:小鼠胆道梗阻后,肠黏膜TLR4 mRNA表达较SH组明显降低(P=0.034);胆汁外引流术后,TLR4 mRNA表达水平稍有上升(P=0.822),仍低于SH组水平(P=0.049);胆汁内引流后,TLR4 mRNA表达明显上调(P=0.127),但尚未升到SH组水平(P=0.480)(见图10)。激动剂组:OJ组、ED组、ID组、SH组肠黏膜TLR4 mRNA表达在四组之间差异无统计学意义(P>0.05)(见图11)。激动剂组中OJ组的TLR4 mRNA表达与对照组中OJ组的比较,差异无统计学意义(P=0.736),而激动剂组中SH组的TLR4 mRNA表达与对照组中SH组的比较,差异有统计学意义(P=0.043)(见图12)。
3 讨论
由于小鼠具有胆囊,与人类的生理结构和功能相对更接近,并且小鼠敲基因的技术相对于大鼠更成熟,因此,使用小鼠可以为后续进一步研究奠定基础。目前利用小鼠梗黄模型来进行实验研究的报道少见,而我们成功地建立了小鼠梗黄及胆汁内外引流的模型。这个模型和我们课题组之前建立的大鼠梗黄模型[7]是一脉相承的,部分细节因小鼠体型小而进行了相应的改良,优点包括二次引流术时粘连较轻、术中出血量少、术后引流管不易堵塞和可以长期存活以供研究。这个模型的成功建立可以通过胆汁内外引流术后肝功能的全面恢复和肠道炎症缓解证明。我们主要研究了胆汁内外引流术对OJ小鼠肠道中FXR与TLR4表达的影响,并通过FXR激动剂灌胃治疗探讨FXR和TLR4之间可能的调控机制。
因FXR可识别和结合生理水平的胆汁酸,FXR也因此被称为胆汁酸受体。FXR在肝脏、肾脏、肾上腺和小肠组织中高表达[8],在回肠中FXR mRNA含量最高[9]。FXR调节体内胆汁酸的水平,同时参与机体内脂代谢和糖代谢,并起着重要的调节作用[9-10]。FXR也可以保护肠黏膜,OJ时,FXR可通过反馈性调节胆汁酸代谢来发挥保护肝细胞并抑制肠道细菌增殖、移位等重要作用。

本研究发现,小鼠胆道梗阻后,OJ组小鼠较SH组小鼠FXR水平明显升高,可能原因是胆道梗阻后,胆汁酸的肠肝循环被中断,胆汁酸无法流入肠道,所以胆汁酸配体FXR表达水平反馈性升高,以促进胆汁酸代谢,从而保护肠黏膜。梗黄小鼠进行外引流术后,胆汁引流到体外,胆汁同样无法流入肠道,FXR受体表达也反馈性地略升高;梗黄小鼠进行内引流术后,胆汁酸从胆肠吻合口重新流入肠道,FXR受体也稍升高,但是更和SH组接近。FXR蛋白表达水平和mRNA水平在OJ组、ED组、ID组、SH组大体上逐渐递减。
机体固有免疫细胞可通过病原PRRs直接识别微生物的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)并与之结合,进而被激活并启动机体免疫防御反应。PRRs包括TLRs和核苷酸结合寡聚化结构域受体家族(nucleotide binding oligomerzation domains,NODs)。TLR4可通过启动天然免疫调节获得性免疫,在一系列免疫性疾病中发挥着重要作用,所以在研究中我们检测TLR4表达水平。在人体内TLR4主要表达于天然免疫细胞(如巨噬细胞、树突细胞)和非免疫细胞(如肠上皮细胞、成纤维细胞、肾脏系膜细胞)上[11]。TLR4可以识别多种内源性和外源性配体,外源性配体主要涉及内毒素,包括革兰氏阴性细菌细胞壁的脂多糖(lipopolysaccharide,LPS)[12]。TLR4是天然免疫系统中的Ⅰ型跨膜受体[13],可非特异性地与PAMPs结合,启动信号转导,最终导致核因子NF-κB激活,引发多种炎症介质表达,因而TLR4可通过启动天然免疫调节获得性免疫,在一系列免疫性疾病中发挥着重要作用。
本研究发现,小鼠胆道梗阻后,TLR4表达水平均较SH组明显下降,并且表达水平在OJ组、ED组、ID组和SH组中逐渐升高,四组之间两两比较,差异均有统计学意义。本研究发现,梗黄后肠黏膜TLR4表达水平下降,考虑可能原因是,梗黄初期手术后LPS刺激TLR4反应性升高[14],随着梗黄时间延长,肠源性细菌移位造成“肠源性脓毒症”进而引起内毒素耐受,最终导致TLR4水平下降。所谓内毒素耐受即在体外或体内,第一次受LPS刺激后,如果不久再次受到LPS冲击,机体免疫应答会明显减弱[15]。
Gadaleta等[5]分别从细胞、组织和动物水平分别给予炎症刺激(TNF-α/IL-1β)和NF-κB的亚单位p50或p65处理,均发现肠道FXR活性降低,下游基因表达下降。研究发现,FXR也可以抑制炎症[16-18],二者相互抑制,进而可能导致恶性循环,降低的FXR活性对炎症抑制作用减弱,进而形成慢性肠道炎症。
本研究发现,小鼠梗黄后回肠末段黏膜FXR表达水平反馈性升高,但既往文献[19]表明,梗黄后FXR活性降低,其靶基因IBABP和FGF15/19等表达明显降低,进而对肠道炎症抑制作用减弱,肠道促炎症因子活化的NF-κB信号通路可能会增强,但由于上述多种原因可能造成肠黏膜固有免疫功能受到抑制,进而TLR4介导的LPS活化NF-κB信号通路中的TLR4表达受到抑制,TLR4表达水平下降。我们的推测在文章另一部分通过分别用FXR激动剂和安慰剂处理四组小鼠后回肠黏膜TLR4表达的情况得到了证明。
四组小鼠给予CMC-Na灌胃后TLR4表达水平趋势和上述无任何处理的小鼠基本保持一致。小鼠给予GW4064灌胃后,四组之间TLR4表达差异消失,可能原因是四组小鼠肠道细菌的生长受到抑制,肠黏膜免疫屏障功能均得到了不同程度的恢复。Gadaleta等[18]证实结肠炎小鼠接受FXR的激动剂INT-747后,肠道炎症反应减轻,结肠黏膜炎症因子释放降低,阻止了肠道通透性的增加。Inagaki等[3]研究发现也和我们基本一致。SH组小鼠分别给予GW4064和CMC-Na处理后,两组之间TLR4表达水平差异有统计学意义,GW4064组低于CMC-Na组。可能原因为肠道本身就不是无菌环境,TLR4维持在适度水平,给予GW4064处理后,致病菌、肠道炎症进一步得到抑制,进而TLR4水平较对照组下降。OJ组小鼠分别给予GW4064和CMC-Na处理后,两组之间TLR4表达水平差异无统计学意义,对照组可能原因是梗黄持续时间长机体固有免疫水平低下,而激动剂组可能因为肠道炎症受到明显抑制而降低。
以上关于FXR与TLR4相互调节的机制的推测有待我们进一步在细胞和组织水平验证,需要进一步利用基因敲除小鼠和野生小鼠来对比观察,并且观察在不同时间点FXR、TLR4及其下游基因表达的变化,以进一步明确FXR和TLR4二者之间具体的免疫调控网络。
本实验发现胆汁内引流效果好于外引流。主要不同在于胆汁内引流术可以使肠道胆汁复现,胆汁酸可以促进肠上皮细胞增生,恢复紧密连接结构正常化,进而恢复肠道屏障功能。胆汁酸还抑制有害细菌生长,降低内毒素血症的发生,肠道固有免疫功能也适当恢复,进而TLR4表达基本恢复至对照组水平。内引流术后使肠道恢复胆汁,而外引流术后胆汁大量丢失,胆汁上述保护机制均缺失,甚至引起水电解质紊乱和酸碱失衡。另外,胆汁内引流术优于胆汁外引流术也表现在小鼠体质量术前、术后的差值上,外引流术后小鼠体质量明显降低,与其他三组比较,差异均有统计学意义。其主要原因是上述机制,其他原因为外引流术创伤确实较大。我们从小鼠回肠末段HE染色结果也可以看出内引流术优于外引流术,表现为内引流组肠道炎症较外引流组略轻。
多项研究[2,20]发现,胆汁内引流术优于胆汁外引流术,我们与这些研究主要的不同在于我们证明胆汁酸通过调节FXR和TLR4在肠上皮细胞的表达来改善肠道功能。
小鼠梗黄形成后,肠道FXR升高,TLR4下降,胆汁内引流和外引流均可逆转这些改变,但内引流效果优于外引流。FXR激动剂通过活化FXR间接调控TLR4,从而保护肠黏膜。肠道内胆汁酸是解释这些现象的关键。
总之,胆汁内引流术效果优于外引流术的机制部分可能与肠黏膜组织FXR、TLR4受体的表达调控有关,具体机制仍待进一步深入研究。

