原子力显微镜在纤维素研究中的应用
郭元龙, 郭 顾, 陈子祥, 张丽华, 谢海波*, 郑 强
原子力显微镜在纤维素研究中的应用
郭元龙1, 郭 顾1, 陈子祥1, 张丽华1, 谢海波1*, 郑 强2
(1. 贵州大学材料与冶金学院,贵州 贵阳 550025;2. 太原理工大学,山西 太原 030024)
综述了原子力显微镜(AFM)的测试原理及在纤维素研究中的应用进展,重点对纤维素的晶体结构、微观形貌、酶解过程及衍生物等方面的研究做了详细论述,确定了AFM对以上研究内容的重要性,并给出了不同AFM应用的具体实施案例和操作方法。不仅如此还对AFM力学性能测试、探针修饰技术及与其他技术手段连用等新型测试方法做了概括性总结。最后展望了AFM高级成像技术在纤维素研究中的发展前景,对纤维素基新材料的研究提供新的思路和方法,具有一定参考价值。
原子力显微镜;探针修饰;定量纳米机械力测试;纤维素;纤维素衍生物
1982年瑞士的科学家Gerd Binnig和Heinrich Rohrer发明了扫描隧道显微镜(STM)[1]。该技术能够简单有效的揭示材料表面信息,主要利用探针和导电表面之间随距离成指数变化的隧穿电流来进行成像,从而获得原子尺度上立体成像。伴随STM技术的问世,这两位科学家获得了1986年诺贝尔物理学奖。基于STM技术,1986年原子力显微镜(AFM)出现了[2]。不同于扫描隧道显微镜,AFM主要通过探针针尖与样品表面间的作用力的变化情况来反映材料纳米级信息。其工作环境可以是在真空、大气甚至液相中,测试对象可以为导体、半导体和绝缘体,鉴于此,AFM在化学、材料和生物等领域得到广泛应用,在一定程度上弥补了STM只能对导电样品的表面进行研究的不足。基于STM和AFM的应用,近年又发展出了由探针在样品表面网格状逐点扫描技术来获取样品形貌的近场光学显微镜(SNOM)[3]、由导电探针扫描半导体表面测量样品电容变化的扫描电容显微镜(SCM)[4]、通过磁性探针扫描磁性样品,检测探针和磁性样品表面的相互作用以重构样品表面磁性结构的磁力显微镜(MFM)[5]、基于微悬臂的扭转弯曲程度随表面摩擦特性变化而增减的横向力显微镜(LFM)[6]、基于测量探针与样品的静电相互作用,来表征样品表面静电势能,电荷分布以及电荷输运的静电力显微镜(EFM)[7]、可以绘制样品的表面电势或功函数的开尔文探针显微镜(KFM)[8]等;随着对快速成像及纳米力学性能的测试需求,又出现了高速扫描显微镜(HS-AFM)[9]和力学显微镜(PF-QNM)等。以上这些显微镜都是基于扫描探针成像机理,可统称为扫描探针显微镜(SPM)。对于AFM而言其反馈的物理量参数决定其成像模式。迄今为止,AFM常用的成像模式有:轻敲模式(Tapping Mode)[10],接触模式(Contact Mode)[11],非接触模式(Noncontact Mode)[12],扭转共振模式(TR Mode)[13]和峰值力模式(Peak Force Tapping Mode)[14],大部分扫描探针显微技术都是从以上模式衍生而来。
1 AFM传统成像技术
1.1 AFM在纤维素的晶体结构表征上的应用
纤维素是木质纤维中的主要组成部分,其广泛存在于植物、动物和菌类等体内,具有生物降解、生物相容性、力学性能优异等特性[15],主要由β-(1-4)-D-葡萄糖重复单元链接而成,由于链的堆砌和排列方式的不同形成了不同晶型结构的分子链。根据分子链极性的差异,纤维素晶型结构可分为两种:一种是平行链晶型,如纤维素Ⅰα、Ⅰβ、ⅢΙ、和ⅣI;另一种是反平行链晶型,如纤维素Ⅱ、ⅣII[16]。其中Ⅰ型是天然纤维素存在形式,通常含有三斜晶体结构的Ⅰα和单斜晶体结构的Ⅰβ。不同晶型纤维素之间可以相互转变:纤维素Ⅰα经热处理可转变为纤维素Ⅰβ,它比Ⅰα更稳定。对于纤维素的结构表征手段主要有:X-射线衍射(XRD)、核磁共振(NMR)、红外光谱(FT-IR)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)及AFM等。Andrew A. Baker等[17]在1998年就使用AFM来研究源于泡状海藻的天然微晶纤维素I型的表面结构。AFM高分辨图像提供了表面清晰的结构,沿纤维素链的葡萄糖亚结构的重复单元约为0.52 nm,并且分子内间距约为0.6 nm。来自于Valonia ventricosa的海藻纤维素,在同一种微纤维束中,同时存在三斜Iα和单斜Iβ晶型。这两种晶型最主要的不同就在于在C轴四分之一周期处即0.26 nm形成了一个纤维素二糖单元对角偏移或者错列排布,导致邻近链产生了替换。此项工作最重要的部分是通过观测纤维素分子上的大体积O6基团的形貌,确定了纤维素二糖重复单元。
Wan Li等[18]通过AFM研究了秸秆的细胞壁上的结晶纤维素。样品先经过DMSO处理再用AFM观察,确定了结晶纤维素的两个异构体三斜Iα和单斜Iβ相(图1)。图1a、1b显示了不同的形态的晶体结构,箭头1表明了纤维素分子链的取向,对应的曲线分别显示了沿箭头线1和沿非箭头线2的截面分析。纤维素分子链上每个突出糖环的大的羧甲基基团显示了AFM图片上纤维素的形貌特征。Connolly算法认为1.04 nm间距的二糖的重复单元是纤维素分子链的基本结构,而不是0.52 nm的单糖重复单元[19]。因此,对应于图1中纤维二糖的重复间距是1.1 nm。从图1a可以看出,线2表面的是分子链上的突出物即羧甲基基团的取向,符合Ⅰα的晶体结构特征。图1b观察到按矩形、单斜(110)晶型排布,即Ⅰβ晶型。图1图片的尺寸约为20 nm,可反映出秸秆的细胞壁的晶粒含有一种晶型的长程结构,Ⅰα和Ⅰβ晶粒分别是按三斜(010)和单斜(110)晶型紧密的平行排列在细胞壁的表面,但是在整个结晶区域Ⅰβ晶粒多于Ⅰα晶粒。

图1 秸秆细胞壁的纤维素AFM图[18]
1.2 AFM在纤维素的微观形貌上的应用
除了研究其晶体结构,也可用AFM研究纤维素微观形貌特征,如木材[20]、稻草秸秆[21]、纸浆木浆[22]、植物细胞壁纤维[23]、细菌纤维素[24]等。Andrew R. Kirby等[25]早在1996年使用AFM来研究含水的植物细胞壁的结构,AFM图清晰地展示了荸荠、苹果、胡萝卜和土豆的细胞壁图(见图2)。其中,图2A显示的是荸荠细胞壁的高度图:高度范围由黑到黄是0~85 nm;图2B苹果细胞壁的高度图:高度范围由黑到黄是0~62 nm;图2C苹果细胞壁的误差信号图;图2D胡萝卜细胞壁的误差信号图:扫描范围2.5×2.5 μm;图2E胡萝卜细胞壁的误差信号图;图2F土豆细胞壁的误差信号图。AFM图片展示了植物细胞壁的分层结构及独立的纤维素束和包间连丝。
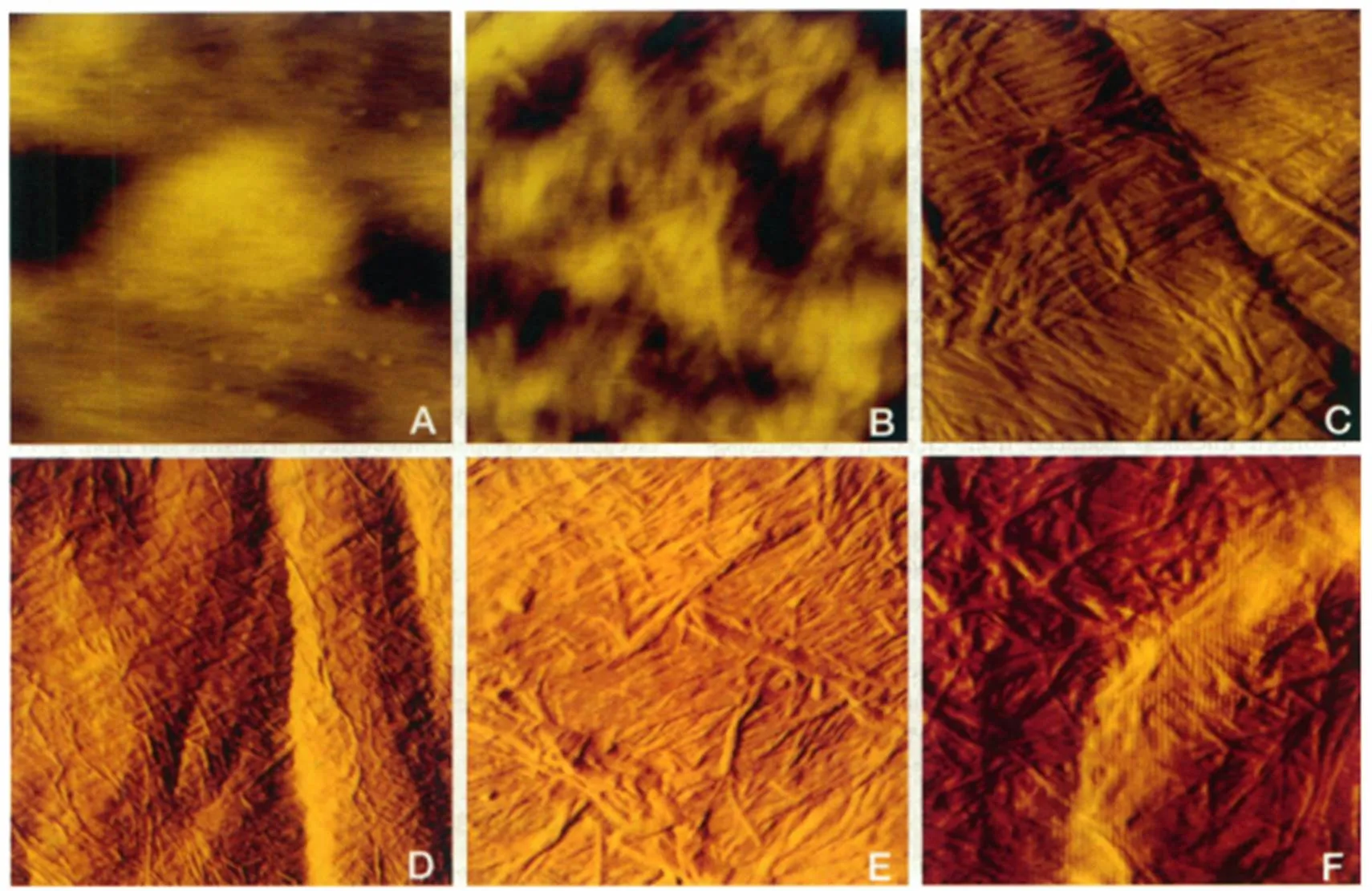
图2 植物细胞壁的AFM图,扫描范围1×1 μm[25]
Tetard L等[20]用AFM表征了柳枝稷和杨树两种植物细胞的不同,并用基于tapping模式的,探针和样品都受多重谐波驱动的多功能性模式(MSAFM)获得了清晰的杨树植物细胞壁结构,并且可以区分不同的组织。如图3所示MSAFM图比普通的AFM图可以获得更多的信息,可以给出木质纤维素样品的结构,以及不同区域或者结构在力学性能上的差异。其中箭头所指区域是植物细胞壁,属于中间层(ML)。
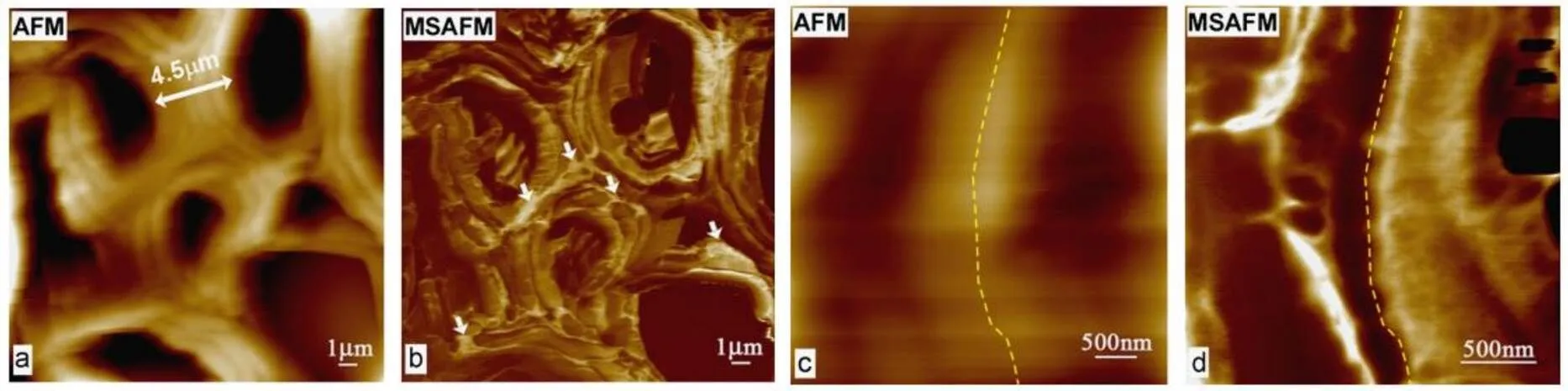
图3 杨树木片的横截面的AFM(a、c)和MSAFM(b、d)图[20]
Song等[26]利用AFM对玉米的初生细胞壁和次细胞壁进行成像,通过分析不同的细胞壁,作者认为主细胞壁的微纤维尺寸是3.68±0.13 nm宽,2.25±0.10 nm高。通过叠加这些微纤维的多个AFM高度剖面,这些截面的叠加面积估计为5.6±0.4 nm2。作者还在初生细胞壁中发现,所有这些单独的微纤维都可以追溯到更大区域的束,这表明纤维素在初生细胞壁中被合成为大束,然后在细胞扩张或伸长时分裂。在细胞停止生长的次细胞壁中,观察到几乎平行缠绕或单独的微纤维被嵌入在基质聚合物中,没有分裂效应,这表明了在初生细胞壁和次细胞壁中不同的纤维素生物合成机制。如图4A所示,显示了生长4周的玉米,箭头所指的第三节间包含(图4B~4F)所有的细胞层;图4B薄的初生细胞壁;图4C茎薄壁组织中增厚和膨大的初生细胞壁;图4D表皮下外皮纤维中加厚和拉长的初生细胞壁;图4E维管束中纤维的次生细胞壁;图4F木质部血管细胞中的次生细胞壁,图中比例尺=2 cm(图4A),50mm(图4B~4F)。

图4 玉米组织的光学图片(A);及使用AFM对其进行成像(B~F)[26]
Anuj K Chandel等[27]研究了甘蔗渣(SB)经草酸调制热化学预处理(OAFEX)过后的超微结构图,以及经休哈塔假丝酵母()和啤酒酵母()酵母菌发酵后乙醇的产量。作者认为经OAFEX处理后,可以克服甘蔗渣的天然抗分解性,从而使纤维素酶更加容易的进入纤维素微纤维的内部。OAFEX处理可以是半纤维溶解,并释放出糖类,并使纤维木质素以一种更容易被酶解的形式存在。通过酶解过程,纤维木质素具有高的水解效率66.51%。用SEM、AFM(图5)、Raman spectroscopy、FT-NIR、FT-IR和XRD表征了经OAFEX处理以及酶解后甘蔗渣的超微结构的变化情况。最终得出这样的结论:OAFEX处理可以使半纤维素分解,提高纤维素酶在纤维木质素上的通过能力,并且可以使经预处理的底物释放发酵糖。并且可以在分子尺度对经各种处理过的甘蔗渣微纤维结构进行表征。AFM图展示了天然甘蔗渣表面上纤维素和半纤维素互相交织的网状结构。经草酸预处理后,不均匀表面上出现了木质素的球状沉积物。图5a显示了天然甘蔗渣,图5b草酸预处理后的甘蔗渣和5c酶解后的甘蔗渣的AFM图片。
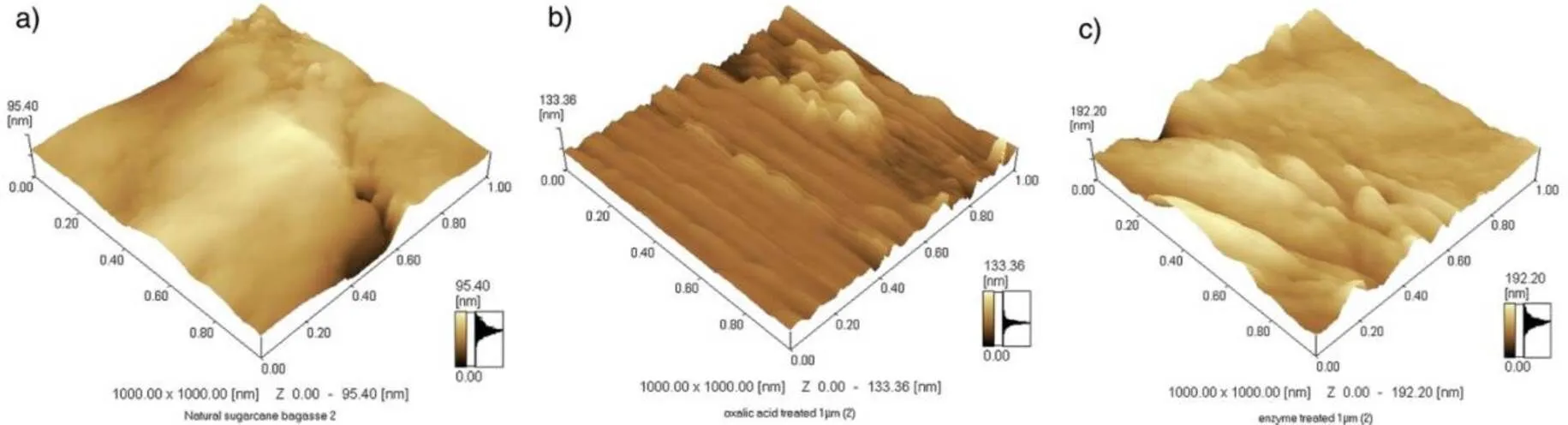
图5 各种不同甘蔗渣的Tapping模式的AFM振幅图[27]
Simola J等[28]则比较了在经氧化/碱的去木质化处理之后松树和桦树纸浆纤维的表面变化情况。可以观察到在去木质化过程中,表面的颗粒状结构被纤维状结构所取代。AFM可以清楚的展现这些区域的变化情况,并且认为纸浆表面的木质素呈现颗粒状结构,因为随着纸浆kappa值的降低,相应的颗粒状相也减少了。并且在处理后期,样品表面的木质素浓度要远高于块状木质素的含量。在去木质化过程即将完成时,两种纸浆都可以观察到单独的纤维素微纤维(直径约为0.01~0.03mm)。图6a、6c是经热制和氧化脱木质素处理后的纤维AFM的高度图;图6b、6d是对应的相位;图6a、6b扫描范围2mm,是桦树纸浆经10 min热制和氧化脱木素处理后的形貌;图6c、6d图扫描范围1.5mm,是经220 min热制和氧化脱木素处理后的形貌。图6a~6d在Z方向的尺度分别为300 nm、30º,500 nm和50º。

图6 经热制和氧化脱木质素处理后的纤维形貌图[28]
Gilli等[29]用臭氧处理高卡帕值牛皮纸浆,并用FT-IR和AFM对其结构进行表征。这两种互补的测试手段对纤维上的反应位点进行了详细的分析,并对使用臭氧进行去木质化的机理给出了解释:首先,臭氧攻击木质素上可能的反应位点如木质素和纤维素的界面处;其次,臭氧对木质素整个表面的攻击是均匀地,表面较为粗糙的地方可以提供更多的反应位点,较小的沉淀物分解的更快,而较大的沉淀物则较慢。氧化反应和暴露在表面的纤维素面积成正比例关系,并且可以用FT-IR对去木质化反应进行定量表征。测试分析进一步表明,纤维素和半纤维素不会被臭氧氧化,主要是由于氧化木质素芳香环所需要的活化能小于氧化纤维素和半纤维素羟基所需的活化能。图7显示了不同卡帕值к(从8~45)的纸浆经氧化处理后表面的沉淀物AFM图:к=8(图7a);к=30(图7b);к=40(图7c);к=45(图7d)。

图7 不同卡帕值к的纸浆经氧化处理后表面的沉淀物AFM图[29]
木醋杆菌是一种可以产生纤维素的细菌,它可以根据培养条件的不同产生两种类型的纤维素(Ⅰ型和Ⅱ型)[24]。木醋杆菌形成的纤维素并不是细胞壁的一部分,而是通过细胞膜的纤维素喷嘴(cellulose export component)分泌到菌体外。纤维素合成酶合成纤维素分子链,它又通过细胞膜外层的纤维素喷嘴“喷丝”到培养基中。在“喷丝”的同时,纤维素分子链组装成原细纤维,原细纤维进而成束聚合成“带状纤维素微纤丝”[30]。在“喷丝”过程中,一些无法穿透细胞膜进入细胞内部但能与纤维素分子链形成竞争氢键的物质(如羧甲基纤维素、荧光增白剂等),使纤维素链的超分子结构发生巨大改变,形成无定形区,导致纤维素微纤丝结构的变化,纤维素Ⅰ转变成热稳定性更高的纤维素Ⅱ。Asako Hirai[31]用TEM和AFM表征由木醋杆菌产生的纤维素带,带状纤维素片的散焦―对比TEM图如图8a所示;图8b是对应于8a方框内区域的AFM图;图8c为8b中对应的3条线的高度曲线。

图8 带状纤维素片的散焦―对比TEM图和相应AFM图[31]
除了以上研究,阎立峰等[32]使用经甲苯/乙醇,过氧化氢,盐酸和乙醇的处理后成功地萃取了小麦秸秆,得到了脱蜡后的样品以及不可溶纤维素残基,半纤维素和木质素。AFM研究展示了秸秆细胞壁的主要结构包含了纤维素微纤维束和半纤维素、木质素。半纤维素的主要作用就是把纤维素交联起来,形成一个网状结构,而木质素主要是聚集在其表面形成一个保护层。AFM结果和Vincent[33]的细胞壁理论模型相一致。除此之外他们还采用氢氧化钠/硫脲水溶液来溶解纤维素[34],使用的原料是微晶纤维素和从小麦秸秆分离出的纤维素。用喷涂工艺把纤维素溶液沉淀在聚丙烯酰胺(PAM)修饰过的基底上,再经洗涤即制得了含有两种纤维素的膜材料。并用AFM对其表面形貌、粗糙度和厚度进行表征。
Xiang Li等[35]通过原位形成的基于有机碱/CO2/DMSO的可逆离子液体混合有机电解质来溶解预处理纤维素。通过FT-IR,XRD,SEM,AFM系统地研究了混合离子液体的组成,CO2压力,预处理时间对纤维素物理化学结构的影响,深入理解了预处理条件,纤维素微观结构和酶解糖化之间的关联性。作者使用AFM表征了经溶解体系预处理前后的纤维素的形貌和粗糙度变化情况,结果表明经该体系预处理的纤维素结构发生了重排,表面变的非常粗糙,更有利于酶解糖化。
1.3 AFM在纤维素酶解研究中的应用
除了以上使用化学试剂方法来处理纤维素外,许多学者也使用纤维素酶来处理纤维素,然后利用原位AFM或者高速AFM(HS-AFM)来进行表征。常使用的里氏木霉纤维素酶主要有三种成分:内切纤维素酶(EG),外切纤维素酶(CBH)和β-葡萄糖苷酶(BG)。EG主要是分解纤维素无定型区,使结晶区暴露出来,随机水解纤维素链内的β-1,4-糖苷键,并产生新的还原性末端,而EG的分解速度决定了整个水解反应的速度[36]。而CBH由两个结构区域组成,一是属于糖类键合模块家族1的小的纤维素键合区(CBD),主要是作用吸附在基底上;二是糖苷水解家族7的催化区(CD),主要作用是催化糖苷键的分裂。总的来说就是切断纤维素链末端,释放可溶的纤维素二糖和葡萄糖;BG降解纤维二糖称为葡萄糖,消除二糖对CBH和EG的底物抑制作用。CBH还分为CBHI和CBHII,CBHII主要是解构结晶纤维素,同时也有可能分解无定型纤维素,使结晶区更加明确的暴露出来并小幅分解结晶纤维素。CBHI主要是针对表面尺寸小于10 nm的结晶纳米纤维束进行分解,如果结晶区表面被无定型区覆盖,不能被分解。所以CBHI需要其他酶的辅助[37]。植物细胞壁中的多晶态纤维素由单个的多糖分子链紧密地连接在一起,形成纳米结构,通常就是指基本的原纤维。这些原纤维又聚集在一起形成更高阶的超分子组装,最终纤维素含有约70%的这种高结晶物质[38]。
Hao Liu等[39]利用完整的纤维素酶:有带纤维素结合域(CBD)的内切纤维素酶(EGV)和突变体不含纤维素结合域的内切纤维素酶(EGI),用于水解漂白的芦苇牛皮纸浆样品。用AFM Tapping相位成像来表征纤维素纤维表面的微纤维素的变化情况,图9显示了分别经历6~24 h纤维素孵化不同时间后的芦苇浆的AFM图。结果表明纤维素酶在水解过程中可以把微纤维素剥离成更小的束(在Y方向),或在垂直于纤维素束方向变短(在X方向),随着水解时间的延长,纤维素束逐渐剥离,并且变成小棒状和谷粒状。经过24小时的处理,纤维素纤维的表面上的微纤维素会降解成更小的片段。EGV和EGI两种酶都会导致纤维素的剥离,但是纤维素束的长度不会有明显的变化。

图9 芦苇浆经纤维素酶N342孵化不同时间后的AFM相图[39]
Kiyohiko Igarashi等[40]通过高速AFM(HS-AFM)实际观察了里氏木霉()纤维素二水解酶I(Cel7A)分子在结晶纤维素上的滑动。它们在结晶纤维素上滑动的平均速度是3.5 nm/s。没有纤维素键合区的催化区的移动速度和完整的Cel7A酶的移动速度基本一样。然而不活跃的催化酶(突变体E212Q,可以和结晶纤维素键合但是不能沿着分子链运动)或者缺乏色氨酸的突变体(突变体W40A,受CD和E212Q控制,只能在纤维素链上抬起一点点,并且是在反复的进行吸附和解吸附过程)也可以被检测到。这说明,除了糖苷键的水解作用,在隧道型活性位点的纤维素链的负载过程对于酶解也是很重要的。
除此之外还可以观察到Cel7A分子沿结晶纤维素Iα型表面单向滑动,但是在某一点处出现了集体的停止,类似交通堵塞的现象。作者使用超临界氨处理纤维素,使其从Iα型转变为纤维素ⅢІ型,可以显著提高Cel7A的酶解作用[41]。这是由于Cel7A对纤维素ⅢІ型的键和能力更强。在纤维素Iα上,酶只沿固定的线路滑动,而在纤维素ⅢІ型上,酶基本布满整个晶面。Lehtiö和他的研究者认为Cel7A的CBD区域是键和在纤维素Iα的疏水晶面(1ī0)上的,并从(1ī0)那面开始降解纤维素[42]。而纤维素Iα的疏水面(1ī0)在亲水面(100)和(010)中间,纤维素ⅢІ有相似的疏水面(1ī0),亲水面(010),但是它的(100)面却是适度疏水的[43]。这就使得Cel7A不止沿(1ī0)面滑动,并且也会沿(100)面滑动。对比纤维素Ⅰα和ⅢІ,增大Cel7A的活动区域,就会促进结晶纤维素的水解。但是在纤维素ⅢІ的表面上,仍然可以观察到当一个酶分子在纤维素表面遇到障碍物停止时,后面的分子就会跟着停止,引起的交通堵塞情况。图10显示了HS-AFM观察到Cel7A分子在纤维素ⅢІ表面的运动情况:Cel7A从右移动到左边,每张图时间间隔是0.3 s(图10A),在纤维素表面出现了拥挤情况;Cel7A在纤维素表面聚集后导致出现了原纤化过程(图10B),每张图的时间间隔是1.5 s;原纤化过程产生的机理示意图(图10C)。

图10 HS-AFM观察到TrCel7A分子在纤维素ⅢІ表面的运动情况[44]
Thomas Ganner等[37]系统地研究了在纤维素水解过程中各种酶之间的协同作用。用原位AFM来表征多晶态纤维素基底的降解过程,结果发现这是一个动态循环过程,并且纤维素是有选择性的暴露和移除。链端―裂开的酶CBHI、CBHII和内部链―裂开的酶EG分别扮演者不同的角色图11显示了通过AFM原位观察单个酶运动情况解析了酶的协同作用:(A)CBHI分解小纤维(AFM相图);(B)CBHII通过移除无定型区来打磨大晶粒的表面(AFM相图);(C)EG通过去除无定型区使表面更加清晰(AFM振幅图);(D)CBH II的“簇”效应;图中标尺为100 nm。首先EG和CBHII通过移除基底上的无定型区域,使结晶的纳米纤维素暴露出来,从而使CBHI更容易的进入到里面。然后这些纳米纤维素就被CBHI所分解,分解后又重新露出无定型区,然后又被EG和CBHII所移除。如果前期没有EG和CBHII的作用,那么CBHI就很难吸附在纤维素基底上。纤维素酶间的协同作用是具有形态依赖性的,通过无定型区和结晶区的分解,各种酶之间有合作关系。因此,结晶纤维素束的尺寸和堆积程度直接决定了酶的降解速度。

图11 酶协同作用解析:AFM原位观察单个酶运动情况[37]
为了进一步解开酶-纤维素的生物反应的基本机理,选择合适的纤维素基底是决定性因素。Thomas Ganner[45]又制备了一种半结晶的薄的纤维素膜(SCFTC)基底,这种基底可以满足对理想纤维素基底的研究:通过改变无定型纤维素基底中尺寸均匀的纤维素纳米晶的含量,来调解纤维素的多晶态结构。研究用HS-AFM来对纳米级的表面进行成像,图12中白色箭头指明了结晶区,而灰色箭头指的是被覆盖的结晶区,深入研究了材料的性质:证实了该SCTFC基底适合酶解,并且通过复合或单独使用Cel6A/Cel7A酶研究其协同作用对纤维素的降解情况。在图12 A是由瘦长的针状的纤维素纳米晶构成的结晶纤维素膜AFM高度图,SEM图,TEM图,图中标尺为200 nm;图12B是SCTFC(半结晶-薄-膜-纤维素)层的AFM力学模式图。内部的三个小图:高度图(上面),刚度图(中间)和形变量图(左下),图中标尺为1 μm。
Chengrong Qin等[46]通过研究里氏木霉和纤维素、木质素之间的作用力不同来说明木质素对纤维素酶有一定的粘合力,从而影响纤维素酶对纤维素的水解作用。首先,把里氏木霉固定在硅片上,然后分别用硫酸盐木质素和羟丙基纤维素来修饰AFM探针针尖,接着测量纤维素酶和木质素以及纤维素酶和纤维素之间的力的变化。结果表明硫酸盐木质素和纤维素酶之间的吸引力比羟丙基纤维素和纤维素酶之间的吸引力大约45%。然后AFM探针针尖分别用疏水基团,-OH和-COOH来进行修饰,用来和纤维酶产生疏水,H键和电荷-电荷作用力。结果表明用疏水基团修饰过的针尖和纤维素酶之间的作用力要比使用-OH和-COOH基团的针尖的作用力强。该工作说明了一个重要的问题,即硫酸木质素和纤维素酶之间的作用力要强于纤维素和纤维素酶之间的作用力,从而会影响酶解过程。并且纤维素酶对木质素的主要作用力来自于疏水键合作用。
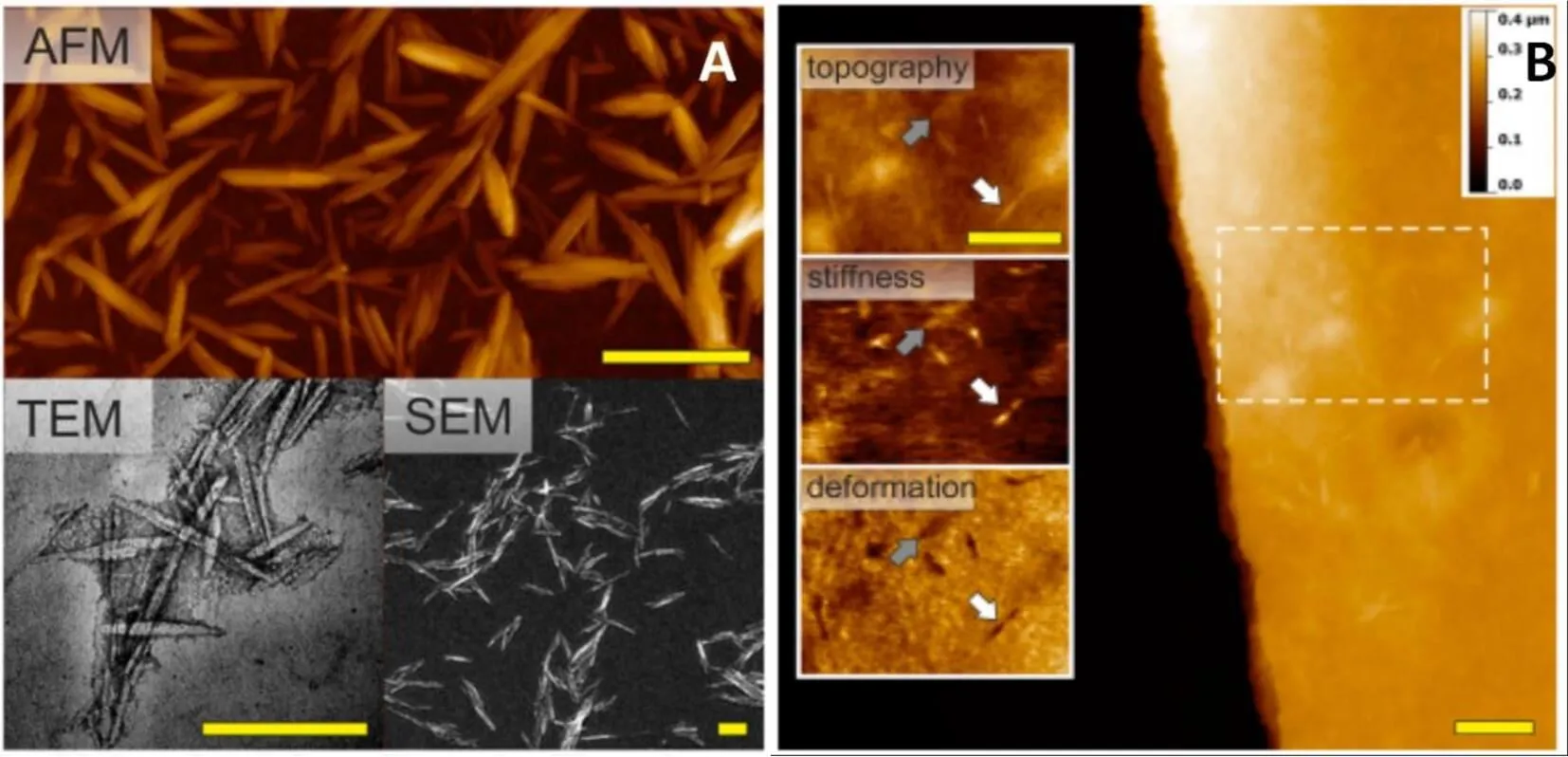
图12 SCFTC基底的AFM,TEM及SEM图(A),相对性的力学模式图(B)[45]
1.4 AFM在纤维素衍生物研究中的应用
除了以上基于纤维素结构特征研究,许多学者还利用AFM对纤维素衍生物做了大量的研究工作:羧甲基纤维素(CMC)是一种多糖,可以广泛应用于食品、纺织、造纸、粘合剂、涂料、制药、化妆品和矿物加工等行业[47]。它是一种无毒无害可生物降解的天然有机高分子。到目前为止,仍然不清楚它和固体表面的作用机制。Wang等[48]通过吸附、电泳迁移率的测量、FT-IR、荧光光谱、AFM和分子模型研究了CMC在固体表面的吸附机理。而AFM在此研究中主要是用于确定pH值对吸附效果的影响,结果表明静电力作用可以影响CMC在固体表面的吸附效果,并且同时测得吸附层的厚度约为1 nm,说明CMC的高分子链是平铺在固体表面的。但是其他测试手段也表明CMC和固体表面也存在氢键作用,所以最终作者认为CMC主要是靠静电力和氢键共同作用而吸附在其表面。
用于蛋白质分离的高分子膜必须有一定的抗污能力,在使用过程中就可以减少膜和蛋白质之间的相互作用[49]。Sahadevan Rajesh利用聚酰胺亚胺(PAI)作为改性剂,使用相转移技术制备出具有卓越性能的醋酸纤维素(CA)膜。并分别用ATR-FTIR、SEM、AFM,分子量筛截和孔径分析来研究PAI对复合膜性能的影响。SEM结果表明复合CA膜的表层更薄,亚层孔隙率更高。用牛血清蛋白作为模型蛋白质,研究了此膜的抗污能力。在蛋白质过滤中,利用一系列的模型分析,研究了其抗污特性。用AFM可以表征膜在吸附蛋白质前后的变化情况,并且还发现蛋白质优先吸附在膜表面上的特殊位置,例如表面较粗糙和具有亲水性的地方。被污染的膜可以轻易地用去离子水超声清洗掉蛋白质。因此,把PAI和CA基体相结合,可以制备出具有低污染、超滤性能的膜,用于蛋白质分离领域。图13显示了不同经4 h蛋白质后污染后的膜(/)的AFM 3D图像:(a)100/0;(b)90/10;(c)80/20;(d)70/30。
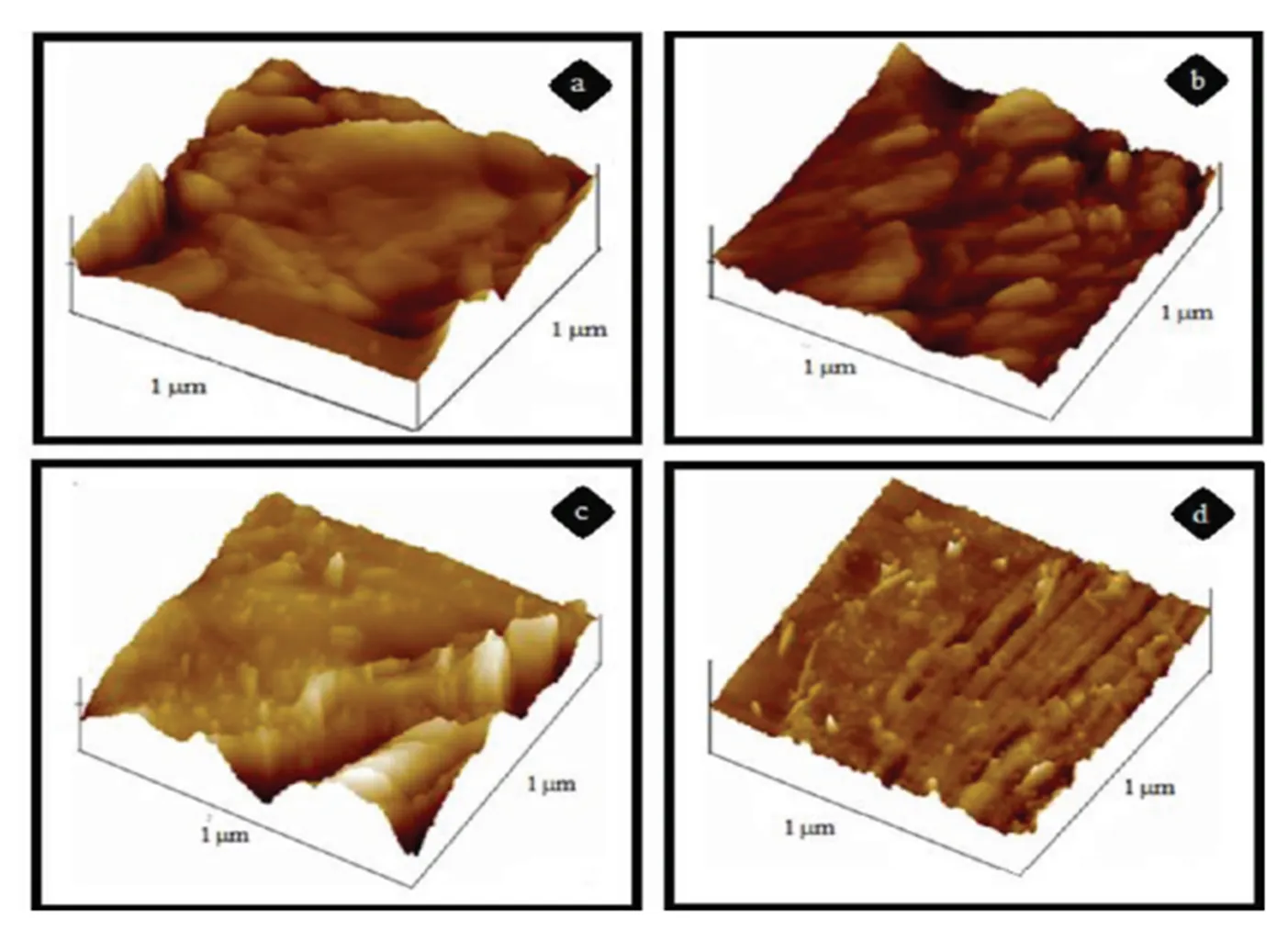
图13 过滤4 h蛋白质后污染后的复合膜(w/w)的AFM 3D图像[49]
Jayalakshmi[50]利用聚异酞酰胺(PIPA)接枝甲基丙烯酰胺(MAA),制备出共聚物PIPA-g-MAA,用于对醋酸纤维素表面修饰改性和提高其抗污性。接枝共聚可以提高PIPA在质子惰性溶剂中的溶解,并使其应用于醋酸纤维素膜的改性。改性后的复合膜只有一个玻璃化转变温度,这说明醋酸纤维素和PIPA-g-MAA具有良好的相容性,并且复合膜的接触角更低,表面亲水性更好。通过与PIPA-g-MAA共混,膜的热力学机械性能也得到了提升。通过AFM研究了膜对不同的商业通用蛋白质的分离效果,同样也发现复合膜比醋酸纤维素膜有更优异的分离性能和抗污性能。
聚乙烯、聚丙烯、聚碳酸酯、纤维素酯的微孔薄膜可以作为带功能团的本征导电高分子(ICP)的基底膜,这种复合膜具有可控的选择透过性[51]。为了制备一种有效的含有微孔结构的非对称的复合膜,控制ICP在基底膜上的沉淀过程是非常重要的。通过精确地ICP沉淀过程制备出的具有可控形态的膜,具有高度的透过性和可选择性。Shehzad[52]用各种原位的溶液―相聚合和化学气相沉淀技术把聚苯胺沉积在纤维素酯微孔膜上,详细地研究了反应物不同的接触模式效果,比如在单体溶液中的浸泡时间和聚合时间。并分别用FT-IR、AFM和XRD研究了膜表面的聚苯胺沉积层和它的均匀性、结晶性。这篇论文系统地讨论了聚苯胺在纤维素微孔膜上的沉积情况及各种影响因素,并认为膜的沉积程度、结晶度、表面粗糙度、导电性都受浸泡时间的影响较大。
2 AFM力学及探针修饰技术
在前面几部分详细讨论了关于纤维素及其衍生物的结构、性能及应用,但是也有学者从AFM技术本身来研究材料的性能,比如基于AFM的力学―定量纳米机械力测量(QNM)、单分子力谱、纳米压痕技术和探针修饰技术。
纤维素纳米晶(CNCs)由于其卓越的力学性能和化学性能被认为是卓越的绿色纳米材料,然而一致缺乏对于单根CNCs的性质的研究。Roya R. Lahiji等[53]利用AFM详细研究了在不同湿度和气氛环境下木材衍生的CNCs的形貌,弹性和粘附力等性质。通过3D有限元计算针尖在CNC上的压入深度来获得力曲线,从而可以通过一系列的模型和公式来计算CNC横截面弹性模量(ET)。如图14显示了CNC-AFM压痕的3D 四分之一对称模型图:(a)当发生接触或大形变时有约20 000元素和网格;虚线正方形表示b部分中显示的放大区域;(b)在载压时,CNC内部的应力分布情况。经过计算,在0.1%相对湿度,氮气环境下,一根单独的CNC的ET在18~50 GPa。研究还发现,尽管单根CNC的高度会有变化(3~8 nm),但CNC的力学性质是沿着整个长度均匀分布的。同时作者还认为相对湿度的变化对CNC的形貌和性质影响不大,从而也证实了纤维素纳米晶具有一定的抗水性。

图14 CNC-AFM压痕的3D 四分之一对称模型图[53]
Peak Force QNM(PFQNM)是一种基于Bruker专利技术Peak Force Tapping的测量模式,它能在获得样品形貌的同时获得材料的定量纳米力学性质。首先通过Peak Force Tapping技术获得一系列力曲线,然后通过数学模型对力曲线进行拟合分析计算,从而获得样品的定量纳米力学性质[54]。Ivan Usov等[55]利用AFM及PFQNM、低温SEM、TEM联合表征三种不同来源和预处理的2,2,6,6-四甲基哌啶氧化物(TEMPO)氧化木材纤维素纳米纤维(W-CNF)、木材纤维素纳米晶(W-CNC)和硫酸水解细菌纤维素纳米晶(B-CNC)在单粒子水平上的高分子物理性能。图15显示了使用PFQNM模式对纳米纤维素进行测试:(a)样品的AFM高度图;(b)相对应的模量图;(c~e)箭头所指的样品的模量分布图;(f)红蓝黑三种颜色分别表示存在扭结的纤维及扭结处相对应的模量分布(g)。
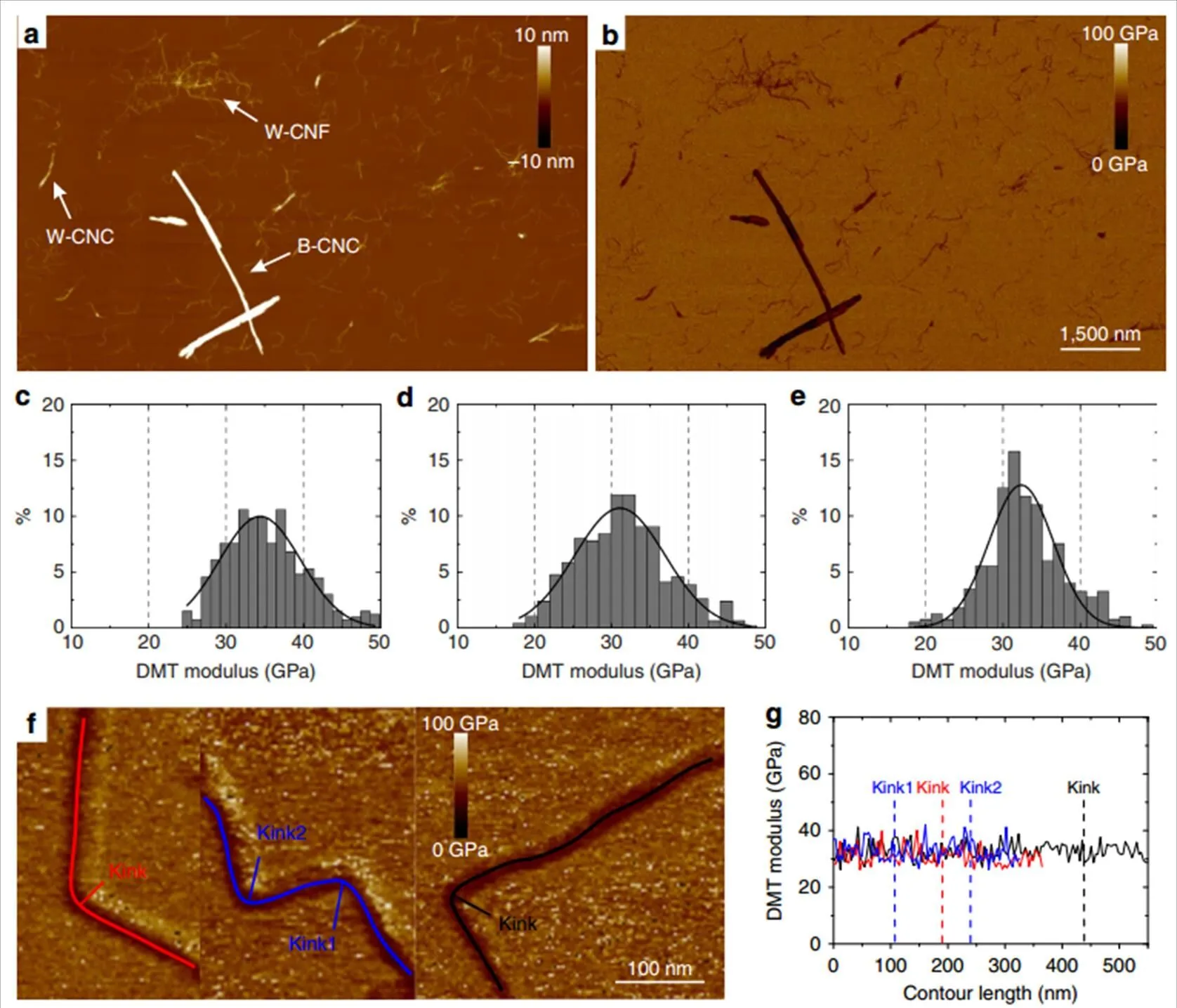
图15 基于PFQNM模式的纳米纤维素数据[55]
作者发现,所有类型的纤维素纳米纤维和纳米晶沿轮廓方向都存在可观察的扭结,并且都是右手手性的。对于W-CNF,更是分别从纤维束和单纤维水平都发现了扭结的右手手性。对于扭结进行统计分析,扭结角度是非高斯分布的,这说明扭结并不是由于纤维素结构上无定型区和结晶区交替分布导致的,这之前文献报道的不同[56]。相反,它们可能源自用于不同的制备加工过程。PFQNM用于表征纳米纤维素在横向上的机械性质,测试结果杨氏模量QNM为20~50 GPa。用持续长度方法计算,在纵向上的模量E为4.5~18.4 GPa,这个模量会受纤维上未被发现的小角度扭结的影响而被低估。最后作者认为W-CNF和W-CNC的单个纤维素高分子链的持续长度为63~65 nm。
Li等[57]利用AFM纳米压痕技术和光学显微镜连用,原位测试了溶剂蒸发过程中,溶胀的纤维素球的机械性能和尺寸变化。并且认为在纤维素球的溶胀过程中有3个影响因素:1)纤维素溶液的浓度;2)纤维素链之间的相互作用;3)纤维素球内网络结构的异质性。Longming Jin等[58]用γ-戊内脂和离子液体的新混合体系来快速溶解预处理玉米秸秆,并通过XRD、SEM和AFM系统的分析了经预处理后的玉米秸秆的成分组成,并阐述了玉米秸秆的物理化学特征对后续生物降解的天然顽固性的处理效果。经过预处理后,玉米秸秆的纤维素会从I型转变为容易降解的纤维素II型,并且其表面的木质素也会明显的减少和迁移。而作者就是利用木质素和纤维素模量的差异,通过PFQNM模式来表征经预处理前后的玉米秸秆的模量和形变量的不同来反映此过程。
在造纸业,单根纸浆纤维之间键和会受到纤维润湿状态时硬度的影响。Christian Ganser等[59]通过AFM-纳米压痕来研究相对湿度(RH)下纸浆纤维横向的硬度和模量。除此之外,还研究了以纤维素、木聚糖/纤维素为模型的膜,分别在水中和CaCl2溶液中的溶胀和硬度的变化情况。纸浆纤维的硬度随着RH的增大逐渐降低,相比于干燥状态,在湿润时纤维的硬度降低了100倍,这可能是由于在纤维表面形成氢键的缘故。而作为模型研究的纤维素膜的变化情况则表明相比于水溶液,CaCl2溶液会使纯的纤维素膜会变硬,而表面含木聚糖的纤维素膜则会变软。这是由于当半纤维素膜浸入到盐溶液中时,Ca2+离子会吸附在羧基上,增加整张膜的盐浓度,最终会导致其溶胀增强,膜变软,硬度降低。通过使用AFM对纤维素模型膜的硬度和模量的研究,提供了一个研究材料硬度的新方法。如果对纤维素材料进行物理和化学改性,那么与聚合度、交联度以及结晶度等相关的现象和数据也可以通过AFM来获得。
Christian Ganser等[60]用AFM和力谱研究了木聚糖覆盖的纤维素薄膜。作者通过多参数表面等离子体共振技术(MP-SPR)在动态条件下将桦树木聚糖沉积到了纤维素膜上。把测试用的AFM探针针尖分别用亲水基-OH和憎水基CH3进行修饰,然后对复合膜进行相位成像和力学成像,从而确认和识别木聚糖在膜表面的沉积位置。从粘附力图上可以分辨出木聚糖和纤维素的不同。但是进一步研究发现,木聚糖和纤维素对探针粘附力的不同只和样品表面的高低起伏有关系,和木聚糖纤维素没有关系。即样品表面粗糙度的增大会导致粘附力增大。这是因为探针针尖单纯只是在比较突出的位置受到的粘附力小,在比较凹陷的位置受到的粘附力大。由于粗糙度原因导致的粘附力范围是5 nN到50 nN,而针尖和纤维素/木聚糖的粘附力是8 nN,包含在这一范围内。所以作者认为用如果想用探针修饰法来检测木聚糖和纤维素粘附力的不同是不行的,结果是不可信的。
Zhang等[61]认为木质纤维素(主要是植物细胞壁)的酶解是一个产生生物石油的关键过程,但是天然复杂的植物细胞壁阻碍了这个过程,同时也大大影响了酶靠近纤维素的表面。所以经过预处理后的植物细胞壁外表面的结构和分子水平的组成变化情况就不明确,因此需要在单分子层面深刻的理解认识植物细胞壁在预处理前后表面纤维素的分布情况。作者使用单分子AFM系统地研究了白杨、柳枝稷和玉米秸秆的原始的、经稀酸预处理过的和经去木质化的细胞壁的表面结晶纤维素的变化情况。具体实验过程如下:首先用梭状芽孢杆菌(CBM3a)修饰AFM探针,这种探针可以通过特殊的键来识别结晶纤维素。图16显示了AFM成像原理示意图:(a)探针修饰和识别过程的示意图;(b)压电TREC控制器的形貌信号和识别信号;把两种信号分开后可以形成纤维素形貌图和纤维素识别图。黄色条纹:结晶纤维素形貌示意图(Topography image);黑色条纹:在形貌图上识别出结晶纤维素(Recognition image)。单分子层面的细胞壁表面结构的变化则通过暴露的结晶纤维素的识别面积(RAP)来计算。结果表明,经过在135℃,不同酸浓度处理后,表面结晶纤维素的覆盖率从17%~20%增大到18%~40%,而经过去木质化后,可以达到40%~70%。经0.5%的稀硫酸预处理后,白杨、柳枝稷和玉米秸秆的纤维素表面覆盖率最大可以到达23%、28%和38%。相比于白杨和柳枝稷,玉米秸秆更容易预处理。所以作者认为经过稀酸预处理后,可以使植物细胞壁上的纤维素更容易暴露出来。
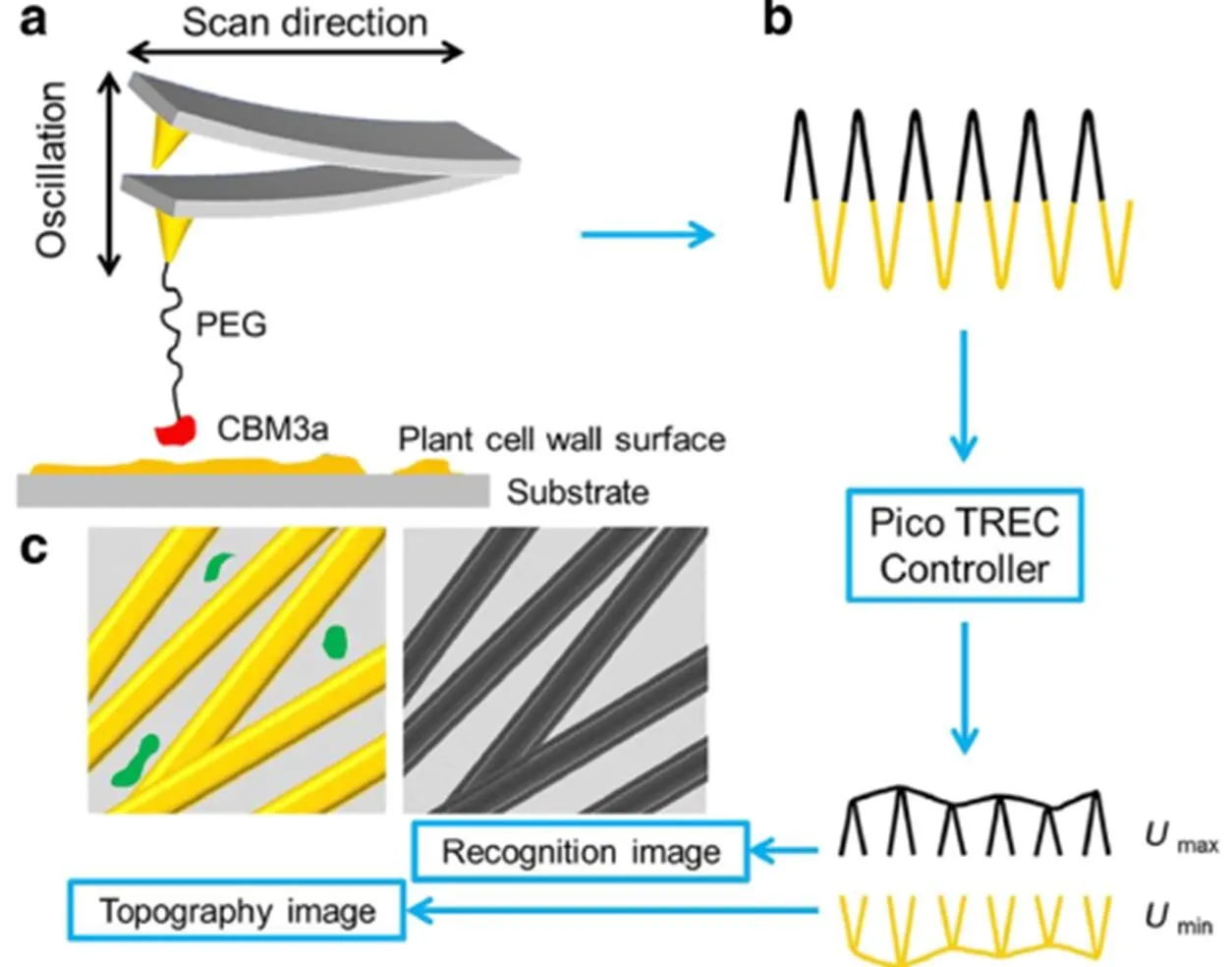
图16 AFM成像原理示意图[61]
Zhu等[62]建立计算模型用实验的方法研究了纤维素表面对金属离子(以Ag(I)为例)的吸附作用。研究选取了三种纤维素微球(天然纤维素和它的硫酸盐、磷酸盐衍生物),然后把硅片浸入到AgNO3溶液中,用AFM胶体探针技术研究了微球和硅片表面的作用力。图17显示了不同的纤维素微球对AFM探针针尖的修饰细节:(a)为CM粒子;(b)为SCM粒子;(c)为PCM粒子。研究表明磷酸纤维素微球(PCM)和AgNO3溶液中的硅表面的粘附力,随着PH值的升高,大幅度提高。而硫酸纤维素微球(SCM)和硅表面的粘附力随PH的升高略微降低。若使用天然纤维素微球(CM),则观察到明显的粘附力。对于PCM系统来说,强烈的粘附力来自于Ag(Ⅰ)和负电的硅表面的静电吸引力,这个力趋势和zeta电位的测量结果相一致。SEM、XPS和ATR-FTIR分析结果表明,经吸附后,纤维素表明的Ag(Ⅰ)被还原成Ag粒子。本研究认为PCM有大量的磷酸基团,所以它吸收Ag(Ⅰ)的能力比CM和SCM都要强,并且可以把Ag(Ⅰ)被还原成Ag粒子。用DFT理论进行数学计算也确认了磷酸基团的存在,以及磷酸基团吸附银离子导致波数向P-OH振动偏移。这项数学计算和IR一样确认了修饰了磷酸基团的纤维素表面可以吸附和收集Ag(Ⅰ)。

图17 CM、SCM和PCM粒子在粘附在AFM V型硅探针的细节图[62]
3 AFM技术与其他技术手段联用
很多时候单独使用AFM并不能完全表征一个材料的性能,所以需要和其他技术手段联用,比如耗散型石英晶体微天平、和频振动光谱、中子反射技术及近红外技术等等来进行综合研究。Niklas Nordgren[63]使用一种新的XET-技术,即自上而下把端基硫醇化(SH)的木聚糖(XG)吸附在QCM-D的金基底上,得到了一种像刷子一样的硫醇键和木聚糖膜。整个接枝反应都是在QCM-D上原位进行。然后同样也是在QCM-D上通过定量的酶解过程来研究了其生物化学反应,再用AFM胶体探针技术直接测量了其对纤维素的粘附力。这个研究利用这些特殊的膜来固定纤维素,为开展多糖特性的研究提供了新的思路。
Terhi Saarinen[64]用QCM-D和AFM研究了漆酶和阿魏酸在木质素基底上的吸附情况。使用了两种不同的制样方法:1)先经漆酶预处理后再加入阿魏酸;2)漆酶和阿魏酸共吸附在木质素表面上。研究使用的漆酶是分别从和两种菌属分离提纯出来的,并用于木质素的活化。作者同时也用了块状材料和热化学热磨机械浆作为对比实验,研究了QCM-D的测试结果:两种漆酶对阿魏酸的吸附不同。在木质素表面没有观察到漆酶的吸附,但是漆酶的吸附却很明显。但是这两种酶仍然可以活化木质素,经漆酶活化后的木质素对阿魏酸的吸附程度明显高于没有活化的木质素。漆酶活化后用水冲洗会从基底上洗掉一些漆酶,进而会降低后续阿魏酸的吸附。只有漆酶会使阿魏酸在木质素上持续附着。QCM-D和AFM结果纠正了以往注重阿魏酸对化学热磨机械浆的键和作用的研究,因此这种方法对研究酶对木质素的吸附行为是很有用的。
Tuomas Hanninen等[65]用TEMPO快速氧化纤维素,制备出可以高效利用的纳米纤维状的纤维素(NFC)材料。这个研究中利用TEMPO制备出氧化的纤维素膜,并用QCM-D来监测分析膜性质的变化情况。结果表明,pH值会影响氧化时间;无定型纤维素由于其表面更容易接触,因此氧化更快速,而NFC则更稳定,氧化速度较慢,AFM测试证明了这一点。图18为经TEMPO氧化过的纤维素材料的AFM形貌图: (a)为纳米纤维状纤维素;(b)为无定型纤维素。本研究为纤维素材料功能化提供了一种更加可控的手段,可以在不对纤维素材料造成永久改变的基础上,制备出理想的羧化纤维素。
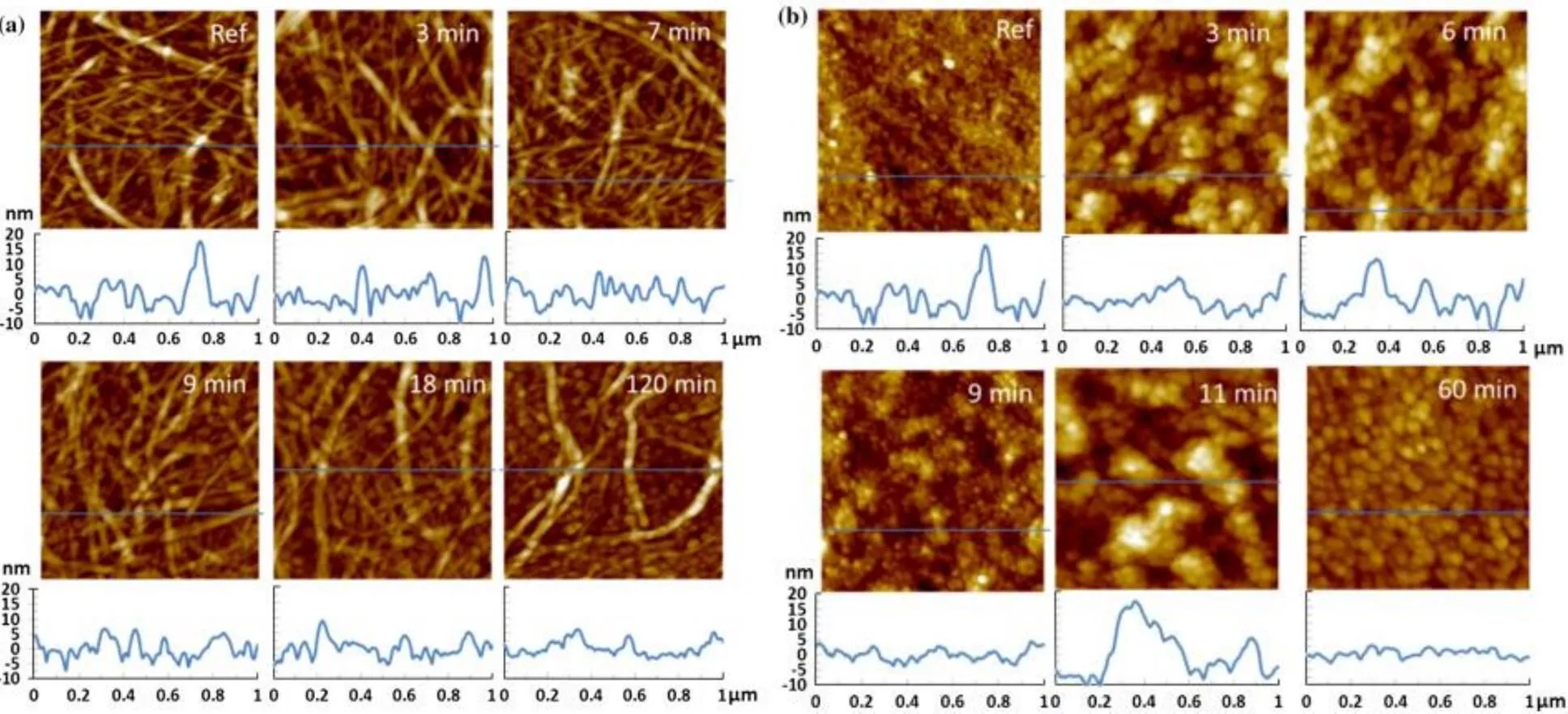
图18 TEMPO氧化过的纤维素材料的AFM形貌图[65]
植物细胞壁上的纤维素微纤维会随着细胞的膨胀和增长而变化。Kabindra Kafle[66]利用和频振动光谱(SFG)和AFM研究了洋葱表皮上纤维素微纤维的取向情况。AFM图像显示表皮轴外的纤维素微纤维是垂直于球茎轴取向的,并且越里面的洋葱表皮上的纤维素分布越分散。纤维素的晶体结构上有偏心对称的功能团,因此它的二阶非线性磁化系数不为零并产生了SFG信号。
Bruno Jean等[67]把纤维素纳米棒和弹性聚烯丙胺盐酸盐通过层层自组装技术制备出两种物质交替分布的多层薄膜,并用AFM与中子反射技术联用对其表征。两种技术手段都显示这种光滑的膜的纤维素含量较高,具有良好的分布,并且随着膜层数的增多,厚度线性增加,但是表面粗糙度却逐渐降低。这种含有纤维素的,且具有良好排布规律的膜,可能应用于模拟像木材等或活的有机体中纤维素微纤维的排布特性。除此之外,近年还有发展较为快速基于近红外技术和原子力显微镜相融合的AFM-IR,该技术可以实现纤维素纳米形貌和化学结构信息的同时成像[68]。还有学者把AFM和亚稳态诱导电子能谱(MIES)、紫外光电子能谱(UPS)和X-射线光电子能谱(XPS)技术相连用,研究了纤维素对银的吸附作用,并且认为纤维素可以作为稳定的银纳米粒子涂层使用[69]。
4 结论
本文系统地讨论了近20年来原子力显微镜AFM在纤维素及其衍生物材料的应用,从早期对纤维素的晶体结构的研究,确认了结晶纤维素的两个异构体三斜Iα和单斜Iβ相以及纤维素链的基本结构是重复间距为1.1 nm的纤维素二糖。对于纤维素微观形貌的研究则确认了植物的细胞壁的结构特征,木质素和纤维素的分布情况,甚至还研究了细菌纤维素的形貌特征以及纤维素酶解过程和材料结构间的构效关系。而利用高速AFM,可以详细探究不同的纤维素酶对纤维素结晶区和非结晶区的具体分解情况,深入揭示了各种酶的分解顺序及它们之间的合作关系,并且还观察到了纤维素酶在材料表面的聚集堵塞情况。对于纤维素衍生物的研究多集中在纤维素改性或者复合材料上,利用AFM研究了不同的改性和复合策略对最终材料性质的影响,比如吸附效果、过滤分离效果、选择透过性和导电性等。基于探针和样品之间相互作用力来成像这一AFM基本测试原理,AFM力学技术及探针修饰技术是近年来发展较为迅速的测试手段。基于其力学技术,AFM力学模式能在获得样品形貌的同时获得材料的定量纳米力学性质,包含模量、硬度、粘附力和形变量等数据,以对材料的结构和性质进行更加准确和深入的表征。不仅如此,利用AFM和其他技术手段联用,比如耗散型石英晶体微天平、频振动光谱、中子反射技术及近红外技术等等也可对材料进行综合研究。而后续AFM在纤维素领域的应用将集中在AFM高级成像技术,比如基于AFM力学模式的定量纳米机械力测量、开尔文电势显微镜等方面为材料的机械性能、电性能等提供新的表征方法。
[1] Binnig G, Rohrer H, Gerber C,. Tunneling through a controllable vacuum gap[J]. Applied Physics Letters, 1982, 40(2): 178-180.
[2] Binnig G, Quate C F, Gerber C. Atomic force microscope[J]. Physical Review Letters, 1986, 56(9): 930-933.
[3] Fischer U C, Pohl D W. Observation of single-particle plasmons by near-field optical microscopy[J]. Physical Review Letters, 1989, 62(4): 458-461.
[4] Matey J R, Blanc J. Scanning capacitance microscopy[J]. Journal of Applied Physics, 1985, 57(5): 1437-1444.
[5] Hobbs P C D, Abraham D W, Wickramasinghe H K. Magnetic force microscopy with 25 nm resolution[J]. Applied Physics Letters, 1989, 55(22): 2357-2359.
[6] Mate C M, Mcclelland G M, Erlandsson R,. Atomic-scale friction of a tungsten tip on a graphite surface[J]. Physical Review Letters, 1987, 59(17): 1942.
[7] Martin Y, Abraham D W, Wickramasinghe H K. High‐resolution capacitance measurement and potentiometry by force microscopy[J]. Applied Physics Letters, 1988, 52(13): 1103-1105.
[8] Sadewasser S, Glatzel T. Kelvin probe force microscopy[J]. Applied Physics Letters, 1991, 58(25): 2921-2923.
[9] Uchihashi T, Iino R, Ando T,. High-speed atomic force microscopy reveals rotary catalysis of rotorless F₁-ATPase[J]. Science, 2011, 333(6043): 755-758.
[10] García R, San Paulo A. Attractive and repulsive tip-sample interaction regimes in tapping-mode atomic force microscopy[J]. Physical Review B, 1999, 60(7): 4961-4967.
[11] Junno T, Anand S, Deppert K,. Contact mode atomic force microscopy imaging of nanometer‐sized particles[J]. Applied Physics Letters, 1995, 66(24): 3295-3297.
[12] Girard P, Solal G C, Belaidi S. Observation of voltage contrast in noncontact resonant mode atomic force microscopy[J]. Microelectronic Engineering, 1996, 31(1-4): 215-225.
[13] Huang L, Su C. A torsional resonance mode AFM for in-plane tip surface interactions[J]. Ultramicroscopy, 2004, 100(3): 277-285.
[14] Alsteens D, Dupres V, Yunus S,. High-resolution imaging of chemical and biological sites on living cells using peak force tapping atomic force microscopy[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2012, 28(49): 16738-16744.
[15] Schurz J. A bright future for cellulose[J]. Progress in Polymer Science, 1999, 24(4): 481-483.
[16] 蔡杰. 纤维素科学与材料[M]. 化学工业出版社, 2015.
[17] Baker A A, Helbert W, Sugiyama J,. High-resolution atomic force microscopy of native valonia cellulose I microcrystals[J]. Journal of Structural Biology, 1997, 119(2): 129-138.
[18] Li W, Yan L, Yang J. AFM study of crystalline cellulose in the cell walls of straw[J]. Polymer International, 2006, 55(1): 87-92.
[19] Baker A A, Helbert W, Sugiyama J,. New insight into cellulose structure by atomic force microscopy shows the I α crystal phase at near-atomic resolution[J]. Biophysical Journal, 2000, 79(2): 1139-1145.
[20] Tetard L, Passian A, Farahi R H,. Spectroscopy and atomic force microscopy of biomass[J]. Ultramicroscopy, 2010, 110(6): 701-707.
[21] Kristensen J B, Thygesen L G, Felby C,. Cell-wall structural changes in wheat straw pretreated for bioethanol production[J]. Biotechnology for Biofuels, 2008, 1: 5-5.
[22] Schmied F J, Teichert C, Hirn U,. Analysis of precipitated lignin on kraft pulp fibers using atomic force microscopy[J]. Cellulose, 2012, 19(3): 1013-1021.
[23] Paniagua C, Kirby A R, Gunning A P,. Unravelling the nanostructure of strawberry fruit pectins by endo-polygalacturonase digestion and atomic force microscopy[J]. Food Chemistry, 2017, 224: 270-279.
[24] Hirai A, Tsuji M, Horii F. TEM study of band-like cellulose assemblies produced by acetobacter xylinum at 4℃[J]. Cellulose, 2002, 9(2): 105-113.
[25] Kirby A R, Gunning A P, Waldron K W,. Visualization of plant cell walls by atomic force microscopy[J]. Biophysical Journal, 1996, 70(3): 1138-1143.
[26] Song B, Zhao S, Shen W,. Direct measurement of plant cellulose microfibril and bundles in native cell walls[J]. Frontiers in Plant Science, 2020, 11: 479.
[27] Chandel A K, Antunes F F A, Anjos V,. Ultra-structural mapping of sugarcane bagasse after oxalic acid fiber expansion (OAFEX) and ethanol production byand[J]. Biotechnology for Biofuels, 2013, 6(1): 4.
[28] Simola J, Malkavaara P, Alén R,. Scanning probe microscopy of pine and birch kraft pulp fibres[J]. Polymer, 2000, 41(6): 2121-2126.
[29] Gilli E, Schmied F, Diebald S,. Analysis of lignin precipitates on ozone treated kraft pulp by FTIR and AFM[J]. Cellulose, 2012, 19(1): 249-256.
[30] Iguchi M, Yamanaka S, Budhiono A. Bacterial cellulose-a masterpiece of nature’s arts[J]. Journal of Materials Science, 2000, 35(2): 261-270.
[31] Hirai A, Tsujii Y, Tsuji M,. AFM observation of band-like cellulose assemblies produced by acetobacter xylinum[J]. Biomacromolecules, 2004, 5(6): 2079-2081.
[32] Yan L, Zhu Q. Direct observation of the main cell wall components of straw by atomic force microscopy[J]. Journal of Applied Polymer Science, 2003, 88(8): 2055-2059.
[33] Vincent J F. From cellulose to cell[J]. Journal of Experimental Biology, 1999, 202(Pt 23): 3263.
[34] Yan L, Wang Y, Chen J. Fabrication of a model cellulose surface from straw with an aqueous sodium hydroxide/thiourea solution[J]. Journal of Applied Polymer Science, 2008, 110(3): 1330-1335.
[35] Li X, Xu Q, Shen H,. Capturing CO2to reversible ionic liquids for dissolution pretreatment of cellulose towards enhanced enzymatic hydrolysis[J]. Carbohydrate Polymers, 2019, 204: 50-58.
[36] Mansfield S D, Mooney C, Saddler J N. Substrate and enzyme characteristics that limit cellulose hydrolysis[J]. Biotechnology Progress, 1999, 15(5): 804-816.
[37] Ganner T, Bubner P, Eibinger M,. Dissecting and reconstructing synergism - in situ visualization of cooperativity among cellulases*[J]. The Journal of Biological Chemistry, 2012, 287(52): 43215-43222.
[38] Eibinger M, Bubner P, Ganner T,. Surface structural dynamics of enzymatic cellulose degradation, revealed by combined kinetic and atomic force microscopy studies[J]. The FEBS Journal, 2014, 281: 275-290.
[39] Liu H, Fu S, Zhu J Y,. Visualization of enzymatic hydrolysis of cellulose using AFM phase imaging[J]. Enzyme & Microbial Technology, 2009, 45(4): 274-281.
[40] Igarashi K, Koivula A, Wada M,. High speed atomic force microscopy visualizes processive movement ofcellobiohydrolase I on crystalline cellulose[J]. The Journal of Biological Chemistry, 2009, 284(52): 36186-36190.
[41] Igarashi K, Wada M, Samejima M. Activation of crystalline cellulose to cellulose III(I) results in efficient hydrolysis by cellobiohydrolase[J]. Febs Journal, 2007, 274(7): 1785-1792.
[42] Lehti J, Sugiyama J, Gustavsson M,. The binding specificity and affinity determinants of family 1 and family 3 cellulose binding modules[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(2): 484-489.
[43] Nishiyama Y, Sugiyama J, Chanzy H,. Crystal structure and hydrogen bonding system in cellulose I(alpha) from synchrotron X-ray and neutron fiber diffraction[J]. Journal of the American Chemical Society, 2003, 125(47): 14300-14306.
[44] Igarashi K, Uchihashi T, Koivula A,. Traffic jams reduce hydrolytic efficiency of cellulase on cellulose surface[J]. Science, 2011, 333(6047): 1279-1282.
[45] Ganner T, Rosker S, Eibinger M,. Tunable semicrystalline thin film cellulose substrate for high- resolution, in-situ AFM characterization of enzymatic cellulose degradation[J]. ACS Applied Materials & Interfaces, 2015, 7(50): 27900-27909.
[46] Qin C, Clarke K, Li K. Interactive forces between lignin and cellulase as determined by atomic force microscopy[J]. Biotechnology for Biofuels, 2014, 7: 65-65.
[47] Metallurgy P E, Jones M J, Gill P,. Mineral processing and extractive metallurgy: Papers presented at the international conference mineral processing and extractive metallurgy organized by the institution of mining and metallurgy and the Chinese society of metals and held in Kunming, Yunnan[M]. The Institution of Mining and Metallurgy, 1984.
[48] Wang J, Somasundaran P. Adsorption and conformation of carboxymethyl cellulose at solid-liquid interfaces using spectroscopic, AFM and allied techniques[J]. Journal of Colloid & Interface Science, 2005, 291(1): 75-83.
[49] Rajesh S, Jayalakshmi A, Senthilkumar S,. Performance evaluation of poly(amide-imide) incorporated cellulose acetate ultrafiltration membranes in the separation of proteins and its fouling propensity by AFM imaging[J]. Industrial & Engineering Chemistry Research, 2011, 50(24): 14016-14029.
[50] Jayalakshmi A, Rajesh S, Kim I C,. Poly(isophthalamide) based graft copolymer for the modification of cellulose acetate ultrafiltration membranes and a fouling study by AFM imaging[J]. Journal of Membrane Science, 2014, 465(13): 117-128.
[51] Bleha M, Kůdela V, Rosova E Y,. Synthesis and characterization of thin polypyrrole layers on polyethylene microporous films[J]. European Polymer Journal, 1999, 35(4): 613-620.
[52] Shehzad M A, Qaiser A A, Javaid A,. In situ solution-phase polymerization and chemical vapor deposition of polyanilne on microporous cellulose ester membranes: AFM and electrical conductivity studies[J]. Synthetic Metals, 2015, 200: 164-171.
[53] Lahiji R R, Xu X, Reifenberger R,. Atomic force microscopy characterization of cellulose nanocrystals[J]. Langmuir, 2010, 26(6): 4480-4488.
[54] Parvej M S, Wang X, Jiang L. AFM based nanomechanical characterization of cellulose nanofibril[J]. Journal of Composite Materials, 2020, 54(28): 4487-4493.
[55] Usov I, Nystrom G, Adamcik J,. Understanding nanocellulose chirality and structure-properties relationship at the single fibril level[J]. Nature Communications, 2015, 6(1): 7564-7564.
[56] Hamedi M, Hajian A, Fall A B,. Highly conducting, strong nanocomposites based on nanocellulose-assisted aqueous dispersions of single-wall carbon nanotubes[J]. ACS Nano, 2014, 8(3): 2467-2476.
[57] Li H, Mystek K, Wågberg L,. Development of mechanical properties of regenerated cellulose beads during drying as investigated by atomic force microscopy[J]. Soft Matter, 2020, 16(28): 6457-6462.
[58] Jin L, Yu X, Peng C,. Fast dissolution pretreatment of the corn stover in gamma-valerolactone promoted by ionic liquids: Selective delignification and enhanced enzymatic saccharification[J]. Bioresource Technology, 2018, 270: 537-544.
[59] Ganser C, Hirn U, Rohm S,. AFM nanoindentation of pulp fibers and thin cellulose films at varying relative humidity[J]. Holzforschung, 2013, 68(1): 53-60.
[60] Ganser C, Niegelhell K, Czibula C,. Topography effects in AFM force mapping experiments on xylan-decorated cellulose thin films[J]. Holzforschung, 2016, 70(12): 1115-1123.
[61] Zhang M, Chen G, Kumar R,. Mapping out the structural changes of natural and pretreated plant cell wall surfaces by atomic force microscopy single molecular recognition imaging[J]. Biotechnology for Biofuels, 2013, 6(1): 147.
[62] Zhu C, Dobryden I, Rydén J,. Adsorption behavior of cellulose and its derivatives toward Ag(I) in aqueous medium: An AFM, spectroscopic, and DFT study[J]. Langmuir, 2015, 31(45): 12390-12400.
[63] Nordgren N, Eklöf J, Zhou Q,. Top-down grafting of xyloglucan to gold monitored by QCM-D and AFM: Enzymatic activity and interactions with cellulose[J]. Biomacromolecules, 2008, 9(3): 942-948.
[64] Saarinen T, Suurnäkki A, Österberg M,. Modification of lignin with laccases for the adsorption of anionic ferulic acid studied by quartz cristall microbalance with dissipation and AFM[J]. Holzforschung, 2009, 63(3): 298-306.
[65] Hänninen T, Orelma H, Laine J. TEMPO oxidized cellulose thin films analysed by QCM-D and AFM[J]. Cellulose, 2015, 22(1): 165-171.
[66] Kafle K, Xi X, Lee C M,. Cellulose microfibril orientation in onion (.) epidermis studied by atomic force microscopy (AFM) and vibrational sum frequency generation (SFG) spectroscopy[J]. Cellulose, 2014, 21(2): 1075-1086.
[67] Jean B, Dubreuil F, Heux L,. Structural details of cellulose nanocrystals/polyelectrolytes multilayers probed by neutron reflectivity and AFM[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2008, 24(7): 3452-3458.
[68] Zhu Q, Zhou R, Liu J,. Recent progress on the characterization of cellulose nanomaterials by nanoscale infrared spectroscopy[J]. Nanomaterials, 2021, 11(5): 1353.
[69] Dahle S, Meuthen J, Viöl W,. Adsorption of silver on cellobiose and cellulose studied with MIES, UPS, XPS and AFM[J]. Cellulose, 2013, 20(5): 2469-2480.
Application of Atomic Force Microscope in Cellulose Research
GUO Yuan-long1, GUO Gu1, CHEN Zi-xiang1,ZHANG Li-hua1, XIE Hai-bo1*, ZHENG Qiang2
(1. College of Materials and Metallurgy, Guizhou University, Guiyang 550025, China;2. Taiyuan University of Technology, Taiyuan 030024, China)
This paper reviews the principle of atomic force microscopy (AFM) and its application progress in cellulose research which is focusing on the crystal structure, microscopic morphology, enzymatic hydrolysis process and derivatives of cellulose. The importance of AFM to the above research content is revealed, and specific implementation cases and operation methods of different AFM applications are given.Not only that, a general summary of new test methods such as AFM quantitative nanomechanical force testing, probe modification technology and combination with other technical methods are shown.Finally, the development prospect of AFM advanced imaging technology in cellulose research is prospected, and new methods are provided for the research of cellulose-based new materials, which has important reference value.
atomic force microscope; probe modification; quantitative nanomechanical force testing; cellulose; cellulose derivative
TB324
A
1004-8405(2022)02-0045-19
10.16561/j.cnki.xws.2022.02.03
2022-03-22
贵州省科技计划项目(黔科合平台人才[2019]5607);贵州省科技计划项目(黔科合平台人才[2016]5652);国家自然科学基金(22065007)。
郭元龙(1989~),女,博士研究生;研究方向:天然高分子衍生新材料。
通讯作者:谢海波(1978~),男,教授,博士生导师;研究方向:生物基合成高分子;天然高分子衍生新材料。hbxie@gzu.edu.cn

