一株高产纤维素酶真菌的分离与鉴定
尹守亮,杨镒婴,李秋园,杨何宝,郭世奇,周志江
一株高产纤维素酶真菌的分离与鉴定
尹守亮1,2,3,杨镒婴2,李秋园3,杨何宝3,郭世奇3,周志江1*
(1.天津大学化工学院,天津 300072;2.华北理工大学生命科学学院,河北 唐山 063210;3. 中溶科技股份有限公司博士后创新实践基地,河北 唐山 064499)
纤维素类生物质是地球上分布最为广泛的可再生资源,筛选高效的纤维素降解菌株对于纤维素生物质资源的开发和利用具有重要的意义。采用微晶纤维素作为唯一碳源的筛选方法,从曹妃甸湿地土壤样品中分离到一株高产纤维素酶的真菌,通过对菌株形态学特征观察和18S rDNA序列比对分析,鉴定其为土曲霉种属。发酵检测该菌株粗酶液中含有较高活性的外切葡聚糖酶和β-葡萄糖苷酶,活力大小分别为110.7、167.7 U/mL;其内切葡聚糖酶和滤纸酶酶活力分别为27.8、51.5 U/mL,土曲霉CB10可作为潜在的开发菌种用于纤维素生物降解的研究。
纤维素;唯一碳源;纤维素酶;形态特征;18S rDNA;土曲霉;酶学活性
纤维素(Cellulose, (C6H10O5))是由数百到数千个葡萄糖分子连接在一起形成的一种复杂的碳水化合物,是地球上最丰富的生物聚合物。它主要由植物、藻类、一些微生物和动物(如被囊类动物)产生,通常可作为植物、藻类和微生物细胞壁的主要结构分子[1-3]。当前,少部分纤维素类物质可为我们所利用,如造纸、纺织、制药等,但大部分被焚烧处理或转变成了各种农业废弃物。纤维素酶能高效催化纤维素分解,它在将纤维素生物质转化为可发酵糖以生产化学燃料解决能源紧缺方面起着关键的作用,近年来受到了众多科研工作者的关注和研究[4]。
根据纤维素的结构特征,纤维素降解酶系主要包括三种水解酶:内切葡聚糖酶(Endo-β-glucanase activity, EG, EC 3.2.1.4)、外切葡聚糖酶(Exoglucanase, CBH, EC 3.2.1.91)和β-葡萄糖苷酶(β-Glucosidase, BG, EC 3.2.21)。EG主要作用于纤维内部,水解β-1,4-葡萄糖苷键使纤维素聚合度降低,产物多为纤维糊精、纤维二糖、纤维三糖等小分子寡糖,为CBH催化反应增加纤维素链末端的数量,通常文献中以羧甲基纤维素钠作为该酶的作用底物来表征其活性;BG作用于纤维二糖和纤维寡糖并将其水解为葡萄糖,此酶虽不直接降解纤维素,但在纤维素完全水解葡萄糖过程中不可或缺;CBH主要作用于寡糖的还原和非还原末端,依次水解下一个纤维二糖[5]。有文献研究表明CBH水解底物主要有微晶纤维素(Avicel)、秸秆(Straw)或稻壳(Rice husk)等结晶度较高的纤维素,CBH活力的高低对于天然纤维素类物质的降解起着非常重要作用[6]。
目前,报道产生纤维素酶的微生物有细菌、真菌和放线菌等,多数文献筛选纤维素降解菌主要采用羧甲基纤维素钠作为唯一碳源底物的方法[4,7],本文以微晶纤维素作为唯一碳源方法从曹妃甸湿地土壤中分离纤维素降解菌,并对高产纤维素酶菌株的纤维素酶活性进行了测定、对菌株的形态学特征及遗传发育进化进行分析和鉴定,本文筛选的高效降解纤维素菌对于开发利用纤维素这类生物质能源具有一定研究意义。
1 实验
1.1 菌株与试剂
大肠杆菌DH5α为本实验室保存菌株;pMD™19-T Vector Cloning Kit(Takara)和DNA聚合酶(Takara)购买自宝生物工程(大连)有限公司。质粒小量提取试剂盒(Solarbio, D1100)和DNA琼脂糖凝胶回收试剂盒(Solarbio, D1200),3,5-二硝基水杨酸(Solarbio, G8600),乳酸酚棉蓝染色液(Solarbio, G1600),微晶纤维素(Solarbio, M8890)和D-(-)水杨苷(Solarbio, S9720)均购买自北京索莱宝科技有限公司(Beijing Solarbio Science & Technology Co.,Ltd.)网上商城。羧甲基纤维素钠(西陇化工, C8621),真菌基因组DNA提取试剂盒(Phygene, PH0216)和Whatman No.1滤纸均购买自北京百奇惠生物科技有限责任公司。其它常用生化试剂购买自当地代理商。
1.2 主要仪器
PCR基因扩增仪(Eppendorf, nexus GSX1),紫外可见分光光度计(北京普析通用仪器有限责任公司,T6新世界),细胞成像系统(美国Life Technologies, EVOS XL Core)。
1.3 唯一碳源培养基
筛选培养基[8]:KH2PO415 g/L,(NH4)2SO45 g/L,MgSO40.6 g/L,CaCl20.8 g/L,MnSO4‧H2O 0.001 6 g/L,FeSO4‧7H2O 0.000 5 g/L,ZnSO4‧7H2O 0.001 4 g/L,CoCl20.000 2 g/L,微晶纤维素10 g/L,琼脂粉20 g/L,pH 4.8。PDA培养基:土豆块200 g,加适量蒸馏水,煮沸30分钟后用纱布过滤去除残渣,葡萄糖20 g,琼脂粉20 g,最后加水定容1 L。LB培养基:蛋白胨10 g/L,酵母膏提取物5 g/L,氯化钠10 g/L。种子瓶盒和发酵瓶培养基成分及配制方法参照文献[8]。
1.4 筛选流程及酶学活性测定方法
1.4.1 样品来源及筛选流程
土壤样品采集自华北理工大学(曹妃甸校区)校园环境中。用无菌水浸泡土壤样品,并稀释涂布到上述筛选培养基中,在30℃恒温培养箱中静置培养7~10天,待长出单菌落,挑选转移至筛选培养基中进一步复筛,将能够在微晶纤维素为唯一碳源的培养基中生长良好的复筛菌株,接种到PDA培养基中进行富集,培养5~7天待孢子生长成熟后,收集孢子接种上述种子和发酵培养基中进行产酶分析,培养温度为30℃,转速为180 r/min,每隔1天收集发酵液上清测定上清中各种纤维素酶的酶学活性。
1.4.2 纤维酶活性测定
测定纤维素酶活性采用二硝基水杨酸(DNS)法[9]。
1)缓冲液与酶学底物的配制方法
0.05 M 柠檬酸缓冲液:柠檬酸 4.83 g,柠檬酸钠7.94 g,定容1 000 mL,pH 4.8。1%羧甲基纤维素钠:称取1 g羧甲基纤维素钠,加适量的柠檬酸溶解成胶状(温度<50℃,充分搅拌溶解),加蒸馏水定容 100 mL,4℃保存。1%水杨苷:称取1.0 g水杨苷溶于100 mL的柠檬酸缓冲液中,4℃保存。1%微晶纤维素悬液:分析天平准确1.0 g微晶纤维素,并溶于100 mL 终浓度0.05 M的柠檬酸缓冲液中混匀备用。
2)DNS试剂配置方法和葡萄糖标准曲线制作方法参照文献[10]
3)滤纸酶活的测定(Filter paper activity)[8]
剪裁长6.0 cm×宽1.0 cm重约50 mg的Whatman No.1滤纸折叠放入反应试管中,加入1.0 mL柠檬酸缓冲液和0.5 mL稀释后的酶液;50℃,水浴反应30 min;立即加入2.0 mL DNS试剂,煮沸10 min后冷却;加蒸馏水定容10 mL;OD540 nm测定吸光度值。酶活力单位(U/mL)定义:在50℃,pH4.8条件下,1 min 内催化滤纸条生成1 μg葡萄糖所需的酶量。
4)β-葡萄糖苷酶活的测定(β-Glucosidase activity)[10-11]
取1.0 mL 1%的水杨苷底物溶液和0.5 mL稀释后的发酵上清酶液充分混合,置于50℃的水浴锅中充分反应30 min,反应结束后立即加入2.0 mL DNS显色试剂,煮沸10 min,待冷却后加入6.5 mL的蒸馏水定容终体积为10 mL;取适量反应混合液置于紫外分光光度计中,在OD540 nm条件下测定吸光度值。β-葡萄糖苷酶活力单位的定义(U):在50℃反应温度,和pH4.8的条件下,1 min内能够催化底物水杨苷生成1 μg的葡萄糖所需的酶量。
5)内切葡聚糖酶活的测定(Endo-β-glucanase activity)[8]
用移液枪准确吸取1.0 mL羧甲基纤维素钠溶液和0.5 mL的发酵粗提酶液充分混匀;放置在50℃的水浴锅中充分反应30 min;加入2.0 mL的DNS显色试剂并煮沸10 min;最终加入6.5 mL蒸馏水定容10 mL,利用紫外分光光度计测定OD540 nm处的吸光值。内切葡聚糖酶活力单位的定义(U):在反应温度为50℃,和pH4.8条件下,1 min内催化反应底物羧甲基纤维素钠生成1 μg的葡萄糖所需的酶量。
6)外切葡聚糖酶活的测定(Exoglucanase activity)[12]
用移液枪准确吸取1.0 mL 1%的微晶纤维素溶液(使用前充分摇匀)和0.5 mL稀释后的发酵上清酶液充分混合;放入50℃的水浴锅中进行酶促反应30 min;最终加入2.0 mL DNS显色试剂,并煮沸10 min,冷却后加6.5 mL的蒸馏水定容至终体积10 mL;利用紫外分光光度计测定OD 540 nm下的吸光度值。外切葡聚糖酶活力单位定义(U):在反应温度为50℃,和pH4.8的条件下,1 min内催化反应底物微晶纤维素水解生成1 μg的葡萄糖所需的酶量。
1.4.3 菌株形态特征观察
将纤维素降解菌划线接种到PDA平板上,在30℃恒温静置培养箱中培养3~7天,观察菌体的宏观生长形态学特征。当菌株培养生长至早期3~4天时,用无菌牙签从培养平板中轻轻挑取少量的菌丝体,加入乳酸酚棉蓝染色液进行固定和染色,并在EVOS XL生物显微镜视野中观察纤维素降解真菌的菌丝体、孢子等微观形态特征(放大倍数:10×20)。
1.4.4 获取纤维素降解真菌的18S rDNA序列
参照文献[10]纤维素降解菌18S rDNA序列的扩增引物为NS1: 5’-GTAGTCATATGCTTGTCTC-3’, NS8: 5’-TCCGCAGGTTCACCTACGGA-3’。PCR扩增反应程序:98℃预变性5 min;98℃变性30 s,54℃退火30 s,72℃延伸2 min,35个循环;最后72℃延伸10 min;4℃保存。利用DNA琼脂糖凝胶回收试剂盒回收纤维素降解菌18S rDNA扩增产物,并与通用pMD™19-T 测序载体进行T-A连接,将上述连接产物转化DH5α中,筛选阳性菌株(含质粒pMD19T-18SrDNA)送由苏州泓迅生物科技股份有限公司进行测序。
1.4.5 种属鉴定
本文利用MEGA X软件程序包构建基于18S rDNA序列的系统发育进化树,对纤维素降解真菌进行分子生物学种属鉴定。将上述测序得到的18S rDNA序列上传至NCBI数据库进行BLAST在线比对,根据序列相似性比对结果鉴定本文纤维素降解菌的种属亲缘关系[13]。
2 结果与讨论
2.1 纤维素降解菌株的筛选
纤维素是自然界中存在的一种最丰富的可再生原料,将纤维素资源充分水解成糖再通过酶法转化成燃料酒精、乙苯丙酸等生物燃料,对于缓解能源危机、防治环境污染等问题起着重要作用[14]。纤维素酶是微生物为了适应环境,有效利用能源产生的一种诱导酶,当微生物感知外界纤维素生物质能时合成一系列纤维素降解酶系。
目前,多数文献采用羧甲基纤维素钠为唯一碳源并接合刚果红显色的方法来筛选纤维素降解菌,羧甲基纤维素钠是天然纤维素与氢氧化钠、一氯乙酸等反应后生成的纤维素羧甲基化衍生物,而微晶纤维素主要是通过稀酸水解天然的纤维素产生的含有β-1,4-葡萄糖苷键的直链式多糖高分子物质,结构上更接近于天然植物纤维素,且在天然植物纤维中微晶纤维素的含量约占40%以上[15]。微晶纤维素的成本价格比羧甲基纤维素钠低,且无臭、无味,安全无毒,耐高温,性质稳定,筛选培养基中加入微晶纤维素后经高压灭菌后其纤维素化学结构不发生改变,因此,本文选择微晶纤维素做为唯一碳源来筛选纤维素降解菌。
曹妃甸湿地位于京津唐环渤海“金三角”地带,畜牧养殖业发达,各种动植物资源丰富,但目前该地区微生物资源的开发和利用鲜有报道[16]。本文由曹妃甸湿地区采集土壤样品,经过平板初筛获得25株真菌均能够在含有微晶纤维素作为唯一碳源的培养基中生长,将这些纤维素降解菌转接传代到PDA培养平板上富集,收集孢子分别接种子瓶和发酵瓶测试纤维素酶活性。
2.2 菌株CB10纤维素酶学活性分析
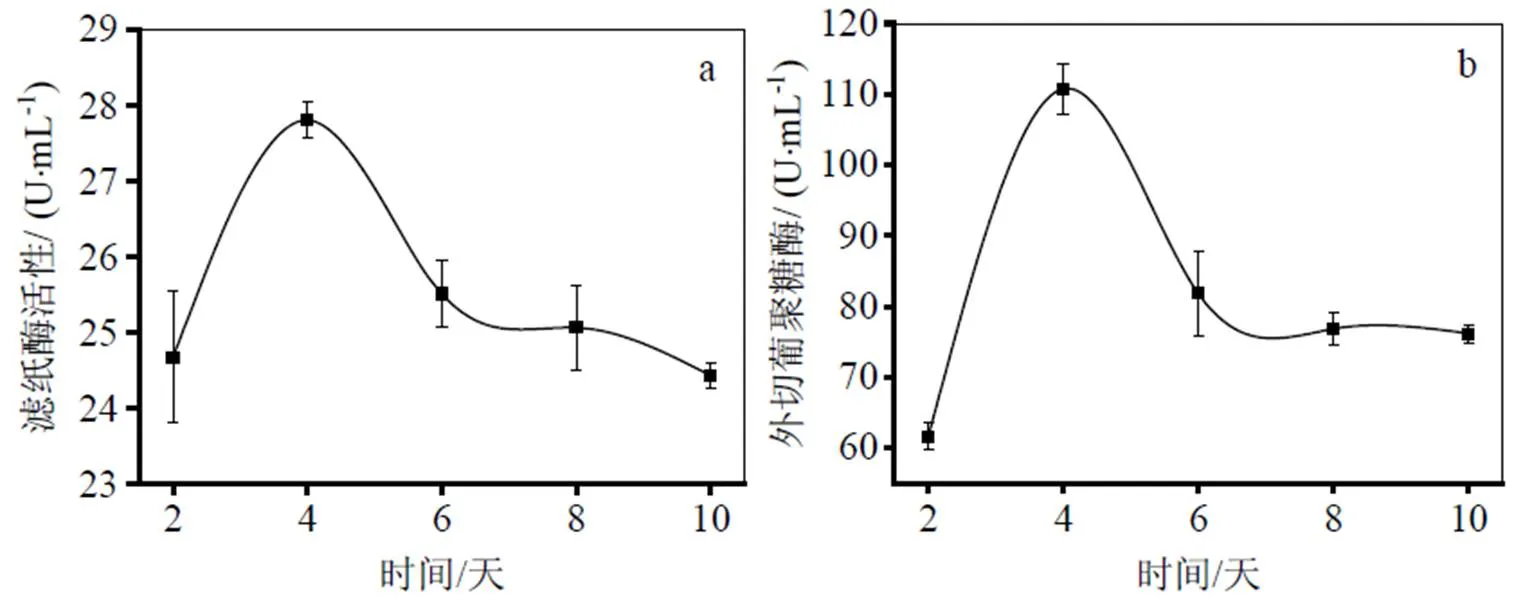
纤维素酶是一种复杂的酶复合物,主要由β-葡萄糖苷酶,内切葡聚糖酶和外切葡聚糖酶组成。滤纸酶活可反映纤维素酶三种水解酶组成复合酶系协同作用后的总酶活[17]。本文对分离筛选得到的菌株进行摇瓶发酵,分别测试了粗酶液中的滤纸酶(Filter paper activity)、β-葡萄糖苷酶(β-Glucosidase activity)、内切葡聚糖酶(Endo-β-glucanase activity)和外切葡聚糖酶(Exoglucanase activity)的活性。通过综合比较,编号CB10菌株粗酶液中四种酶活力均较高,其中内切葡聚糖酶和外切葡聚糖酶活力分别达到51.5、110.7 U/mL,滤纸酶和β-葡萄糖苷酶的活力最高达到27.8、167.7 U/mL(如图1所示)。
2.3 菌株CB10的形态特征
利用无菌水收集纤维素降解菌株CB10的孢子,并用血细胞计数板对孢子进行计数,稀释至终浓度1.0×106个/mL,取2.0 μL接种于PDA 培养基平皿上,30℃条件静置培养。如图2所示,菌株CB10生长速度较快,6天菌落直径约达到37±2 mm,平板正面菌体平坦且有辐射状皱纹,外边缘菌丝呈白色,中心为土黄色,中心气生菌丝能够向空气中延长生长,成熟的孢子呈黄色且饱满易脱落,培养平板背面内生菌体呈现辐射状,中心呈黄色向外周扩散黄色逐渐变浅。
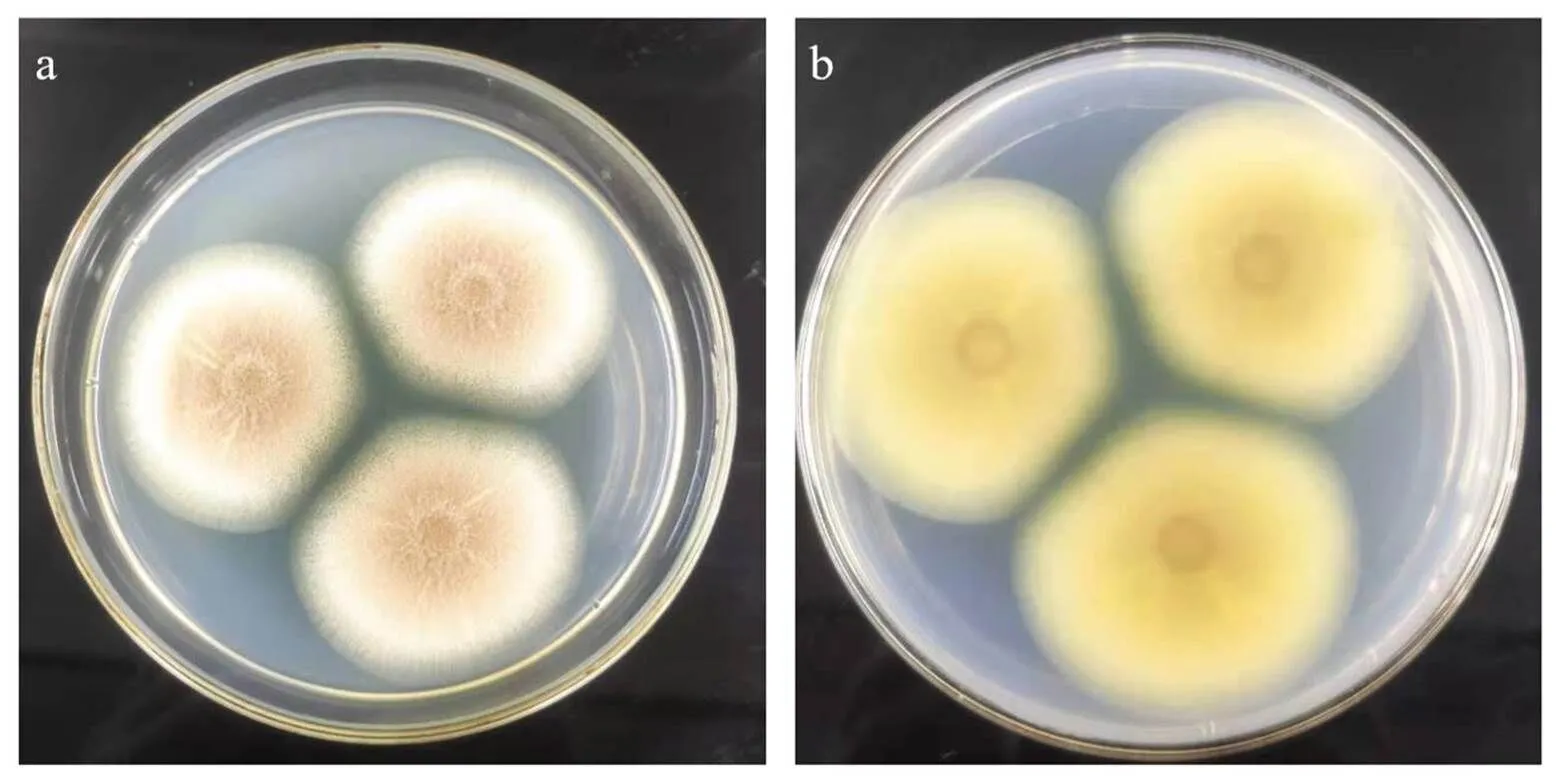
图2 纤维降解菌株CB10的PDA培养平板形态特征(a. 培养平板正面,b. 培养平板反面)
从PDA平板上挑取少量培养3~5天的菌丝体及孢子于载玻片上,在菌丝体上滴管滴加1~2滴乳酸酚棉蓝,盖上盖玻片稍微加热进行染色固定。镜检特征如图3所示,分生孢子头呈致密状,分生孢子梗直径较粗,顶囊呈半球状,散落的分生孢子呈球形圆滑且多聚集在一起。
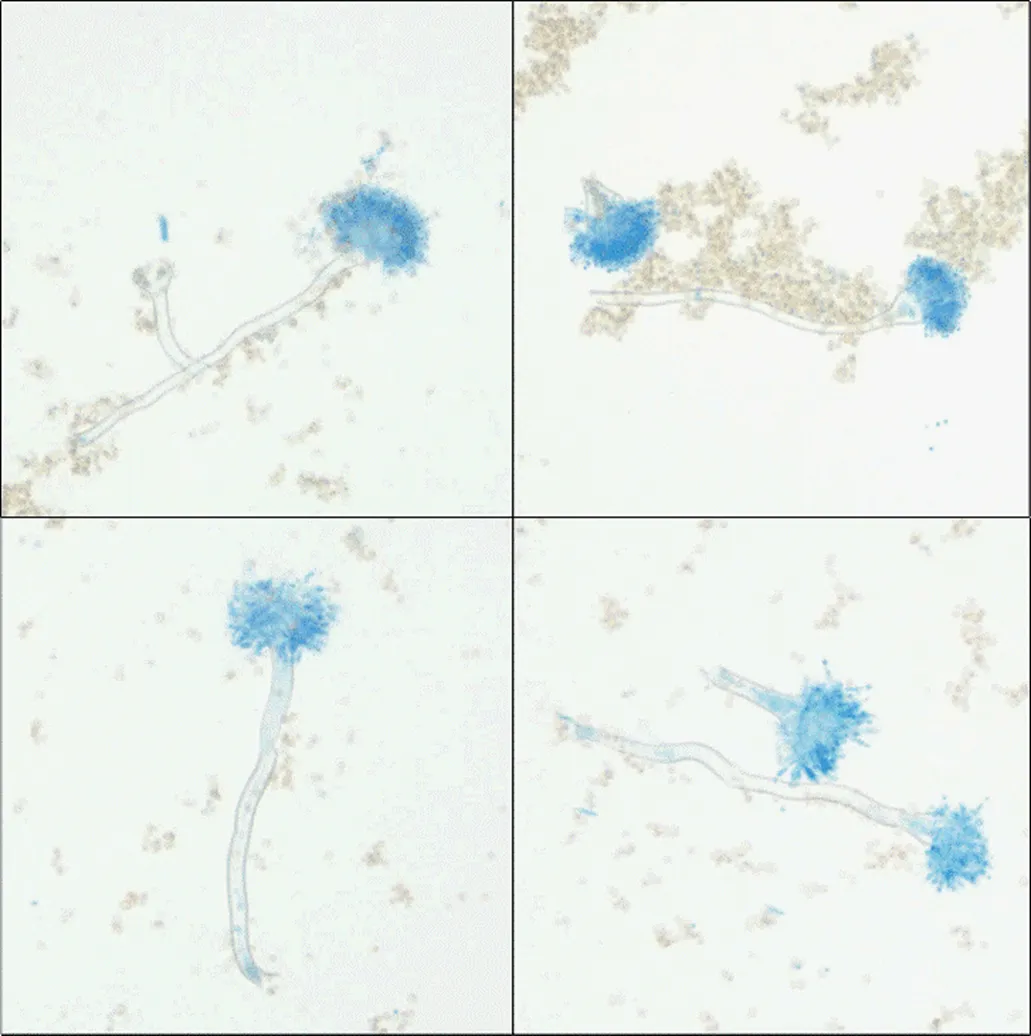
图3 菌株CB10菌丝体微观形态特征
2.4 菌株CB10在不同碳源培养基中生长情况
碳源为微生物的生长和代谢活动提供能源及合成各种产物的骨架,是微生物正常新陈代谢活动的物质基础[18]。为了进一步探究不同碳源对菌株CB10生长的影响,将等量的孢子(2 μL, 106/mL)接种到分别填加了终浓度1%的羧甲基纤维素钠(sodium carboxymethylcellulose, CMC)、微晶纤维素(avicel)、纤维二糖(cellobiose)、葡萄糖(glucose)、蔗糖(sucrose)、乳糖(lactose)、甘油(glycerol)和淀粉(starch)的基本培养基中(minimal medium)。结果如图4所示,菌株CB10不仅能在羧甲基纤维素钠,微晶纤维素和纤维二糖的碳源培养基中良好生长,同时也能充分的利用蔗糖和乳糖两种二糖,菌株CB10在甘油为唯一碳源的培养基中菌落尺寸相对较小,但菌落形态比较致密。尤其注意的是菌株CB10对于淀粉的利用尤为明显,初步预测菌株CB10自身能够编码和分泌丰富的的淀粉酶。
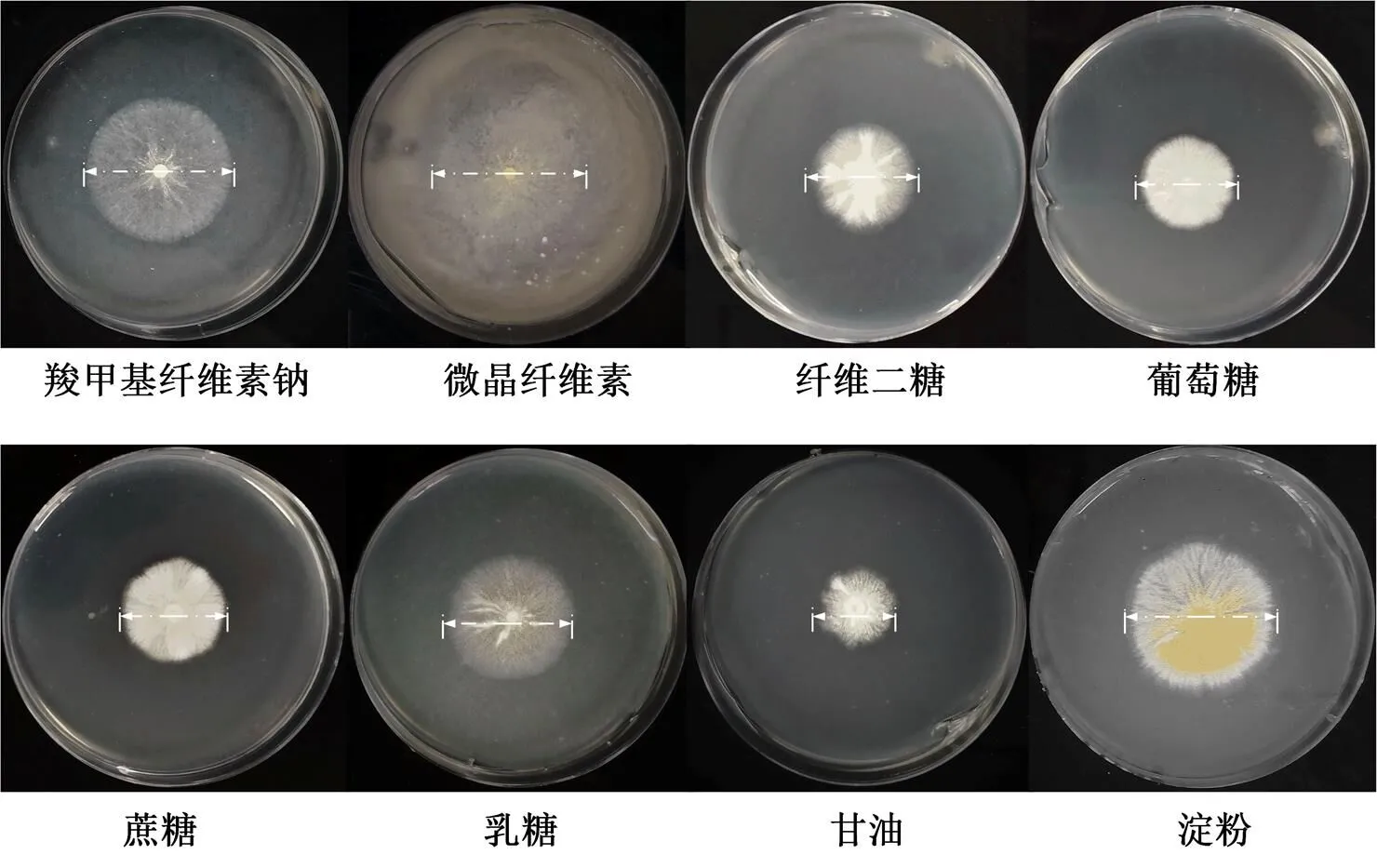
图4 菌株CB10在不同碳源培养基中生长情况
2.5 种属鉴定及系统发育分析
按照试剂盒操作步骤提取纤维素降解菌CB10的基因组DNA作为扩增模板,利用NS1和NS8两个引物PCR扩增该菌株的18S rDNA基因。扩增电泳结果如图5所示,其PCR产物经DNA回收试剂盒纯化回收后与pMD19T测序载体进行连接和转化,并对阳性克隆菌株进行序列测定,测序结果表明菌株CB10的18S rDNA序列长度为1 770 bp,将此序列上传至NCBI的Genbank数据库获得唯一序列号NO.OM250078。
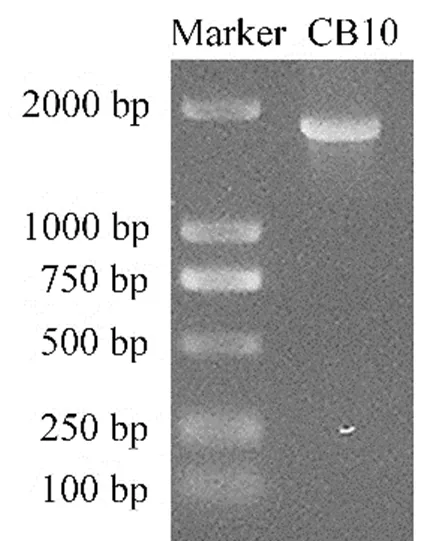
图5 菌株CB10 18S rDNA基因PCR产物琼脂糖凝胶电泳结果
将CB10菌株的18S rDNA基因序列与NCBI数据库中的已有的参考菌株的18S rDNA序列进行Blast核酸序列比对,利用MEGA(X)软件将数据库中相似性较近的18S rDNA序列作为参考序列,与菌株CB10的18S rDNA序列进行多重比对,采用邻位相连的计算方法(Neighbor-joining, NJ),自展次数选择1000次,进行系统发育进化树状图的绘制,结果如图6所示,CB10与菌株ATE 1(Genbank No. KM462826.1)和ATCC1012(Genbank No. NG064804.1)亲缘关系最近。参考关于土曲霉报道的相关文献[19-21],同时接合图2和图3,菌株CB10的形态学特征基本与土曲霉相符,因此,初步鉴定菌株CB10为土曲霉种属。
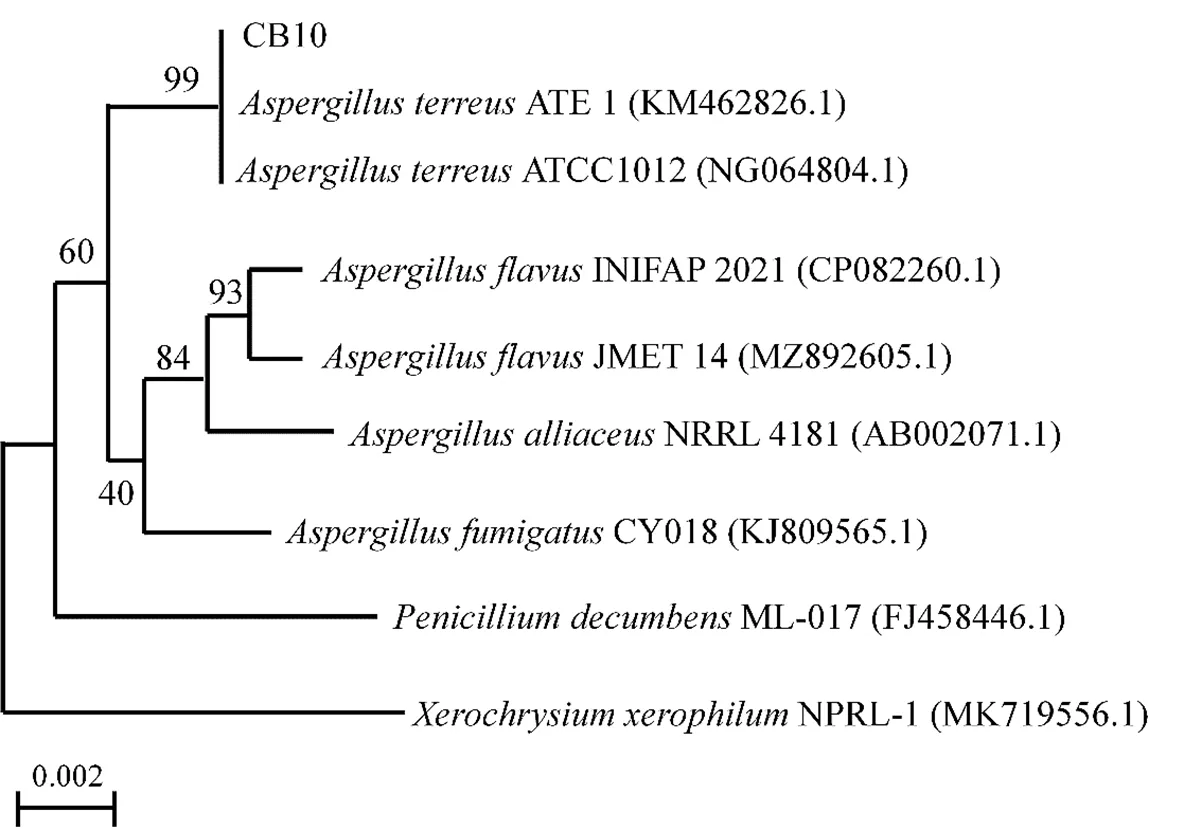
图6 系统发育进化树状关系图
土曲霉在自然界中分布十分广泛,土壤、几乎所有的植物中均有被发现。当前,土曲霉在工业上主要用于大规模生产衣康酸和洛伐他汀两种天然产物,其中衣康酸作为化工领域合成树脂、增塑剂、塑料等材料的常用前体分化合物,被美国能源部列为12种最具应用前景和潜在研究价值的分子之一,而洛伐他汀是医药领域里治疗高胆固醇血症的重要药物之一[22-25]。Afolake等[26]采用羧甲纤维素钠和木聚糖作为唯一碳源从非洲西部腐烂的木薯皮中分离一株产纤维素酶和木聚糖酶的土曲霉优势菌株(编号KJ829487),在最适pH为6和最适温度40℃条件下,菌株KJ829487粗酶液分解酸预处理的木薯皮可获得最高浓度 584 mg/L的葡萄糖。Muhammad等[27]从土壤中分离出一株编号为MS105的土曲霉菌株,其产生的内切葡聚糖酶最适温度可高达70℃,尤其对草类、玉米棒芯等纤维素具有较高效的分解能力。目前,里氏木霉()是最早被发现和应用的纤维素酶产生菌之一, 它在将植物纤维原料生物转化制取乙醇工艺中具有重要的工业价值。里氏木霉自身合成外切葡聚糖酶和内切葡聚糖酶含量较高(>92%),但是合成β-葡萄糖苷酶活性极低,因此,β-葡萄糖苷酶作为纤维素降解过程中的一种限速酶极大的限制了里氏木霉在工业上的实际应用[28-29]。本文研究发现在相同的发酵培养条件和相同的检测方法下,虽然土曲霉CB10菌株的滤纸酶、外切葡聚糖酶和内切葡聚糖酶的活性均低于里氏木霉RUT-C30,但菌株CB10 β-葡萄糖苷酶活力是工业菌株里氏木霉RUT-C30的8.8倍(见图7)。本文后续将对CB10菌株的发酵产酶工艺、对纤维素类废弃物(杂草、玉米芯等)的降解能力等应用方面做进一步的研究,同时土曲霉CB10菌株纤维素酶系相关基因的克隆表达做进一步分析。
3 结论
本文利用微晶纤维素为唯一碳源的筛选方法,从河北省唐山市华北理工大学(曹妃甸校区)的校园土壤样品中得到一株能够合成较高纤维素酶活力的真菌,经过形态学观察和基于18S rDNA序列的系统发育分析,鉴定其为土曲霉属,并命名为CB10。土曲霉CB10发酵粗酶液具有较高的外切葡聚糖酶和β-葡萄糖苷酶活性,该菌株可作为潜在的开发菌种用于纤维素生物降解的研究,进一步丰富纤维素水解酶基因及菌种资源库。
致谢:感谢华东理工大学生物工程学院王玮老师馈赠的产纤维素酶模式菌里氏木霉RUT-C30。
[1] Chen X, Cheng W, Li S,. The “quality” and “quantity” of microbial species drive the degradation of cellulose during composting[J]. Bioresource Technology, 2021, 320(Pt B): 124425.
[2] Soni V K, Krishnapriya R, Sharma R K. Algae: Biomass to biofuel[J]. Methods in Molecular Biology, 2021, 2290: 31-51.
[3] Ye D, Rongpipi S, Kiemle S N,. Preferred crystallographic orientation of cellulose in plant primary cell walls[J]. Nature Communications, 2020, 11(1): 4720.
[4] 傅科鹤, 范莉莉, 陈慧颖, 等. 高产纤维素酶菌株的筛选及产酶条件优化[J]. 江苏农业科学, 2021, 49(3): 214-218.
[5] 李娜. 海洋细菌的高通量分离培养、多相分类研究及浒苔纤维素降解酶的挖掘[D]. 济南: 山东大学, 2021.
[6] 李方正, 唐亮, 赵建文, 等. 一株高效秸秆纤维素降解真菌的分离、鉴定及系统发育分析[J]. 山东农业科学, 2011, 7: 5-8.
[7] 谢洁, 商必志, 任慧爽, 等. 一株纤维素酶产生菌JYMB2菌株的筛选鉴定[J]. 西南大学学报(自然科学版), 2016, 38(5): 45-51.
[8] 孟庆山. 里氏木霉纤维素酶基因转录调控因子鉴定及纤维素酶高产菌株构建[D]. 大连: 大连理工大学, 2019.
[9] 王琳, 刘国生, 王林嵩, 等. DNS法测定纤维素酶活力最适条件研究[J]. 河南师范大学学报(自然科学版), 1998, 26(3): 69-72.
[10] 尹守亮, 杨镒婴, 徐黛云, 等. 一株高活性纤维二糖酶真菌的筛选与鉴定[J]. 华北理工大学学报(自然科学版), 2022, 44(3): 119-125.
[11] 彭利沙, 张永祥, 闫青, 等. 绿色木霉耐热β-葡萄糖苷酶分离纯化及酶学性质研究[J]. 生物技术通报, 2016, 32(9): 189-196.
[12] 唐自钟, 刘姗, 韩学易, 等. 产外切葡聚糖酶真菌的筛选鉴定及毕赤酵母中的表达[J]. 微生物学通报, 2014, 41(4): 629-635.
[13] Kumar S, Stecher G, Li M,. MEGA X: Molecular evolutionary genetics analysis across computing platforms[J]. Molecular Biology and Evolution, 2018, 35(6): 1547-1549.
[14] 张野, 王吉平, 苏天明, 等. 筛选微生物降解木质纤维素的研究进展[J]. 中国生物工程杂志, 2020, 40(6): 100-105.
[15] 王曼泽, 黄钰馨, 马玲. CMC-MCC中MCC含量测定方法的建立及验证[J]. 宁夏医学杂志, 2021, 43(9): 820-822.
[16] 刘连军. 曹妃甸湿地旅游产业发展战略研究[D]. 天津: 河北工业大学, 2014.
[17] 王勇, 张育铭, 朱洪磊, 等. 高效纤维素降解菌的筛选及产酶活力测定[J]. 江苏农业科学, 2020, 48(23): 255-260.
[18] 张玉千, 周学, 夏文静, 等. 棘孢曲霉液体发酵产β-葡萄糖苷酶培养基的优化[J]. 江苏农业科学, 2021, 49(11): 208-212.
[19] Panigrahi P K, Roy R, Pal S S,.endogenous endophthalmitis: Report of a case and review of literature[J]. Indian Journal of Ophthalmology, 2014, 62(8): 887-889.
[20] Varga J, Toth B, Kocsube S,. Evolutionary relationships amongisolates and their relatives[J]. Antonie Van Leeuwenhoek, 2005, 88(2): 141-50.
[21] Mohamadnia A, Salehi Z, Namvar Z,. Molecular identification, phylogenetic analysis and antifungal susceptibility patterns ofcomplex andcomplex isolated from clinical specimens[J]. Journal of Medical Mycology, 2020, 30(3): 101004.
[22] 韦苏慧, 黄雪年, 张伟, 等. 洛伐他汀工业菌株土曲霉HZ01的次级代谢产物合成分析[J]. 微生物学报, 2018, 58(5): 793-803.
[23] 廖国侠. 土曲霉菌丝形态及组蛋白修饰对洛伐他汀合成的影响[D]. 深圳: 深圳大学, 2020.
[24] 杨静. 林业剩余物土曲霉发酵制备衣康酸的研究[D]. 北京: 中国林业科学研究院, 2018.
[25] Werpy T, Petersen G. Top value added chemicals from biomass volume I—results of screening for potential candidates from sugars and synthesis gas[M]. U.S. Department of Energy, 2004.
[26] Olanbiwoninu A A, Odunfa S A. Production of cellulase and xylanase byKJ829487 using cassava peels as subtrates[J]. Advances in Microbiology, 2016, 6(7): 502-511.
[27] Sohail M, Ahmad A, Khan S A. Production of cellulase fromMS105 on crude and commercially purified substrates[J]. 3 Biotech, 2016, 6(1): 103-110.
[28] 李程程. 里氏木霉高产纤维素酶的机理研究和应用[D]. 南京: 东南大学, 2018.
[29] Ng I S, Tsai S W, Ju Y M,. Dynamic synergistic effect oncellulases by novel beta-glucosidases from Taiwanese fungi[J]. Bioresource Technology, 2011, 102(10): 6073-6081.
Isolation and Identification of a High Efficiency Cellulose Degrading Fungus
YIN Shou-liang1,2,3, YANG Yi-ying2, LI Qiu-yuan3,YANG He-bao3, GUO Shi-qi3, ZHOU Zhi-jiang1*
(1. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China;2. School of Life Sciences, North China University of Science and Technology, Tangshan 063210, China;3. Postdoctoral Innovation Practice Base, Zhongrong Technology Co., Ltd., Tangshan 064499, China)
Cellulosic biomass is the most abundant biorenewable material on the earth. Screening efficient degrading enzymes is of great significance for the development and utilization of cellulosic biomass. A fungal species with high cellulase was isolated from soil samples in Caofeidian using the method of avicel as the only carbon source. The strain was identified asbased on the morphological features and 18S rDNA sequence comparison analysis. The exoglucanase and β-glucosidase activities of the fermentation supernatant were 110.7 U/mL and 167.7 U/mL, respectively, and the endo-β-glucanase and filter paper activities were 27.8 U/mL and 51.5 U/mL, respectively. The strain CB10 could be used as a potential resource for the biodegradation of cellulose.
cellulose; the only carbon source; cellulase; morphological feature; 18S rDNA;; enzyme activity
Q939.9
A
1004-8405(2022)02-0009-10
10.16561/j.cnki.xws.2022.02.01
2022-02-25
河北省自然科学基金面上项目(C2019209399);唐山市科技局项目(20130208b);华北理工大学引进人才科研启动资金(BS201833)。
尹守亮(1983~)男,博士,研究方向:微生物资源菌株筛选与应用。yinsl@ncst.edu.cn
通讯作者:周志江(1960~),男,教授,研究方向:微生物资源多样性研究和功能分析。zzj@tju.edu.cn
——谷物β-葡聚糖的最新研究进展

