溯河洄游型刀鲚MHCⅡβ基因克隆的初步研究
轩中亚,姜 涛,刘洪波,陈修报,杨 健,
(1.南京农业大学无锡渔业学院,江苏无锡 214081;2.中国水产科学研究院淡水渔业研究中心,中国水产科学研究院长江中下游渔业生态环境评价与资源养护重点实验室,江苏无锡 214081)
主要组织相容性复合体(major histocompatibility complex,MHC)是脊椎动物中一组参与适应性免疫反应的基因[1-3]。MHCⅡ基因编码的MHCⅡ蛋白主要负责细胞外病原体抗原的识别及呈递给T淋巴细胞[4];MHC是基因组中多态性最丰富的区域之一,一个特点是物种间和物种内的基因座拷贝数的极大差异,从大西洋鳕(Gadus morhua)没有MHCⅡ基因座到尼罗罗非鱼(Oreochromis niloticus)拥 有 超 过10 个 基 因座[5-7];另一特点是同一物种群体内等位基因间的高度多态性[8-9]。在MHC基因中,多态性最丰富的为MHCⅡ基因,而多样化选择往往作用于在MHCⅡ基因第二个外显子中决定等位基因特异性的抗原结合位点,抗原结合位点正是MHCⅡ最高多态性的来源[8,10]。
刀鲚(Coilia nasus)是一种溯河洄游性的小型鱼类,在河口及近海海域生长,每年春季亲鱼自海区进入河口上溯至河流平缓的回水湾或者通江湖泊内产卵,在长江流域最远甚至可上溯至洞庭湖一带繁殖,繁殖产生的幼鱼在淡水中生活一段时间后进入河口或近海区域生长[11]。一般认为,刀鲚主要是溯河洄游生态型[11],然而一些湖泊中也存在着陆封型的刀鲚种群[12],另外耳石微化学的研究证实了淡水定居型的刀鲚[13]。最近的研究发现,实际上刀鲚存在溯河洄游型长颌鲚、淡水定居型长颌鲚、溯河洄游型短颌鲚、淡水定居型短颌鲚以及陆封型湖鲚5种生态表型[14]。由此可见,刀鲚具有高度的生态适应性,而淡水定居与溯河洄游型刀鲚应对的疾病及寄生虫的对策也截然不同。MHCⅡ由α链和β链构成,其中MHCⅡβ基因的多样性与外源性抗原(如疾病和寄生虫)介导的自然选择具有密切的关系,这为洄游鱼类的局部种群适应和分化的研究提供了良好的视角。然而,迄今对于不同生态型刀鲚的MHCⅡβ基因是否具有多样化和差异,是否受到选择作用的影响等问题尚缺乏了解。探索和解决这些问题对厘清刀鲚生态适应性及其背后的不同类型的疾病和寄生虫的抗性特征将具有重要意义。
本研究首次对洄游型刀鲚的MHCⅡβ基因进行基因序列克隆,获得其MHCⅡβ基因全长序列,并通过MHCⅡβ基因编码的氨基酸序列研究该类刀鲚MHCⅡ基因的系统进化,以期为进一步探讨洄游型刀鲚MHCⅡ基因多态性、种群遗传多样性、自然选择类型及适应机制(如抗病性等)分析提供理论依据。
1 材料与方法
1.1 实验材料
实验动物为2018年5月在长江镇江段进行的刀鲚资源调查中捕捞的3尾刀鲚。上颌骨长度均长于头长(上颌骨/头长的比率分别为1.12、1.21和1.09),再经耳石微化学确认,全部为溯河洄游型个体,故判定3尾个体为刀鲚的溯河洄游型长颌鲚生态表型[14]。在渔船上对刚捕离水面的新鲜刀鲚进行取样。取其脑、鳃、心脏、脾脏、胃、肾脏、肌肉、皮肤、肠、肝脏等组织后,立即浸入RNA保存液,于4℃置放过夜,待组织充分浸润后再置于干冰中低温保存,运到实验室后立即转入-80℃冰箱中保存。实验所用的所有解剖器械和玻璃器皿均经180℃烘烤3 h,以灭活RNA酶,使用无RNase的2 mL冻存管存放样品。
1.2 DNA和总RNA的提取及cDNA模板的制备
基因组DNA提取使用动物组织基因组DNA提取试剂盒(康为世纪),参照说明书进行操作,DNA提取后使用1%的琼脂糖凝胶电泳检测DNA质量。各组织总RNA提取方法参照Trizol reagent(Invitrogen,美国)说明书,1%琼脂糖凝胶电泳检测提取出的总RNA的完整性,分光光度计测定RNA浓度。取1μg总RNA样品,使用反转录试剂盒ReverTra Ace-α-TM First Strand cDNA Synthesis Kit(TOYOBO,日本)合成第一链cDNA。在无RNA酶的PCR管中加入1μg的总RNA(总RNA浓度400ng·μL-1,共2.5μL),和1μL的100μM的oligo(dT)引物,并加入DEPC处理过的灭菌水8.5μL使混合液最终体积为12μL,将上述混合液于65℃处理5 min,然后在冰上立即冷却1 min。然后再在反应液中依次加入4μL 5X reaction buffer、1μL RiboLock RNase Inhibitor(20 U·μL-1)、2μL 10 mM dNTP mix、1μL RevertAid M-MuLV Reverse Transcriptase(200 U·μL-1),将其轻轻混匀,并短暂离心后在PCR仪上42℃孵育1 h,之后70℃孵育5 min结束反应。
1.3 MHCⅡβcDNA全长及基因组序列扩增
以反转录产物为模板,根据SHEN等[15]公布的转录组文库中MHCⅡβ的相对保守序列,设计引物对扩增中间片段(引物序列见表1,MHCⅡβ partial-F和MHCⅡβpartial-R)。PCR反应条件:首先在94℃下预变性2 min,之后为35个循环,每个循环在94℃下变形30 s、55℃下退火30 s、72℃下延伸1 min;最后在72℃下延伸10 min,PCR产物4℃保存。扩增3′端和5′端的巢式引物,根据已获得的cDNA中间序列分别设计(表1)。
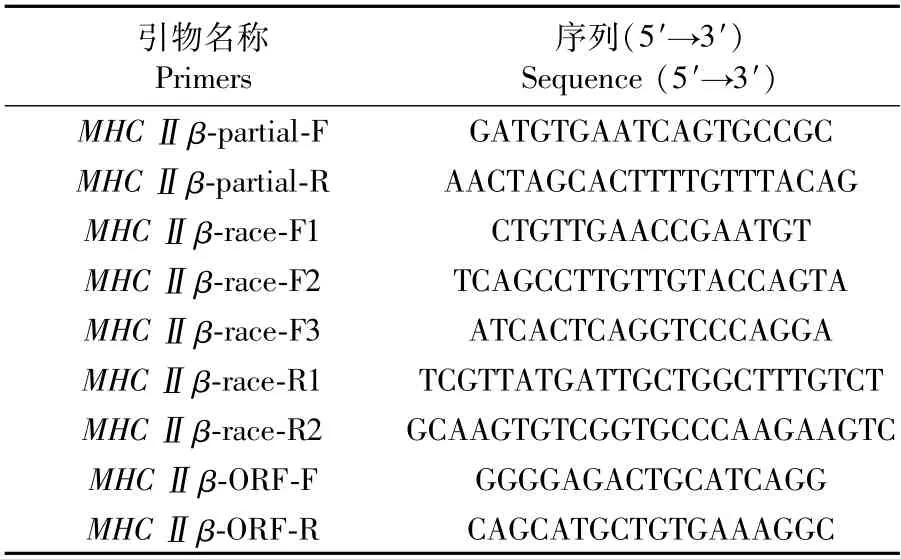
表1 MHC基因克隆反应引物组合Tab.1 Primer pairs of combination used in cloning
使用SUPERSCRIPT II RT酶和引物MHCⅡβ-race-F1对总RNA进行目的基因第一链cDNA的合成,对合成的cDNA进行去RNA处理并进行纯化。使用TdT酶和dCTP对纯化后的cDNA进行末端加上多聚C,再使用引物MHCⅡβ-race-F2和试剂盒里面带的桥连铆钉引物AAP对已经加dC尾的cDNA进行PCR第一轮扩增。使用引物MHCⅡβ-race-F3和试剂盒里面带的桥连通用扩增引物AUAP进行巢式PCR第二轮扩增,将第二轮PCR产物进行电泳并对目的条带进行切胶回收纯化,纯化后的PCR产物与pMD18T进行连接,转化后对阳性克隆进行测序,得到5′端序列。使用引物MHCⅡβ-race-R1和UPM,以cDNA为模板进行第一轮PCR扩增。将第一轮PCR扩增产物稀释50倍,然后用引物MHCⅡβ-race-R2和UPM进行第二轮PCR扩增。将第二轮PCR产物进行电泳并对目的条带进行切胶回收纯化后克隆测序,得到3′端序列。
将中间片段、3′-RACE、5′-RACE序列片段进行拼接,根据拼接获得的溯河洄游型刀鲚MHCⅡβ基因cDNA序列,在其序列两端非编码区选取保守片断设计特异引物MHCⅡβ-ORF-F和MHCⅡβ-ORF-R进行ORF验证,检验拼接所得cDNA全长序列。
1.4 序列分析与进化树的构建
DNAtools 6.0软件预测MHCⅡβ基因的开放读码框,并翻译成相应的氨基酸序列;在开放型网站NCBI(https://www.ncbi.nlm.nih.gov)上比对核苷酸同源性;MHCⅡβ基因编码的蛋白质的分子式、相对分子质量、等电点等基本信息使用网站工具Prot-Param tool(http://www.expasy.org/)进行分析;预测跨膜区位置使用在线软件TMHMM (http://www.cbs.dtu.dk/services/TMHMM/),预测信号肽位置使用在线软件SignalP(http://www.cbs.dtu.dk/services/SignalP/)。采用蛋白二级结构预测及注释平台(http://smart.embl-heidelberg.de/)进行结构域分析,通过Swiss Model对MHCⅡβ蛋白的三级结构进行预测。
蛋白序列的多重比对使用Clustal X 1.8软件;与NCBI上下载的其他脊椎动物的MHCⅡβ蛋白序列进行系统发育分析,不同MHCⅡβ蛋白序列的物种及登陆号为:智人(Homo sapiens,AAH24269)、小家鼠(Mus musculus,P18469)、驼背非鲫(Cyphotilapia frontosa,AAA49157)、斑马鱼(Danio rerio,AAA50043)、三刺鱼(Gasterosteus aculeatus,AAU01920)、半 滑 舌 鳎(Cynoglossus semilaevis,ACZ69608)、虹 鳟 (Oncorhynchus mykiss,AAD53032)、大黄鱼(Larimichthys crocea,ABV48908)、青鳉(Oryzias latipes,BAA94279)、鲤(Cyprinus carpio,CAA88847)、斜 带 石 斑 鱼(Epinephelus coioides,ACU46020)、圆 斑 星 鲽(Verasper variegatus,ADB43564)、大 西 洋 鲑(Salmo salar,CAA49725)、大 西 洋 鲱(Clupea harengus,XP_012688403)、舌齿鲈(Dicentrarchus labrax,CAJ34344)。进化树由MEGA软件构建。
2 结果与分析
2.1 溯河洄游型刀鲚MHCⅡβcDNA全长及序列分析
根据SHEN等[15]公布的刀鲚转录组数据获得长度为821 bp的刀鲚MHCⅡβ基因片段,根据这以基因片段的序列设计特异性引物进行验证。验证得到长度为689 bp的核心序列片段。在核心序列片段上设计的RACE引物MHCⅡβ partial-F和MHCⅡβpartial-R扩增分别扩增出了长度约为295 bp的3′片段,和长度约为188 bp的5′片段,将刀鲚MHCⅡβ中间片段,3′片段和5′片段序列根据核苷酸序列的重叠部分碱基序列进行拼接,获得了刀鲚MHCⅡβ的全长cDNA为917 bp,其中,5′非编码区长度为23 bp,开放读码框(open reading frame,ORF)765 bp,3′非编码区长度为129 bp(图1)。经BLAST比对后发现刀鲚的MHCⅡβ基因序列与大西洋鲱MHCⅡβ基因相似性达84.20%。根据ProtParam预测,刀鲚MHCⅡβ基因编码的蛋白质分子质量为28 710.88,等电点为6.53,蛋白分子式为C1309H2006N334O375S9,总平均疏水指数(grand average of hydropathicity,GRAVY)为-0.189。经过SignalP分析发现22-23 号氨基酸为信号肽序列。TMHMM预测的跨膜区为220-241号氨基酸。应用SMART软件对MHCⅡβ蛋白进行二级结构预测,结果显示MHCⅡβ蛋白由1个MHCⅡβ结构域(从第32个氨基酸开始到第107个氨基酸结束)、1个IGc1免疫球蛋白(从第132个氨基酸开始到第203个氨基酸结束)及一个跨膜区(从第220个氨基酸开始到第241个氨基酸结束)组成(图2-a)。通过Swiss Model对MHCⅡβ蛋白的三级结构进行预测的结果见图2-b。

图1 溯河洄游型刀鲚MHCⅡβ基因序列及其推导的氨基酸序列Fig.1 MHCⅡβgene sequence and derived amino acid sequences in anadromous Coilia nasus
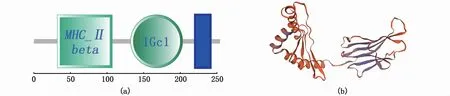
图2 溯河洄游型刀鲚MHCⅡβ蛋白的二级结构(a)和三级结构(b)示意图Fig.2 Schematic diagram of the secondary structure(a)and tertiary structure(b)of MHCⅡβin anadromous Coilia nasus
2.2 同源性及系统进化树分析
对本研究溯河洄游型刀鲚MHCⅡβ氨基酸序列和其他一些硬骨鱼类、哺乳动物(鼠和人)的MHCⅡβ氨基酸序列进行比对,同源性分析显示,刀鲚MHCⅡβ氨基酸序列与同属于鲱形目的大西洋鲱的同源性最高,为71.79%;与鲈形目的斜带石斑鱼、驼背非鲫、大黄鱼的同源性分别为56.69%、58.27%、57.09%,与刺鱼目的三刺鱼的同源性为52.36%,与鲽形目的半滑舌鳎的同源性为55.12%,与鳉形目的青鳉的同源性为53.94%,与鲑形目的大西洋鲑的同源性为58.66%,与智人及小家鼠的同源性较低,仅为32.09%和33.46%。
由MEGA 7.0软件基于MHCⅡβ氨基酸序列构建的系统进化树显示(图3),刀鲚的MHCⅡβ氨基酸序列与同属于鲱形目的大西洋鲱进化关系最近,与鲈形目的舌齿鲈、驼背非鲫、斜带石斑鱼、大黄鱼,鳉形目的青鳉,鲽形目的圆斑星鲽、半滑舌鳎、刺鱼目的三刺鱼共同构成了一个支系;而鲑形目的大西洋鲑、虹鳟以及鲤形目的斑马鱼、鲤等形成了另一个支系,与刀鲚MHCⅡβ氨基酸序列的进化关系较远。硬骨鱼类与智人及小家鼠形成了两个不同的大的分支,进化关系最远(图3)。
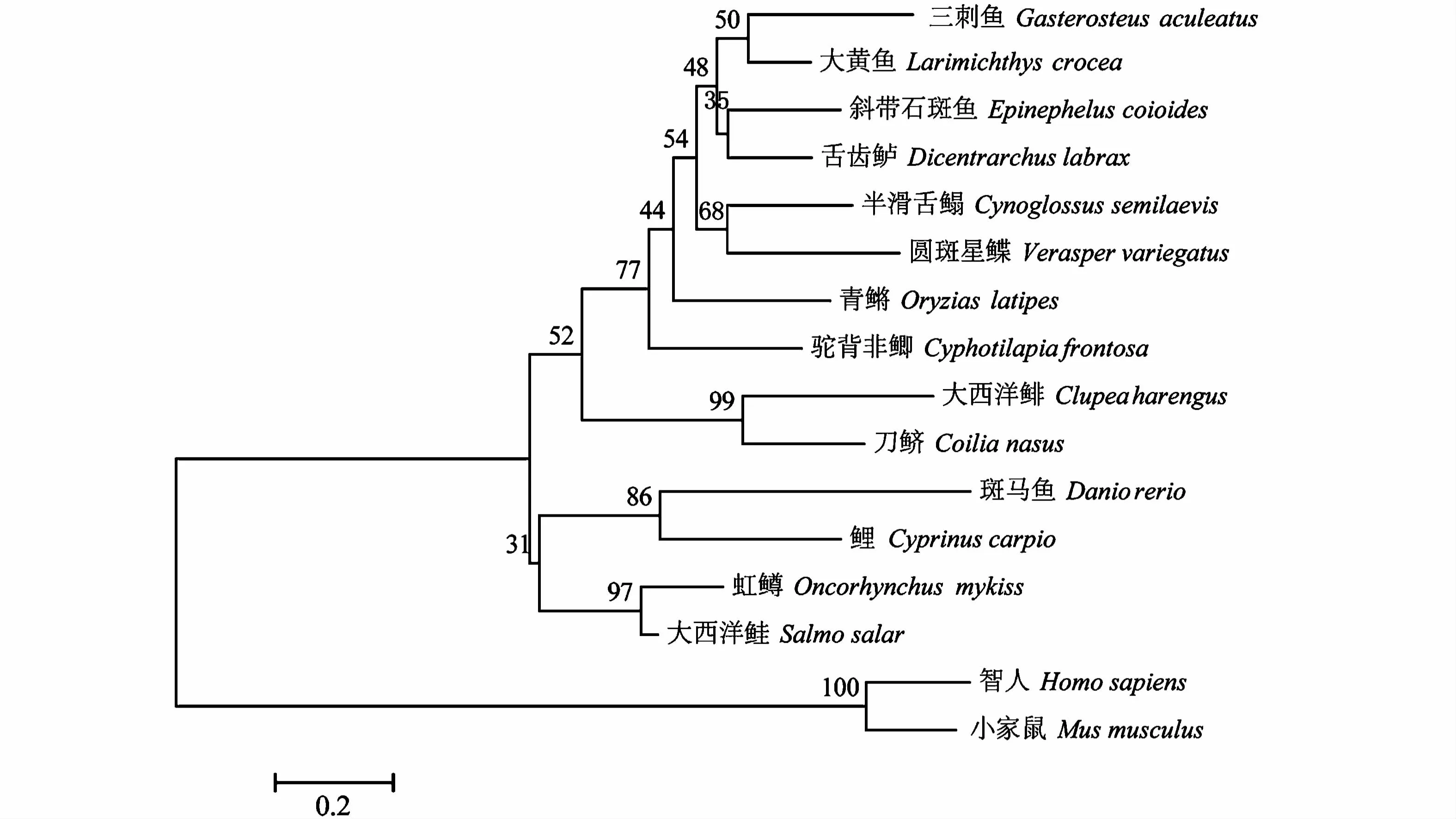
图3 基于邻接法构建的溯河洄游型刀鲚MHCⅡβ与其他脊椎动物的进化树分析Fig.3 Phylogenetic analysis of MHCⅡβin anadromous Coilia nasus and other vertebrates by neighbor-joining method
3 讨论
主要组织相容性复合体 (major histocompatibility complex,MHC)在脊椎动物适应性免疫过程中负责抗原识别及抗原递呈。另外,除了与抗病性相关外,MHC还被认为与性选择和配偶选择具有重要联系[16-17]。同时,由于MHC是基因组中多态性最丰富的区域之一,MHCⅡ又是MHC基因中遗传多样性最丰富的区域,因此也被当做一种分子标记,广泛用于物种内种群遗传多样性和遗传分化评估[9,18-19],受到分子育种和分子生态学研究的重视[20-21]。
全基因序列的克隆和序列结构分析是对基因进行功能分析的基础。目前,水产动物MHCⅡ基因的克隆与序列分析已有广泛报道,现已得到多种鱼类MHCⅡ类基因cDNA全长[22-24]。本研究使用Race技术首次克隆了洄游型刀鲚MHCⅡβ基因的cDNA全长,结果显示洄游型刀鲚MHCⅡβ基因全长917 bp,开放阅读框长度为765 bp,编码254个氨基酸。通过软件分析,预测了洄游型刀鲚MHCⅡβ基因编码蛋白的二级及三级结构(图2),显示刀鲚MHCⅡβ蛋白的三维模型具有两个不同的典型结构域,这与尼罗罗非鱼、长吻鮠(Leiocassis longirostris)、舌齿鲈等具有相似的模型结构[25-27],表明了刀鲚MHCⅡβ蛋白在抗原呈递性等功能上与其他鱼类MHCⅡβ蛋白的相似性。同源性分析和分子系统进化分析的结果显示,洄游型刀鲚MHCⅡβ氨基酸序列和同属于鲱形目的大西洋鲱(Clupea harengus)同源性最高,刀鲚与硬骨鱼类的同源性高于与哺乳类的同源性;在进化树上刀鲚与大西洋鲱相邻,并且与其他硬骨鱼类聚在一起,而与哺乳类处于不同的两枝,这与刀鲚的分类地位相符。
MHCⅡβ基因上的外源性抗原(如疾病和寄生虫)介导的选择可能会导致局部种群适应和种群分化,例如CRISPO等[28]对加拿大西部亚伯达省的3个吻鱥(Rhinichthys cataractae)种群的研究发现,尽管微卫星标记在不同的采样地间没有体现出种群结构化和距离隔离模式,但是发现了MHCⅡβ基因经受平衡选择的证据,因为这些种群中的MHCⅡβ基因的非同义突变相对于中性期望较高。并且,MHCⅡβ基因的平衡选择主要发生在同一河流的上下游之间而非不同河流之间,因此推测上下游种群平衡选择的差异可能是由不同的病原体群落驱动的,以使不同种群能够适应不同的环境条件。另外,MARTÍNEZ等[29]发现在洄游型和上游隔离的定居型虹鳟(Oncorhynchus mykiss)之间1个与MHCⅡ基因关联的微卫星位点上存在歧化选择。LARSON等[30]发现红大麻哈鱼(Oncorhynchus nerka)不同产卵生态类型间MHC的差异是中性标记的30倍,中性遗传结构较低、空间距离接近,表明不同产卵生态类型间的基因交流丰富,在这种情况下MHC高度的遗传分化可能是由强烈的选择压力保持的;并且发现MHC的分化水平不是随着地理范围的增大而增加,反而可能是由病原体群落或病原体毒性在精细的地理范围内的差异导致的。然而,寄生虫/病原体介导的选择并不是影响鱼类MHC多样性的唯一变量。SEIFERTOVÁ等[31]发现在欧洲圆鳍雅罗鱼(Squalius cephalus)中寄生虫介导的选择并不是影响其MHCⅡβ多样性的唯一变量,中性进化进程也是跨种群MHCⅡβ基因多样性的重要驱动力。
对于刀鲚而言,目前的研究已经表明,洄游型刀鲚在被陆封到太湖、巢湖、洪泽湖和骆马湖等4个不同的湖泊里之后形成了快速的、平行的淡水环境适应的基因组机制[32]。ZONG等[32]认为刀鲚染色体LG6和LG22上的两个染色体倒位区很可能与陆封型刀鲚的平行淡水适应有关,并且基因富集分析富集到的注释涉及多种生物过程,如渗透调节、免疫调节、生长成熟、运动等过程。其中注释到的关于免疫调解的基因是否与MHC基因的作用途径相关,洄游型与陆封型刀鲚之间MHCⅡβ基因是否具有遗传差异,以及是否经历过自然选择等问题,仍需要进一步的研究。

