光谱对小黄鱼胚胎在孵化、关键免疫因子水平及感光和节律基因表达的影响分析
李 沪,韩明明,詹 炜,刘 峰,谢庆平,徐万土,楼 宝
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江省农业科学院水生生物研究所,浙江杭州 310021;3.象山港湾苗种有限公司,浙江宁波 315799)
光谱除能够影响大多数鱼类的生长、发育、激素分泌、免疫等过程外[1-4],对胚胎畸形和孵化时长等方面同样具有物种特异性影响,如大菱鲆Scophthalmus maximus胚胎在蓝光下心跳比在其他光谱下提早半小时出现,并且绿光下初孵仔鱼的畸形比例明显高于其他光谱处理组[5]。大西洋鳙鲽Hippoglossus hippoglossus(Linnaeus,1758)胚胎在黑暗下2 d 之内完成出膜,在红光或橙光下将延长至4 d,在蓝光或者白光下需要的时间则更长[6]。在一些鱼类如大菱鲆、欧洲鳗鲡Anguilla anguilla中发现光谱组成对胚胎孵化率没有影响[5,7],但是在其他鱼类中是否同样如此尚不清楚。
胚胎自母源传递途径获得的免疫因子如IgM 和C3 对保护胚胎在孵化过程中抵抗外界水体病菌的入侵具有重要保护作用[8-9]。研究发现上述免疫因子除以蛋白形式外,还可以mRNA 的形式进行母源传递并在发育过程中进行转录和翻译[10]。TGF-βs(Transforming growth factor βs)在一系列免疫过程如T 细胞和B细胞分裂[11-12],淋巴细胞对高内皮微静脉细胞附着[13]及单核细胞内细胞因子翻译[14-15]中起抑制作用。在对虹鳟Oncorhynchus mykiss头肾巨噬细胞的研究中发现TGF-β1 与呼吸爆发有关[16]。Interleukin-1 是重要的促炎性细胞因子,通过上调或下调其他细胞因子来导致炎性反应发生[17],其中鱼类中IL-1β 主要在激活T细胞过程中发挥作用[18]。对于光谱是否影响胚胎发育过程中免疫因子的转录和翻译尚不得而知。除免疫因子外,生物节律调控相关基因同样自胚胎阶段开始表达,如斑马鱼Danio rerio胚胎中节律系统组成基因period1自受精第一天开始自主转录,但是其表达水平的节律变化需要随外界温度波动来调节,另外2 个节律调控相关基因clock1和bmal1的转录变化则需要光照:黑暗的周期转换来完成调整[19]。另外,前人研究认为温度和光照主要分别影响孵化时长和孵化率大小[20],但在光谱影响下节律调控关键基因的表达存在何种变化尚没有说明。
大多数鱼类胚胎因其视网膜尚未发育完善而不具备感光能力,此时脑部在介导外界光环境的过程中起重要作用[21]。黑视蛋白(melanopsin)是一种非视觉类视蛋白,具有感光特性[22-23]。研究已经发现该蛋白在鱼类大脑中具有分部位点多、表达形式多样的特点,如在鳙鲽的间脑、后脑、间-后脑间隙、视顶盖和松果体部位均发现opn4m1,opn4m3,opn4x1和opn4x2分布[24]。同样在斑马鱼胚胎脑部不同部位存在opn4xa,opn4a和opn4b表达[25]。目前普遍认为黑视蛋白能诱导哺乳动物由光引发的生物节律行为,如在小鼠中已经证明该蛋白与光引起的节律调控变化密切相关[26],在硬骨鱼类中如斑马鱼中同样发现该蛋白与“光动反应”和急性反应存在明确联系[27],在大西洋鳙鲽中同样发现该蛋白可能参与胚胎组织发育调控过程[28],在鱼类胚胎中黑视蛋白是否具有类似作用及作用模式尚不明确。
目前光谱对海水鱼类胚胎的影响研究主要集中在底栖的鲆鲽鱼类如大西洋庸鲽和大菱鲆中,而在中上层海水养殖鱼类中尚没有相关研究。小黄鱼Larimichthys polyactis是我国历史上“四大海产”之一,具有可观的养殖前景。与鲆鲽鱼类不同,该鱼主要生活在中上层海域[29]。为进一步揭示光谱影响鱼类胚胎发育的主要过程并揭示黑视蛋白和节律调控系统在响应外界光谱中的作用,笔者以小黄鱼为材料,通过对不同的光谱环境下胚胎孵化率、孵化时长、免疫水平等方面进行比较,并通过荧光定量表达技术对melanopsin和clock的表达进行相对定量来探索光谱影响鱼类胚胎孵化的主要过程机制,同时为实际生产中的光谱运用提供参考依据。
1 材料与方法
1.1 实验设计
实验由6 组不同光谱(红光,red:660~670 nm;蓝光,blue:455~465 nm;绿光,green:515~525 nm;白光,full:400~780 nm)及黑暗(dark)和自然光照(natural)组成,每组有3 个重复(n=3)(图1),不同光谱的特定波段由定制的LED 灯(无锡华兆泓光电科技有限公司,www.ledhzh.com)提供。不同光谱组之间用不透光的塑料纸隔开。每个养殖桶(h=1.50 m,d=0.80 m,水深:0.60 m)中放置一个孵化网兜(d=h=0.30 m),并且在网兜内布1 000 粒受精卵,受精卵由宁波象山港湾苗种有限公司提供。在养殖桶上方悬挂实验用灯并用遮光帘将灯和养殖桶遮盖,利用光谱仪(Everfine,PLA30)测量并调整LED 灯的旋钮使得每个养殖桶水面的光通量均为(1.76±0.04) μmol·m-2·s-1。实验水温为18±1 ℃,光照周期为24 L:0 D,盐度为24±0.5。

图1 不同光谱影响小黄鱼胚胎孵化实验现场设计Fig.1 The site design of embryo incubation of L.polyactis under different spectra
1.2 取样及处理
每2 h 从每个养殖桶里的孵化兜中随机取20 粒受精卵并在体视显微镜(莱卡,S9D,德国)下观察和拍照,直至孵化完成,并随后用液氮将所取的胚胎进行固定。孵化完成后统计各实验组的孵化率和孵化时长。分析各组在各取样点的发育时期,从而确定各组的发育进度。
免疫因子测定:按照试剂盒操作方法对液氮冻存的各组出膜前(51 hpf)胚胎(n=60 粒)中免疫因子(IgM、C3、TGF-β 和IL-1β)含量水平进行分析(默沙克,武汉)。
基因表达分析:
(1)RNA 提取:按照Trizol 方法进行,主要步骤如下:自液氮中取出液氮冻存的51 hpf 胚胎100 mg 置于1.50 mL 离心管中,加入1 mL Trizol 充分匀浆,室温静置5 min 后加入0.2 mL 氯仿,振荡15 s,室温静置15 min;4 ℃离心,12 000 r·min-1×15 min,取上清;加入等体积异丙醇,将管中液体轻轻颠倒混匀,室温静置10 min;4 ℃离心,12 000 r·min-1×15 min,弃上清;加入1 mL 75%乙醇,轻轻洗涤沉淀,4 ℃离心,12 000 r·min-1×15 min,弃上清并重复1 次;室温干燥,加入3~50 mL DNAsae/RNAsae Free H2O,溶解后得到样品RNA。通过1.2%琼脂糖凝胶电泳检测所提RNA 的质量,并利用微量分光光度计(Nanodrop 2 000,美国)测定RNA 样品的浓度。
(2)RNA 反转录:利用翌圣试剂盒(翌圣,中国,编号:11141ES60)完成,过程如下:①去除残留基因组DNA:配制混合液,其中5 g DNA digester Mix 3 μL,total RNA 1 μg,用RNase free H2O 补足至15 μL,用移液器轻轻吹打混匀。42 ℃孵育2 min。②往①的反应管中直接加入5 μL 4×HifairⅢSuperMix plus,用移液器轻轻吹打混匀。按照如下程序进行反转录:25 ℃,5 min;55 ℃,15 min;85 ℃,5 min。
(3)荧光定量PCR 实验:设计并委托相关试剂公司进行合成引物(表1),以actin 为内参基因,以自然光组为对照组,利用荧光定量PCR 技术对各组孵化后期(51 hpf)胚胎中的melanopsin和clock基因的相对表达水平进行检测和相对定量分析。该实验利用试剂盒(诺唯赞,中国,编号:Q411-03)完成并按以下程序进行:预变性:95 ℃,30 s;循环反应:95 ℃,10 s;60 ℃,30 s;40 个循环。

表1 荧光定量PCR 引物细节一览表Tab.1 The list of primer details for the relative real-time quantitative PCR
1.3 数据分析
利用Graphpad Prism 8 软件的“One-way ANOVA analysis”对不同实验组进行组间孵化率及相关基因表达的显著性差异分析,并完成图表制作。以P<0.05 为显著差异(*),P<0.01 为非常显著(**),P<0.001 为极其显著(***)。
2 实验结果
2.1 不同光谱下小黄鱼胚胎发育速度
对同一时间点下各组胚胎照片进行统计和比较,我们发现各光谱组间胚胎发育快慢有明显区别。经选取,以组间发育差异明显的13、24、29、40 和51 hpf 为关键点进行分析(图2 和表2)。
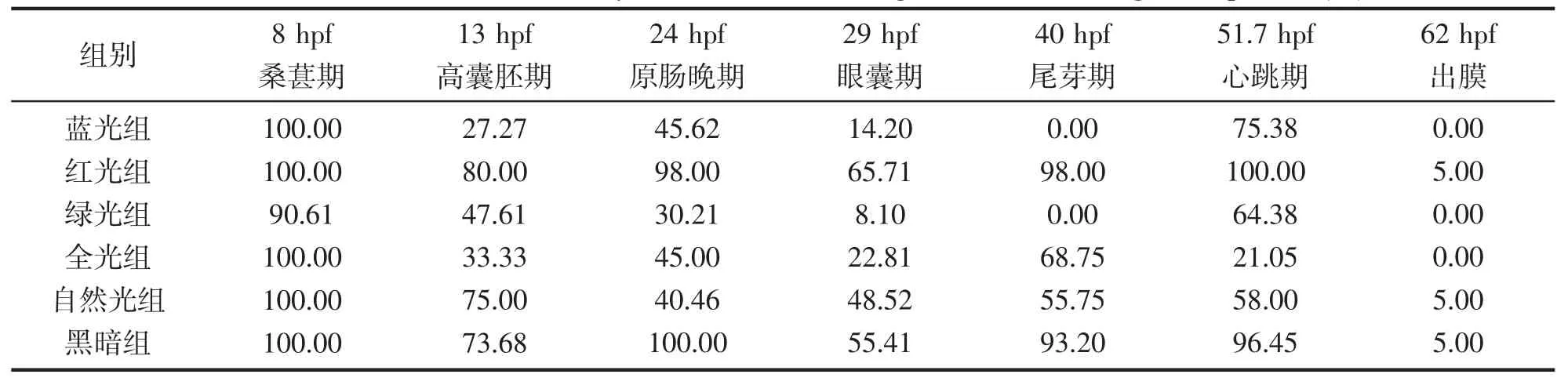
表2 在下列时间点各组胚胎处于当前发育阶段的百分率(%)Tab.2 The ration of the embryo at the current stage at the following time points (%)

图2 不同光谱组胚胎发育速度不同Fig.2 The embryonic development speed was different among the spectra groups
各组从13 hpf 已经可见明显的孵化速度差异,如此时红光组已有80% 胚胎进入高囊胚期,自然光组和黑暗组则分别有75.00%和73.68%的胚胎进入该发育阶段,而绿光组和蓝光组分别只有47.61%和27.27%的胚胎处于高囊胚期阶段。
24 hpf 时,红光组和黑暗组的几乎全部胚胎进入原肠晚期,而其他4 组进入该时期的胚胎不到50%。29~51 hpf 阶段内各组胚胎依次进入眼囊期、尾芽期和心跳期,此时组间胚胎发育进度差异逐渐明显,尤其在40 hpf 时,红光组和黑暗组胚胎已分别有98%和93.20%的胚胎进入尾芽阶段,同时进入该时期的自然光组和全光组胚胎所占比例分别为55.75%和68.75%,而蓝光组和绿光组尚没有胚胎进入该时期。从62 hpf 开始各组胚胎逐渐开始出膜,其中首次在红光组、黑暗组和全光组中观察到出膜仔鱼。
2.2 不同光谱组胚胎孵化率
实验发现各组小黄鱼胚胎在本实验条件下经过约62 h 开始出膜,但各组孵化率各不相同(图3)。孵化率方面,红光组胚胎孵化率最高,为49.56%,其他各组由高到低依次为黑暗组(38.66%)、全光组(31.46%)、自然光组(31.25%)、绿光组(30.72%)和蓝光组(29.58%)。显著性差异方面,除自然光组与全光组、全光组与绿光组、绿光组与蓝光组及自然光组与绿光组之间没有显著差异外,其他各组间均差异显著。
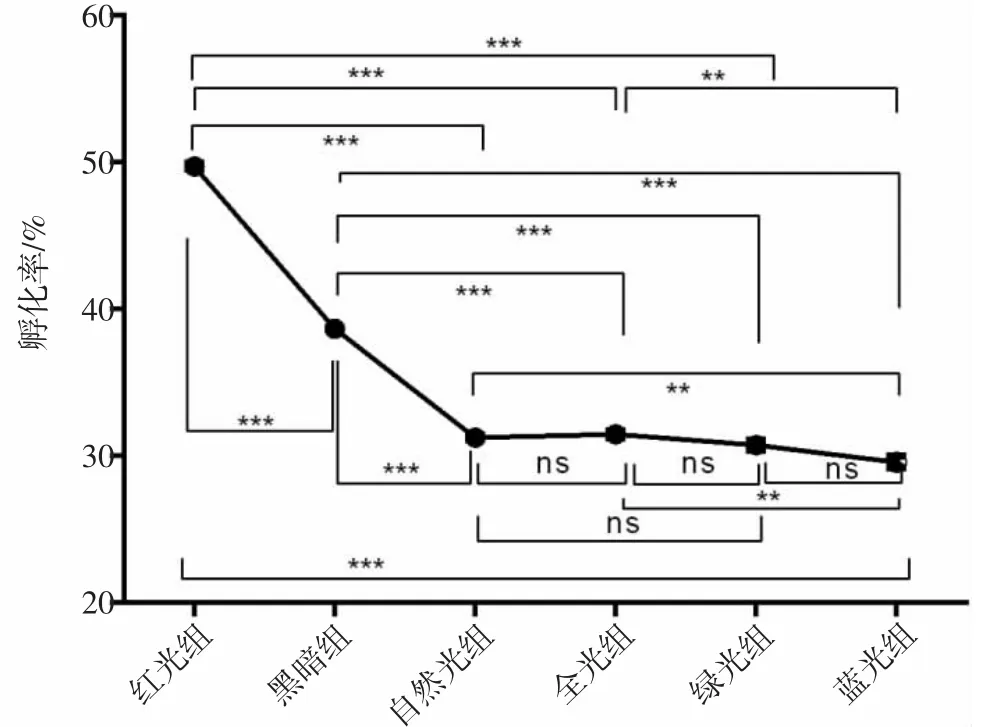
图3 不同光谱下小黄鱼胚胎孵化率不同Fig.3 The hatching rate was different when under different spectra
2.3 不同光谱下小黄鱼胚胎免疫水平
对出膜前(51 hpf)6 组胚胎中免疫球蛋白(IgM)、补体C3、转化生长因子TGF-β、白介素IL-1β 的含量水平进行测定,结果发现光谱对上述指标同样存在不同影响(图4)。其中红光组胚胎中IgM 含量水平显著高于其他组,其他各组从高到低依次为自然光组、绿光组、全光组和蓝光组。其中蓝光组与绿光组、全光组与绿光组、全光组与蓝光组之间差异不显著。自然光组、绿光组和全光组中的C3 水平高于黑暗组、蓝光组和红光组。TGF-β 和IL-1β 在不同实验组间同样存在显著差异,两者均在自然光组中含量最高,其次在蓝光组和绿光组中的含量也高于黑暗组和红光组。

图4 51hpf 时小黄鱼各组胚胎中IgM、C3、TGF-β 和IL-1β 的含量比较Fig.4 The comparison of the concentration of IgM,C3,TGF-β and IL-1β in the embryo of L.polyactis at 51 hpf
2.4 不同光谱影响下小黄鱼胚胎melanopsin 和clock 的表达水平
荧光定量real time-PCR 实验结果显示,黑视蛋白基因melanopsin及节律调控基因clock在不同实验组中的相对表达水平均存在显著性差异,其中melanopsin在蓝光组中表达水平最高,其余由高到低依次为全光组、绿光组、黑暗组和红光组(图5-A)。clock在红光组中表达水平最高,其余各组表达水平由高到低依次为全光组、黑暗组、绿光组和蓝光组(图5-B)。

图5 51 hpf 时不同光谱下小黄鱼胚胎中melanopsin 和clock 基因的相对表达情况Fig.5 The relative expression of melanopsin and clock in the embryo of L.polyactis at 51 hpf under different spectra
3 讨论
3.1 光谱能够影响小黄鱼胚胎孵化率、孵化时长
不同鱼类由于生活水层不同,其所处的光谱组成也不尽相同,在对环境长期适应的过程中其各自进化出适合自己的光谱感知系统及最适波长范围[30]。本实验发现,红光组胚胎孵化率和发育速度明显高于其他组,黑暗组胚胎孵化率和发育速度介于红光组和其他组(自然光组、全光组、绿光组和蓝光组)之间,蓝光组胚胎孵化率及发育速度均低于其他光谱组,说明红光能够加快小黄鱼胚胎发育及提高孵化率,而蓝光则对该过程具有抑制作用。自然光和全光是混合光,可能由于各光谱的复合效应而使得该两组胚胎的孵化率及发育速度在6 个实验组中居中。以往有观点认为鱼类胚胎的孵化时长或者进程快慢主要取决于温度,而孵化率的高低则主要取决于光照条件[20],我们的实验结果显示光谱环境除能影响孵化率外,对胚胎发育快慢同样具有显著差异影响,这一点在吴乐乐等[5]对光谱影响大菱鲆胚胎孵化的研究中同样得到证明。小黄鱼属于暖温性近底层鱼类,生活在水深不超过100 m 的海区[29],其产卵场主要在50 m 以内的浅海域[31],其受精卵为浮性卵,长波长的光线如红光因携带能量低只能穿透很浅的水域,并且极易在表层水域处发生反射和散射,而短波长的光线如蓝光因携带能量大能穿透到100 m 水深处甚至更多[32]。本实验中红光下胚胎孵化率最大,胚胎发育快于其他实验组,说明在长期对环境的适应过程中,小黄鱼胚胎在孵化过程中有可能进化出了区别于鲆鲽类的趋向以长波长的光为最适光谱的感知系统。
3.2 光谱能够影响小黄鱼胚胎免疫分子的转录和表达
母源传递现象存在于包括鱼类在内的许多物种中。鱼类通过该过程可以将营养和免疫成分传递到未受精卵中,后者通过和精子结合进而将这些营养和免疫组分传递到受精卵中。卵膜作为第一道免疫防线能够保护胚胎免受外界物理损伤和阻挡外界病原菌到达胚胎[33],除此之外,经母体传递来的免疫因子如IgM和C3 等构成了胚胎的第二道免疫防线[34-35]。研究已经证明母源传递来的补体系统能通过旁路途经(alternative pathway,AP)保护胚胎抵御外界病菌入侵[10,36-37]。与此同时免疫球蛋白IgM 可能起到调理素的作用,协助吞噬细胞进行吞噬作用[38]。本实验的另一个发现是光谱能影响胚胎内免疫因子如IgM 和C3 的转录和翻译水平。通过对不同实验组出膜前胚胎中的免疫因子含量进行检测,发现IgM、C3、TGF-β 和IL-1β 均存在表达,其含量水平由高到低依次为C3>IgM>IL-1β>TGF-β,并且光谱对上述免疫因子的含量具有显著差异影响。以IgM 和C3 为例,IgM 在红光组胚胎中含量水平最高,在黑暗组中最低,其他实验组中IgM 的表达水平介于上述两组之间。C3 在自然光组和绿光组中的含量水平远高于其他实验组。通常,C3 在急性反应(acute phase response)中水平会升高[39],由此我们推测这两组光谱环境不适用于胚胎孵化并在出膜过程对胚胎产生胁迫效应,从而使得胚胎中C3 水平远高于其他组。尽管蓝光同样对孵化有抑制作用,但是该组中C3 含量水平却低于上述3 组,其中原因还不明确。实验中小黄鱼胚胎来自相同亲鱼的同一批受精卵,孵化过程中除外界光谱环境不同外,其他环境条件如孵化温度、光照周期和水质等因素都相同,这说明各组间胚胎中免疫水平存在差异主要由光谱环境影响了它们的转录和翻译过程导致的。
TGF-β 与IL-1β 与炎性反应(inflammatory responses)有关,前者主要是通过抑制作用来防止炎性反应对宿主自身的伤害,而后者主要通过激活T 细胞来激活炎性反应[11-16]。我们的实验结果显示上述两者均在自然光组中的水平最高,而在其他组中存在不同的变化趋势,这说明不同的光谱组成对TGF-β 与IL-1β这两类免疫因子的转录和翻译影响不同。但是进一步比较发现,IL-1β 在不同组中的变化趋势与C3 基本一致,这或许与它们在免疫过程中的作用是一致的。TGF-β 与上述两种免疫因子不同,结合其具有抑制免疫效应的特点,并且除黑暗组和红光组外,在其他组中的含量都较高,我们猜测除其他光谱环境因对胚胎的孵化产生不利的胁迫作用,进而激发并使得胚胎内TGF-β 的含量水平升高。
3.3 光谱能够影响小黄鱼胚胎的节律调控
胚胎发育节律调控过程具有物种特异性,如在斑马鱼胚胎中,生物钟关键基因period1自受精卵发育第一天开始就可以在无光存在的情况下进行表达,并且其表达的节律波动随外界温度变化而发生。与period1不同,clock1和bmal1的节律性转录则需要光照-黑暗的周期变化来诱导产生[19]。本实验中,相比较其他实验组,黑暗条件下胚胎中节律调控基因clock依然存在表达,这说明在小黄鱼胚胎中该基因可以不依赖光照-黑暗周期变化而表达。并且黑暗组胚胎中该基因只与在红光组中的表达水平有显著差异,与其他光谱组无差异,说明小黄鱼中该基因的表达水平高低受外界光谱环境影响,其中长波长的红光能够促进其表达。
黑视蛋白(melanopsin)在由外界光谱引发的自身节律调整过程中起重要的光子感知、能量转化的作用。该蛋白是一类广泛存在于脊椎动物中的具有7 个跨膜结构的G 蛋白结合受体[40],以11-顺视黄醛为感光基团,当吸收外界光子后,蛋白结构由顺式变为反式[41],并通过与Gq/11类G 蛋白结合激活磷脂酶C(phospholipase C,PLC)[42],后者进一步水解磷脂酰肌醇(PIP2)产生二酰基甘油(DAG)和三磷酸肌醇(IP3)[43-44],随后引发膜外Ca2+经过TRP 离子通道进入胞内,使得膜电位发生去极化并激活电压门离子通道(voltage-operated calcium vhannel,VOCC)[45-47]。黑视蛋白对短波长的蓝色光具有光敏性,其表达水平随外界光谱环境而变化,并且与节律调控之间存在密切联系。如热带鱼视网膜上合成的褪黑素和黑视蛋白表达水平因外界光谱环境不同而变化[48-49]。靳二辉等[50]在研究单色光对肉鸡松果体黑视蛋白表达的影响时,发现该蛋白的表达水平在蓝光、白光、绿光、红光组中依次降低。该蛋白在硬骨鱼类如大西洋庸鲽鱼眼部视网膜和脑部广泛存在,并且在胚胎后期脑部已经存在表达[20]。我们的实验结果与之相似,发现蓝光组melanopsin表达水平最高,而其clock表达水平最低,红光组则与之相反。结合两组胚胎的孵化情况,我们推测红光通过提高胚胎中clock的表达,促进了胚胎发育的节律调控过程,进而产生了提高孵化率、缩短孵化时长和提高免疫水平的最终孵化效应。
通过本研究得出以下结论:光谱对小黄鱼胚胎在孵化率、孵化时长、主要的免疫因子的表达及节律调控均具有显著影响,其中红光下小黄鱼胚胎孵化率最高,完成最快,而且IgM 的含量水平最高。蓝光不利于小黄鱼胚胎孵化,其他光谱组成对胚胎孵化的影响介于红光和蓝光之间。自2015 年首次实现小黄鱼人工繁育和养殖以来,其胚胎孵化率和仔鱼存活率逐年上升,但胚胎的孵化率仍然较低,在一定程度上影响了小黄鱼养殖产业的进一步推广。目前在生产中依旧采用自然光或节能灯照明,本研究从理论上验证了采用光谱调控对小黄鱼胚胎孵化的重要促进作用,对在生产中推广新型的光谱调控应用具有一定的参考意义。

