基于杂化纳米花、试纸条的大肠杆菌检测方法的建立及评价
马丽,卜胜君,张文广,万家余,陈志宝
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.军事科学院军事医学研究院军事兽医研究所;3.广东海洋大学滨海农业学院)
大肠杆菌(E.coli)是食源性疾病相关的主要食源性致病菌之一。属于革兰氏阴性菌,杆状、无芽孢、兼性厌氧[1]。大肠杆菌的菌株多数是无害的,但一些血清型(如:大肠杆菌O157)可引起宿主的严重性血性腹泻、溶血性尿毒症、低血小板症等疾病[2-5]。世界上大约有近十分之一的人因食用受污染的食物而患病,每年导致42 万人死亡[6]。能够对其进行早期临床诊断,可以有效减少其带来的危害。目前对病原菌的检测方法有传统方法及现代检测方法。通过微生物学方法检测细菌的传统方法[7],包括预富集、选择性富集、生化筛选,血清学确认和毒素检测耗时(结果和确认需要2~6 d),费力,结果不清晰[8-10]。平板培养法、聚合酶链式反应(PCR)和酶联免疫吸附试验(ELISA)是目前常用的大肠杆菌O157 的检测方法[11-12]。要求严格的操作程序且检测时间长,特定的检测仪器,耗时长,特异性差[12-14]等检测问题的存在。所以开发和建立快速、选择性、敏感、简单、准确、易于使用的检测方法具有非常重大的意义。
近年,生物传感器已经成为一种现代的检测方法,该检测方法具有检测限低,操作简便,价格便宜,提供实时测量,多目标测试,可携带性,小型化和快速检测等优点。已开发的传感器有电化学生物传感器[15-16]、比色生物传感器[17-18]等。在不同类型的传感器中,比色生物传感器由于其简单性和敏感性及肉眼可识别性。用于病原微生物以及小分子疾病标记物的快速检测[19]。 2006 年由Qian 等[20]首次提出一种为金-铂双金属纳米球状结构,形状似花的纳米结构。其大小通常在几百纳米到几微米不等。研究发现,通过将其包裹不同成分及不同的标记物,以达到检测不同靶标的目的。常见为磷酸铜或硫酸钙蛋白纳米花[21-22]。由于其非常高的比表面积,纳米花的信号放大作用极大,被用在生物检测领域中[23]。
基于此开发一种有机无机杂化纳米材料比色生物传感器,通过比色传感器肉眼可见的显色方法对大肠杆菌O157 进行检测,该纳米花通过“一锅法”在常温下合成、无需有机溶剂,与其他杂化纳米传感器材料[24-25]相比,无需变温及复杂仪器等特殊条件。该纳米花传感器使用可以特异性识别大肠杆菌O157的抗体及可与细菌表面碳水化合物特异性反应的伴刀豆蛋白(Con A)作为生物传感器的识别元件。纳米花中的GOx 作为信号输出元件,催化β-D-葡萄糖生成葡萄糖酸及过氧化氢(H2O2),通过过氧化氢试纸条显色的变化,实现对靶标的检测。该检测方法不需特殊仪器,通过“一步法”进行实验,避免了复杂的检测步骤,大大缩短了试验时间,为在食品安全、临床诊断和环境监测领域提供病原菌检测的新的参考策略。
1 材料与方法
1.1 材料
1.1.1 试验材料
研究所应用到的食源性致病菌菌株,包括大肠杆菌O157(CICC 21530),大肠杆菌(CICC 10389),鼠伤寒沙门氏菌(CCICC 21482),金黄色葡萄球菌(CICC 21600)和单核细胞增生李斯特菌(CICC 21529),副溶血性弧菌(CICC 21617)均由中国工业微生物菌种保藏管理中心提供,由军事科学院军事医学院军事兽医研究所长期保存。磁珠-大肠杆菌O157 抗体购自美国赛默飞世尔有限公司,过氧化氢试纸条购自于德国默克有限公司,伴刀豆蛋白A(Con A)及葡萄糖氧化酶(GOx)购自于上海西格玛贸易有限公司,β-D-葡萄糖购自于上海麦克林生化科技有限公司。
1.1.2 试剂
洗涤缓冲液1 mM PBS(1 mmol·L-1磷酸二氢钠(NaH2PO4)、1 mmol·L-1磷酸氢二钠(Na2HPO4))。pH值使用氢氧化钠(NaOH)及盐酸(HCl)进行调节,用0.22 μm 滤膜过滤溶液,保存于4 ℃冰箱待用。所用金属盐类化学试剂均购自北京化工厂,纯度均为分析纯。试验用水由长春市莱博帕特科技发展有限公司(型号:LAB-DI-10)纯水仪处理的超纯水。
1.1.3 仪器
常温高速离心机(型号:D3024)购自于无锡德凡仪器有限公司,OPPO Reno 5 Pro 智能手机购自于OPPO 广东移动通讯有限公司,生化培养箱(型号:HPS-250 购自于哈尔滨东明科技有限公司。核酸蛋白分析仪(型号:SmartSpec Plus)购自于美国伯乐公司。
1.2 方法
1.2.1 原理
研究采用简单的“一锅法”室温条件下将伴刀豆球蛋白A(Con A)、葡萄糖氧化酶(GOx)及Ca2+离子在PBS 溶液混合,合成了Con A-葡萄糖氧化酶-Ca2(PO4)3纳米花(CGC)。Ca2+作为无机骨架可以固定Con A 和氧化酶,并且Ca2+离子与氧化酶共存产生协同增效作用,可以增强氧化酶催化活性这得益于Ca2+离子辅助的α-淀粉酶的变构效应[26]。Con A 对大肠杆菌表面O-抗原具有很高的结合亲和力。葡萄糖氧化酶作为信号放大元件,可以将β-D-葡萄糖催化为葡萄糖酸及H2O2。将含有大肠杆菌O157 特异性抗体的磁珠、大肠杆菌O157 及纳米花(CGC)采用“一步法”形成“抗体-靶标-纳米花”三明治夹心结构。在存在靶标时,加入β-D-葡萄糖后GOx 可以将H2O2试纸条氧化成蓝色,用智能手机记录信号,ImageJ 软件结果分析;反之当没有靶标时,无夹心结构,GOx 无法将β-D-葡萄糖氧化,H2O2试纸条无颜色变化。因此,通过建立大肠杆菌O157 与H2O2试纸条颜色变化的相关性,对大肠杆菌O157 的浓度进行灵敏性分析。原理图如图1 所示。

图1 原理图Fig.1 Schematic diagram
1.2.2 Con A-葡萄糖氧化酶-Ca2(PO4)3纳米花(CGC)的合成
(1)在1.5 mL PCR 管中依次加入780 μL 10 mM PBS 缓冲溶液、0.1 mg Con A、0.1 mg 葡萄糖氧化酶(GOx)及20 μL 200 mM 氯化钙(CaCl2)溶液,立即振荡混匀,并静置于室温下16 h,产生白色絮状沉淀物。
(2)将步骤(1)中的混合溶液在25 ℃,10 000 rpm,离心5 min 后,去除上清液,加入1 mL 1 mM PBS 缓冲溶液洗涤、离心两次。最后,加入100 μL 1 mM PBS 缓冲液制成Con A-葡萄糖氧化酶-Ca2(PO4)3纳米花悬浮液,保存于4 ℃冰箱里,待用。
1.2.3 具体试验步骤
(1)大肠杆菌O157 抗体磁珠预处理:试验前将抗体磁珠用等体积1 mM PBS 缓冲溶液洗涤三次,用等体积缓冲溶液悬浮备用。
(2)将3 μL 磁珠、50 μL 大肠杆菌O157 及6 μL纳米花(CGC)加入200 μL PCR 管中,37 ℃下孵育50 min,形成“抗体-靶标-纳米花”结合的“夹心结构”复合物。用50 μL 1 mM PBS 缓冲溶液洗涤三次,备用。
(3)将10 μL 40 mM β-D-葡萄糖加入到步骤(2)复合物中,移液枪混匀后,用磁珠分离器将磁珠吸附,吸取上清溶液滴加在H2O2试纸条上,反应30 s后立即用智能手机拍摄信号,用ImageJ 软件结果分析。
1.2.4 试验条件优化
首先,试验中“抗体-靶标-纳米花”的孵育时间直接影响着“夹心结构”复合物中葡萄糖氧化酶的量,所以优先对孵育时间进行对优化;其次,“夹心结构”复合物的孵育温度及洗涤缓冲溶液的pH 值对复合物体系中三者结合的效率有很大影响,所以对孵育温度及洗涤缓冲溶液的pH 值进行进一步优化;最后,β-D-葡萄糖的量影响复合物中葡萄糖氧化酶将其催化为葡萄糖酸的量,对试纸条的显色信号具有影响作用,所以对β-D-葡萄糖的加入量进行优化。试验条件优化步骤按照1.2.3 具体试验步骤进行优化,根据葡萄糖诱导H2O2试纸条的比色强度%,优化条件选择比色强度%最大时为最佳条件,计算如下:比色强度%=[(In阳性-In阴性)/In阳性]×100%,选择结果数据均进行3 次重复。
1.2.5 灵敏度分析
在所优化的最佳试验条件下,进行研究的灵敏度分析,用核酸蛋白分析仪计算菌液浓度,以梯度稀释法依次稀释到10、102、103、104、105、106、107CFU·mL-1,待用。对检测方法的灵敏度进行分析,确定线性方程及检测范围,检出靶标最低检测限。结果数据均进行3 次重复。
1.2.6 特异性分析
分别使用107CFU·mL-1的大肠杆菌O157、大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌及副溶血性弧菌,进行基于形成“抗体-靶标-纳米花”结合的“夹心结构”复合物,以探究检测方法的特异性。结果数据均进行3 次重复。
1.2.7 实际样品检测
在脱脂奶粉中加入大肠杆菌O157 以分别达到104、105、106CFU·mL-1。对牛奶样品进行形成“抗体-靶标-纳米花”结合的“夹心结构”复合物,以探究检测方法的回收率。结果数据均进行3 次重复。
2 结果与分析
2.1 试验条件优化
为探究最佳试验条件,分别对孵育时间、孵育温度、洗涤缓冲液pH 值以及β-D-葡萄糖进行了优化,结果如下:
2.1.1 “抗体-靶标-纳米花”孵育时间优化
在孵育时间分别为20、30、40、50 及60 min 情况下,按照具体实验步骤进行优化,分析如图2 可以得出随着孵育时间的增加H2O2试纸条的比色强度%也随之增加,当孵育时间达到50 min 时比色强度%达到最大值且趋于稳定。所以选择50 min 作为最佳孵育时间。
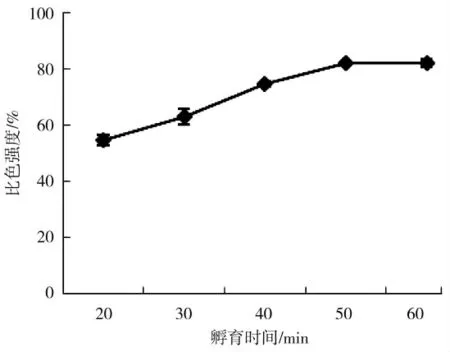
图2 孵育时间的优化Fig.2 Optimization of incubation time
2.1.2 “抗体-靶标-纳米花”孵育温度优化
选择4、25、37 及55 ℃进行优化,分析如图3 可以得出随着孵育时间温度的增加H2O2试纸条的比色强度%先增加后减小,当孵育温度达到37 ℃时比色强度%达到最大值,从结果可以看出孵育温度过高(过低)都会影响抗体、靶标和纳米花三者的结合效率,对比色强度%有影响。所以选择37 ℃作为最佳孵育温度。
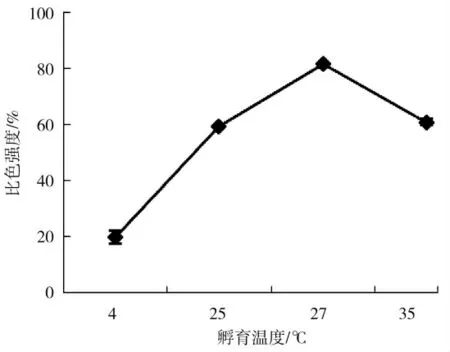
图3 孵育温度的优化Fig.3 Optimization of incubation temperature
2.1.3 洗涤缓冲溶液的pH 值优化
选择pH 值为4.5、5.5、6.5、7.5 及8.5,按照具体实验步骤进行优化,分析如图4 可以得出随着洗涤缓冲溶液的pH 值的增加H2O2试纸条的比色强度%先增加后减小,当洗涤缓冲溶液的pH 值达到7.5 时比色强度%为最大值,从结果可以看出洗涤缓冲溶液pH 值过高(过低)都会影响“夹心结构”复合物的结合效率,对比色强度%有影响。选择最佳洗涤缓冲溶液的pH 值为7.5。

图4 洗涤缓冲溶液pH 的优化Fig.4 Optimization of the pH of the washing buffer solution
2.1.4 β-D-葡萄糖加入量优化
选择10、20、30、40、50 及60 mM 的β-D-葡萄糖,按照具体步骤进行优化。分析如图5 可以得出随着β-D-葡萄糖加入量的增加H2O2试纸条的比色强度%也随之增加,当孵育时间达到40 mM 时比色强度%达到最大值且趋于稳定。所以选择40 mM 作为最佳β-D-葡萄糖加入量。

图5 β-D-葡萄糖用量优化Fig.5 β-D-glucose optimization
2.2 灵敏度分析
基于最佳反应时间为50 min、孵育温度为37 ℃、洗涤缓冲溶液pH 为7.5 的条件下用于定量检测大肠杆菌O157 的浓度。如图6-A 所示,随着加入浓度梯度的增加,H2O2试纸条颜色逐渐加深。H2O2试纸条的比色强度%随大肠杆菌O157 浓度的增加而增加(图6-B),且在10~106CFU·mL-1具有良好的线性关系(图6-C),线性方程为Y=11.22 X+20.69(其中Y代表比色强度%,X 代表大肠杆菌O157 的浓度),相关系数R2可达0.987 8。
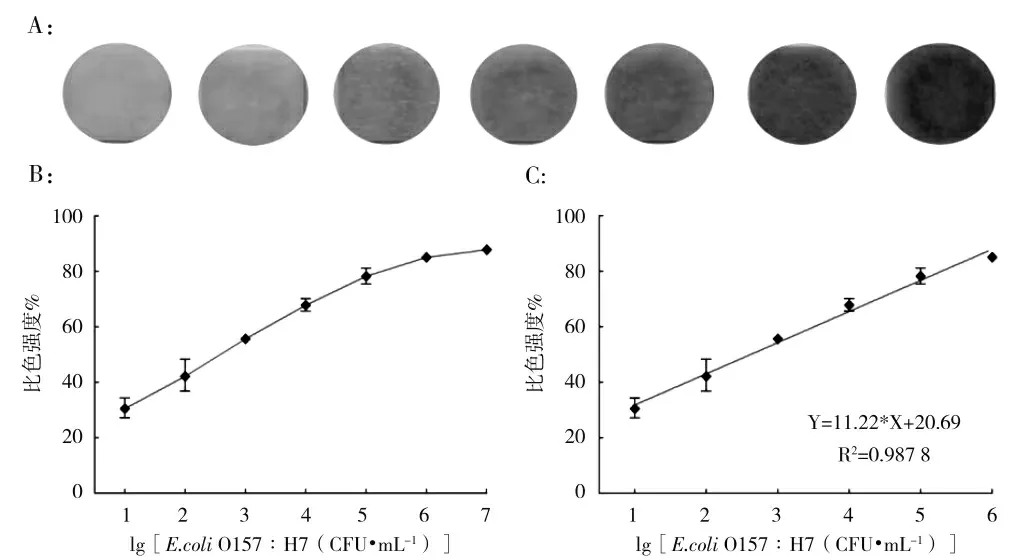
图6 (A)H2O2 试纸条灵敏度显色;(B)大肠杆菌O157 浓度从10~107 CFU·mL-1 与比色强度%;(C)大肠杆菌O157 与比色强度%的线性关系分析图Fig.6 (A)Sensitivity color development of H2O2 test strip;(B)E.coli O157 concentration from 10~107 CFU·mL-1 and colorimetric intensity%;(C)Linear relationship between E.coli O157 and colorimetric intensity%
2.3 特异性分析
方法选择与靶标菌同是革兰氏阴性菌的大肠杆菌(E.coli)、鼠伤寒沙门氏菌(Sal.t)和副溶血性弧菌(Vibiro.p)及革兰氏阳性菌的金黄色葡萄球菌(S.aur)和单核细胞增生李斯特菌(List.m)作为对照菌进行特异性分析,对照菌均为常见的食源性病原菌,常与靶标菌共存于受污染的食品中。其中从图7 中可以看出,对照菌株E.coli、鼠伤Sal.t、S.aur 和List.m 及Vibiro.p 显示的H2O2试纸条的比色强度%平均低于20%,低于靶标菌最低检测限的比色强度%。而靶标大肠杆菌O157 的H2O2试纸条的比色强度%非常高,从这些数据可以看出,研究策略对病原性大肠杆菌O157 具有良好的特异性。

图7 本方法特异性Fig.7 Specificity of this method
2.4 实际样品检测
评估该检测方法在实际样品检测中的应用效果,使用脱脂奶粉样品进行了回收实验,样品添加了密度为104、105和106CFU·mL-1的大肠杆菌O157。方法的回收率从93±0.71%到102±1.31%(表1)。根据我国GBT 27404-2008 实验室质量控制规范食品理化检测附录中对加标样品回收率规定加表样品回收率范围在80%~110%之间[27],回收结果表明该检测方法可为初步的实际应用提供可行和可靠的病原细菌测量。
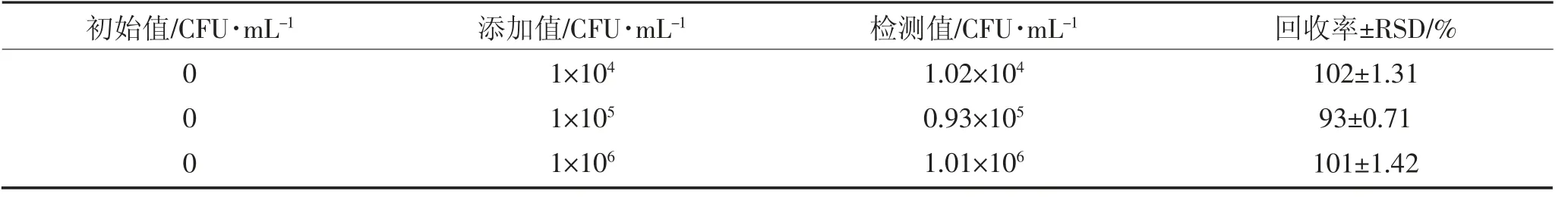
表1 脱脂奶粉样品中大肠杆菌O157 的检测Table 1 Detection of E.coli O157 in skimmed milk powder samples
2.5 试验方法对比
为了评估该方法的性能,查阅相关文献检测方法,与此试验进行性能对比(表2),发现与其他检测方法相比,此方法具有检测线性范围广、灵敏度高、操作步骤简单且无需大型昂贵实验仪器。

表2 不同的大肠杆菌O157∶H7 检测方法的性能比较Table 2 Performance comparison of different E.coli O157∶H7 detection methods
3 讨论
食源性致病菌污染给人类健康和社会造成巨大的经济负担,急需灵敏而有效的检测方法对早期诊断病原细菌进行检测。传统的检测方法操作繁琐、耗时久、结果不明确。因此,需要开发低成本、方便、快速和灵敏的检测方法。研究方法成功建立了一种Con A-葡萄糖氧化酶-Ca2(PO4)3纳米花(CGC)并将其运用于大肠杆菌O157 的检测;在实际样品检测中获得了良好的灵敏性能。与王月等[32]以病原菌DNA为模板,通过PCR 技术和DNA 酶的介导的核酸横流生物传感器对病原菌检测方法将比,此方法不需要对病原菌的核酸进行提取,使步骤更加简便,避免核酸提取中的污染。但此方法作为商业化策略或用于实际检测中还有一定局限性。首先,对于合成纳米复合材料的稳定性、存储条件需要进一步研究;其次,需要对此检测方法的稳定性及灵敏度进一步优化,使此方法在更多实际样品检测中仍具有准确行;最后,需要将检测方法与国际检测标准进行进一步比较。为临床诊断因病原致病菌导致疾病的常规诊断、快速检测方法提供很大的潜能。
4 结论
检测方法通过“一锅法”合成了Con A-葡萄糖氧化酶-Ca2(PO4)3纳米花(CGC),将其作为大肠杆菌O157 的识别生物分子,用“一步法”将使抗体-靶标-纳米花三者形成三明治夹心结构,用于检测大肠杆菌O157。Con A 作为识别元件与大肠杆菌O157 细胞膜识别结合;纳米花中的葡萄糖氧化酶由于Ca2+离子的作用具有增强的活性和稳定性,催化β-D-葡萄糖转化为葡萄糖酸及H2O2,H2O2试纸条比色度变化强度作为信号输出端。结果表明,基于CGC 对大肠杆菌O157 的夹心测定法实现对靶标菌10 CFU·mL-1的灵敏度。检测范围在10~106CFU·mL-1有良好线性关系。回收率在93%~102% 之间,符合国家回收率标准。表明此检测方法具有较高的准确性,且在其他病原菌或临床诊断的检测中具有巨大应用潜力。

