基于Planteye F500 三维定量研究盐碱胁迫对大豆幼苗生长的影响
赵强,陈素玉,王广达,杜艳丽,杜吉到,2
(1.黑龙江八一农垦大学,大庆 163319;2.黑龙江省盐碱地改良工程技术研究中心)
盐碱胁迫是自然界中广泛存在的一种非生物胁迫,严重影响作物的生长发育和产量的形成。世界范围内大约4.15×108hm2的土地呈现渍化,已经成为制约全球作物布局和生产的主要因素[1]。我国盐碱化的耕地面积约为760 万hm2,占全国可利用土地总面积的4.88%[2]。黑龙江省土壤盐碱化问题严重,全省盐碱化土壤面积已超过200 万hm2,盐碱化耕地面积超过30 万hm2,且近年来有逐年增加的趋势[3]。自然界中的盐碱土通常包含中性盐和碱性盐,导致土壤溶液呈现高盐度和高酸碱度(PH 值≥8)的特点,影响植物的生长发育[4]。盐碱胁迫导致的渗透胁迫会影响植物的形态特征和生理进程,例如影响相对生长率、水分供给、蒸腾速率、水分利用效率、养分吸收能力、气孔导度、光合作用效率、产量构成因素及产量的形成[5-6]。而在长期的盐碱胁迫下,植物体内Na+和Cl-的大量累积会对细胞产生离子毒害作用,导致细胞代谢和生理进程的紊乱[4]。盐碱胁迫对植物最直观的影响表现为抑制种子萌发[7-8]、抑制光合作用[9]、阻碍植株生长等[10],这些影响在植物生长的不同时期表现有所差异[11],不同植物种类也会对盐碱胁迫表现出不同的敏感性[12-13]。因此,明确盐碱胁迫对植物的生长影响,培育耐盐碱品种,研发提高植物耐盐碱能力的调控措施,对提高农业生产力意义重大。
通常来讲,盐碱等非生物胁迫对植物的最直观的影响是改变植株的形态特征。由于植物的形态特征同时受到基因型和环境因素的影响,因此,植物形态特征的改变可以直观地反映出不同植株对胁迫的反应和耐受性差异。在生理指标检测和分子标记等技术被广泛应用之前,人们就开始根据植物的形态特征对作物的品种进行定向的选择、培育和改良工作。通常情况下,植物可测量的形态指标包括株高、茎粗、叶片形态(包括叶片面积、数量、叶面倾角、结构、分布等)、植株形态(包括倒伏、分蘖、形态、抗病虫害、抗旱等)、根形态(包括根系体积、表面积、长度、直径、根尖数量等)、果实特征(包括果实大小、形状、数量、颜色等)等。然而,由于植物形态特征指标的种类复杂性、受环境影响的多变性、生育周期全程动态性和统计分析的复杂性,导致植物的形态学研究滞后于基因型研究。
近年来,随着光学成像传感器技术的发展,自动化植物表型测试和分析技术被广泛的应用于植物形态指标检测,从而诞生了“前景光明(aspiring)”的表型组学[14]。植物表型分析技术能够在不破坏植物生长状态的情况下,高通量、高效率、高精度、低误差的收集植物的表型数据,并通过对数据的综合定量分析,形成不同条件下的植物表型组数据,并可以实时监测植物的形态和生理性状指标的变化[15]。通过将表型组与基因组、代谢组、生理指标等数据进行关联分析,定量的反映出植物生长、产量和适应性等生物学信息与环境变化和非生物胁迫等自然因素之间的复杂相关性,为分析逆境胁迫对植物的影响、建立植物生长模型和作物新品种的选育提供参考依据[16-17]。大豆是我国重要的粮油兼用作物,是人类主要的植物性蛋白和油脂的主要来源,对盐碱胁迫非常敏感。关于盐碱胁迫对大豆种子萌发、植株形态、叶片光合及产量性状的影响研究已有相关报道[18-21],但少有结合形态指标和光谱数据定量分析盐碱胁迫对大豆生长影响的研究。
研究利用植物表型分析系统Planteye F500,对盐碱胁迫下不同品种的大豆幼苗植株进行多光谱三维扫描,同步测定植株的形态指标和光谱特征参数,定量分析盐碱胁迫对大豆幼苗植株的生长影响,为表型组学在大豆抗盐碱栽培措施改良和耐盐碱大豆品种选育等研究上的应用提供依据。
1 材料和方法
1.1 材料的培养
大豆品种黑河49(HH49,盐碱不敏感大豆品种)和合农95(HN95,盐碱敏感大豆品种)的种子由黑龙江八一农垦大学农学院豆类作物抗逆高产技术创新栽培团队提供。试验于2021 年7 月15 日,在国家杂粮工程技术中心(黑龙江省,大庆市,E125°17',N45°59')盆栽场地内进行。挑选大小均一、饱满、无病斑、无虫斑的大豆种子,分别播种于盛有正常土(CK,PH=7.4)和盐碱土(SA,混有25 mM NaCl、25 mM NaSO4、12.5 mM Na2CO3和12.5 mM NaHCO3,PH=9.5)的塑料盆中(上口径18 cm,下口径12.5 cm,高15 cm),每盆播入大豆种子6 粒。待大豆植株真叶展开后,挑选长势均匀一致的大豆幼苗进行定苗,每盆保留大豆幼苗2 棵。在大豆植株的第三叶期(V3)进行表型测定,每个处理重复5 次。
1.2 大豆幼苗形态指标扫描测定
使用植物激光三维表型仪Planteye F500(Phenospex,瑞士)对大豆植株幼苗进行扫描,以测量和收集植物的表型数据。PlantEye F500 扫描仪可收集植物在蓝光波段(RBlue,峰值波长460~485 nm)、绿光波段(RGreen,峰值波长530~540 nm)、红光波段(RRed,峰值波长620~645 nm)、近红外波段(RNIR,峰值波长820~850 nm)和3D 激光(940 nm)的光谱反射率。仪器的参数设置如下:Z 轴长(扫描仪底部向下测量的距离)= 70 cm,分辨率<0.1 mm;Y 轴分辨率(Vscan=50 mm·s-1)=1 mm;X 轴分辨率=0.19 mm。利用Phena 软件(Phenospex,荷兰)建立植物的三维模型,并使用HortControl 软件(Phenospex,荷兰)计算植物相关形态指标。测量内容包括植株的数字生物量、数字株高、叶片角度、叶片投影面积、叶片倾斜度和光穿透度。
1.3 大豆幼苗植株光谱参数测定
利用植物激光三维表型仪测定植株的色调值(hue),建立植株的3D 模型,并根据不同波长的光谱反射率数据计算植株的光谱参数,计算公式如下:
绿 度 指 数(Greenness index,GI)=(2 ×RGreen-RRed-RBlue)/(RGreen+RRed+RBlue);
归一化植被指数(Normalized difference vegetation index,NDVI)=(RNIR-RRed)/(RNIR+RRed)。
1.4 大豆幼苗生物量的测定
从大豆幼苗植株的子叶节位置将地上部分剪下,使用直尺测量其实际株高;使用游标卡尺测量其茎粗;使用万分之一天平测量地上部分鲜重。使用自来水洗净植株根系上附着的泥土,并用吸水纸吸干根系表面的水分,测量其鲜重。将植株地上部分和根系样品分别装入牛皮纸信封中,置于105 ℃烘箱内烘干30 min 后,于80 ℃烘干至恒重,测量其干重。
1.5 数据分析与作图
利用SPSS Statistics 26.0 软件进行数据的处理。使用SigmaPlot 12.5 软件绘图。
2 结果与分析
2.1 盐碱胁迫对大豆幼苗植株生长的影响
图1 表示的是使用正常土和盐碱土种植大豆时幼苗植株的生长状态。从图1 中可以看出,与对照组相比较,盐碱胁迫能够抑制黑河49(HH49,盐碱不敏感大豆品种)和合农95(HN95,盐碱敏感大豆品种)植株的生长。对大豆品种HH49 和HH59 的植株进行生物量测定,结果如表1 所示。与对照组相比较,盐碱胁迫显著(P<0.05)抑制了两个大豆品种幼苗株的株高、茎粗、地上干/鲜重和根系的干/鲜重。同时,盐碱胁迫下,HN59 植株的各项生物量指标的下降幅度均高于HH49。以上结果表明,HH49 对盐碱胁迫的耐受性高于HN59。

图1 盐碱胁迫下大豆幼苗植株的生长状态Fig.1 Growth status of soybean seedlings under saline-alkali stress

表1 盐碱胁迫对大豆幼苗植株生物量积累的影响Table 1 Effects of saline-alkali stress on biomass accumulation of soybean seedlings
2.2 盐碱胁迫对大豆幼苗形态指标的影响
为了定量分析盐碱胁迫下大豆幼苗植株的形态变化,采用多光谱扫描仪建立植株的3D 模型,计算植物的形态指标,结果如图2 所示。与对照相比较,盐碱胁迫显著的降低了两个大豆品种幼苗植株的数字生物量、株高、投影叶面积和光穿透度,且对HN59植株的抑制程度高于对HH49 植株。盐碱胁迫对HH49 植株的叶面积指数没有显著的影响,但是显著地降低了HN59 植株的叶面积指数,降低的幅度达到17.14 %。虽然盐碱胁迫对于HH49 植株的叶片角度没有显著的影响,但是显著地增加了HN59 植株的叶片角度,增加幅度达到11.22 %。
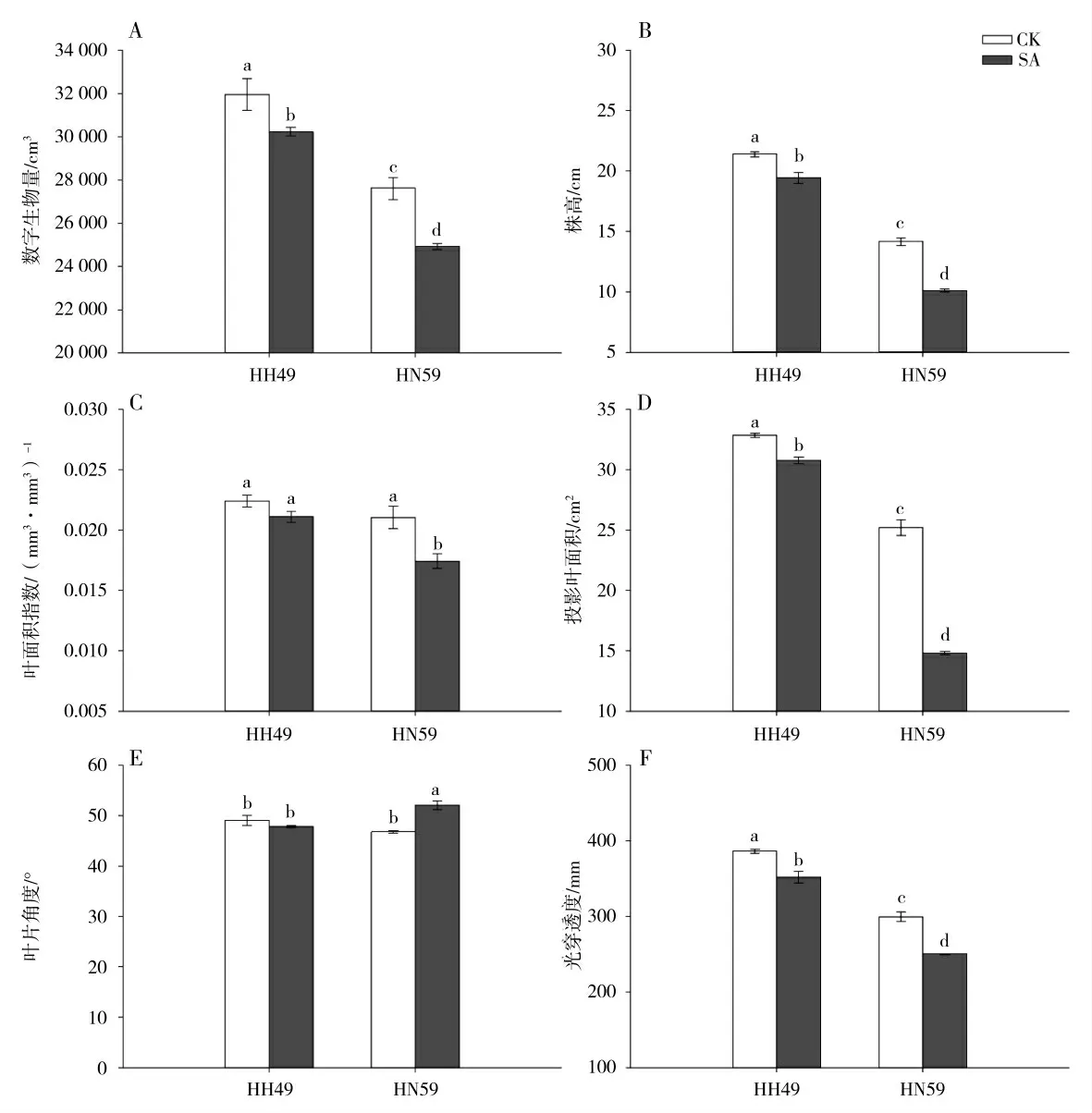
图2 盐碱胁迫对大豆幼苗植株形态指标的影响Fig.2 Effects of saline-alkali stress on plant morphological indices of soybean seedlings
2.3 盐碱胁迫对大豆幼苗光谱参数的影响
使用多光谱扫描仪建立的HUE3D模型图片如图3 所示,NDVI 模式下大豆的模型图片如图4 所示。对盐碱胁迫下大豆幼苗的光谱参数进行定量分析,结果如图5 所示。与对照组相比较,盐碱胁迫显著的抑制了HH49 和HN59 幼苗植株的色调值(Hue),降低幅度分别达到4.89 %和7.69%。同时,盐碱胁迫下两个大豆品种的归一化指数(NVDI)的降低幅度分别达到8.19%和25.81%,而绿度指数(GI)的降低幅度分别达到17.95%和23.23%。

图3 盐碱胁迫下大豆幼苗植株的HUE3D 图像Fig.3 HUE3D images of soybean seedlings under saline-alkali stress

图4 盐碱胁迫下大豆幼苗植株的NDVI 图像Fig.4 NDVIimages of soybean seedlings under saline-alkali stress
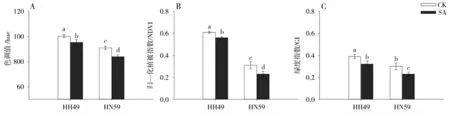
图5 盐碱胁迫对大豆幼苗光谱参数的影响Fig.5 Effects of saline-alkali stress on spectral parameters of soybean seedlings
2.4 各形态指标主成分及相关性分析
如表2 所示,对盐碱胁迫下大豆幼苗植株的15 个形态特征指标进行主成分分析,以特征值大于1 为阈值,共得到2 个主成分,对应的特征根分别为3.566 和1.209,其贡献率分别为84.790%和9.747%,累计贡献率为94.537 %(表2),其余贡献率较小的成分则忽略不计。其中,第1 主成分CI1中数字株高、叶面积指数、投影叶面积和NDVI 的特征向量最高,分别为0.280、0.280、0.279 和0.27。第2 主成分为中度敏感主成分,其中地上部鲜重的特征向量最高,为0.583。

表2 盐碱胁迫下大豆幼苗植株各综合指标的系数及贡献率Table 2 Coefficient and contribution rate of comprehensive indexes of soybean seedlings under saline-alkali stress
对盐碱胁迫下大豆幼苗植株的15 个形态特征指标的相关性进行分析,结果如图6 所示。盐碱胁迫下,大豆幼苗植株的叶面积指数、投影叶面积、茎粗、数字株高、株高、地上部干重、NDVI 值、光穿透度等指标之间呈极显著正相关性(P<0.01);地上部鲜重与地上部干重、数字生物量等指标之间呈现显著的正相关性(P<0.05);数字生物量与株高、地上部干重和NDVI 值等指标之间呈现极显著正相关性(P<0.01),而与叶面积指数、投影叶面积、茎粗、数字株高、光穿透度、地上部鲜重等指标之间呈现显著的正相关性(P<0.05);GI 指数与光穿透度呈现极显著正相关性(P<0.01),而与叶面积指数、投影叶面积、茎粗、数字株高、NDVI 值、根干重、hue 等指标之间呈现显著的正相关性(P<0.05);根干重与光穿透度、NDVI 和GI指数呈现等指标之间呈现显著的正相关性(P<0.05);hue 值与叶面积指数、投影叶面积、茎粗、数字株高、株高、NDVI、GI、根鲜重等指标之间呈现显著的正相关性(P<0.05),而与光穿透度呈现极显著正相关性(P<0.01);叶片角度与叶面积指数、投影叶面积、茎粗、数字株高、株高、地上部干重、NDVI 值、光穿透度和hue 值等指标呈极显著的负相关性(P<0.01),而与数字生物量、GI 和根干重呈现显著的负相关性(P<0.05)。
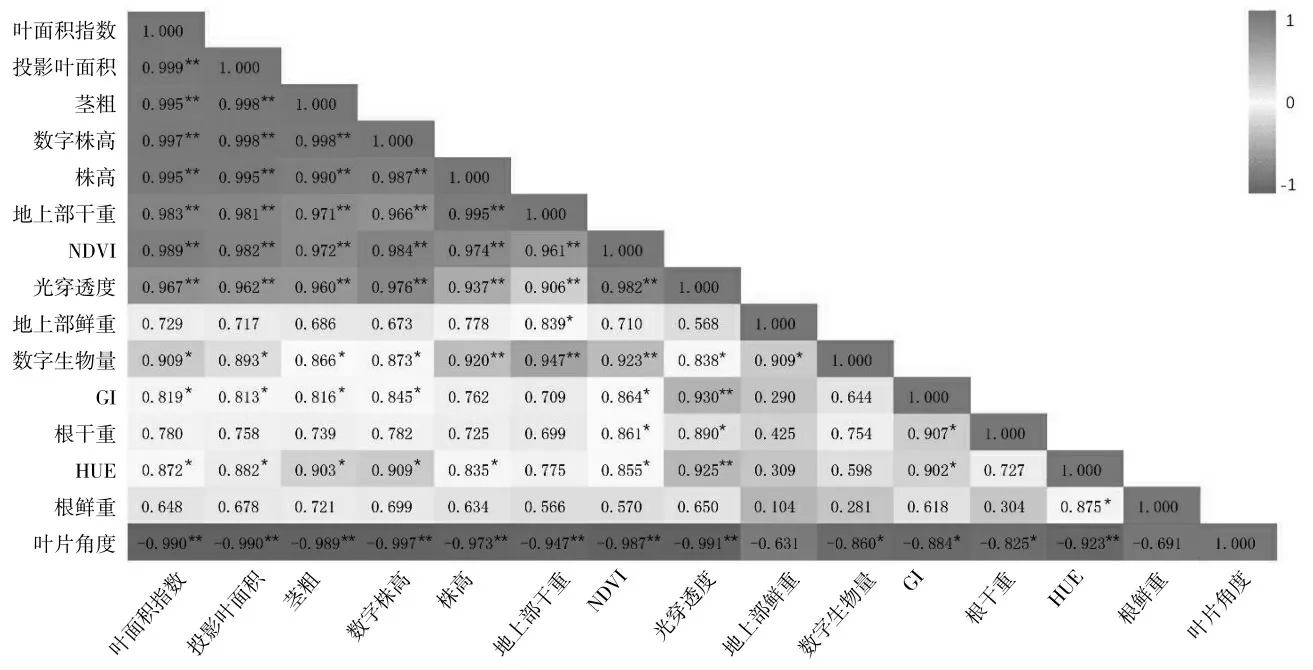
图6 盐碱胁迫下大豆幼苗生物量、形态和光谱参数指标的相关系数分析Fig.6 Correlation coefficient analysis of biomass,morphology and spectral parameters of soybean seedlings under salt-alkali stress
3 讨论
盐碱土壤中较高的盐离子含量和PH 值能够引起植物吸水能力下降、体内离子失衡、生理代谢紊乱、生长抑制、质量和产量降低,甚至导致植物死亡。因此,培育耐盐碱的作物品种,提高作物的耐盐碱能力有利于盐碱土地的利用,具有较好的生态效益和经济效益。相对于传统的植物形态数据收集方法,自动化表型检测技术能够综合的、高通量的、定量的、无损的、实时的分析植物形态和生理指标变化,能够更加准确和快速的反应出环境-基因型-表型之间的关系,有利于优良品种的选育和耕作措施的改进。
盐碱胁迫下植株最常见的形态变化是生物量和叶面积减少,这可能与胁迫条件下植物的蒸腾作用和散热调节等生理代谢进程的调节反应相关[23]。以前的研究表明,盐碱胁迫显著的抑制了野生大豆[24]、大豆[21]、苜蓿[25]、水稻[26]等作物的株高、地上部分和根系的生长速率和生物量积累,并表现出显著的基因型差异。在研究中,盐碱胁迫显著的降低了两个大豆品种的株高、茎粗、地上部的鲜/干重和根系的鲜/干重、数字生物量、株高、投影叶面积和光穿透度(图1、2,表1),表明盐碱胁迫抑制了大豆幼苗植株的生物量积累,并使得株形变得更加的紧凑(图1)。同时,盐碱胁迫下对HH49 的生物量积累和形态参数的抑制程度小于HN59,表明HH49 对于盐碱胁迫的耐受性高于HN59,这与我们之前的品种筛选试验的结果一致。
植物通过光合作用为机体提供生长代谢所需要的能量和物质。研究表明,低浓度盐碱胁迫下,植物叶片的气孔关闭,胞间CO2浓度下降,降低了植物的光合速率[27];而高浓度的盐碱胁迫引起植株叶片内光化学猝灭和光系统II(PSⅡ)反应中心激发能捕获效率(F'v/F'm)的下降,从而导致光合速率的降低[28]。在光照条件下,绿色植物的叶片对红光波段的光波具有较高的吸收率,而对近红外波段具有高的反射率、高的透射率和极低的吸收率[29]。这些光谱参数可以有效地反映出植株的冠层信息和光合特征,也与植株的生长状态相关[30]。在研究中,与对照组相比较,盐碱胁迫显著的降低了大豆幼苗植株的hue 值(图3),表明盐碱胁迫增加了大豆幼苗植株的红色、绿色和蓝色的反射率,降低了近红外反射率,导致光合有效辐射吸收率降低。而归一化植被指数(NDVI)和绿度指数(GI)的降低表明盐碱胁迫下大豆幼苗植株的光合能力的下降与叶绿素含量降低有关,这与前人的研究一致[31-33]。GI 和NDVI 通常与叶片内叶绿素含量和植物的地上部生物量积累有关[30,34]。叶绿体作为植物响应盐碱胁迫最重要的细胞器之一,其内叶绿素的含量可作为植物耐盐碱性的重要参考指标之一[28,35]。
在植物的逆境胁迫响应研究中,通过对胁迫最敏感的植株形态指标或生理指标进行定量分析,能够有效地判断逆境胁迫对植株生长的影响,对于耐性品种的选育具有重要的意义[36]。在研究中,主成分分析和相关性分析结果均表明,利用植物表型仪获得的植物形态学指标(数字生物量、数字株高、叶面积指数、投影叶面积、NDVI 等)均能够较好的反应出盐碱胁迫对大豆幼苗植株的生长影响,并且这些形态学指标与植株的茎粗、株高、地上部鲜/干重等具有显著的正相关性。在后续的试验中,可将植株的光合参数、荧光参数、生理学参数与表型仪获得的形态参数进行深入的关联分析,以综合分析逆境胁迫对植物生长的影响,以更好的服务于抗逆品种选育、植物生长调节剂开发、栽培措施改良等研究。
4 结论
研究基于植物表型分析系统(Planteye F500),通过对盐碱胁迫下两种大豆品种的形态指标、光谱特征参数和生物量数据进行综合的定量分析,研究了盐碱胁迫对大豆幼苗生长的影响。结果表明盐碱胁迫显著的降低了大豆幼苗植株的地上/根系的生长和生物量积累,使得株形变得更加紧凑,同时降低了植株的光合能力。同时,分析了大豆幼苗响应盐碱胁迫的主成分,并建立了相关指标的相关性,明确了利用植物表型分析系统器获得的形态参数可以作为新的指标应用于大豆响应盐碱胁迫的研究。

