牛坏死杆菌43K OMP 的生物信息学分析及B 细胞表位预测
王丽娜,贺显晶,蒋剑成,汪锋锋,肖佳薇,蒋凯,赵鹏宇,王天硕,于思雯,毕栏,郭东华
(黑龙江八一农垦大学动物科技学院,大庆 163319)
牛坏死杆菌(bovine Fusobacterium necrophorum)是革兰氏阴性厌氧多形性细菌,无芽孢、鞭毛,不产生荚膜,常驻于动物和人的口腔和消化道,是一种机会性病原体,常与坏死性感染有关[1]。它的毒力因子主要包括白细胞毒素、溶血素、内毒素、血凝素、黏附因子等[2]。近年来研究发现,牛坏死杆菌在牛子宫内膜炎和牛乳房炎的感染中参与广泛,严重影响牛的生产性能[3]。牛坏死杆菌病给养殖业带来的损失,是畜牧业有待解决的重大问题,因此,对牛坏死杆菌感染相关蛋白的结构和免疫原性的研究,对牛坏死杆菌病的防治具有深远意义。
外膜蛋白(outer membrane protein,OMPs)是革兰氏阴性菌外膜的主要成分,其不仅有维持细菌结构、调节物质运输等生物学功能,还作为毒力因子发挥黏附宿主细胞和逃避宿主防御机制的作用[4-5]。在2013 年,Sun D 参考具核梭杆菌外膜蛋白FomA 的核苷酸序列,首次在牛坏死杆菌中鉴定出一个大小为43 kDa 的外膜蛋白,并将其命名为43K OMP,随后发现其与坏死杆菌同属其他梭菌成员的外膜蛋白相似,广泛存在于牛坏死杆菌不同分离菌株中[6]。2014年,Kumar 等[7]进一步验证了43K OMP 的存在,并发现其有黏附牛血管内皮细胞(EJG 细胞)的功能。前期研究发现,43K OMP 可激起小鼠的体液免疫和细胞免疫[8],且截短表达的43K OMP 基因片段中位于19-108aa 和283-377aa 的两个重组蛋白有较好的免疫原性[9],提示其可以作为牛坏死杆菌基因工程疫苗的候选抗原。但目前,有关该蛋白的空间结构、理化特性、细胞表位等信息尚不明确,因此实验利用生物信息学方法对该基因编码蛋白的理化性质、二级结构、三级结构,B 细胞表位等进行预测,为该蛋白的功能研究及基因工程疫苗研制提供依据。
1 材料与方法
1.1 基因、蛋白质序列号及主要试剂
牛坏死杆菌43K OMP 的基因及蛋白Gen Bank登陆号分别是JQ740821.1 和AFJ54023.1。HRP-山羊抗兔IgG 购自Biosharp 公司;碳酸氢钠购自天津市登峰化学试剂厂;无水碳酸钠购自国药集团化学试剂有限公司;TMB 单组份显色液购自Biosharp 公司;43K OMP 兔多克隆抗体来自黑龙江八一农垦大学兽医分子病理学实验室;兔阴性血清来自黑龙江八一农垦大学兽医分子病理学实验室。
1.2 理化性质分析
应用Prot Param(https://www.expasy.org/resources/protparam)在线软件,分析43K OMP 氨基酸序列的理化性质。
1.3 跨膜结构域、信号肽和磷酸化位点预测
应用TMHMM(http:llwww.cbs.dtu.dk/services/TMHMM/)在线软件预测蛋白的跨膜结构域;SignalP(http://www.cbs.dtu.dk/services/SignalP/)在线软件分析 蛋 白 的 信 号 肽;Net Phos(http://www.cbs.dtu.dk/services/NetPhos/)在线软件预测43K OMP 的磷酸化位点。
1.4 亲水性、可及性和柔韧性预测
用ExPASy(http://www.expasy.ch/tools/protscale.html)在线软件中的ProtScale 工具,对43K OMP 进行Hopp&Woods 亲水性预测、Janin 表面可及性预测、Karplus 柔韧性预测,预测时分别选择参数"Hphob./Hopp & Woods"、"% accessible residues" 和"Average flexibility"提交后获取结果。
1.5 二级结构预测
利用DNA Star 软件分析43K OMP 的二级结构。
1.6 三级结构预测
利用I-TASSER(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)在线软件预测43K OMP 的三级结构。
1.7 B 细胞表位预测
用BepiPred(http://www.cbs.dtu.dk/services/Bepi Pred/)、Ellipro(http://tools.immuneepitope.org/main/bcell/)在线软件预测43K OMP 的B 细胞表位。
1.8 预测表位肽合成
根据两种不同在线软件预测B 细胞表位的结果,选出预测的公共区域,取位于19-108aa 和283-377aa 之间的线性B 细胞表位,依据亲水性、可及性和柔韧性预测结果综合分析,确定出预测的表位肽,同时选一个无关肽作为阴性对照,将肽段送至南京金斯瑞生物技术有限公司合成,肽浓度为4 mg,净度≥90%。
1.9 预测表位肽ELISA 验证
采用间接ELISA 方法:以合成的预测表位肽为包被抗原,重组蛋白多克隆抗体为一抗,HRP-山羊抗兔IgG 为二抗,鉴定预测表位肽的反应活性。首先用棋盘法筛选抗原包被浓度和抗体最佳稀释度,取一个预测表位肽溶解于ddH2O 中,调整至不同浓度,包被ELISA 板,以不同比例稀释的43K OMP 兔多克隆抗体,为一抗,HRP-山羊抗兔IgG 为二抗,筛选出最佳包被浓度和最佳血清稀释比例。结果以阳性值大于等于1,阴性值小于0.2 为标准,取P/N(阳性/阴性)值最大处的抗原包被浓度和抗体稀释度为工作浓度。按照筛选出的最佳包被浓度和适宜一抗稀释度,用合成的肽(预测肽和无关肽)包被ELISA 板,进行ELISA 检测。
2 结果与分析
2.1 43K OMP 的理化性质
Prot Param 预测结果显示:43K OMP 的基因共编码377 个氨基酸,其相对分子质量为42.927×103;理论等电点为8.74,为碱性蛋白,带负电荷的残基(天冬氨酸+谷氨酸)总数为50,带正电荷的残基(精氨酸+赖氨酸)总数为54;氨基酸组成成分见表1;43K OMP 的半衰期(哺乳动物网织红细胞)为30 h,不稳定系数为18.82,表明该蛋白很稳定;脂溶性指数为64.93,总平均亲水性为-0.710。
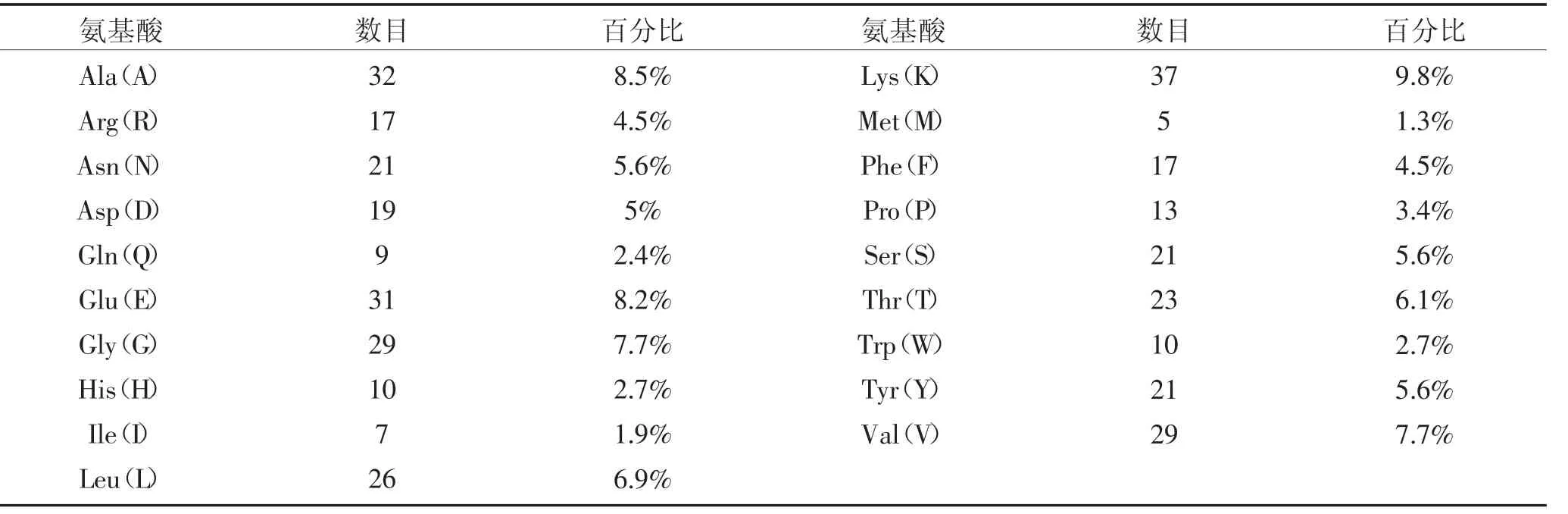
表1 牛坏死杆菌43K OMP 的氨基酸组成Table 1 Amino acid composition of 43K OMP of bovine Fusobacterium necrophorum
2.2 43K OMP 的跨膜区、信号肽和磷酸化位点预测结果
TMHMM、SignalP 和NetPhos 在线软件预测结果显示(图1):43K OMP 不存在跨膜区,为膜外蛋白;在1-20aa 之间存在一个信号肽区域;其氨基酸序列上共有34 个磷酸化位点,包括15 个丝氨酸磷酸化位点,10 个苏氨酸磷酸化位点,9 个酪氨酸磷酸化位点。

图1 43K OMP 的信号肽(A)跨膜区(B)及磷酸化位点(C)预测结果Fig.1 Signal peptide(A)transmembrane region(B)and phosphorylation site(C)prediction results of 43K OMP
2.3 43K OMP 的亲水性、柔韧性和可及性预测结果
用Prot Scale 工具,对牛坏死杆菌43K OMP 基因编码的氨基酸序列,做Hopp&Woods 亲水性预测、Karplus 柔韧性预测和Janin 表面可及性预测;结果如图2 所示:得到各氨基酸位点的预测得分,图中红线以上的区域为亲水性区域、柔韧性区域和可及性区域;其中图2A 为亲水性预测结果阈值为0.168,亲水区域包括:18-23,28-38,44-45,48-51,54-59,63-100,110-116,123-139,165-174,205-207,209-212,244-257,268-275,290-299,301-320,350-358。其中,244-257 区域亲水性显著高于其他区域。
图2B 所示为柔韧性预测结果,其阈值为1.000,大 于 均 值 的 柔 韧 性 区 域 为:28-51,56-98,110-116,124-141,147-154,194-213,243-254,306-319,347-358。其中,243-254 区间显著高于其他区域。
图2C 为可及性预测结果,其阈值为5.767,大于均 值 的 可 及 性 区 域 为:12-23,53-62,69-90,93-106,121-135,147-159,186-191,240-257,267-275,291-297,311-321,325-331,353-360。其 中,121-135,240-257,69-90,311-321 这些区域显著高于其他区域。
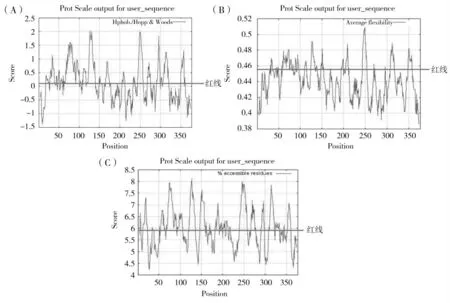
图2 43K OMP 的亲水性(A)、柔韧性(B)可及性(C)预测结果Fig.2 Hydrophilicity(A),flexibility(B)and accessibility(C)prediction results of 43K OMP
2.4 43K OMP 的二级结构预测结果
利用DNA Star 软件分析43K OMP 的二级结构,结果如图3 所示:其中α 螺旋主要分布于:10-24,38-53,75-83,95-102,128-132,176-181,185-195,215-225,228-237,250-300,317-323,332-344区域内;β-折叠主要分布在:3-17,58-65,108-122,135-140,150-158,168-180,200-225,235-240,318-321,370-377 区域内;β-转角主要分布在:16-23,42-47,55-60,65-78,83-93,105-112,120-148,162-166,182-185,192-196,203-206,223-227,242-250,260-264,268-273,308-317,320-328,342-355,361-365 区域内。
图3 43K OMP 的二级结构预测结果Fig.3 The secondary structure prediction results of 43K OMP
2.5 43K OMP 的三级结构预测结果
用I-TASSE 在线软件预测43K OMP 三级结构,得到五个蛋白质模型(见图4),图中红色为α 螺旋,黄色为β 折叠,绿色为无规则卷曲,其中模型4(图4 D)综合评分最高,可根据模型4 预测该蛋白的构象B 细胞表位。

图4 43K OMP 的三级结构Fig.4 The three-level structure prediction results of 43K OMP
2.6 43K OMP 的B 细胞表位预测结果
Bepipred 在线软件预测的B 细胞表位结果如图5 所示:其具体氨基酸序列及位置见表2;Ellipro 预测的线性B 细胞表位和构象B 细胞表位具体氨基酸位点见表3 和表4,球棒模型图见图6 和图7,其中黄球为预测肽的残基,白棒为蛋白质非表位残基。表2、表3 和表4 中仅展示了位于190-108aa 和283-377aa 区间内预测得到的表位。

图7 Ellipro 预测的构象B 细胞表位球棒模型图Fig.7 Ball-and-stick model of conformational B cell epitope predicted by Ellipro

表4 Ellipro 预测的构象B 细胞表位氨基酸序列Table 4 Amino acid sequences of conformational B cell epitopes predicted by Ellipro

图6 Ellipro 预测的线性B 细胞表位球棒模型图Fig.6 Linear B cell epitope ball-and-stick model predicted by Ellipro

表3 Ellipro 预测的43K OMP 的线性B 细胞表位氨基酸序列Table 3 Amino acid sequence of the linear B cell epitope of 43K OMP predicted by Ellipro
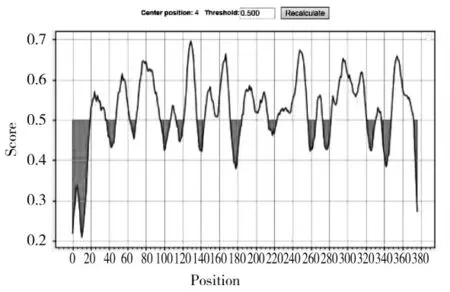
图5 43K OMP 的B 细胞表位预测结果(Bepipred)Fig.5 43K OMP B cell epitope prediction results(Bepipred)

表2 Bepipred 预测的43K OMP B 细胞表位氨基酸序列Table 2 Amino acid sequence of 43K OMP B cell epitope predicted by Bepipred
2.7 预测表位肽ELISA 验证
两个在线软件均预测到的氨基酸残基汇总至表5 中,预测得到的4 个表位肽,分别命名为T1、T2、T3、和T4;此外,取信号肽区域的一段氨基酸序列作为无关对照肽命名为T0。按表5 所示的氨基酸序列合成肽段,用棋盘法筛选出最佳检测包被浓度为20 μg·mL-1,最佳一抗稀释度为1∶2 500,最佳二抗稀释度为1∶1 000。用所选包被浓度和抗体稀释度对合成表位肽进行ELISA 检测,结果显示:4 个预测表位肽(T1、T2、T3 和T4)均能与重组全长43K OMP 兔多克隆抗体结合,而不与兔阴性血清反应,1 个无关对照肽(T0)不能与重组全长43K OMP 兔多克隆抗体和兔阴性血清结合。说明4 个预测表位肽与一抗特异性结合,有较好的免疫反应活性。通过实验证实了预测的表位肽T1、T2、T3、T4 为43K OMP 的线性表位。通过抗原抗体结合的亲和力反应得出,预测的表位肽免疫反应活性从大到小依次是T3>T2>T4>T1,由此可知T3 的免疫活性最高。

表5 预测表位肽及无关肽氨基酸序列Table 5 Prediction of amino acid sequences of epitope peptides and unrelated peptides
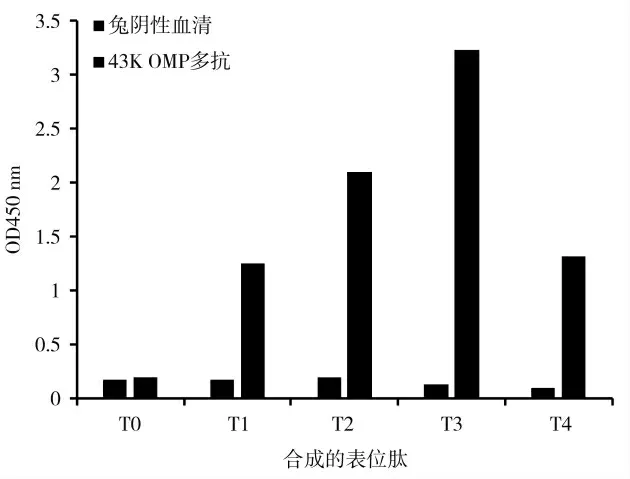
图8 合成表位肽ELISA 检测结果Fig.8 ELISA test results of synthetic epitope peptides
3 讨论
牛坏死杆菌是革兰氏阴性厌氧多形性细菌,广泛分布于人和动物的口腔、胃肠道和泌尿生殖道,常引起人和动物的多种坏死性、化脓性疾病,在牛、羊等反刍动物中以腐蹄病和肝脓肿最为常见[10-11]。该菌有许多毒力因子,如白细胞毒素、溶血素、内毒素、蛋白水解酶、黏附因子等[12],这些毒力因子在细菌侵入机体、黏附宿主细胞、逃避机体天然防御以及形成坏死性感染等方面发挥着重要的作用。研究初期,人们发现牛坏死杆菌白细胞毒素对家兔、绵羊的白细胞和牛的外周血白细胞有很强的毒性作用[13-14],其溶血素对白细胞也具有毒性作用,但不同物种对其敏感性不同,以兔红细胞最为敏感[15]。所以较长一段时间人们致力于对白细胞毒素和溶血素作为亚单位疫苗和候选抗原的研究[16-17]。虽然白细胞毒素和溶血素作为疫苗候选抗原在一定程度上可以抑制坏死杆菌感染,但其免疫保护效果与临床需求有一定的差距[18]。这些研究提示,防治牛坏死杆菌病仅依靠白细胞毒素和溶血素等毒力因子是不够的。所以,对坏死杆菌其他功能蛋白的研究变得十分必要。
外膜蛋白是革兰氏阴性细菌外膜的主要成分,在细菌与外界环境之间的沟通中起到桥梁作用。许多革兰氏阴性菌的OMP 能介导细菌与宿主细胞的粘附[19],除此之外细菌的OMP 具有免疫原性且能诱导保护性免疫反应,因此研究并开发OMP 基因工程疫苗具有十分广阔的应用前景[21]。前期研究发现,坏死杆菌不同亚种间外膜蛋白有所不同,在Fnn 亚种(subsp.necrophorum)中最显著的是大小为40 kDa 的蛋白,在Fnf 亚种(subsp.funduliforme)中最显著的是大小为37.5 kDa 的蛋白[22]。此外,徐晶等[23]在坏死杆菌中提取了一个大小为44.5 Ku 的蛋白,并发现其有就较好的免疫原性。2013 年,Sun 等[8]发现43K OMP后,有研究人员用坏死杆菌感染重组43K OMP 免疫过的小鼠,发现43K OMP 对小鼠具有免疫保护作用。贺显晶等[24]制备了43K OMP 多克隆抗体,发现该蛋白反应性良好。由此可知,43K OMP 在坏死杆菌感染机体的过程中发挥重要作用,由于其对机体有很好的免疫保护作用,具备成为基因工程疫苗候选抗原的条件。
生物信息学分析是生命科学研究中的重要技术,其对于感染性疾病中的病原体,宿主的整体基因信息分析,抗感染药物的设计,疫苗的研发,个体化的预防策略等均有重要的作用。随着生物信息学的不断发展,其在分析蛋白质理化性质、预测蛋白质结构、推测蛋白质功能等方面有着不可取代的地位,目前,生物信息学分析技术已经广泛应用于蛋白质抗原表位预测的研究当中[25]。蛋白翻译后修饰也称之为“细胞开关”,它对于不同的细胞需求而提供不同的蛋白质角色,任何蛋白质都需要经过适当的翻译后修饰才能表现出正常的生物学活性。蛋白质磷酸化作为最重要的一种蛋白翻译后修饰方式,参与和调控信号转导、基因表达、细胞周期等诸多生命活动[26]。研究通过分析其理化性质,发现43K OMP 为碱性蛋白,不稳定系数较低,表明该蛋白很稳定。此外,测出43K OMP 共有15 个丝氨酸磷酸化位点,10 个苏氨酸磷酸化位点,9 个酪氨酸酸化位点,在1-20aa 处有一个信号肽区域,没有跨膜区为膜外蛋白。预测出的43K OMP 基本信息为以后43K OMP 蛋白功能研究提供依据。
一般认为,疏水性残基一般存在于蛋白内部,而亲水性残基位于蛋白表面,因此蛋白的亲水部位与蛋白抗原表位有密切的联系,表面可及性是指氨基酸残基被溶剂分子接触的可能性,柔韧性是指蛋白质构象中活动性较强的氨基酸残基,也就是可塑性大的位点,容易形成抗原表位[27]。这些特性为潜在的B 细胞抗原表位选取可提供重要的参考价值。所以在蛋白质抗原表位的预测中,选择了那些具有较好的亲水性,较强的表面可及性以及较好的柔韧性的区域。抗原表位的分布与蛋白质的二级结构密切相关,由于α 螺旋、β 折叠是支撑蛋白质二级结构的基本骨架,起稳定作用,不易变形,较难嵌合抗体,一般不作为抗原表位经分析,无规则卷曲和β 转角结构松散突出,主要位于蛋白质表面,有利于和抗体结合,成为抗原表位的可能性较大。在43K OMP 蛋白中α螺旋和β 折叠区各占总氨基酸的比例分别为44.41%和13.82%,很可能形成抗原表位的无规则卷曲和β 转角所占比例为36.35%和5.43%。这种结构上的优势提示43K OMP 很有可能具有多个抗原表位。预测蛋白质三级结构主要有三种方法,即同源建模、穿线法、从头预测法,其中同源建模法要求模型蛋白与预测蛋白的同源性大于等于30%,而43K OMP 与模型蛋白同源性较小,所以选用不需要模型蛋白的穿线法对该蛋白的三级结构进行预测,通过I-TRISS 预测结果得到5 个模型,选取其中综合评分较好的模型4 对蛋白质的构象表位进行预测,共得到10 个构象B 细胞表位,综合三个不同服务器预测的线性B 细胞表位预测结果取交集,并选取位于19-108aa 和283-377aa 之间的表位,共得到4 个线性B细胞表位,合成后验证,其中预测表位肽T3 的免疫反应活性最高,且预测出的4 个表位肽,均具有反应活性,说明该蛋白不仅可以引起体液免疫还能引起细胞免疫,可作为基因工程疫苗候选因子。总之,43K OMP 的生物信息学分析从结构特征和抗原表位上为进一步开展蛋白功能的研究提供了理论依据,为牛坏死杆菌43K OMP 致病机制和研制疫苗提供实验依据。
4 结论
研究利用生物信息学分析技术对牛坏死杆菌43K OMP 的性质、结构、表位进行了初步预测,发现43K OMP 为碱性蛋白,不存在跨膜区,含有多个磷酸化位点及多个B 细胞构象表位及线性表位表位,验证的4 个线性B 细胞表位均有较高的反应活性。

