外源H2S供体NaHS浸种对盐碱胁迫下裸燕麦种子萌发特性的影响
刘建新 刘瑞瑞 刘秀丽 贾海燕 卜 婷 李 娜
(甘肃省高校陇东生物资源保护与利用省级重点实验室/陇东学院生命科学与技术学院,庆阳 745000)
裸燕麦(Avena nudaL.)是起源于中国的一种禾本科(Gramineae)燕麦属(Avena)一年生杂粮作物,我国主要在内蒙古、河北、山西、陕西和甘肃等地种植,播种面积仅次于小麦(Triticum aestivum)、玉米(Zea mays)和水稻(Oryza sativa)[1]。裸燕麦虽具较强抗逆性,但其籽粒蛋白质和油脂含量高,种子容易劣变[2]。北方地区土壤常含较高盐碱成分,使盐碱胁迫成为抑制裸燕麦种子萌发的重要限制因子之一[3]。种子播前预处理是提高作物种子活力的一项重要措施,其中浸种是一种操作简单、便于实施的有效方法[4]。因此,探寻盐碱条件下提高种子活力的浸种剂及适宜使用浓度对提高盐碱地裸燕麦的成苗率具有重要意义。
硫化氢(Hydrogen sulfide,H2S)是植物体中发现的第3种气体信号分子,它参与植物生长发育和生理代谢过程调控[5],并能增强植物对盐胁迫的耐性。如Lai 等[6]发现,用NaHS 预处理能够阻止Na-Cl 胁迫引起的紫花苜蓿(Medicago sativa)幼苗根部K+的外流,从而保持胞内Na+和K+的稳态。Chen等[7]进一步证明,外源H2S 通过NO 介导的Na+/H+转运子及H+-ATPase 蛋白和基因表达来保持高盐胁迫下大麦(Hordeum vulgare)幼苗的Na+、K+平衡。外源H2S 在植物种子萌发及逆境响应过程中也发挥着重要作用。如外源H2S 激活β-淀粉酶活性,促进小麦种子萌发[8];通过增强活性氧清除,减缓干旱抑制水稻种子萌发[9];并提高盐胁迫苜蓿种子萌发抗氧化酶同工酶活性和转录物水平[10];促进NaCl 胁迫下番茄(Lycopersicon esculentum)种子活力提升[11]。然而,用外源H2S 供体NaHS 浸种对盐碱混合胁迫下作物种子萌发特性影响的研究目前尚未见报道。本研究以裸燕麦种子为试验材料,模拟其在甘肃种植区土壤的盐碱组成,研究不同浓度NaHS 浸种处理对不同强度盐碱混合胁迫下种子萌发特性的影响,探索不同强度盐碱条件下提高作物种子活力适宜的NaHS浸种浓度,以期为农作物种子播前预处理提供理论依据。
1 材料与方法
1.1 试验材料和盐碱溶液配制
供试裸燕麦品种‘定莜9 号’种子由甘肃省定西市农业科学研究院提供。H2S 供体硫氢化钠(NaHS)购自Sigma-Aldrich 公司,其他化学试剂均为国产分析纯。按文献[12]方法分别配制NaCl、Na2SO4、Na2CO3和NaHCO3原液,模拟甘肃省裸燕麦种植区土壤盐碱成分,按NaCl∶Na2SO4∶Na2CO3∶NaHCO3摩尔比12∶8∶1∶9配制不同浓度盐碱混合溶液。
1.2 种子发芽试验
裸燕麦种子表面消毒后洗净、晾干,分别用浓度为0、50、100、200 和400 μmol·L-1NaHS 溶液在常温黑暗条件下浸种8 h,然后用清水冲洗干净。取培养皿(直径120 mm)铺一层滤纸,分别选饱满健康、大小均一且用不同浓度NaHS 浸种的种子100 粒均匀摆在培养皿中,分别加入浓度为0、15、30、45、60 mmol·L-1盐碱混合溶液5 mL,置于培养箱中25℃、光/暗(16 h/8 h)交替培养。以胚根突破种皮2 mm 为发芽标准,在种子置床后每12 h 观察1 次,记录种子发芽数,每次观察时补充适量盐碱溶液,共观察6 d。发芽6 d后,每皿随机选取10粒萌发苗用直尺测量胚芽长;将每皿全部发芽苗杀青30 min 后采用称重法测定幼苗(根、芽)干重,计算每株幼苗干重(SDW)。试验以每个培养皿为1次重复,共重复3次。
1.3 萌发参数的计算
发芽结束后,根据记录和测定结果,分别计算种子发芽率、发芽指数、活力指数、平均发芽时间等萌发参数。
式中:Gt为t(d)的种子发芽数,Dt为相应的发芽天数。
式中:S为胚芽长。
式中:Dt为发芽天数,Gt为相应天数的发芽数。
1.4 数据统计分析
为综合反映NaHS 浸种对盐碱胁迫下种子萌发的影响,分别计算Gp、Gi、Vi、MGT、SDW 的隶属函数值,通过客观法赋权,计算综合评价值D[12]。所有数据用SPSS20.0 软件单因素或双因素方差分析,其中百分数数据进行反正弦平方根转换后分析,SSR 法检验差异显著性,结果以平均值±标准差表示。
2 结果与分析
2.1 NaHS浸种对盐碱胁迫下裸燕麦种子发芽率的影响
由表1 可知,在不同浓度NaHS 处理下,裸燕麦种子发芽率(Gp)随盐碱浓度增大呈显著下降变化,说明盐碱混合胁迫显著抑制裸燕麦种子的发芽率。在0~30 mmol·L-1盐碱胁迫下,与0 μmol·L-1NaHS 处理(CK)相比,50 和100 μmol·L-1NaHS 处理均能一定程度提高Gp,200和400 μmol·L-1NaHS处理的Gp差异不显著或明显下降;在45 和60 mmol·L-1盐碱胁迫下,50~400 μmol·L-1NaHS 处理的Gp与CK 差异不显著或使Gp显著降低。说明50或100 μmol·L-1NaHS 浸种能够提高30 mmol·L-1以下浓度盐碱混合胁迫裸燕麦种子的发芽率。
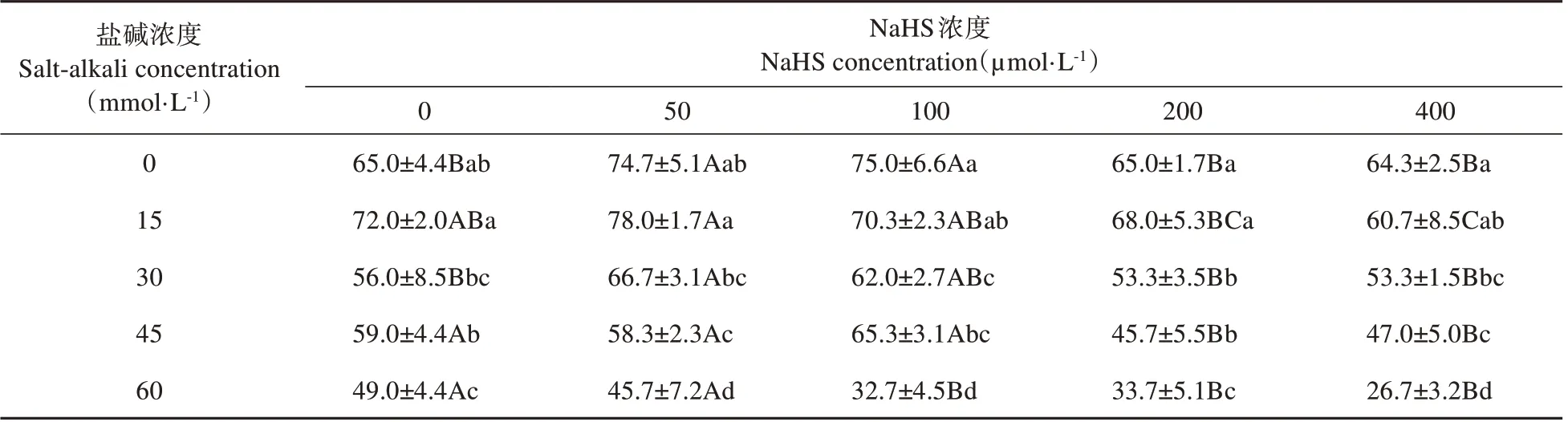
表1 NaHS浸种对盐碱胁迫下裸燕麦种子发芽率的影响Table 1 Effect of soaking seeds with NaHS on germination percentage of naked oat seeds under salt-alkali stress(%)
2.2 NaHS浸种对盐碱胁迫下裸燕麦种子发芽指数的影响
表2 显示,除15 mmol·L-1盐碱胁迫能显著提高0 μmol·L-1NaHS 处理的发芽指数(Gi)外,随盐碱浓度提高,不同浓度NaHS 处理的Gi均呈显著下降趋势。在0~45 mmol·L-1盐碱胁迫下,50 和100 μmol·L-1NaHS 处理的Gi与0 μmol·L-1NaHS 处理相比均有一定程度提高,200和400 μmol·L-1NaHS处理的Gi 差异不显著或显著下降;在60 mmol·L-1盐碱胁迫下,50~400 μmol·L-1NaHS 处理的Gi均低于0 μmol·L-1NaHS处理。
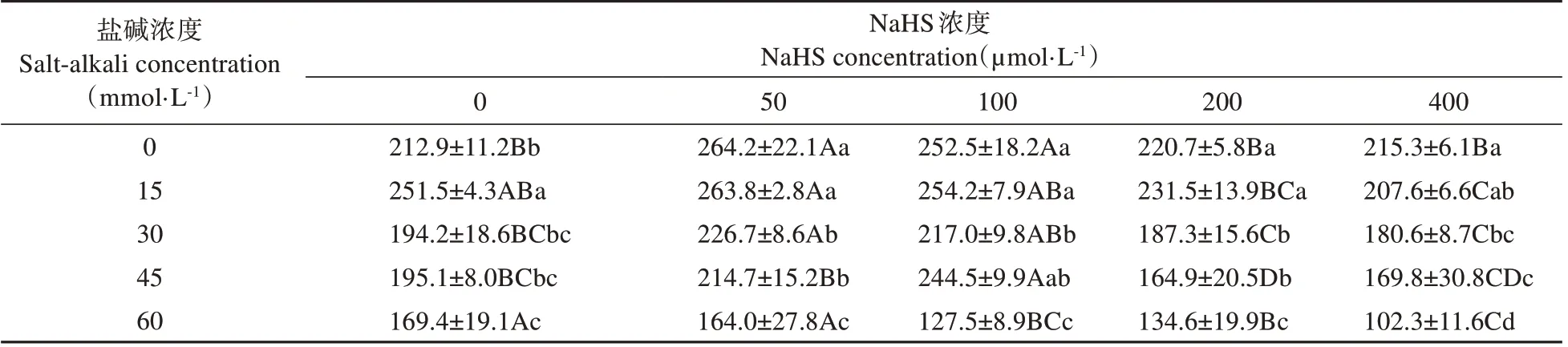
表2 NaHS浸种对盐碱胁迫下裸燕麦种子发芽指数的影响Table 2 Effect of soaking seeds with NaHS on germination index of naked oat seeds undersalt-alkali stress
2.3 NaHS浸种对盐碱胁迫下裸燕麦种子活力指数的影响
表3 表明,在不同浓度NaHS 处理下,随盐碱浓度提高,裸燕麦活力指数(Vi)呈持续显著下降趋势。50和100 μmol·L-1NaHS处理显著提高了0 mmol·L-1盐碱胁迫下的Vi,50 μmol·L-1NaHS 处理使15 和30 mmol·L-1盐碱胁迫下的Vi 一定程度提高,而其他浓度NaHS 处理的Vi 显著下降。说明50 μmol·L-1NaHS 浸种可以提高30 mmol·L-1及以下浓度盐碱混合胁迫裸燕麦种子的活力指数。
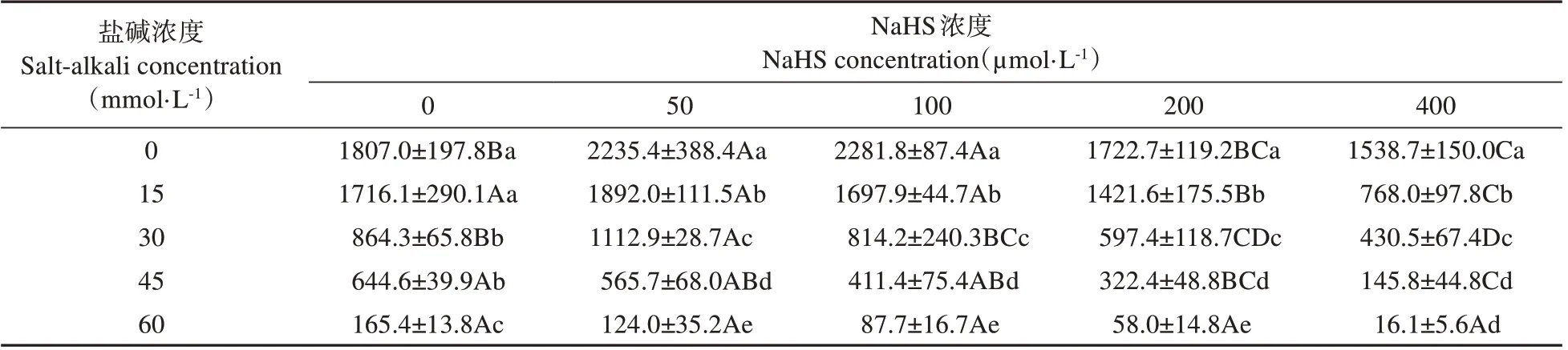
表3 NaHS浸种对盐碱胁迫下裸燕麦种子活力指数的影响Table 3 Effect of soaking seeds with NaHS on vigor index of naked oat seeds under salt-alkali stress
2.4 NaHS浸种对盐碱胁迫下裸燕麦种子平均发芽时间的影响
从表4可知,随盐碱浓度提高,0和50 μmol·L-1NaHS 处理的平均发芽时间(MGT)无显著差异,100~400 μmol·L-1NaHS 处理的MGT 呈显著降低趋势。在0~30 mmol·L-1盐碱胁迫下,不同浓度NaHS处理的MGT无显著差异;在45和60 mmol·L-1盐碱胁迫下,50~400 μmol·L-1NaHS处理的MGT低于0 μmol·L-1NaHS 处理。说明NaHS 浸种不会影响30 mmol·L-1及以下浓度盐碱混合胁迫裸燕麦种子萌发的平均发芽时间,但会缩短45 mmol·L-1以上浓度盐碱胁迫下的平均发芽时间。
2.5 NaHS浸种对盐碱胁迫下裸燕麦萌发苗单株干重的影响
由表5 可见,随着盐碱浓度和NaHS 浓度提高,裸燕麦萌发苗单株干重(SDW)均呈显著下降趋势。与0 μmol·L-1NaHS处理相比,除50 μmol·L-1NaHS 处理使0 和15 mmol·L-1盐碱胁迫下的SDW差异不显著外,其他浓度NaHS处理均使不同浓度盐碱胁迫下的裸燕麦萌发苗SDW 显著下降。说明用50~400 μmol·L-1NaHS 浸种并不能促进裸燕麦萌发苗的生长。

表5 NaHS浸种对盐碱胁迫下裸燕麦种子萌发苗单株干重的影响Table 5 Effect of soaking seeds with NaHS on dry weight of each plant of naked oat seedlings undersalt-alkali stress(mg)
2.6 NaHS浸种对盐碱胁迫下裸燕麦种子萌发隶属函数综合评价值的影响
不同发芽指标对NaHS 和盐碱浓度的响应存在差异,为综合反映裸燕麦种子萌发状况,采用隶属函数计算上述发芽指标的综合评价值(D)。从表6 可知,随着盐碱浓度提高,不同浓度NaHS处理的D值均表现为显著下降变化。与0 μmol·L-1NaHS处理相比,50 和100 μmol·L-1NaHS 不同程度提高了0~45 mmol·L-1盐 碱 胁 迫 下 的D 值,200 和400 μmol·L-1NaHS 的D 值差异不显著或明显降低;在60 mmol·L-1盐碱胁迫下,不同浓度NaHS 处理的D值无显著差异。
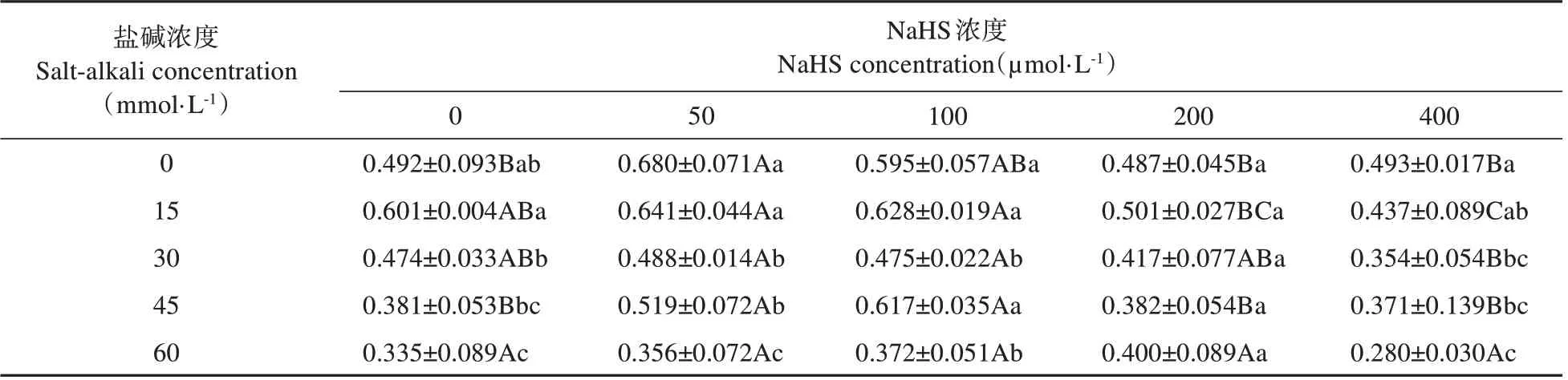
表6 NaHS浸种对盐碱胁迫下裸燕麦种子萌发隶属函数综合评价值(D)的影响Table 6 Effect of soaking seeds with NaHS on comprehensive evaluation value of membership function(D)for naked oat seed germination under saline-alkali stress
2.7 盐碱与NaHS 浓度对裸燕麦种子萌发的双因素方差分析
从表7 可见,盐碱浓度对Gp、Gi、Vi、MGT、SDW 和D 值的影响极显著;NaHS 浓度对Gp、Gi、Vi、SDW和D值的影响极显著,对MGT的影响显著;盐碱浓度和NaHS 浓度的交互作用对Gp、Gi、Vi、SDW的影响极显著,对MGT和D值的影响显著。
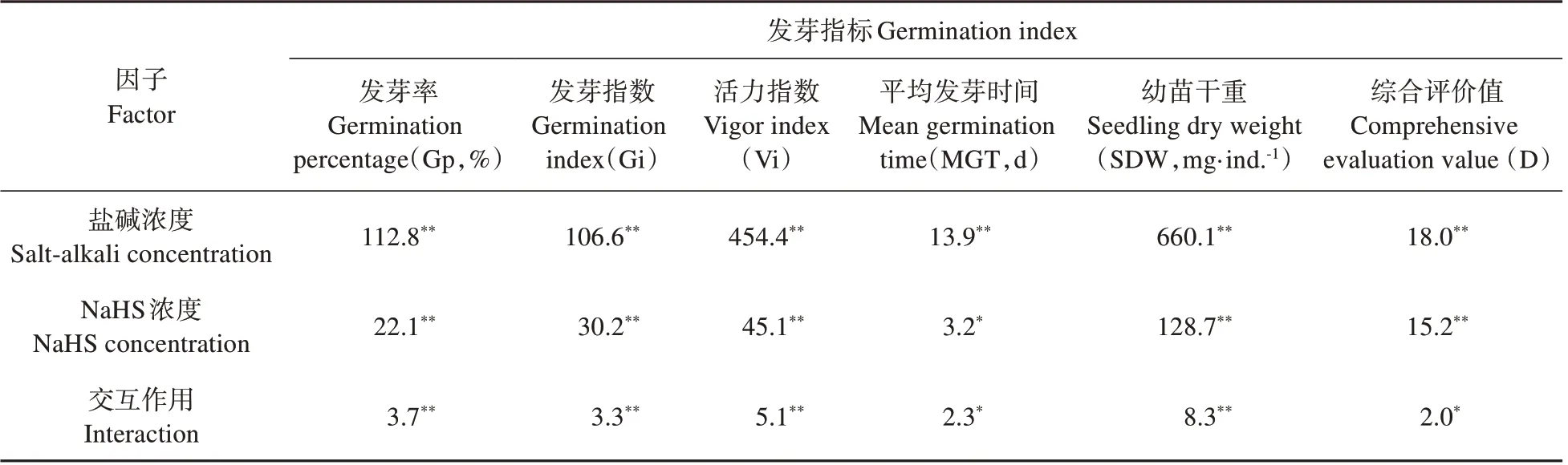
表7 盐碱浓度和NaHS浓度对裸燕麦种子萌发的双因素方差分析Table 7 Two-way analysis of variance for salt-alkali and NaHS concentrations on seed germination of naked oat
与CK 相比,15 mmol·L-1盐碱胁迫除显著降低Vi 和SDW 外,对Gp、Gi、MGT 和D 值无显著影响;除30 mmol·L-1盐碱胁迫的MGT 无显著变化外,30~60 mmol·L-1盐碱胁迫的Gp、Gi、Vi、MGT、SDW和D 值显著降低(见表8)。表9 表明,与CK 相比,50 和100 μmol·L-1NaHS 处理下Gp 变化不显著,Gi、Vi 和D 值升高,MGT 和SDW 下降;200 和400 μmol·L-1NaHS 处理显著降低了Gp、Gi、Vi、MGT、SDW和D值。

表9 NaHS浓度对裸燕麦种子萌发影响的多重比较Table 9 Multiple comparisons of the effects of NaHS concentration on seed germination of naked oat
3 讨论
3.1 盐碱胁迫对裸燕麦种子萌发的影响
中国大约有1/4 耕地面积的盐渍化土壤,盐碱胁迫成为抑制作物种子萌发,从而导致出苗不齐和幼苗生长速率降低的障碍因素[3~4]。裸燕麦这一重要杂粮作物虽然具有耐盐碱的优良特性[1],但盐碱胁迫仍对种子萌发和幼苗生长产生显著抑制作用,进而造成其产量和品质下降[13]。有研究表明,低盐(50~100 mmol·L-1)胁迫对燕麦种子萌发[14]、根长和芽长[15]及根数[4]增加有一定促进作用,但较高强度盐碱胁迫显著抑制燕麦种子萌发和幼苗生长,表现为随盐碱胁迫加剧,种子发芽率、发芽指数和活力指数下降,胚根和胚芽生长减缓[3],植株干重和叶面积[16]、茎长和茎生物量降低[17]。有关燕麦种子萌发对不同类型盐碱响应的研究结果显示,无论是单盐或复盐胁迫[18],还是中性盐或碱性盐胁迫[19],总体上表现为单盐胁迫对种子萌发的抑制程度大于复盐胁迫,碱性盐胁迫的抑制程度大于中性盐胁迫。本研究进一步表明,盐碱混合胁迫对裸燕麦种子的Gp、Gi、Vi、MGT、SDW 和D 值有极显著的影响(见表1~7),随着盐碱混合胁迫浓度提高,裸燕麦种子的Gp、Gi、Vi、MGT、SDW 和D 值呈显著下降趋势,其中15 mmol·L-1盐碱胁迫对Gp、Gi、MGT 和D 值的影响不显著,却使Vi和SDW 显著降低(见表8),说明低浓度盐碱混合胁迫虽不影响种子萌发,而显著抑制萌发苗的生长;30~60 mmol·L-1盐碱混合胁迫使裸燕麦种子的Gp、Gi、Vi、MGT、SDW和D值显著下降(见表8),表明中高浓度的盐碱混合胁迫对裸燕麦种子的萌发和幼苗生长产生显著抑制作用。这与杨科等[20]的盐碱混合胁迫对不同品种燕麦种子萌发和幼苗生长影响的趋势基本一致,但程度有所不同。
3.2 外源H2S 对盐碱胁迫下裸燕麦种子萌发特性的影响
利用外源信号物质缓解作物盐碱胁迫是一种有效方式。目前在缓解燕麦盐碱胁迫伤害上施用的外源信号物质主要有NO 和H2O2等[21~22],而利用外源气体信号H2S 供体NaHS 浸种能否缓解盐碱胁迫对作物种子萌发抑制的研究迄今鲜见报道。有研究表明,用NaHS 处理能够减弱NaCl 胁迫对紫花苜蓿种子萌发及幼苗生长的抑制[10];NaCl 胁迫下两种耐盐性不同的番茄种子发芽率、发芽势、发芽指数和活力指数随着NaHS 浓度提高呈先升后降趋势[11]。前人的这些研究以单一中性盐胁迫为对象,主要针对NaHS 处理浓度对作物种子活力的影响。本研究模拟土壤盐碱环境,探讨了盐碱混合胁迫下盐碱浓度和NaHS 浸种浓度交互对裸燕麦种子萌发特性的影响,并采用隶属函数法综合评价了外源H2S 对盐碱胁迫下裸燕麦种子萌发的影响。结果发现,NaHS 浓度及NaHS 浓度和盐碱浓度的交互作用对Gp、Gi、Vi、MGT、SDW 和D值有显著或极显著的影响(见表7)。本试验中,50和100 μmol·L-1NaHS 处理没有引起Gp 的显著改变,却使Gi、Vi 和D 值升高,MGT 和SDW 下降;200和400 μmol·L-1NaHS 处 理 的Gp、Gi、Vi、MGT、SDW 和D 值均显著降低(见表1~6,9)。Gp是最终发芽率高低的体现,Gi 和MGT 反映发芽速率的快慢,Vi 和SDW 与发芽苗的健壮程度相关[14~15]。这说明用50 和100 μmol·L-1NaHS 浸种虽不能提高盐碱混合胁迫下裸燕麦种子的发芽率和促进萌发苗生长,相反还对幼苗生长有抑制作用,但可加快种子的萌发速率,而200 和400 μmol·L-1NaHS 浸种则显著抑制裸燕麦种子的萌发。本试验结果进一步表明,50 和100 μmol·L-1NaHS 不同程度提高了0~30 mmol·L-1盐碱胁迫下的Gp(见表1)和Vi(见表3)及0~45 mmol·L-1盐碱胁迫下的Gi(见表2)和D 值(见表6),而MGT 和SDW 变化不大或显著下降(见表4~5);200 和400 μmol·L-1NaHS 浸种则降低了不同浓度盐碱胁迫下的Gp、Gi、Vi、MGT、SDW 和D 值,50~400 μmol·L-1NaHS 浸 种 使60 mmol·L-1盐碱胁迫下的各发芽指标无显著变化或明显下降(见表1~6)。这说明用NaHS浸种能够缓解盐碱胁迫对裸燕麦种子萌发的抑制,但缓解作用与盐碱胁迫强度和NaHS浓度有关。总体来看,50和100 μmol·L-1NaHS 能够缓解45 mmol·L-1以下浓度盐碱胁迫对种子萌发的抑制,其中50 μmol·L-1NaHS 的 效 果 好 于100 μmol·L-1,而200 和400 μmol·L-1NaHS 浸种反而会加重盐碱胁迫对种子萌发的抑制,NaHS 浸种不能缓解60 mmol·L-1盐碱胁迫对裸燕麦种子萌发的抑制。这与鲍敬等[23]以小麦种子为材料的研究结果基本一致。而外源H2S 促进盐碱胁迫下作物种子萌发的作用机理尚需进一步探讨。
4 结论
外源H2S 供体NaHS 浸种可以提高裸燕麦种子在盐碱混合胁迫下的萌发能力,且这种作用与NaHS 浓度及盐碱浓度有关,以50 μmol·L-1NaHS浸种缓解低于45 mmol·L-1盐碱混合胁迫的效果最佳,NaHS 对60 mmol·L-1盐碱混合胁迫抑制裸燕麦种子萌发无缓解作用,高浓度(200和400 μmol·L-1)NaHS加重盐碱胁迫对裸燕麦种子萌发的抑制。

