基于CRISPR/Cas9的拟南芥CKX3基因编辑载体构建及转化研究
王泽琛 肖 荣 欧阳乐军* 李莉梅 梁楚炎 潘璟茵 刘智超
(1. 喀什大学生命与地理科学学院,叶尔羌绿洲生态与生物资源研究高校重点实验室,喀什 844000;2. 广东石油化工学院生物与食品工程学院,茂名 525000)
植物生命活动的正常代谢由激素调控,其影响着植物的生命周期中的全过程。植物激素包括有生长素(auxin)、细胞分裂素(cytokinin,CK)、赤霉 素(gibberellin,GA)、脱 落 酸(abscisic acid,ABA)、油菜素甾醇类(brassinosteroids,BRs)、乙烯(ethylene,Eth)、茉莉酮酸酯类(jasmonates,JAs)、多胺(polyamines,PAs)以及水杨酸类(salicylic acid,SAs)等九大类[1],这些激素在植物体内构成一个复杂的调控网络,调控着植物生命周期中的各阶段。
细胞分裂素氧化酶(cytokinin oxidase,CKX)在20 世纪70 年代首次发现于烟草的髓组织培养物粗匀浆中,之后随着研究的深入在菜豆、蚕豆、小麦和玉米中相继被报道[2]。CKX 是一种黄素酶,对DNA 的次级代谢产物—细胞分裂素(CK)有着很强的专一性。CKX 是目前已知的专一降解天然异戊烯类CK 及其核苷的酶,该反应为不可逆降解,被认为是调节植物内源CK 含量的关键因素之一[3]。在CKX 发现之后的十多年中,绝大多数学者认为CKX 为含铜的胺氧化酶,在催化反应中其活性受到氨基乙腈和氰化物强烈抑制并且需要分子氧参与。研究表明CKX可以降解作为电子受体的2,6-二氯靛酚。随后,代谢产物H2O2在玉米重组CKX的研究中检测不到[4]。证明从大麦和小麦中纯化的CKX 的催化反应无需氧且不产生H2O2,因此建议将该酶更名为脱氢酶[5]。目前,在多种植物中CKX基因已经被克隆鉴定。经研究发现,在不同的物种中CKX基因均为多基因家族[6]。随着植物CKX基因的获取、转基因技术的发展以及模式植物的建立,极大加快研究CKX基因的功能的步伐。在转CKX的拟南芥植株中,CKX 的代谢明显增强,同时CK 的含量减少,转基因植株的表型为根部异常发达,而地上茎矮小[7]经过科学家们多年的研究证明,CK 对地上部分茎为促进作用,而对地下部分的根系统为负调控作用[8]。在拟南芥中转入Ds CKX1基因后,该植株表现出CK 不足的性状[9]。也有研究表明在调控植物相关花器官的发育过程中CKX 也起到十分重要的作用,在玉米中花特异性启动子下游转入ZmCKX1基因,在启动子的控制下,转基因植株花芽检测到CK 含量显著地减少,并表现出雄性不育的症状[10]。作为降解CK的酶CKX广泛存在于植物各个部位,因此研究CKX的功能和代谢具有重要的现实意义。
CRISPR/Cas是细菌和古菌在长期进化过程中形成的一种免疫系统,该系统可以抵抗外源性的遗传物质的入侵,为它们提供获得性免疫。CRISPR/Cas 系统可以精准识别出外源性遗传物质,并将外源基因切断并沉默其表达[11]。正是因为这种精准的靶向功能,所以成为一种快速高效的基因组编辑工具。在自然界中,CRISPR/Cas9 系统是CRISPR/Cas 系统众多类型中的一种,而其在实际应用中更适合于基因编辑,因此对其研究最深入,应用相对比较成熟。利用CRISPR/Cas9 系统,在模式植物拟南芥中,选取部分其CKX基因构建一种带有红色荧光蛋白基因mCherry定向敲除基因的CRISPR/Cas9 载体。在转化后进一步检测拟南芥CKX基因编辑后对于其生长发育的影响。将可视化筛选与分子鉴定相结合,为后续研究纯合转基因后代RNA 丰度、激素水平提供材料。纯合转基因子代还可再进行敲除,达到CKX基因家族的单敲除、部分敲除,甚至完全敲除。本研究建立的高效编辑载体不仅局限于模式植物的应用,还可进行更多生物的基因编辑研究。从而为植物功能基因编辑、植物激素调控研究提供借鉴与参考。
1 材料和方法
1.1 主要试验材料
本试验所用的带有荧光筛选标记基因mCher‐ry的质粒pHDE-mCherry由加州大学(圣地亚哥分校)Professor Zhao Yunde 赠送,DH5α大肠杆菌感受态细胞和GV3101 农杆菌感受态细胞分别购自广州鼎国生物技术有限公司和上海维地生物技术有限公司,Col-0 野生型拟南芥生长于广东石油化工学院植物培养室。
1.2 主要试验试剂
质粒小提试剂盒、琼脂糖凝胶DNA 回收试剂盒、Platinum SuperFi ⅡDNA 聚合酶购于赛默飞公司、Epicentre T5 exonuclease、Husion DNA polymerase(DNA 聚合酶)、BsaI 限制性内切酶和Taq DNA Ligase(DNA 连接酶)购自NEB 公司(美国),DNA Loading Buffer、氯霉素、卡那霉素、Tiangen DNA Marker 购自天根生化(北京)科技有限公司、引物合成及基因测序在上海生物工程有限公司完成,二硫苏糖醇(DTT)购自碧云天生物技术公司。
1.3 靶位点的设计
在NCBI 上查阅下载拟南芥CKX3、CKX4、CKX7基因序列,以此目标序列。通过CRISPR/Castarget 在线设计网站(http://crispr.dbcls.jp)分别设计CKX基因的2个Target位点。
1.4 引物设计
实验所用引物均在NCBI引物在线设计,并由上海生工生物工程股份有限公司进行合成(见表1)。
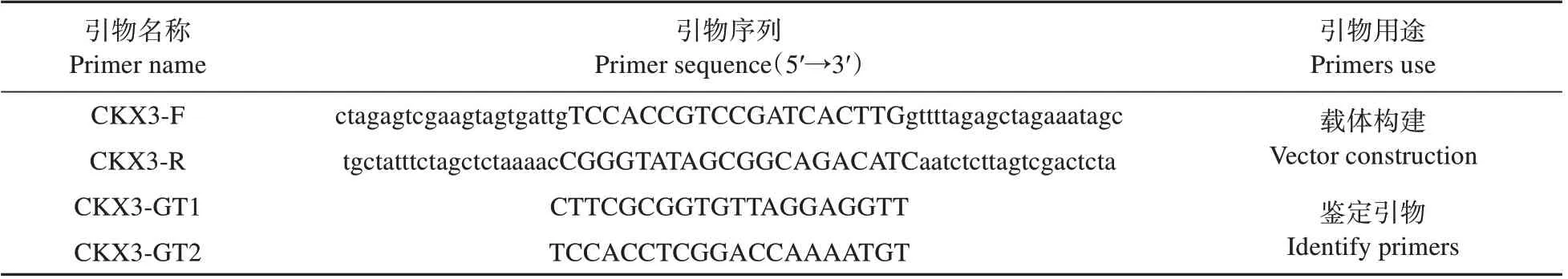
表1 引物序列Table 1 Primer sequence used in the expriment
1.5 pHEE401-mCherry-CKX表达载体的构建
1.5.1CKX3sgRNA片段的扩增
以pCBC 质粒(含gRNA)为模板,CKX3-F 和CKX3-R 为引物,进行PCR 扩增,反应程序:预变性94℃4 min,35 个循环(变性94℃30 s,退火56℃30 s,延伸72℃45 s),总延伸72℃2 min,4℃保存。然后使用1.4%的琼脂糖凝胶进行PCR 产物检验,将符合预期结果的目的条带切胶,用琼脂糖凝胶DNA 回收试剂盒进行回收。CKX4和CKX7的sgRNA片段按照上述方法进行扩增获取。
1.5.2 质粒pHEE401-mChenry的酶切及同源重组
用BasⅠ酶对pHEE401E 质粒进行酶切,酶切缓冲液(Cutsmart)2.0 μL,BsaⅠ(10U)0.8 μL,pHEE401E 质粒(850 ng·μL-1)3.0 μL,ddH2O 补足至20.0 μL,37℃反应6 h,以未酶切质粒为对照,将酶切好的质粒进行1.0%的琼脂糖凝胶电泳进行验证。
将CKX3纯化回收到的目的片段与酶切产物进行同源重组,5.0 μL体系(重组酶2.5 μL,酶切质粒0.5 μL,目标sg RNA片段2 μL),50℃水浴1 h。
1.5.3 重组产物转化大肠杆菌与菌液PCR鉴定
利用热击法将重组产物导入DH5α 感受态细胞,将转化后的DH5α 感受态细胞在LB 固体培养基上(含Kan)培养12 h。每个同源载体从转化后的培养基上挑取单克隆,接种至500 μL LB培养基中,37℃下200 r·mim-1摇床培养5 h 后进行PCR 鉴定。反应程序:预变性94℃4 min,35个循环(变性94℃30 s,退火56℃30 s,延伸72℃45 s),总延伸72℃2 min,4℃保存。
1.5.4 重组PHEE401-mCherry-CKX的质粒提取与重组质粒鉴定
将菌液PCR 结果符合预期的菌液在LB 液体培养基中(含50 mg·mL-1卡那霉素)扩繁培养,并于37℃摇菌12 h,用质粒小提试剂盒提取重组质粒,并进行质粒PCR 鉴定,反应条件同菌液PCR。挑选质量较好的的重组质粒送到生工生物工程股份有限公司(广州)测序,并用Mega7 软件进行序列比对。
1.6 拟南芥的转化
1.6.1 重组质粒转化农杆菌及浸染液的配制
将测序成功的质粒转入农杆菌感受态细胞,制备工程菌浸染液。
1.6.2 拟南芥的浸染
选用未开放花苞的Col野生型拟南芥,如果已经开放花蕾的植株,需在浸染前1 d 前将所有已经开放的花蕾以及出现的果荚剪除。用配置好的工程菌浸染液浸染花苞,并轻轻搅动,在浸泡1~2 min 后取出,并用小木棍将其固定支撑植株,叶片以及茎上的残留液体用吸水纸吸除,使用保鲜膜将浸泡好的拟南芥罩住,并留有一定孔洞透气,暗培养3 d 后正常培养,待新一批花苞长出时再次浸染。在果荚成熟后及时收取,并做好标记。
1.7 转化后代的可视化筛选与鉴定
将转化后的种子命名为T0,然后利用倒置荧光显微镜在T0代种子中筛选带有红色荧光的种子并种植,得到的植株命名为T1。
观察T1植株的表型是否与野生型植株有所异同,并剪取T1植株(尤其是性状特殊)幼嫩叶片,提取植株的DNA,以此为模板,并利用对应CKX基因的GT1 和GT2 这对鉴定引物对目标序列进行PCR扩增,并用1.0%的琼脂糖凝胶电泳后初步鉴定目的基因打靶的优劣。
选取电泳结果符合预期的植株,再次提取其基因组,并使用高保真Pfu 酶再次PCR,并使用1.0%琼脂糖凝胶电泳,用DNA 凝胶回收试剂盒回收PCR 产物,并送往生工生物工程股份有限公司(广州)测序。使用Mega7 软件进行序列比对验证目标基因编辑情况。
1.8 拟南芥突变体激素测定
取CKX3 纯合突变体幼苗的全部根部进行激素提取和测定。操作步骤为:突变体幼苗全部根部样品用液氮研磨,经异丙醇/盐酸、二氯甲烷处理、氮气除有机相、甲醇(1%甲酸)溶解后,进行HPLC-MS/MS检测。
取野生型幼苗全部根部进行激素提取和测定。方法如同突变体提取。
2 结果与分析
2.1 pHEE401E-mCherry-CKX3 表达载体的构建结果
经PCR 扩增目的基因条带CKX3sgRNA(见图1A),大小为600 bp 左右,与预期扩增长度610 bp相符,切胶回收后可与酶切后的质粒同源重组。
重组质粒经热激法导入DH5α感受态细胞后,菌液PCR 结果(见图1B)显示,扩增条带大小与预期结果相符。选取图1B 中符合预期结果的菌液进行扩大培养之后,分别提取CKX3sgRNA 的pHEE401E-mcherry-CKX3表达载体质粒,进行质粒PCR 检验结果(见图1C),与预期结果相符。表明分别含有CKX3sgRNA、的pHEE401E-mCherry-CKX表达载体构建成功。
2.2 重组质粒pHEE401E-mCherry-CKX 转化农杆菌结果
将重组好的pHEE401E-mCherry-CKX3质粒分别转化GV3101农杆菌感受态细胞;为验证转化是否成功进行菌液PCR 鉴定(见图2),由图2 可知,条带大小600 bp 左右,与预期结果相符,证明农杆菌转化工程菌转化成功。
2.3 转化Col野生型拟南芥后的可视化筛选
在构建好含有拟南芥种皮重组启动子的重组质粒中启动荧光筛选标记,mCherry基因的红色荧光标记转化成功的T0种子,在580 nm 激发光中会发出红色荧光;没有转化成功的种子不会发出荧光(见图3)。基于这种可视化的筛选方法,能够更加快速筛选出阳性转化后代,极大地提高工作效率。
2.4 CKX3转化阳性T1后代分子鉴定
将阳性T0后代种子种植,在萌发后提取幼嫩叶片的DNA进行分子鉴定(见图4A),图4A显示在转化中有部分呈现出两条带的结果:一条为1 000 bp左右,另一条则为750 bp 左右,在与野生型结果条带(大约1 000 bp)对照可知为杂合子,即敲除CKX3等位基因中1个;另一情况为单一条带为500 bp左右且清晰,可知为完整敲除CKX3基因的纯合突变。
将鉴定结果中的纯合子,进行移栽成长之后再次进行DNA 基因组提取鉴定(见图4B)。图4B呈现单一500 bp 左右的条带,再次表明敲除成功。将PCR 产物进行切胶回收,将其送往上海生工广州分公司进行测序(见图5),表明在位于两个Target 位点之间的CKX3基因大片段敲除,与预期设计完全致。
2.5 CKX3转化阳性T0后代性状分析
T0后代中经可视化筛选,将阳性纯合拟南芥植株培养成熟,并与野生型对比(见图6);结果表明阳性纯合敲除CKX3基因的植株,相较野生型产生了自身解除顶端优势的性状,并可以明显观察到植株的主茎明显变粗,侧枝生长旺盛。由此可见,在当CKX3基因敲除之后,CK 代谢发生改变,持续积累于植株体内。结果导致自解除顶端优势,植株横向发展(杆茎变粗)。
2.6 CKX3转化阳性T1后代激素测定
经激素检测GA3、ABA、6-BA 在突变体中分别是0.503、3.633、4.280 ng·g-1,野生型含量分别为是0.190、2.766、3.223 ng·g-1经差异显著性检验都达到显著水平,且突变体中激素含量均比野生型拟南芥有所提高(见图7)。
3 讨论
在进行分子设计育种和功能基因组学基础研究的重要材料是植物突变植株,同时也是研究植物体内激素含量、代谢机理的重要材料。常规的植物突变体来源于剧烈的外界环境因素影响如物理、化学等因素或者自身DNA的错配导致突变,具有很大的盲目性和局限性,不能满足大规模的分子设计育种和功能基因组学研究的需求。随着生物技术的发展,在进行目标基因打靶的需求下,作为第三代基因编辑的技术CRISPR/Cas 就表现出其优越性,CRISPR-Cas技术因其操作便捷、有效得到广泛使用[12]。到目前为止,广泛使用的CRISPR/Cas 技术包括Ⅱ型的Cas9 以及Ⅴ型的Cas12a[13]具有成本低廉,操作简易方便且基因编辑效率的高效性的优点,只需将目标靶位基因设计入sgRNA中,并与Cas9 组装便可获取打靶载体[14]。其次,CRISPR/Cas9 技术体系在完成对目的基因的遗传编辑之后,在形成合子的时候伴随染色体的自由组合,加上一定的外界人工干预可在编辑后代中不留下转基因的痕迹、剔除外源基因、生物安全性高。特别在近年CRISPR/Cas9 技术的研究潮来临,其所具有的优势得到更一步挖掘和利用,应用范围也将越来越广泛,对任何物种的基因组编辑成为可能,促使更加深入了解各种基因的功能作用。
在基因编辑中,编辑目的靶位基因的成功表达检测是一件较为繁琐、成本较高的事情;在考虑目的靶位基因的表达高效性同时需要考虑基因表达的时间、空间特异性。利用来自于蘑菇珊瑚的红色荧光蛋白mCherry,所编码的蛋白具有很强的光稳定性[15]。在荧光显微镜的特定波长的激发下,应用外源转化元件具有荧光的特点。本研究中将种皮特异性启动子At2S3促使其表达,实现在转化后代中可视化筛选出阳性转化种子。CRISPR/Cas9表达系统的方法简单便于操作,基因打靶精度和效率都较高[16],经过可视化筛选后基因编辑植株的检测只需要进行简单的PCR 验证,即可确定是否获得基因编辑阳性的植株后代。
本研究分别通过设计CKX3的sgRNA,使其识别基因靶向序列,提高打靶特异性,最终构建pHEE401E-mCherry-CKX3的高效编辑载体,进行CKX3基因打靶。CKX 为降解CK 的活性酶类,当CKX 含量和活性受到影响,将造成CK 在植物体内的累积,并出现自身顶端优势解除的性状,侧面证明CK 可能为植物控制腋芽生长的信使。有研究证明当对植株打顶后,在之后6 h 可在腋芽检测到大量的CK[17]。并可在纯合植株的基础上,进行RNA 研究,进一步去验证CKX3基因对植物CK 代谢影响;另一方面也可将CKX4、CKX7载体浸染纯合植株,获得双突、多突的纯合植株,甚至将CKX家族全员敲除,更进一步研究CKX基因。进而通过CK 代谢控制为农业、林业等经济型植物的种植生产活动增产增收。但在具体应用、降低脱靶概率、提高基因重组效率和基因编辑后的优良性稳定遗传等仍是需要深入探究的问题。
——一道江苏高考题的奥秘解读和拓展

