毛果杨类胡萝卜素裂解双加氧酶基因家族全基因组水平鉴定及其干旱与盐胁迫响应分析
田双慧 程 赫 张 洋 刘 聪 夏德安 魏志刚
(1. 林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040;2. 国家林业和草原局盐碱地研究中心,中国林业科学研究院,北京
100091)
类胡萝卜素是广泛存在于光合生物和非光合生物(如细菌与真菌)中的一类异戊二烯化合物,在生物体生长发育过程中具有重要作用[1~2]。如叶绿体和有色体中的类胡萝卜素,在植物光合作用中发挥着光吸收、传递电子和清除三线态氧及超氧阴离子等作用[3~4]。此外,类胡萝卜素衍生产物玉米黄质醛可转化为植物激素脱落酸(abscisic acid,ABA),在植物非生物胁迫响应和种子发育等多个生物学过程中发挥重要作用[5~6]。
类胡萝卜素代谢途径中,类胡萝卜素裂解氧化酶(carotenoid cleavage oxygenases,CCO)可特异性催化裂解类胡萝卜素分子多烯链的共轭双键从而形成各种脱辅基类胡萝卜素及其衍生物[5,7]。CCO 含 有 一 个RPE65(retinal pigment epithelial membrane protein)结构域,而且Fe2+能够激活其催化活性[8~13]。根据底物是否形成环氧结构,CCO 可以进一步分为类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenases,CCD)和9-顺式-环氧类胡萝卜素双加氧酶(nine-cis-epoxycarote noid dioxygenases,NCED)[14]。植物中,第一个参与前体黄素生物合成的类胡萝卜素裂解酶NCED 来自于脱落酸激素缺陷型玉米(Zea maysLinn)突变体[15]。拟南芥(Arabidopsis thaliana)基因组CCD家族 可 分 成CCD1、CCD4、CCD7和CCD8四 个 亚族[9,16],其中CCD1 和CCD4 主要作用于9,10(9’10’)双键的切割,可催化C40(类胡萝卜素)和C27(类萜)形成如β-紫罗兰酮和香叶基丙酮类C13 和C14 化合物,在气味性状的形成中具有重要作用[17~18];CCD7 和CCD8 能够连续氧化β-胡萝卜素产生独角金内酯激素合成前体[19~21],在分枝形成、侧根形成、种子萌发以及干旱和盐胁迫响应等生物学过程中起重要作用[22]。大豆(Glycine max)CCD在盐、干旱、低温及高温胁迫下,表达水平发生了明显的变化,表明大豆CCD参与其非生物胁的迫响应过程[23]。甘蓝(Brassica oleracea)CCD1和CCD4对干旱和盐分胁迫均具有较高响应能力[10]。苹果(Malus domestica)CCD在盐和干旱胁迫下表达量均发生明显变化,表明MdCCD参与苹果非生物胁迫响应过程[24]。上述结果表明,CCD家族基因在植物生长发育和逆境胁迫响应中具有重要生物学功能。然而,目前为止,尚无全基因组水平鉴定毛果杨CCD家族基因的研究。
毛果杨(Populus trichocarpa)是首个被全基因组测序的木本植物,也是研究生长发育、材质材性、逆境胁迫响应和其它重要性状分子机制的模式植物。本项研究在全基因组水平鉴定出毛果杨CCD家族成员的基础上,对其系统进化、同源关系、选择压力在进化中的作用、基因结构、顺式作用元件和编码蛋白保守基序等特征进行了分析。此外,利用实时荧光定量PCR,对PtrCCD家族成员的组织表达特性以及干旱与盐胁迫的响应特性进行分析。上述结果将为进一步阐明PtrCCD家族基因在其生长发育与逆境胁迫响应中的生物学功能奠定了基础。
1 材料与方法
1.1 毛果杨CCD家族成员鉴定及基本特征分析
利用报道的拟南芥CCD 氨基酸序列比对Phytozome 网站(https://Phytozom-e.jgi.doe.gov)中的毛果杨基因组数据库,同时在毛果杨数据库检索已注释的CCD,将获得的序列结果汇总并剔除重复序列后作为候选基因。为了验证初始结果的可靠性,将候选基因的氨基酸序列上传至HMMER 网站(https://www.ebi.ac.uk/To-ols/hmmer)以及NCBI保守结构域数据库(https://www.ncbi.nlm.nih.gov/cdd/)鉴定保守结构域,以含有PRE65 结构域为标准进行筛选,并根据保守结构域鉴定蛋白类型,最终鉴定出PtrCCD家族全部成员。
从Phytozome 网站中获得PtrCCD家族成员的染色体位置、基因序列等信息,并根据与拟南芥同源关系进行命名,染色体位置信息经TBtools 软件进行处理。通过ExPasy(https://web.expasy.org)在线预测其等电点与分子质量[27]。通过Plant-mPLoc(http://www.csbio.sjtu.edu.cn/)在线预测其亚细胞定位位置[26]。
1.2 PtrCCD家族基因系统进化分析
采用MEGA X 软件的ClustalW 程序对鉴定出的PtrCCD与拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、油菜(Brassica napu)、豌豆(Pisum sativum)、牛油果(Persea americana)、菊花(Chry‐santhemum morifolium)、、红木(Bixa orellana)及菜豆(Phaseolus vulgaris)8 个物种CCD编码的氨基酸序列进行多序列对比,并采用临近法(Neighborjoining)构建系统进化树。其中,bootstrap 设置参数1 000 次重复,得到系统发育进化树数据,经iTOL(https://itol.embl.de/)网站可视化处理[27~29]。
1.3 PtrCCD家族同源基因Ka和Ks分析
利用Blast(https://blast.ncbi.nlm.nih.go-v/Blast.cgi)相互比对PtrCCD 的CDS 序列,超过300 bp 且同源性超过80%为标准确定为同源基因对,同源关系通过TBtools 分析。同时,利用TBtools 计算同源基因之间的同义替换率(synonymous substitutions rates,Ks)、非同义替换率(nonsynonymous substitution rates,Ka)以及Ka/Ks 比率,并以此分析PtrCCD家族基因进化过程中的选择压力[30~31]。
1.4 PtrCCD 家族基因结构及其编码蛋白保守型基序分析
从毛果杨数据库(https://geno-me.jgi.doe.gov/portal/pages/dynamicOrganismDownload.jsf?organism=Ptrichocarpa)下载基因组数据后,通过TBtools软件提取各PtrCCD家族各基因外显子、内含子长度及位置信息并进行可视化处理[32]。
利用Motif Elicitation 网站MEME 程序(http://meme-suite.org/tools/meme)分析PtrCCD保守基序并用TBtools进行可视化处理[32]。
1.5 PtrCCD 家族基因启动子区顺式作用元件分析
在Phytozome 网站(https://Phytozom-e.jgi.doe.gov)下载PtrCCD家族各基因起始密码子前2 000 bp 的序列作为启动子区域汇总,再上传至Plantcare 网 站(http://bioin-formatics.psb.ugent.be/webtools/plantcare)进行顺式作用元件在线分析[33]。
1.6 PtrCCD家族基因表达特性分析
实验材料:野生型毛果杨来自东北林业大学林木遗传育种国家重点实验室,组织培养扩繁。将组培苗在1 个月大小时移栽到土壤中,在25℃、长日照(光照16 h/黑暗8 h)温室中培养3周。
组织表达特异性分析:在Phytozome 网站中下载各PtrCCD在毛果杨根、茎和叶的表达量。同时,进一步采集温室中培养3 周大小毛果杨的根、茎和叶组织用于qRT-PCR 验证。采用2-ΔΔCT计算相对表达量并利用TBtools可视化[34,36]。
干旱胁迫响应特性分析:上述在温室中培养3周大小的毛果杨幼苗随机分成3 组,每组包含3 棵毛果杨幼苗。干旱处理5、7 d,并以正常浇水处理作为对照组。分别采集上述处理组内各植株材料的根、茎和叶组织。
盐胁迫响应特性分析:将上述在温室中培养3周大小的毛果杨幼苗随机分成7 组,每组包含5 棵毛果杨幼苗。用100 mmol·L-1NaCI 处理3、6、12、24、36 及72 h,并以水处理作为对照组。分别采集上述处理组内各植株材料的根、茎和叶组织。
RNA 提取、反转录及qRT-PCR:利用植物总RNA 提 取 试 剂 盒(MiniBEST,TaKaRa)提 取 总RNA,然后采用PrimeScriptTMRT reagent Kit(Perfect Real Time,TaKaRa)试剂盒反转录RNA 获得cDNA 用于qRT-PCR。根据荧光定量引物设计原则,设计PtrCCD家族基因定量引物,以PtrActin为内参基因(见表1)。在赛默飞ABI 7500 实时荧光定量PCR 仪上进行试验,体系如下:2×TransStart TOP/Tip Green qPCR Supermix 10 μL、上下游混合引物(10 μmol·L-1)0.4 μL,cDNA 1.5 μL,Passive Reference Dye(50×)0.4 μL,加ddH2O 至20 μL。反应条件:94℃30 s;94℃5 s,60℃15 s,72℃35 s,循环40 次;95℃15 s,60℃1 min,95℃30 s。PtrCCD家族基因及内参PtrActin定量引物见表1。每组处理重复3 次,采用2-ΔΔCT法计算相对表达量并利用TBtools可视化[3]。
2.3 两组AECOPD患者血凝血因子检查结果 两组AECOPD患者血凝血因子水平比较,D-二聚体、血浆黏度、全血黏度低、高切均有统计学差异,患者病情与D-二聚体、血浆黏度、全血黏度低、高切呈正相关,见表3。

表1 PtrCCD家族基因qRT-PCR引物序列Table 1 Primer sequences for qRT-PCR of PtrCCD gene family
2 结果与分析
2.1 PtrCCD及其编码蛋白基本特性
根据已报道的拟南芥CCD 氨基酸序列对比毛果杨基因组数据库得到19个候选基因。以是否含有完整RPE65 结构域为标准筛选,剔除8 个不具完整RPE65 结构域的蛋白基因,共得到11 个PtrCCD(见表2)。根据它们与拟南芥CCD的直系同源关系分别命名为PtrCCD4a到PtrCCD8b(见图1 和表2)。PtrCCD家族基因编码蛋白氨基酸残基数在331~626、分子质量在37.86~70.42 kDa、理论等电点在5.75~8.42;亚细胞定位预测表明,PtrCCD4i编码蛋白在叶绿体、内质网和细胞质中均有分布,而其它家族基因编码蛋白均定位于细胞质(见表2)。
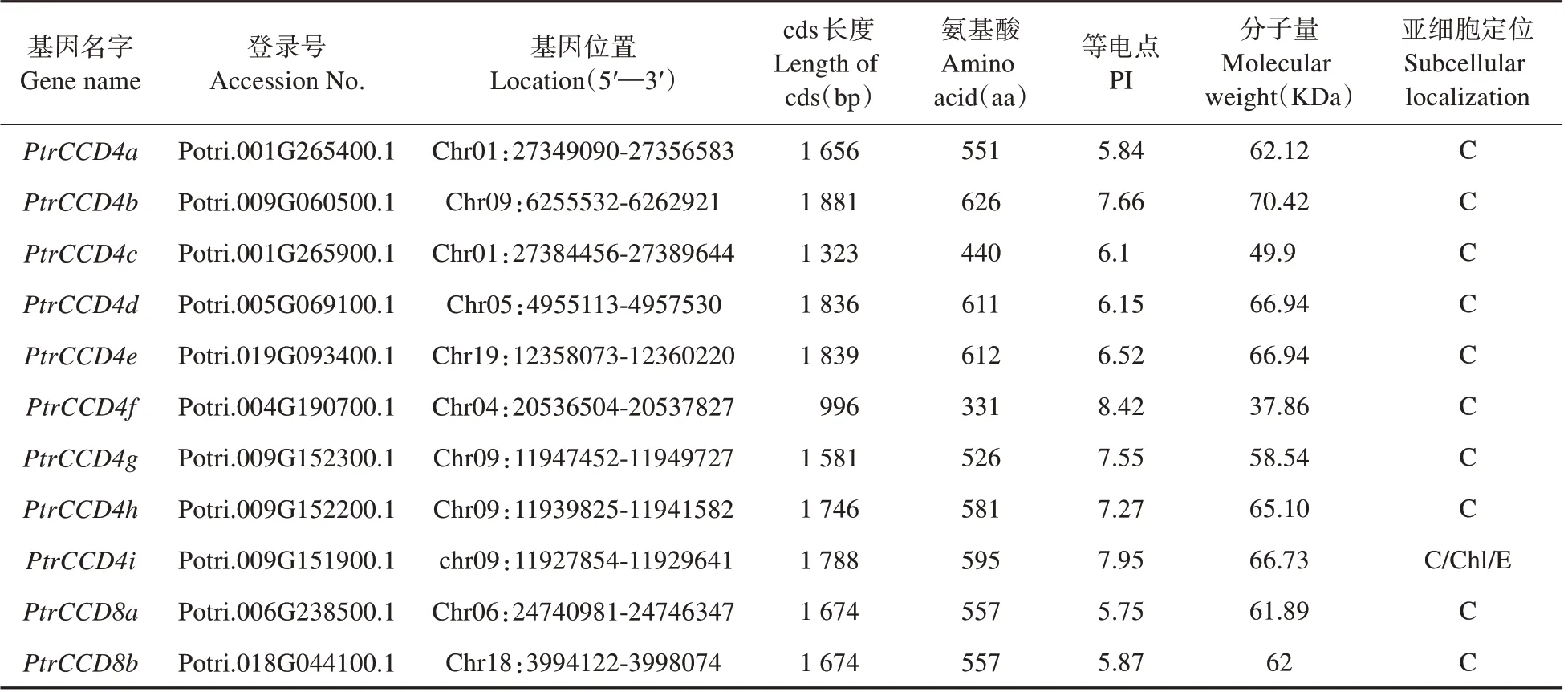
表2 PtrCCD及其所编码蛋白特征Table 2 Characteristics of PtrCCD and their encoded proteins
2.2 PtrCCD家族进化特性
为了解PtrCCD家族的进化历史,构建11 个PtrCCD 与拟南芥、水稻等8 个物种CCD 家族基因编码蛋白序列的进化树(见图1)。根据拟南芥CCD基因家族进化关系,将PtrCCD 家族基因分为CCD4和CCD8两个亚家族,其中CCD4包含9 个 基 因,CCD8包 含2 个 基 因。每 个CCD亚 族中,亲缘关系较近的物种CCD多处于同一分支中,如CCD1亚族中,豆科PvCCD1a、PvCCD1b、PsCCD1和BoCCD1、十字花科AtCCD1和BnCCD1分在同一分支。同时,我们也发现PtrCCD8a、PtrCCD8b与OsCCD8b、PtrCCD4a~PtrCCD4i与 水稻与OsCCD4a与OsCCD4b处于同一进化分枝,表明该植物CCD 基因家族在不同物种间较为保守,其进化晚于草本与木本、单子叶与双子叶植物的进化。
2.3 PtrCCD家族基因的扩张与收缩
为分析PtrCCD家族在进化过程中是否存在扩张与收缩现象,利用TBtools 软件分析了家族各基因在染色体位置。结果见图2 表明:毛果杨11个PtrCCD不均匀分布在1、4、5、6、9、18 和19 号染色体上,其中1号染色体有2个基因,9号染色体上有4个基因,其余染色体上均仅有1个PtrCCD。
PtrCCD家族共线性分析以及序列Blastn 分析表 明,PtrCCD4a和PtrCCD4b、PtrCCD4a和PtrCCD4c、PtrCCD4b和PtrCCD4c、PtrCCD4d和PtrCCD4e以及PtrCCD8a和PtrCCD8b分别具有共线性关系(见图3),且同源片段长度远大于300 bp,同源性超过80%,其中PtrCCD4a和PtrCCD4c同源性最高(见表3)。据此,我们推测上述基因对是由于基因片段复制而形成的旁系同源基因。此外,1 号染色体上由PtrCCD4a和PtrCCD4c形成基因 簇,9 号 染 色 体 上 由PtrCCD4h、PtrCCD4i和PtrCCD4g形成的基因簇(见图2),表明上述基因是由基因串联复制事件演化而来。
为了阐明选择压力在PtrCCD家族进化中的作用,利用TBtools 分析了PtrCCD家族同源基因的Ks 值、Ka 值和Ka/Ks 值。结果(见表3)发现,5 对同源基因Ka/Ks均远小于1,表明PtrCCD家族在进化过程中经历了较强的纯化选择。
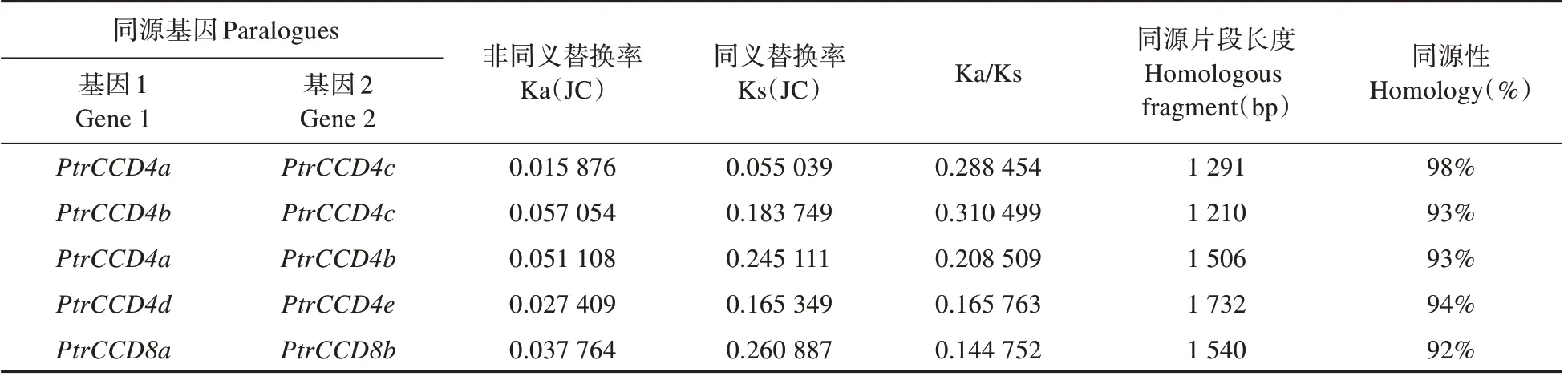
表3 同源PtrCCD的Ka/Ks比值及同源性Table 3 Ka/Ks values and homologous status of homologous PtrCCD
2.4 PtrCCD家族基因结构以及编码蛋白结构特征
为了解PtrCCD家族各基因系统进化和基因结构以及其编码蛋白中保守基序之间的关系,结合PtrCCD家族的系统进化树对各基因结构以及编码蛋白保守结构域的分布进行了分析。结果(见图4)表明,PtrCCD家族各个基因的内含子、外显子分布方式在保持家族共有特征的同时,在进化过程中也产生了明显的分化。多数处于同一进化分支上的基因结构较为相似,如PtrCCD8a和PtrCCD8b均 含 有6 个 外 显 子。 同 时,除 了PtrCCD4i、PtrCCD4g和PtrCCD4f外,其它家族基因都含有UTR结构。
PtrCCD家族各基因编码蛋白保守基序分析表明,PtrCCD家族编码蛋白共含有20 个基序,其中Motif 1、Motif 2、Motif 3、Motif 9 和Motif 11 为家族共有基序(见图6)。此外,不同基因编码蛋白所含基序数量与种类存在一定的差异,但处于相同进化分支的基因编码蛋白具有相似的基序组合(见图6)。上述结果表明,PtrCCD家族基因编码蛋白结构在具有保守性的同时也产生了一定的分化。同时,处于同一进化分枝蛋白所含保守基序的数量与分布模式基本相同。
2.5 PtrCCD家族基因启动子元件特征
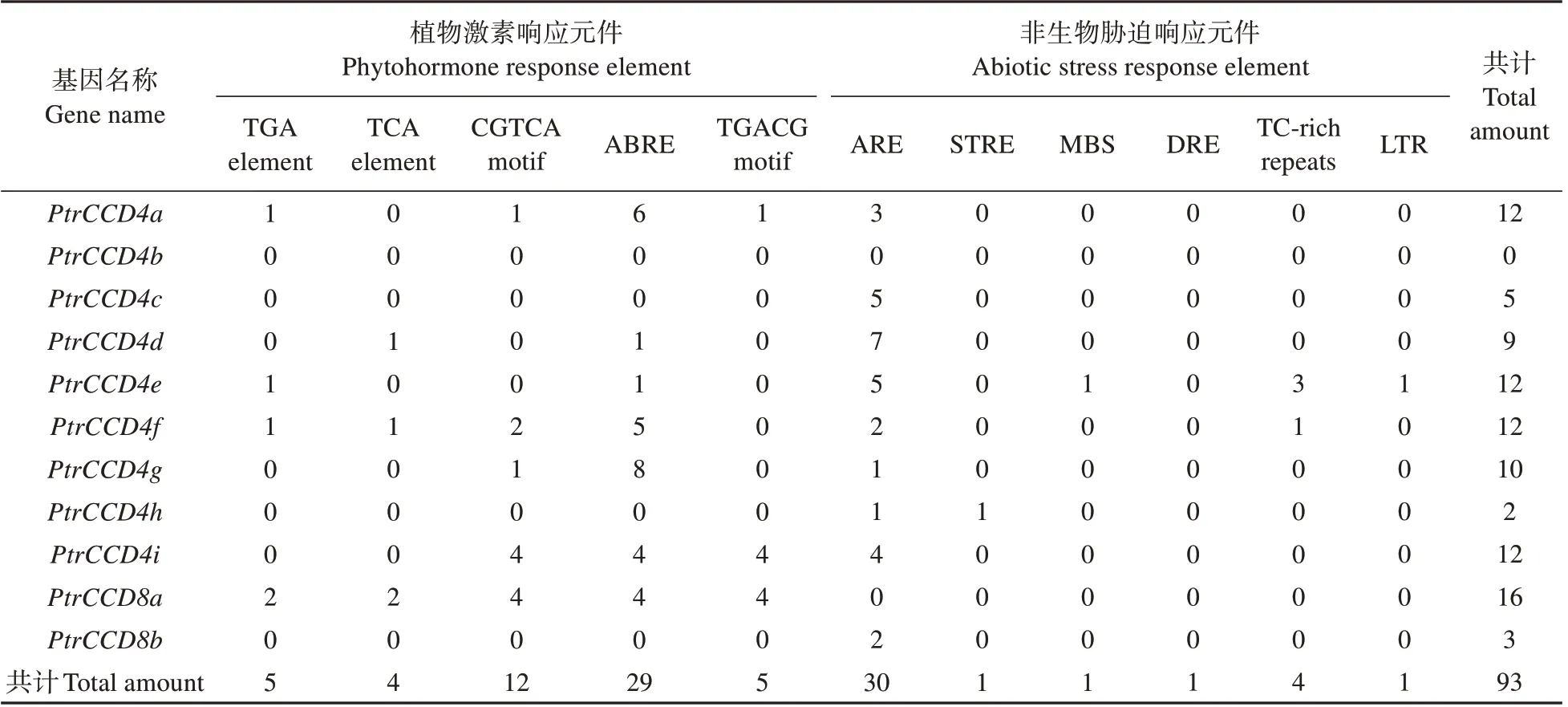
表4 PtrCCD家族基因启动子区域顺式作用元件Table 4 Cis acting elements in promoter sequence of PtrCCD family genes
为分析PtrCCD家族基因的进化对其启动子元件的影响,我们进一步结合PtrCCD家族进化树对各成员启动子所含元件进行比较分析。结果(见表4)表明,PtrCCD家族同一进化分枝中,各基因启动子所含元件的数量与种类基本相同;不同进化分枝中,各基因启动子所含元件存在种类和数量上的差异,如PtrCCD8a启动子中含有元件数量最多(16 个),而PtrCCD4b启动子中含有元件的数量最少(0 个)。上述结果表明,PtrCCD家族基因启动子序列在进化过程中,在保守性的基础上,也产生了一定的分化,从而导致不同进化分枝基因启动子中元件的种类和数量产生了分化。
2.6 PtrCCD家族基因的表达特异性
为了解PtrCCD家族基因在杨树生长发育中和响应环境中的潜在作用,先从Phytozome 网站收集的PtrCCD家族各基因在不同组织的表达量进行分析。结果(见图6A)表明,根部组织中,PtrCCD4c、PtrCCD4g和PtrCCD8a表达量高;茎部组织中,PtrCCD4c、PtrCCD4b和PtrCCD8a表达量低;叶部组织中,PtrCCD4b表达量最高。此外,利用qRT-PCR 技术进一步对PtrCCD家族各基因在根、茎和叶组织器官中的表达量进行了分析,结果(见图6B)表明,PtrCCD家族基因在根、茎和叶组织器官中表达存在差异,并与Phytozome 网站中PtrCCD家族各基因的表达整体吻合。上述结果表明,PtrCCD家族各基因在杨树不同组织器官的发育过程扮演不同角色。
为了确定PtrCCD家族基因的干旱胁迫响应特性,我们利用qRT-PCR 技术分析了干旱胁迫下5 d、7 d 时PtrCCD家族各基因在根、茎和叶组织中的表达量。结果表明,PtrCCD家族各基因对干旱胁迫均具有明显响应特性,同一分支基因响应干旱胁迫表达模式基本相同,但各基因的响应能力大小不同。在茎中多数PtrCCD家族基因随着干旱胁迫时间的延长表达量呈现先上升后下降的趋势,而在叶中,多数PtrCCD基因随胁迫时间的延长则表现为下降趋势(见图7)。上述结果表明,PtrCCD家族基因在杨树生长发育和干旱胁迫响应具有不同作用。
为了确定PtrCCD家族基因的盐胁迫响应特性,我们利用qRT-PCR 技术分析了100 mmol·L-1NaCl 胁迫不同时间(3、6、12、24、48 和72 h)时PtrCCD家族各基因在根、茎和叶组织中的表达量。结果(见图8)表明,PtrCCD家族各基因对NaCl 胁迫均具有明显响应特性,同一分支基因响应NaCl胁迫表达模式基本将同,但各基因的响应能力大小不同。在根和茎两组织中多数PtrCCD家族基因随着盐胁迫时间的延长表达量呈现先上升后下降的趋势且在胁迫后的12 h 达到高峰,而在叶中,多数PtrCCD基因随胁迫时间的延长则表现为上升、下降再上升的双峰表达趋势且多在e 达到峰值。上述结果表明,PtrCCD家族基因在杨树生长发育和非生物逆境胁迫响应具有不同作用。
3 讨论
前期研究表明,CCD家族基因在草本植物生长发育以及逆境胁迫等生物学过程中具有重要作用[18,20,22,24~25],如茄子(Solanum melongena)[14],辣椒(Capsicum annuum)[34],甘 蓝(Brassica oleracea)[10]和水稻[12]等。本项研究通过对毛果杨全基因组分析,共鉴定出11 个PtrCCD,可分成为CCD4和CCD8亚族,分别包含包括9 个和2 个基因(见图1)。拟南芥和水稻中包含四个亚族,豌豆中含有CCD1 和CCD4 两个亚族,菊花中含有CCD3 和CCD4 两个亚族,而油菜、牛油果、红木和菜豆中仅含有CCD1 亚族,说明不同物种间基因存在差异,并且推测在物种进化过程中,一些基因的功能被替代,导致毛果杨中只含有CCD4 和CCD8 两个亚族。拟南芥CCD家族包括CCD1、CCD4、CCD7 和CCD8 亚族,每个亚族含有1 个基因[9],水稻中含有以上四个亚族,包含8个基因,其中CCD8包含4个基因,CCD4 中包含2 个基因,菜豆中仅含有CCD1一个亚族,其含有两个基因,油菜、牛油果、红木中仅含有1 个基因,而毛果杨中含有2 个亚族,11 个CCD基因,因此推测毛果杨CCD家族在进化过程中出现了基因扩张现象。PtrCCD家族成员不均匀的分布在毛果杨7 条染色体上,其中9 号染色体上最多,有4 个PtrCCD(见图2),1 号染色体上含有2个PtrCCD,而4、5、6、18 和19 号染色体上仅分布1个PtrCCD;同时,PtrCCD家族11 个基因中有5 对具有旁系同源关系,且Ka/Ks 比值远低于1(见表3),其中仅有PtrCCD4a和PtrCCD4c是由基因串联复制事件演化而来,而其余的4对是由基因组复制事件演化而来,表明它们在进化过程中经过了较强的纯化选择,从而导致有害的非同义替换在进化过程消失,也进一步表明基因复制是PtrCCD基因家族扩张的主要原因(见图2~3 和表3),这与已报道苹果CCD家族分析结果十分相似[34]。同时,本项研究结果也与基因复制事件植物基因进化的重要机制的公认结论一致[35,37]
PtrCCD家族基因编码蛋白含有多个基序,而Motif 1、Motif 2、Motif 3、Motif 9、Motif 11(见图5)是所有PtrCCD家族基因编码蛋白均含有的基序,表明这5 个基序是该家族的特征基序,此外,PtrCCD家族基因还含有其他的基序,表明该基因家族生物学功能的多样性。在毛果杨PtrCCD基因结构中,同一分支的基因具有较为相似的结构,而不同分支间差异较大,如PtrCCD8a和PtrCCD8b都具有6 个外显子和5 个内含子,PtrCCD4a和PtrCCD4b都具有13 个内含子和14 个外显子,而PtrCCD4d、PtrCCD4e、PtrCCD4h和PtrCCD4i仅含有一个外显子而不含内含子,这与柑橘(Citrus clementina)家族情况相似[38]。上述结果也预示着PtrCCD家族不同亚组之间基因功能产生了分化。
PtrCCD家族基因启动子区域含有5 种植物激素响应元件和6 种非生物胁迫响应元件(见表4),如厌氧诱导元件、胁迫响应元件和MYB 干旱诱导性结合位点。同时,各个家族所含元件数量与种类也存在差异,PtrCCD8a启动子共含有16 个响应元件,而PtrCCD4h仅含有2 个元件。上述结果表明,PtrCCD家族基因在毛果杨生长发育与逆境胁迫响应中具有重要作用,但各个成员发挥的作用存在差异。
PtrCCD家族成员的表达特性分析表明,其中3 个家族成员在根部表达水平较高,7 个在茎部表达水平较高,3个在叶部表达水平较高(见图6),这可能预示着各个成员在毛果杨生长发育过程中发挥着不同的作用。干旱和NaCl 胁迫后CCD家族qRT-PCR 结果发现,毛果杨CCD 家族基因表达量均随着胁迫时间的长短有不同程度的响应(见图7~8),其中PtrCCD8b都表现为先上升后下降的趋势;毛果杨在盐胁迫不同时间下qRT-PCR 分析结果(见图8)表明,在根和茎中多数基因均表现为先上升后下降的表达趋势,这与大豆[24]和甘蓝[25]CCD家族在盐胁迫中表达情况较为相似;而不同的是,CCD家族在NaCl处理的毛果杨叶片中,表达量呈现出、上升、下降再上升的双峰趋势。盐胁迫对植物的伤害是一个复杂的生理生化过程,主要包括渗透胁迫、离子毒害,活性氧胁迫等[39~40]在盐胁迫环境下,植物首先受到渗透胁迫并作出相应调整[41],因此第一阶段上升的趋势可能是基因响应渗透胁迫的过程。土壤中的部分金属离子如Ca2+、Mg2+、Fe2+等沉积,从而抑制植物对这些金属离子的吸收,引起营养失衡,长期在盐胁迫环境下,植物对离子吸收不均衡,容易产生离子毒害[42~43],而第二阶段上升可能是因为某些CCD 家族的基因响应离子毒害的过程。以上结果表明,PtrCCD家族基因在干旱和盐胁迫情况下具有不同程度的响应能力,进一步表明该基因家族在非生物胁迫中具有重要作用。本研究对于PtrCCD家族基因生物学功能的鉴定和抗逆基因资源挖掘具有积极意义。

