超声波微波协同提取沙棘叶黄酮及其组成和活性研究
刘馨雨 张海生 许铭芯 辛相余 穆明月 梁鑫宇
(陕西师范大学食品工程与营养科学学院,陕西 西安 710000)
沙棘叶富含黄酮、多酚、多糖、维生素、微量元素、氨基酸等物质[1-2],具有抗氧化、抗癌变、降低血糖血脂、调节代谢等功能,可以作为生物活性物质和功能性食品的来源[3-4]。但是在沙棘采收过程中,沙棘叶往往被视作废弃物丢弃,从而造成资源严重浪费。研究表明,沙棘叶中黄酮类化合物是主要的抗氧化活性物质[5]。目前,对沙棘叶黄酮的研究主要集中于提取方法,有机溶剂萃取法、回流法等传统方法使用溶剂量大、得率低[6-7];酶解法、超临界流体萃取法等新兴方法提取率较高,但成本高,操作难度较大[8-9]。因此,寻求合适的沙棘叶黄酮提取方法并进行工艺优化,对开发利用沙棘叶、推进沙棘叶产业化发展具有一定参考价值。
近年来对沙棘叶黄酮的提取方法有超声波提取和微波辅助提取。在此基础上的超声波微波协同提取法是一种新兴的提取技术,因其整合了超声波、微波2种提取技术的优势,具有较好的应用前景[10]。研究表明,利用超声波微波协同技术提取阿拉比卡咖啡豆中的绿咖啡油[11]、荸荠皮中的总黄酮[12]、菠萝蜜果皮中的果胶[13],均获得了较高的提取率,且对产品品质的影响较小。而目前将超声波微波协同技术应用于沙棘叶黄酮提取中的研究极为少见。
本研究通过比较常规溶剂萃取、超声波辅助提取、微波辅助提取和超声波微波协同提取4种不同提取方法的沙棘叶黄酮得率及其组织结构变化,筛选出沙棘叶黄酮的最佳提取方法,并对提取工艺进行优化,测定沙棘叶黄酮组成成分和体外抗氧化活性,以期为沙棘叶的综合开发利用提供技术指导和理论依据。
1 材料与方法
1.1 材料与试剂
沙棘干叶:由延安市圆方集团公司提供,2019年6月采摘于延安市。
标准品:芦丁、儿茶素、槲皮素、山萘酚、异鼠李素、丁香酸、杨梅素、原花青素、大豆苷元、柚皮素,均购于美国Sigma公司。
乙醇、盐酸、色谱级甲醇、色谱级乙腈、亚硝酸钠、硝酸铝、氢氧化钠、水杨酸、过氧化氢、抗坏血酸、无水碳酸钠、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯化铁、硫酸亚铁、DPPH、ABTS,均为分析纯,购于天津市科密欧化学试剂有限公司。
1.2 仪器与设备
XO-SM100型超声波微波协同反应工作站,南京先欧仪器制造有限公司;Multiskan Go型全波长酶标仪,美国热电公司;Anke TGL-16G型飞鸽离心机,上海安亭科学仪器厂;YR-PTB型真空泵,上海亚荣生化仪器厂;PL203型电子天平,梅特勒-托利多仪器(上海)有限公司;雷磁PhSJ-4A型 pH计,上海久世环保科技有限公司;GZX-9146MBE型数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;SY-5000型旋转蒸发仪,上海亚荣生化仪器厂;UltiMate3000高效液相色谱仪,美国Thermo Fisher公司;Quanta 200环境扫描电子显微镜,美国FEI公司。
1.3 试验方法
1.3.1 沙棘叶样品处理 将沙棘叶置于电热鼓风干燥箱中,在55℃恒温条件下干燥4 h,粉碎过20目筛,备用。
1.3.2 沙棘叶黄酮的提取 常规溶剂萃取:参照韩雅慧等[14]的方法,精确称取5 g沙棘叶粉末于250 mL具塞三角瓶中,按1∶30 (g∶mL) 料液比加入150 mL 60%乙醇溶液,摇匀,盖塞,在室温下避光浸提24 h,过滤,滤液用旋转蒸发仪旋蒸后用95%乙醇溶解并定容至100 mL,待测。
超声辅助提取:参照Ghasemzadeh等[15]的方法,精确称取5 g沙棘叶粉末于超声提取杯中,按1∶30(g∶mL)料液比加入150 mL 60%乙醇溶液,采用150 W的超声功率提取20 min,过滤,滤液用旋转蒸发仪旋蒸后用95%乙醇溶解并定容至100 mL,待测。
微波辅助提取:参照Huang等[16]的方法,精确称取5 g沙棘叶粉末于250 mL烧杯中,按1∶30(g∶mL) 料液比加入150 mL 60%乙醇溶液,置于微波加热仪中,采用400 W的微波功率提取2 min,过滤,滤液用旋转蒸发仪旋蒸后用95%乙醇溶解并定容至100 mL,待测。
超声波微波协同提取:参照孙岩等[17]的方法,精确称取5 g沙棘叶粉末于250 mL烧杯中,按1∶30(g∶mL) 料液比加入150 mL 60%乙醇溶液,置于超声波微波协同反应工作站中,采用400 W的微波功率、150 W的超声功率提取20 min,过滤,滤液用旋转蒸发仪旋蒸后用95%乙醇溶解并定容至100 mL,待测。
1.3.4 黄酮含量的测定
1.3.4.1 芦丁标准曲线的制作 将20 mg芦丁标准品溶于60%的乙醇溶液中并定容至100 mL,即得0.2 mg·mL-1的芦丁标准溶液。参照都宏霞等[19]的方法,精密量取上述芦丁标准溶液0、0.5、1、1.5、2、2.5、3 mL至7个10 mL容量瓶中,加入0.3 mL 5%的NaNO2,静置6 min,再分别加入0.3 mL 10%的 Al(NO3)3溶液,静置6 min后加入4 mL 4% NaOH溶液,再用30%乙醇定容至10 mL,摇匀,静置15 min,最后于510 nm处测定吸光度值。设定横坐标为黄酮质量浓度,纵坐标为吸光度值,绘制标准曲线,得到芦丁标准曲线的回归方程为Y=7.350 8X-0.003 8,相关系数R2=0.999 8。
1.3.4.2 黄酮含量的测定 取0.3 mL沙棘叶黄酮提取液,参考上述操作测定吸光度值。根据回归方程和吸光度值计算沙棘叶中黄酮的含量。
1.3.4.3 黄酮得率的计算 按照以下公式计算黄酮得率:
R=(C×V)/m
(1)
式中,R:沙棘叶黄酮得率,mg·g-1;C:沙棘叶黄酮浓度,mg·mL-1; V:沙棘叶黄酮提取液体积,mL; m:沙棘叶粉末质量,g。
1.3.5 单因素试验 参照Ghasemzadeh等[15]的方法,固定超声功率150 W、超声温度30℃,分别考察不同乙醇体积分数(40%、50%、60%、70%、80%)、协同提取时间(5、10、15、20、25 min)、微波功率(200、300、400、500、600 W)和料液比(1∶10、1∶20、1∶30、1∶40、1∶50 g∶mL)对黄酮得率的影响。
1.3.6 响应面试验 以乙醇体积分数(A)、微波功率(B)、协同提取时间(C)为试验因素,黄酮得率为考察指标,进行三因素三水平的响应面试验,确定超声微波协同技术提取沙棘叶中黄酮的最佳工艺条件。试验设计如表1所示。
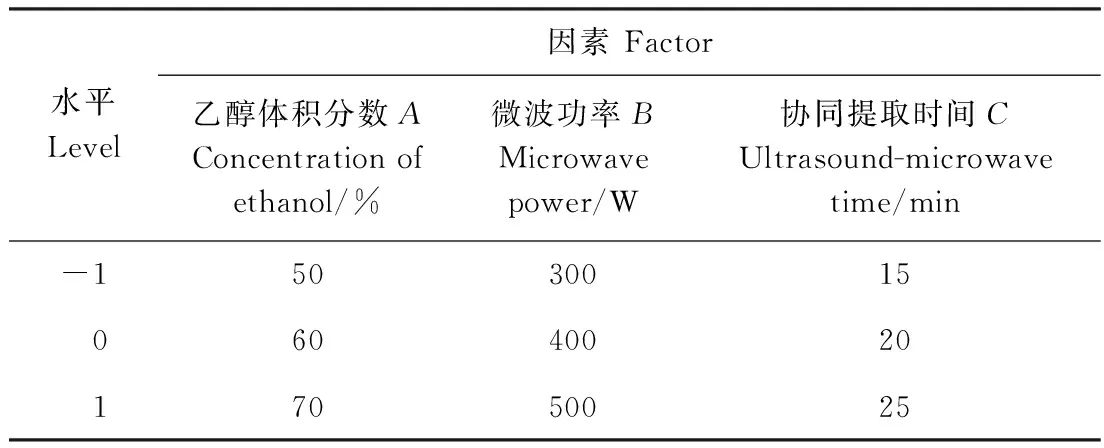
表1 响应面试验设计因素水平表Table 1 Factors and levels of response surface design
1.3.7 沙棘叶黄酮的组成成分及含量分析 利用超声波微波协同提取的最佳工艺条件提取沙棘叶黄酮,采用高效液相色谱法(high performance liquid chromatography, HPLC)对其组成成分进行分析。参照Weng等[20]的方法,取各样品提取液1 mL,0.45 μm滤膜过滤。液相色谱条件:采用UltiMate3000 HPLC系统,Diamonsil C18(2)(250 mm×4.6 mm,5 μm)色谱柱,流动相A为乙腈,流动相B为1%冰乙酸溶液,柱温30℃,检测波长280 nm,流速1.0 mL·min-1, 进样量20 μL,总运行时间50 min,洗脱程序见表2。

表2 高效液相色谱的梯度洗脱程序Table 2 Gradient elution program of HPLC
1.3.8 沙棘叶黄酮的抗氧化活性
1.3.8.1 沙棘叶黄酮对DPPH自由基的清除能力 利用超声波微波协同提取的最佳工艺条件提取沙棘叶黄酮,并进行下述抗氧化活性测定试验。
参照Choi等[21]的方法,将2 mL质量浓度为0.2、0.4、0.6、0.8、1 mg·mL-1的沙棘叶黄酮提取液加入到 2 mL 0.5 mmol·L-1DPPH乙醇溶液中,避光放置30 min,然后在517 nm处测定吸光度值。以Vc和蒸馏水代替黄酮提取液作为阳性和阴性对照,以无水乙醇溶液代替DPPH溶液作为本底对照。根据式(2)进行计算:
(2)
式中,d1:DPPH自由基清除率,%;A:沙棘叶黄酮溶液的吸光值; A0:阴性对照组的吸光值; Ax:本底的吸光值。
1.3.8.2 沙棘叶黄酮对ABTS自由基的清除能力 参照付晓丹等[22]的方法,取7.4 mmol·L-1ABTS溶液和2.6 mmol·L-1过硫酸钾溶液各5 mL混合均匀,室温避光放置过夜,然后加入无水乙醇至吸光值为0.68~0.72(在734 nm处)。向5支试管中分别加入0.2 mL质量浓度为0.2、0.4、0.6、0.8、1 mg·mL-1的沙棘叶黄酮提取液和5.8 mL ABTS+溶液,20 min后于734 nm处测定其吸光值,以Vc和蒸馏水代替黄酮提取液作为阳性和阴性对照,以无水乙醇溶液代替ABTS稀释溶液作为本底对照。根据式(3)进行计算:
(3)
式中,d2:ABTS自由基清除率,%;A:沙棘叶黄酮溶液的吸光值; A0:阴性对照组的吸光值; Ax:本底的吸光值。
1.3.8.3 沙棘叶黄酮的FRAP还原能力 参照Muller等[23]的方法,用0.1 mL质量浓度为0.2、0.4、0.6、0.8、1 mg·mL-1的沙棘叶黄酮提取液与4.9 mL FRAP 试剂反应,10 min后于593 nm处测定吸光度值。以Vc代替黄酮提取液作为阳性对照,以70%的乙醇作为本底对照。根据式(4)进行计算:
Ap=A-Ax
(4)
式中,Ap:FRAP还原能力;A:沙棘叶黄酮溶液的吸光值; Ax:本底的吸光值。
1.3.8.4 沙棘叶黄酮对羟基自由基的清除作用 参照Zhang等[24]的方法,向2 mL质量浓度为0.2、0.4、0.6、0.8、1 mg·mL-1的沙棘叶黄酮提取液中依次加入2 mL 6 mmoL·L-1硫酸亚铁溶液、2 mL 6 mmoL·L-1双氧水溶液和2 mL 6 mmoL·L-1水杨酸乙醇溶液,37℃恒温反应15 min,测定510 nm处的吸光值。以VC和蒸馏水代替黄酮提取液作为阳性和阴性对照,以蒸馏水代替过氧化氢溶液作为本底对照。根据式(5)进行计算:
(5)
式中,d3:羟基自由基清除率,%;A:沙棘叶黄酮溶液的吸光值; A0:阴性对照组的吸光值; Ax:本底的吸光值。
1.4 数据处理
采用SPSS 17.0软件进行统计分析,采用Duncan多元回归方法分析0.05水平上均值的显著性差异,选用Design-Expert.V8.0.6.1软件进行响应面分析。
2 结果与分析
2.1 不同提取方法对沙棘叶黄酮提取率的影响
常规溶剂萃取、超声辅助提取、微波辅助提取和超声波微波协同提取4种提取方法提取沙棘叶黄酮的得率如表3所示。通过常规溶剂萃取法提取的沙棘叶黄酮得率最低,仅有29.36 mg·g-1,超声波微波协同提取法提取的沙棘叶黄酮得率最高,为41.85 mg·g-1。与其他3种方法的黄酮得率相比,采用超声波微波协同提取法黄酮得率显著增加(P<0.05),分别提高42.54%、28.41%和16.83%,因此超声波微波协同提取法的提取效果最好。
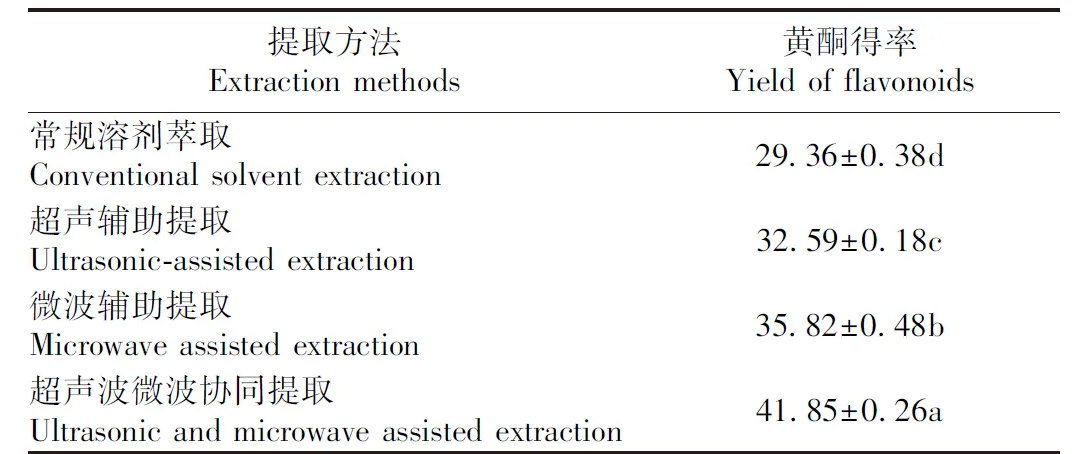
表3 4种提取方法的黄酮得率Table 3 Flavonoid yields of four extraction methods /(mg·g-1)
2.2 不同提取方法对沙棘叶组织结构的影响
经常规溶剂萃取、超声辅助提取、微波辅助提取和超声波微波协同提取4种方法提取后的沙棘叶粉末残渣的扫描电镜观察结果见图1。常规溶剂萃取处理的样品表面有完整的细胞组织,原来紧密的结构变得松散,细胞壁没有明显的破坏(B),但与未处理的样品相比,表面有轻微的裂痕。超声处理样品的细胞壁有一定程度的破坏(C),仍能看到大体的细胞结构,片状颗粒变得细小均匀,这是因为声波具有穿透作用,使溶剂穿透细胞壁,导致其破裂,且超声过程中产生的气泡也有助于细胞壁的破裂。经微波处理的样品表面破坏严重(D),仅保留小部分细胞结构,片状颗粒细碎松散,这是由于温度在微波过程中突然升高,粉碎了样品的组织结构。超声波微波协同处理的样品破坏最严重(E),细胞结构被完全破坏,产生很多空洞和层层断裂面,表面积增大,可能是超声波和微波的共同作用下,细胞内蒸气压升高,加速了细胞的破裂。可见,超声、微波处理提取会导致沙棘叶细胞的破裂和损伤,黄酮类物质更易溶出,常规溶剂萃取则是依靠溶剂扩散到固体基质中并通过溶解来萃取黄酮,因此4种方法下沙棘叶细胞破损程度大小为:常规溶剂萃取<超声辅助提取<微波辅助提取<超声波微波协同提取。

注:1和2分别为放大200倍和500倍。Note: 1 and 2 are 200× and 500× magnifications respectively.图1 未处理沙棘叶(A)、常规溶剂提取叶(B)、超声辅助提取叶(C)、微波辅助提取叶(D)和超声波微波协同提取叶(E)的扫描电镜观察Fig.1 Scanning electron microscopic images of residues in the extraction of untreated leaves (A),conventional-solvent extracted leaves (B), ultrasound-assisted extracted leaves (C), microwave-assisted extracted leaves (D) and ultrasound-microwave assisted extracted leaves (E)
2.3 单因素试验结果与分析
2.3.1 乙醇体积分数对沙棘叶黄酮得率的影响 如图2所示,随着乙醇体积分数的增加,沙棘叶黄酮的得率呈现先增加后减少的趋势,当体积分数为60%时得率最高(P<0.05)。当乙醇体积分数大于60%时,随着乙醇体积分数的逐渐增大,黄酮得率显著降低(P<0.05),这可能是因为沙棘叶黄酮的极性与60%乙醇相似,故在60%乙醇溶液中溶解度最大,提取率最高。
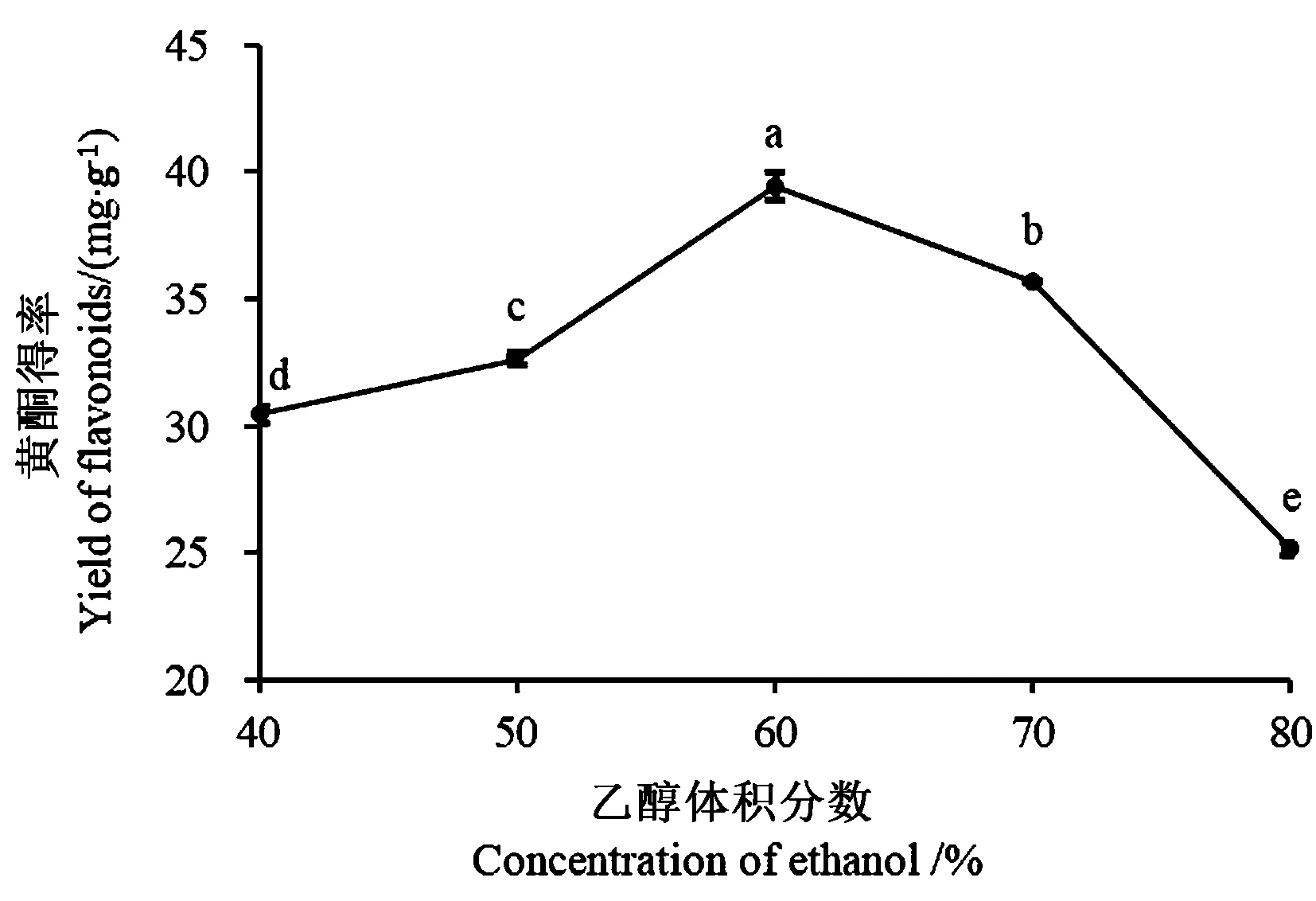
图2 乙醇体积分数对黄酮得率的影响Fig.2 Effect of concentration of ethanol on the yield of flavonoids
2.3.2 协同提取时间对沙棘叶黄酮得率的影响 如图3所示,随着超声波微波协同提取时间的增加,沙棘叶黄酮的得率先增加后降低,在20 min时提取效果最好。当协同提取时间小于20 min时,微波提取时间越长,溶液温度越高,黄酮溶出量越多,黄酮得率也越大;当协同提取时间大于20 min时,时间过长,可能会导致黄酮类物质在高温下发生降解、缩合等化学反应,也可能是由于乙醇溶液挥发,提取能力降低,导致得率降低。
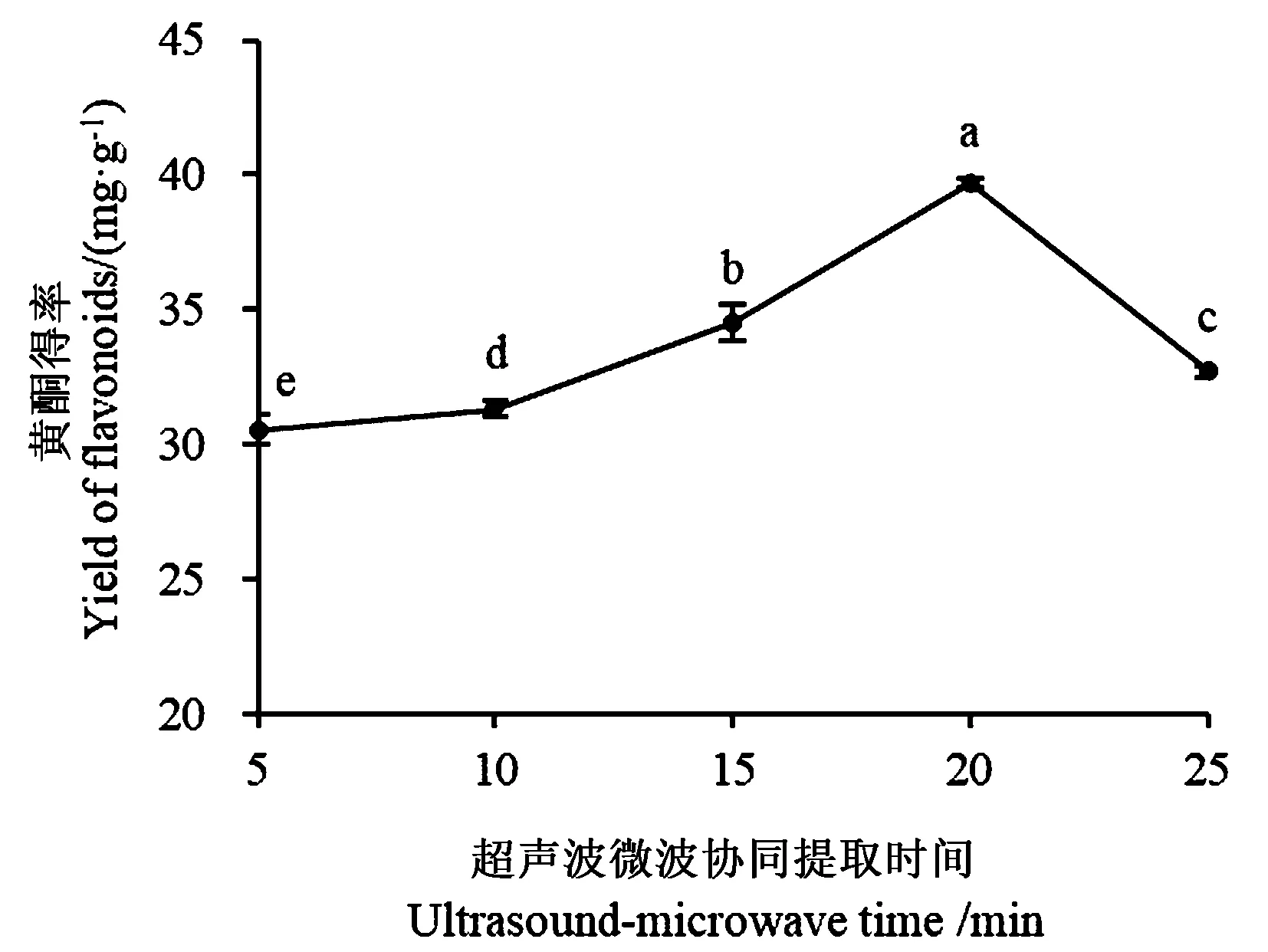
图3 超声波微波协同提取时间对黄酮得率的影响Fig.3 Effect of ultrasound-microwave time on the yield of flavonoids
2.3.3 微波功率对沙棘叶黄酮得率的影响 如图4所示,沙棘叶黄酮的得率随着微波功率的增加先升高后降低。功率小于400 W时,增加提取功率,可以加快分子运动,使沙棘叶黄酮更易溶出,得率升高;功率大于400 W时,功率的增加使沙棘黄酮提取液的温度过高,黄酮类物质可能发生降解,从而降低得率。
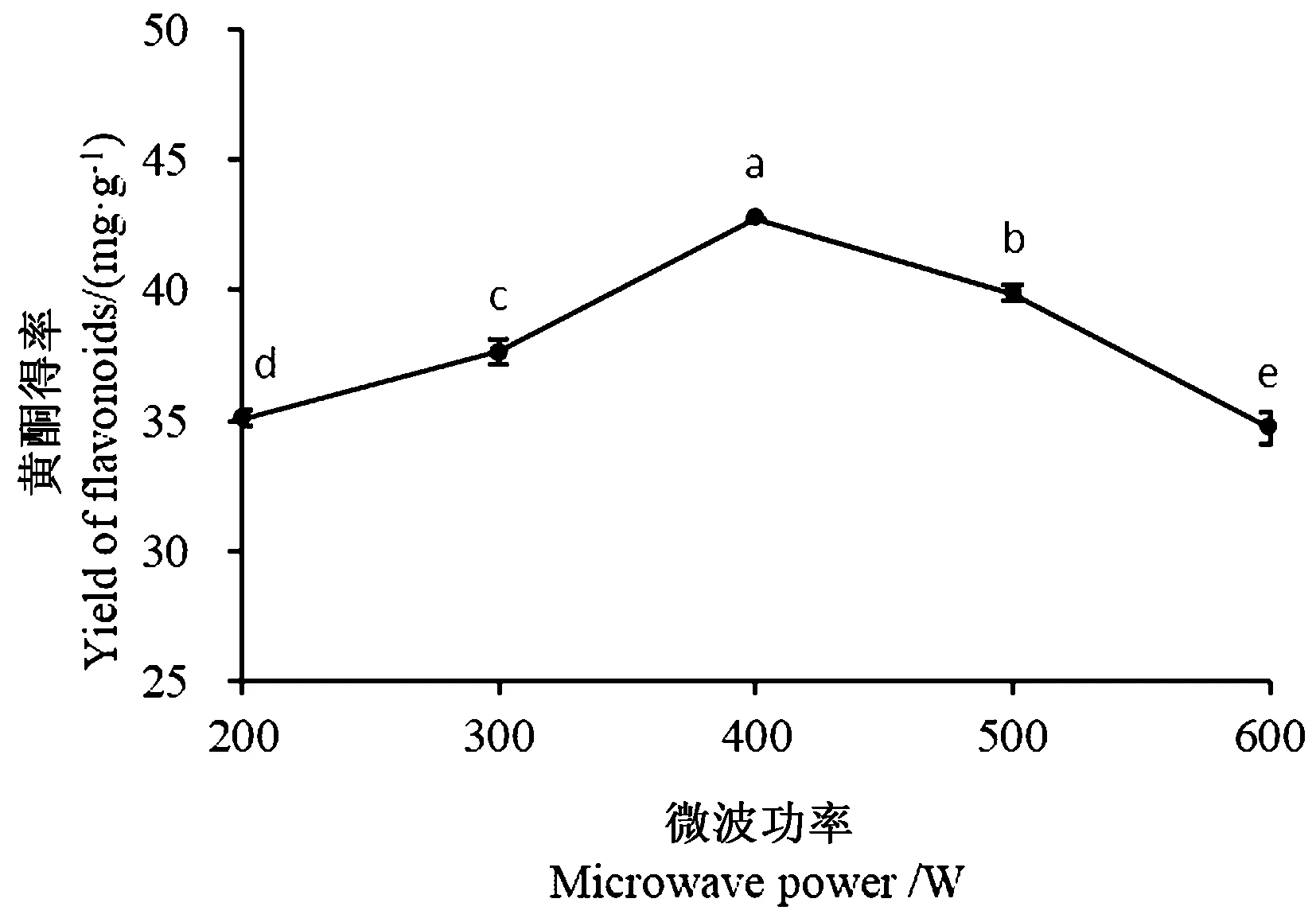
图4 微波功率对黄酮得率的影响Fig.4 Effect of microwave power on the yield of flavonoids
2.3.4 料液比对沙棘叶黄酮得率的影响 图5表明,当料液比由1∶10(g∶mL)提高至1∶30(g∶mL)时,沙棘叶黄酮的得率也随之显著增加(P<0.05),这是因为当料液比小于1∶30(g∶mL)时,料液比越高,传质过程越快,越利于黄酮的提取,得率增加;当料液比大于 1∶30(g∶mL) 时,沙棘叶黄酮得率随溶剂用量的增加趋于相对稳定,可能是黄酮已被最大限度提取。由此可知,1∶30(g∶mL)的料液比可以在获得较高得率的同时减少溶剂的消耗,节约资源,降低成本。
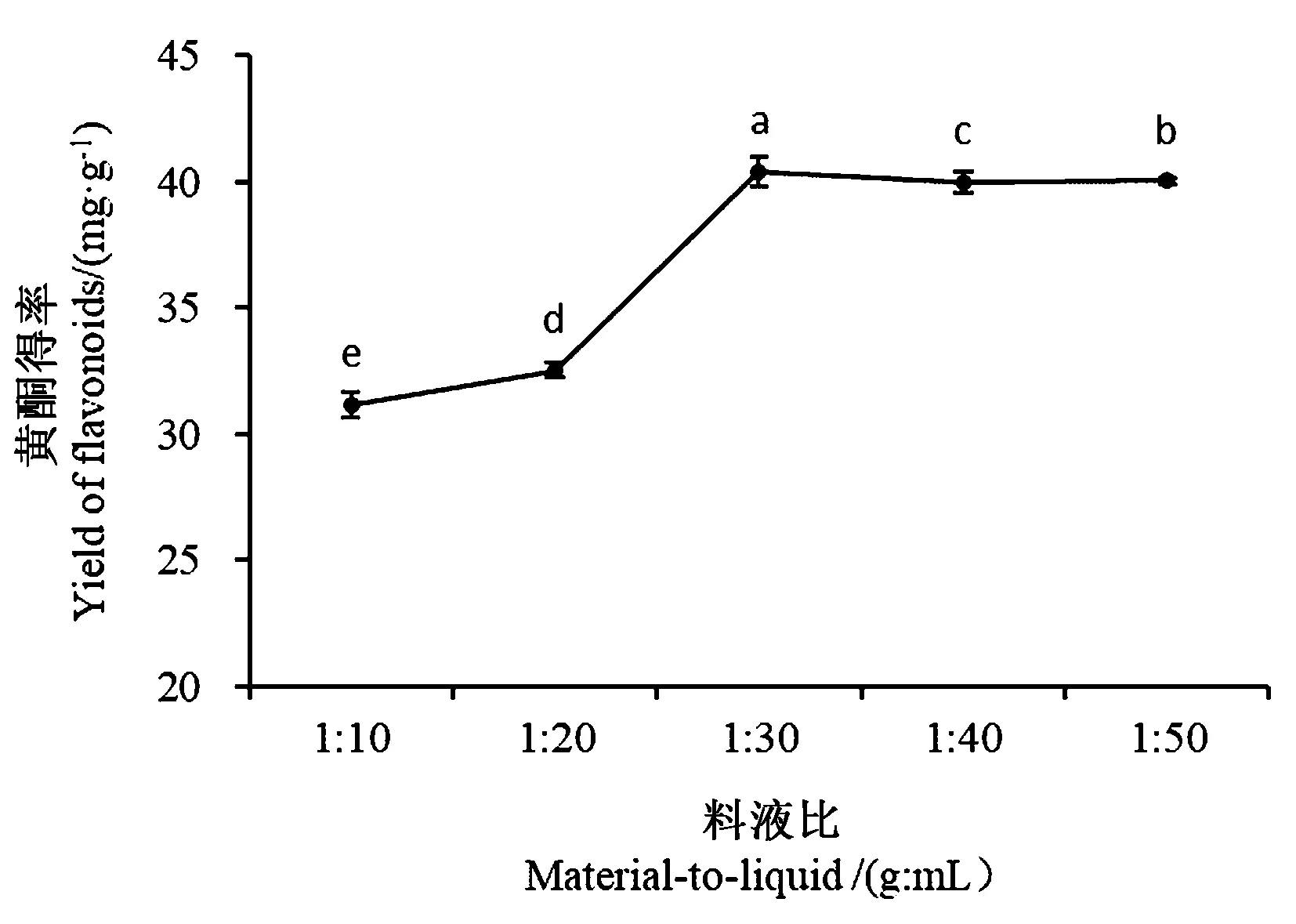
图5 料液比对黄酮得率的影响Fig.5 Effect of solvent to solid ratio on the yield of flavonoids
2.4 响应面优化试验结果
2.4.1 回归模型的建立及方差分析 采用Box-Behnken响应面试验进行沙棘叶黄酮提取工艺条件的优化,试验设计及其结果见表4。试验共17组,其中1~13号为沙棘叶黄酮得率的析因试验,14~17为其中心试验,每组试验均重复3次。
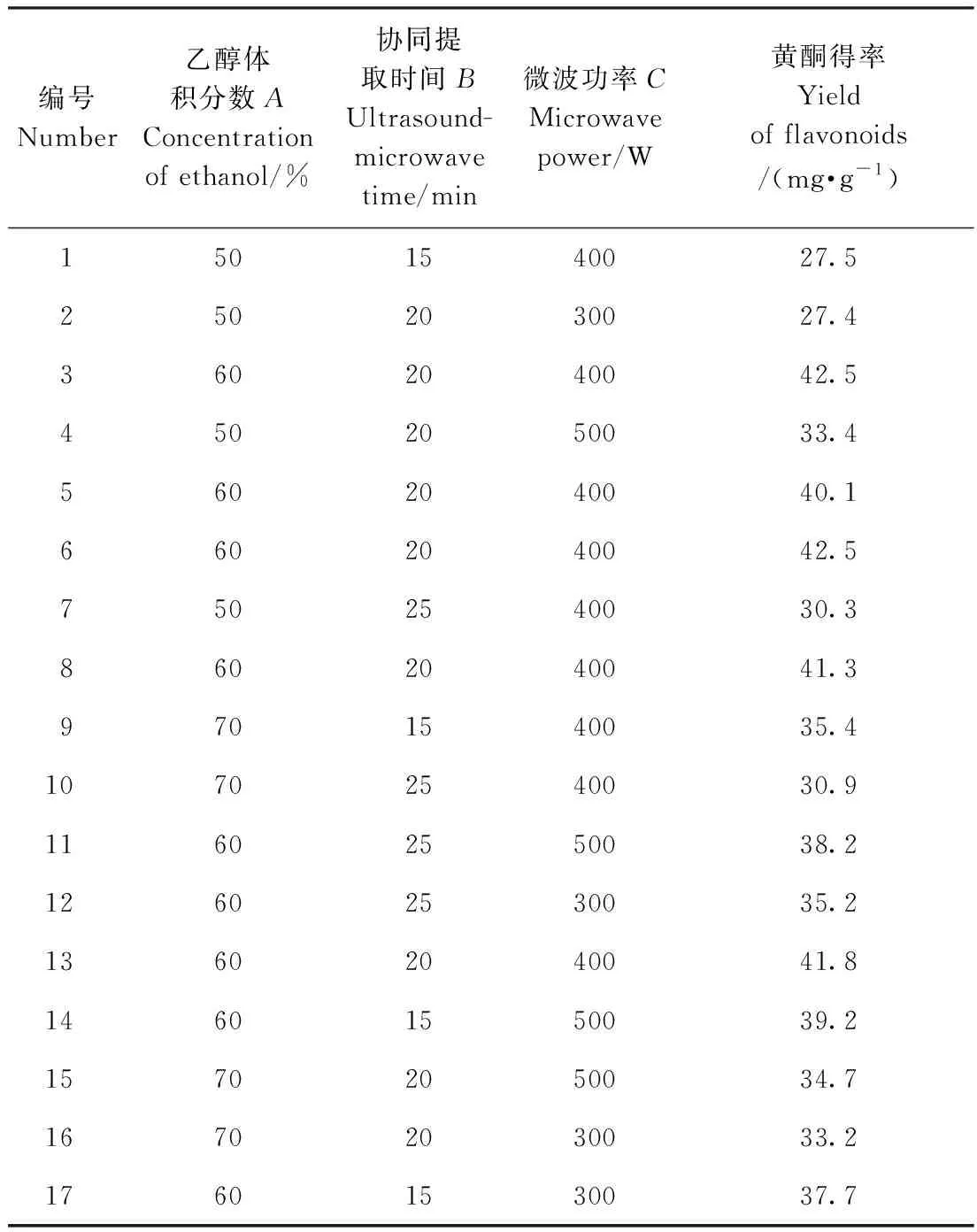
表4 Box-Behnken试验方案及结果Table 4 Box-Behnken design in terms of coded levels with response variable
用Design Expert V8.0.6.1软件对试验数据进行回归处理,得到沙棘叶黄酮得率(Y)与3个试验因素的回归方程:Y=-391.57+10.98A+5.93B+0.18C-0.04AB-0.001AC+0.000 8BC-0.08A2-0.10B2-0.000 1C2。
黄酮得率的方差分析如表5所示,其回归模型极显著(P<0.01),失拟项不显著(P>0.05),表明沙棘叶黄酮得率的回归方程模型比较可靠,拟合度较好,可分析、预测超声微波协同技术对沙棘叶黄酮的提取效果。各因子对黄酮得率影响的大小依次是A>C>B,其中A和C对黄酮得率的影响达到极显著水平,B不显著;交互项AB影响极显著,AC显著;A2、B2影响极显著,C2显著。
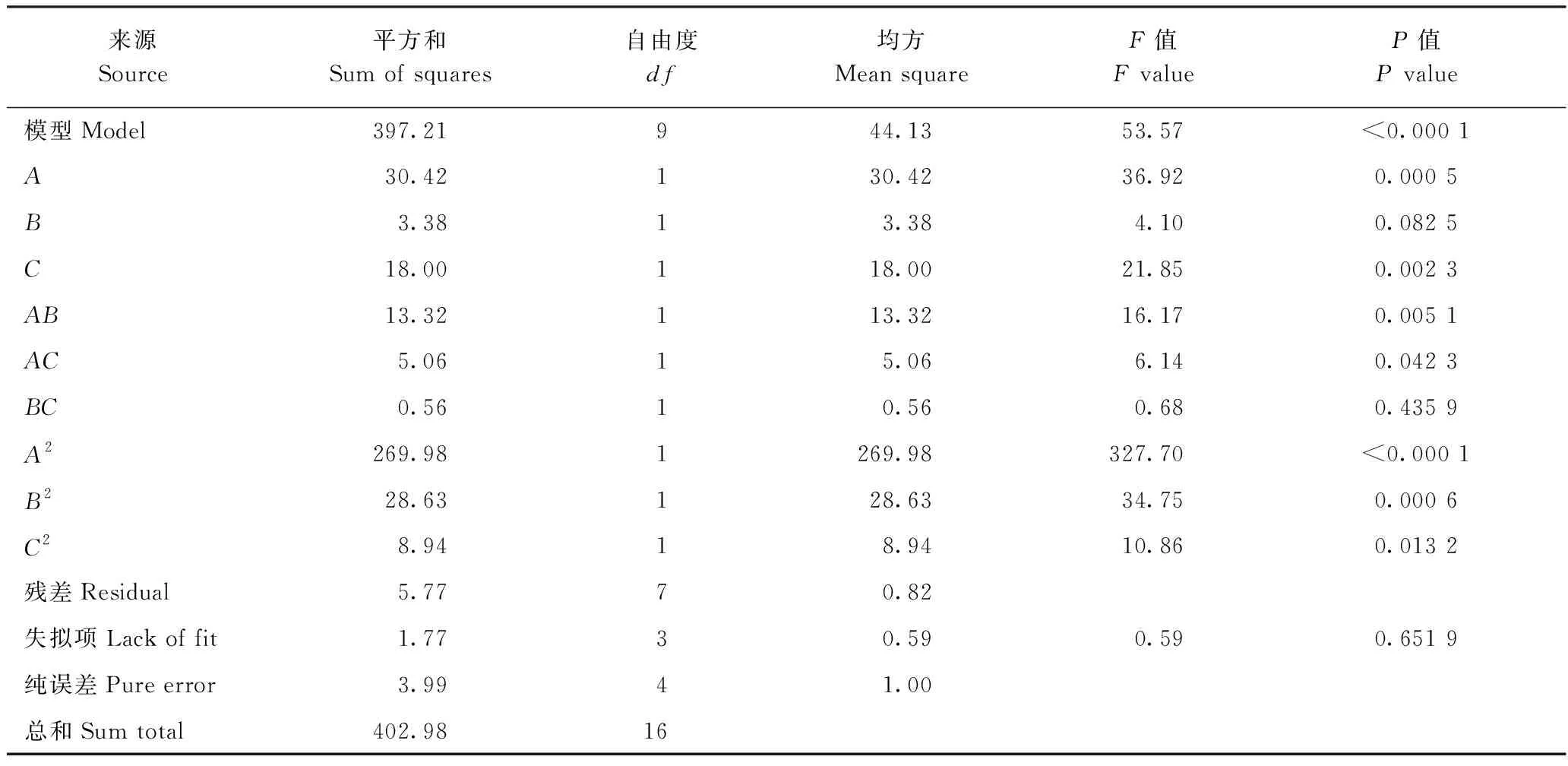
表5 方差分析表Table 5 Variance analysis (ANONA) of test results
2.4.2 响应面分析及最佳工艺条件 由图6可知,乙醇体积分数和协同提取时间的交互作用以及乙醇体积分数和微波功率的交互作用对黄酮得率的影响显著(P<0.05),提取时间和微波功率的交互作用对黄酮得率的影响不显著(P>0.05)。
利用Design-Expert软件对沙棘叶黄酮的超声波微波协同提取工艺参数进行优化,得到最佳工艺参数为乙醇体积分数61.04%、协同提取时间18.16 min、微波功率445.73 W,预测黄酮得率为42.13 mg·g-1。
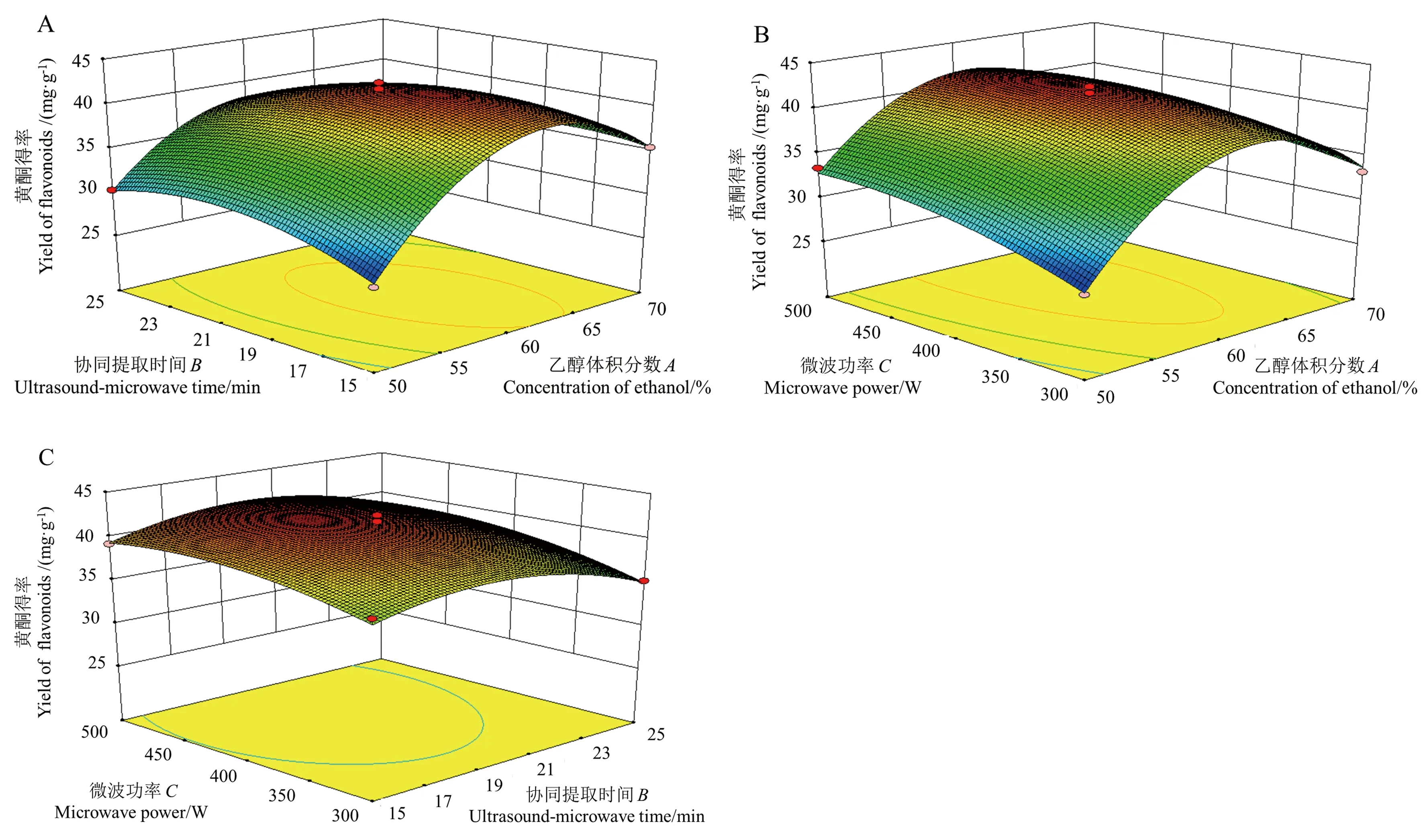
图6 两因素交互作用对黄酮得率的影响Fig.6 The effect of the interaction of two factors on the yield of flavonoids
2.4.3 验证试验 为了实际操作方便,将优化后的工艺条件修改为乙醇体积分数61%、协同提取时间18 min、微波功率446 W。经验证,此条件下的黄酮得率为42.09 mg·g-1,与理论预测值42.13 mg·g-1仅相差0.04 mg·g-1。故通过响应面所得到的沙棘叶黄酮提取工艺的方程适用性强,优化的工艺参数准确可靠,具有实用价值。
2.5 沙棘叶黄酮的组成成分分析
采用高效液相色谱法对沙棘叶黄酮的组成成分进行分析。对比黄酮标准品混合溶液和沙棘叶黄酮提取液的HPLC色谱图中各成分的保留时间,沙棘叶黄酮中主要检测出了6种黄酮类物质,各成分及具体含量见表6。沙棘叶黄酮中含量最高的为儿茶素,为1.474 8 mg·g-1,其次是丁香酸和槲皮素,含量在0.2~0.4 mg·g-1之间,其余均在0.1~0.2 mg·g-1之间,含量最低的为山萘酚。
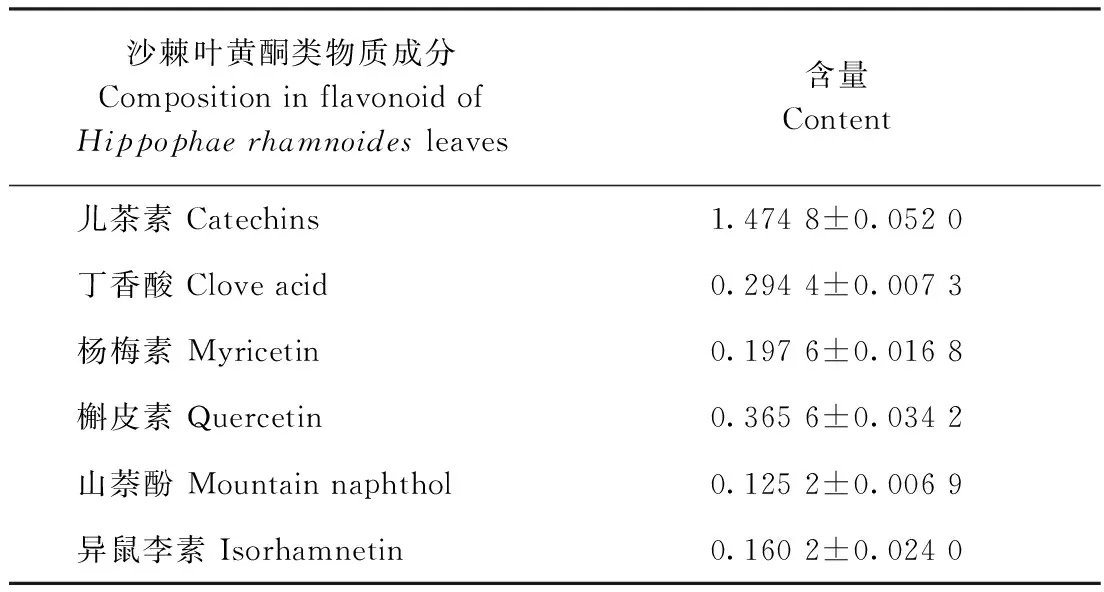
表 6 沙棘叶黄酮的成分及含量Table 6 Composition and content in flavonoid of Hippophae rhamnoides leaves /(mg·g-1)
2.6 沙棘叶黄酮的抗氧化活性测定结果
2.6.1 沙棘叶黄酮对DPPH自由基的清除作用 由图7可知,当溶液浓度小于0.2 mg·mL-1时,样品质量浓度越高,沙棘叶黄酮和Vc对DPPH自由基清除效果越好。黄酮清除率在样品浓度为0.2 mg·mL-1时高达88%,浓度继续增大对DPPH自由基清除率的增加无明显影响。此外,沙棘叶黄酮对DPPH自由基的清除效果稍弱于Vc,但超过80%的DPPH自由基清除率也表明沙棘叶黄酮具有较高的抗氧化活性。
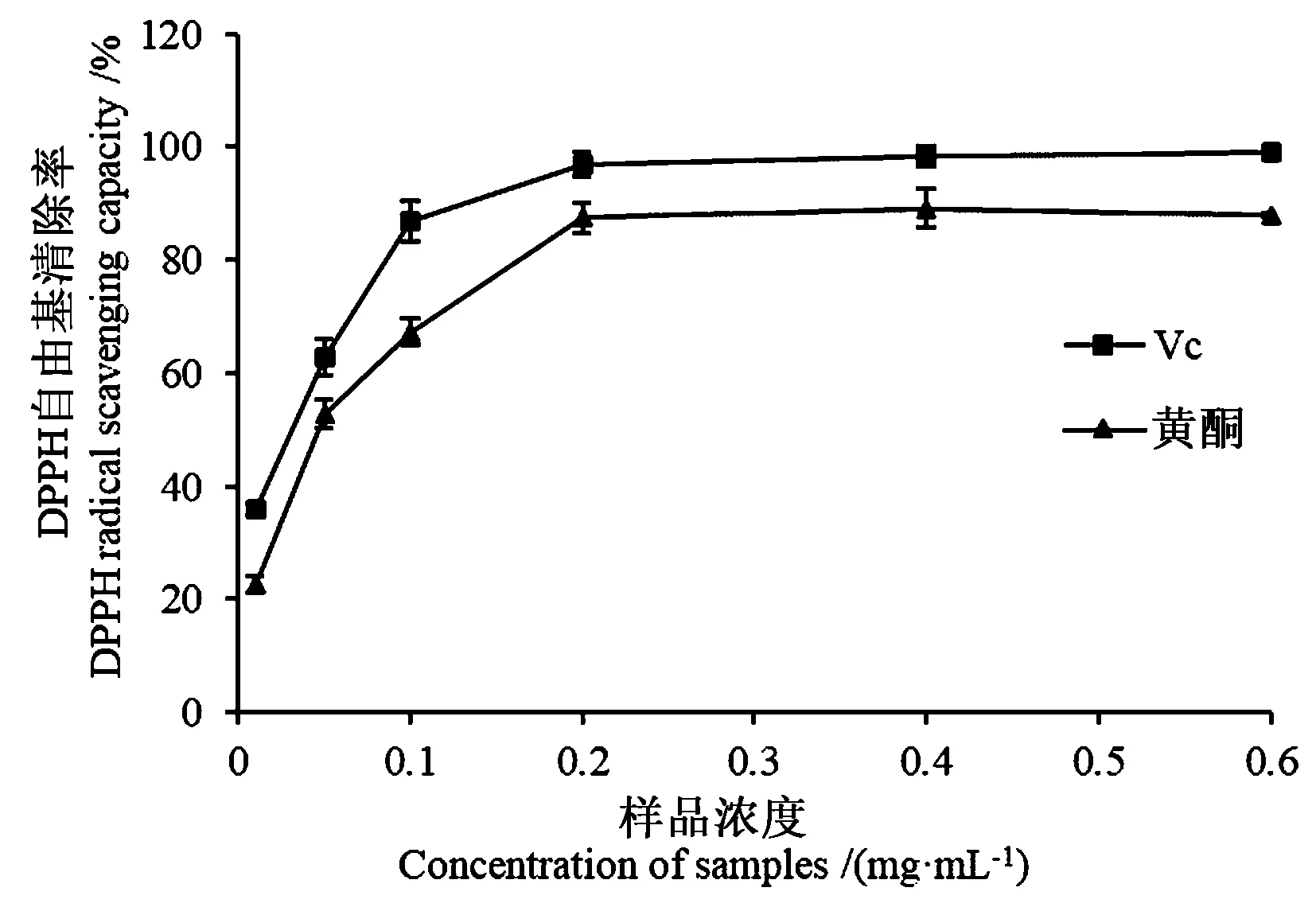
图7 样品浓度与DPPH自由基清除率的关系Fig.7 Relationship between sample concentration and DPPH radical scavenging rate
2.6.2 沙棘叶黄酮对ABTS自由基的清除作用 图8表明,Vc和沙棘叶黄酮均对ABTS自由基具有很强的清除作用,并且清除作用与样品浓度息息相关,表现出明显的剂量依赖性。样品浓度低时,沙棘叶黄酮对ABTS自由基清除作用弱,但其清除作用随样品浓度的增加不断增强,浓度为0.6 mg·mL-1时,与Vc的清除作用基本相同,清除率高达98.1%。即沙棘叶黄酮在浓度高时对ABTS自由基清除能力较强。
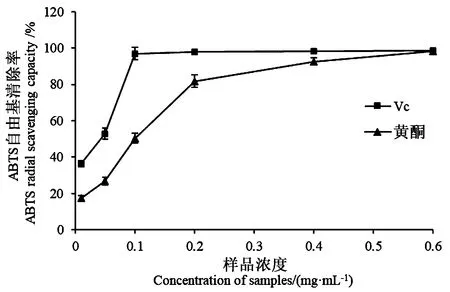
图8 样品浓度与ABTS自由基清除率的关系Fig.8 Relationship between sample concentration and ABTS radical scavenging rate
2.6.3 沙棘叶黄酮的FRAP还原能力 由图9可知,Vc和沙棘叶黄酮都具有较强的还原能力,都可以把Fe3+还原为 Fe2+,从而使溶液的颜色发生明显的变化。溶液浓度越高,沙棘叶黄酮和Vc的还原力越强,还原力和浓度成正相关,同浓度沙棘叶黄酮的还原力低于Vc。
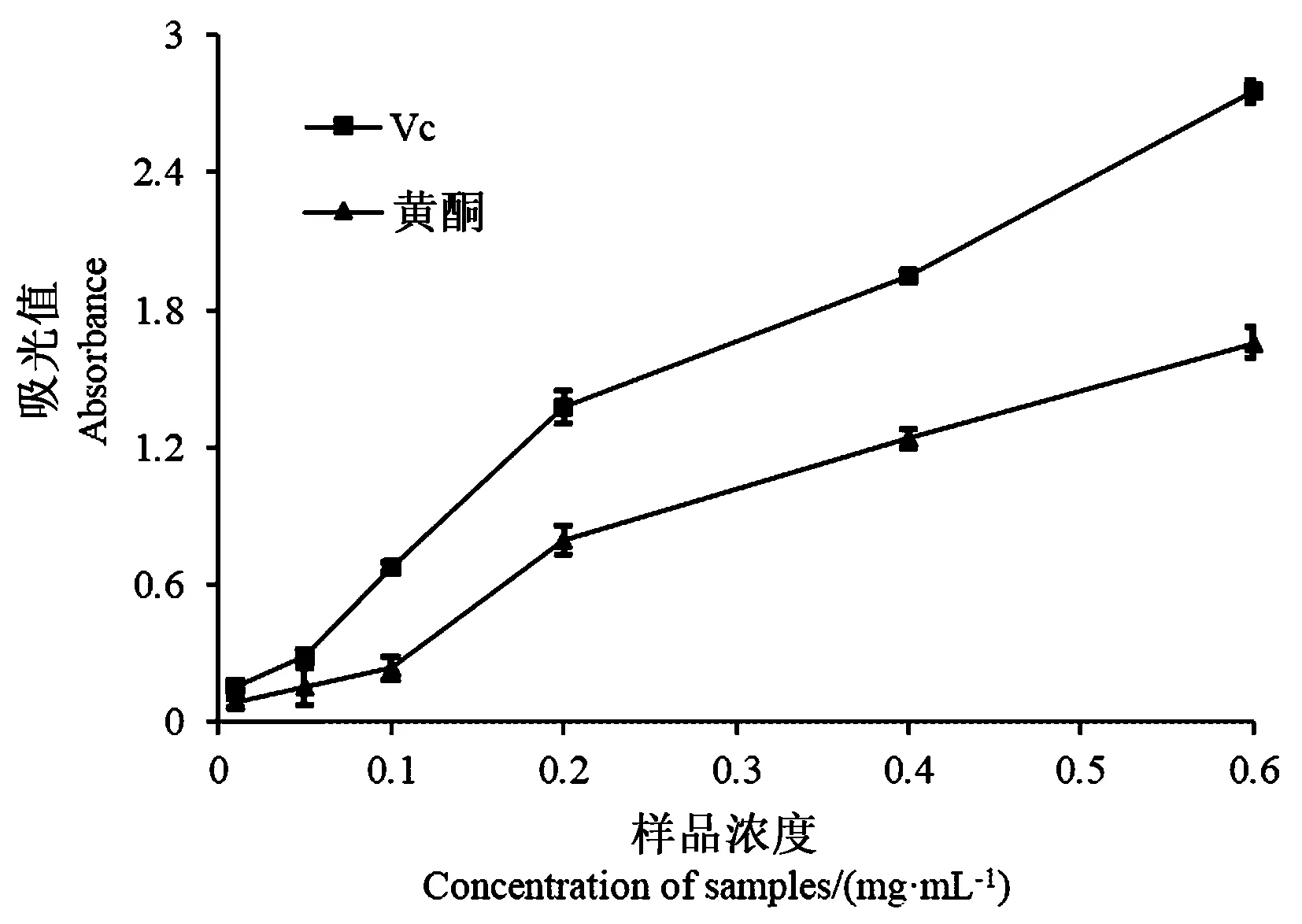
图9 样品浓度与FRAP还原力的关系Fig.9 Relationship between sample concentration and FRAP reducing power
2.6.4 沙棘叶黄酮对羟基自由基的清除作用 由图10可知,Vc和沙棘叶黄酮对羟基自由基的清除效果随着浓度的变化,呈现出相同的趋势,且沙棘叶黄酮的清除作用弱于Vc。溶液浓度小于0.2 mg·mL-1时,随着浓度的增加,Vc和沙棘叶黄酮对羟基自由基的清除能力大幅提高;当浓度大于0.2 mg·mL-1时,增幅减小,曲线趋于平缓。
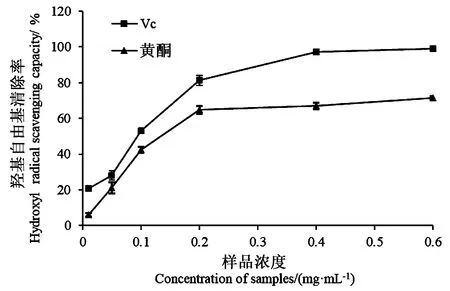
图10 样品浓度与羟基自由基清除率的关系Fig.10 Relationship between sample concentration and hydroxyl radical scavenging rate
3 讨论
本研究发现超声波微波协同提取技术是最适合沙棘叶黄酮的提取方法。Wang等[25]研究了甘草中黄酮类化合物的不同提取方法,发现与乙醇回流法、水抽提法和酶萃取法相比,超声波微波协同提取法的能源节约率分别为38%、75%和16%,且耗时低、提取率最高、CO2排放最少。这可能是因为此方法结合了超声波提取和微波提取两种方法的优势。超声波产生的强烈的物理混合打破了植物的组织结构,但缺乏为天然植物化合物产生高热能的能力;微波为天然植物化合物提供快速方便的加热,使结构变得膨胀,但具有传质限制[10,26]。超声波微波协同提取法将机械振动和热效应有机结合,可快速、彻底地破坏细胞结构,有利于内容物快速溶出,将其应用在沙棘叶黄酮的提取上,表现出更高的提取效率。
通过响应面试验优化沙棘叶黄酮的超声波微波协同提取工艺发现,乙醇体积分数对黄酮得率的影响达到极显著水平(P<0.01),且随着乙醇体积分数的增加,黄酮得率先增加后减小。Munhoz等[27]研究表明,溶剂的极性对萃取有显著影响。乙醇是一种低极性溶剂,水是一种高极性溶剂,使用水和乙醇的混合物,可以提高黄酮类化合物在内的酚类化合物的提取效率。黄酮类化合物在乙醇中的溶解度比在水中的溶解度高,所以乙醇在溶剂中的浓度越高,提取率就越高;且由于溶剂有利于微波提取黄酮中的热量分配,当溶剂含量逐渐增大,对微波加热的介电性能增强,得率增加。然而,在水溶液中加入一定浓度的乙醇后,得率开始下降,这是因为水对溶剂极性有积极的调节作用,可以增加植物材料的溶胀,提供更大的接触表面积,促进提取过程,随着乙醇的不断加入,溶剂的极性将不断降低,从而降低了黄酮类物质的溶解度,因此得率减小[28]。
提取的沙棘叶黄酮具有较高的抗氧化活性,这可能是由于沙棘叶黄酮中所含的儿茶素、槲皮素等成分具有很强的抗氧化作用。Grzesik等[29]研究表明,儿茶素在体外抗氧化试验中,对ABTS自由基清除能力以及对Fe3+的还原能力都很强,可作为抗氧化治疗的纳米制剂的理想候选者。Algandaby等[30]研究发现槲皮素可以抑制谷胱甘肽以及超氧化物和谷胱甘肽过氧化物酶的消耗,具有显著的抗氧化作用。但沙棘叶黄酮提取液中具体起抗氧化作用的成分还有待进一步提取分析。
4 结论
通过常规溶剂萃取、超声辅助提取、微波辅助提取、超声波微波协同提取4种提取方法提取沙棘叶黄酮,并对黄酮得率、沙棘叶组织结构进行比较研究,得出超声波微波提取法是提取沙棘叶黄酮的最佳方法。采用响应面法对超声波微波协同提取沙棘叶黄酮的工艺进行优化,最终乙醇体积分数61%、提取时间18 min、微波功率446 W条件下的黄酮得率最高。沙棘叶黄酮提取液中共鉴定出6种黄酮类成分,并且具有较强的抗氧化活性。研究结果证实了超声波微波协同提取法对沙棘叶黄酮提取的可行性,提高了黄酮提取率且对品质影响较小。

