双价抗虫节水抗旱稻新材料旱恢3CA的创制
叶水烽 高宁宁 陈魅瑶 曾海云 马国华
(1 上饶师范学院生命科学学院,江西 上饶 334001;2 温州科技职业学院(温州市农业科学研究院) 浙南作物育种重点实验室,浙江 温州 325006;3 上海市农业生物基因中心,上海 201106)
水稻(Oryzasativa)是全世界最重要的粮食作物之一,为快速增长的人口提供了近一半的主粮[1]。矮秆品种的培育和杂种优势的利用是水稻育种史上的两次大跨越,为我国粮食生产做出了巨大贡献[2]。长期以来,追求高产是我国农业生产的首要任务,然而,以提高单位产量为目的的“高投入、高产出、高污染”生产模式对资源的需求巨大,不利于农业的可持续发展。2005年,我国科学家提出了“绿色超级稻”构想和育种目标:少打农药、少施化肥、节水抗旱、优质高产[3-4]。结合水稻种质资源研究、功能基因组研究和分子辅助育种技术,科学家们培育出一系列绿色超级稻新品种,实现了资源节约型、环境友好型农业生产的转型[5]。
水稻在生长过程中需水量大,尤其在生育后期,缺水会导致减产乃至绝收[6],因此培育节水抗旱的水稻品种十分紧迫。节水抗旱稻是指结合了水稻的高产优质和旱稻的节水抗旱特性的新栽培稻品种类型[7-8]。在灌溉条件下,节水抗旱稻的产量、米质与水稻基本持平,但对灌溉用水的需求不到水稻的一半;在缺乏灌溉条件的中低产田种植节水抗旱稻,可实现旱直播旱管、增产稳产[9-11]。
除了受干旱影响,水稻生长中还经常遭受虫害的侵袭,其中鳞翅目害虫每年给我国农业造成高达近百亿元的经济损失[12]。为了培育抗虫水稻,科学家们对包括野生稻和栽培稻的水稻种质资源进行了筛选鉴定,目前已定位和克隆出水稻抗褐飞虱基因,并培育出了抗褐飞虱水稻品种[13]。然而目前,在水稻及其近缘种中还没有发现二化螟、三化螟、稻纵卷叶螟等鳞翅目害虫的抗性种质资源,因此无法通过常规育种及分子标记辅助选择技术等方式来培育抗虫水稻新品种[14]。通过转基因育种的手段增强水稻自身的抗虫性,是解决上述问题的有效途径。目前应用最广的方法是将源于苏云金芽孢杆菌(Bacillusthuringiensis)的Bt基因转入水稻,以培育抗虫品种,使用较多的Bt基因主要有cry1Ab/Ac[15]、cry1Ab[16]、cry1Ac[17]、cry2AX1[18]等。通过密码子优化,华中农业大学林拥军教授课题组获得了具有自主知识产权的能显著提高转基因水稻抗虫性的抗虫基因cry2A[19]和cry1C*[20-22]。
随着Bt制剂或转Bt基因作物的广泛使用,害虫在持续的高压下会对Bt蛋白产生抗性,因此,延缓害虫抗性发展是未来转Bt基因作物商业化的重要课题,而利用多基因聚合策略是目前延缓害虫对Bt蛋白产生抗性的重要手段[23]。美国、澳大利亚、印度等国家主要种植含有cry1Ab/cry1Ac+cry1F、cry1Ac+cry2Ab等双价抗虫基因的转基因棉花品种[24-26]。在水稻研究中,1999年第一例双价的Bt(cry1Ac+cry2A)水稻诞生[27],我国科学家又陆续创制了一系列双价抗虫转基因水稻新材料,为转Bt基因抗虫水稻提供了技术和材料保障[28-29]。
本研究利用华中农大转基因明恢63(T1C-19)和转基因明恢63(T2A-1)两个已经通过环境释放的成熟转基因水稻材料为Bt基因供体,与节水抗旱稻恢复系旱恢3号杂交,经过多次回交和自交,通过大田农艺性状考察和自然条件抗性鉴定,获得高抗螟虫的新恢复系旱恢3CA,以期为后续杂交选育既节水抗旱又高抗螟虫的新品种奠定材料基础。
1 材料与方法
1.1 试验材料
cry1C*、cry2A基因供体材料分别为转基因明恢63(T1C-19)和转基因明恢63(T2A-1)水稻品种,由华中农业大学作物遗传改良国家重点实验室林拥军教授提供。节水抗旱稻恢复系品种旱恢3号由上海市农业生物基因中心提供。
1.2 试验方法
1.2.1 旱恢3CA的选育 以明恢63(T1C-19)和明恢63(T2A-1)为cry1C*基因、cry2A基因供体,分别与节水抗旱稻恢复系旱恢3号杂交,田间喷施草丁膦(Basta)进行抗性筛选,并进行PCR和蛋白检测筛选阳性植株,回交3代后自交1代获得分别携有cry1C*和cry2A基因的纯合旱恢3号,而后进行双Bt基因聚合杂交,回交3代后自交4次获得纯合的双价纯合抗虫材料,命名为旱恢3CA,每世代进行取样,并进行cry1C*基因和cry2A的PCR检测及田间喷施Basta抗性筛选。具体选育流程见图1。

图1 旱恢3CA恢复系的选育流程Fig.1 Breeding of restore line Hanhui 3CA
1.2.2 田间Basta抗性筛选 分蘖初期,配制终浓度为0.3%的Basta直接在田间喷施转育水稻植株,叶片变黄甚至死亡的为阴性植株,不受影响的为阳性植株。
1.2.3 转育植株的PCR鉴定 利用CTAB法提取水稻基因组DNA作为扩增模板。根据cry1C*和cry2A基因的序列信息设计引物,引物序列信息见表1。PCR反应体系为20 μL:DNA 模板30~50 ng,10× buffer 2.0 μL,2 mmol·L-1dNTP 1.0 μL,25 mmol·L-1MgCl21.0 μL,10 μmol·L-1引物(F/R)各0.2 μL,Taq酶1个单位,加灭菌ddH2O至20 μL。PCR反应程序:94℃预变性5 min;94℃变性1 min,57℃退火45 s,72℃延伸1 min,30个循环;72℃终延伸10 min。1%的琼脂糖凝胶电泳后置于凝胶成像系统下观察条带。

表1 Bt 基因的引物序列信息Table 1 Primer sequence of Bt genes
1.2.4 Cry1C*和Cry2A蛋白的定性和定量检测 Bt蛋白的定性检测采用武汉上成生物科技有限公司的Cry1C和Cry2A胶体金试纸条。取分蘖期新鲜叶片,加缓冲液碾磨出汁,取500 μL碾磨液置于1.5 mL离心管,将胶体金试纸条插入液体中,3~5 min后读取结果,有质控线和检测线双条线即为阳性植株。Bt蛋白的定量测定采用EnvironLogix公司(美国)的ELISA检测试剂盒(QualiplateTMkit for Cry1Ab/Cry1Ac),样品的制备、酶联免疫反应及OD值的测定,均严格按照试剂盒的使用说明书进行。
1.2.5 农艺性状考察 在正常大田水肥、防治螟虫(打药)管理下,每个小区各种植6行旱恢3CA和旱恢3号,每行8株,共48个单株,3次重复,每个重复随机取10个单株,对株高、单株有效穗数、穗长、每穗粒数、结实率、千粒重及单株产量等农艺性状进行考察。
1.2.6 田间自然条件下的抗虫性鉴定 在上海市青浦区白鹤镇、海南省陵水县光坡镇上海市农业科学院转基因基地内,种植旱恢3CA和旱恢3号水稻,进行除防治螟虫外的正常水肥及病虫害管理,观察植株的卷叶和白穗情况。
1.2.7 数据统计与分析 试验数据采用SPSS 17.0软件进行统计分析,采用t测验法进行差异显著性检验。
2 结果与分析
2.1 杂交选育过程的Basta抗性和PCR阳性检测
因T1C-19和T2A-1均含有bar基因,因此,在选育过程中,对水稻植株喷施0.3%的Basta。含有cry1C*或cry2A的杂交后代会表现出Basta抗性,生长不受影响;而不含外源bar基因的植株会发黄直至死亡(图2-A)。 对存活的植株进行PCR检测,只有同时含有cry1C*和cry2A两个基因的后代,电泳检测结果才会同时含有799和600 bp 2条目标带,含单基因的植株则只能扩增出799或600 bp的1条带(图2-B)。
2.2 杂交选育过程的Cry1C*和Cry2A蛋白定性检测
根据PCR检测结果,对同时含有cry1C*和cry2A基因的转育植株进行Bt蛋白定性检测,阴性植株只显示1条质控线,阳性植株同时显示质控线和检测线(图3),每一代保留Cry1C*和Cry2A蛋白双阳性植株进行回交及自交。
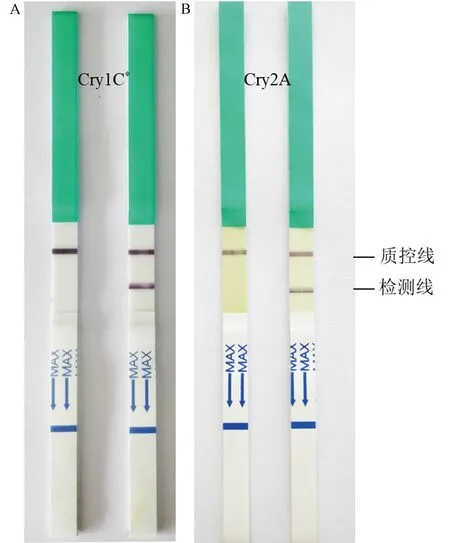
注:左为阴性植株,只显示质控线;右为阳性植株,质控线和检测线均有。Note: Left: Only one quality control line in negative plants. Right: Both quality control line and detection line in positive plants.图3 水稻植株Cry1C*(A)和Cry2A(B)蛋白的阳性检测Fig.3 Positive detection of Cry1C*(A) and Cry2A(B) protein in rice plant
2.3 旱恢3CA的Cry1C*和Cry2A蛋白的定量测定
在分蘖期,采用ELISA试剂盒,分别以T1C-19和T2A-1为对照,对旱恢3CA的Cry1C*和Cry2A蛋白进行测定。由图4可知,旱恢3CA中叶片和茎秆中的Cry1C*蛋白含量分别为1.93 μg·g-1FW和0.11 μg·g-1FW,T1C-19叶片和茎秆中的Cry1C*蛋白含量分别为2.64 μg·g-1FW和0.17 μg·g-1FW,表明cry1C*基因成功转入旱恢3号并正常表达,新材料旱恢3CA叶片中Cry1C*蛋白含量显著低于亲本(P<0.05)。对旱恢3CA中的Cry2A蛋白含量进行定量检测,结果显示,叶片和茎秆中的Cry2A蛋白含量分别为62.65 μg·g-1FW和4.07 μg·g-1FW,而亲本T2A-1叶片和茎秆中的Cry2A蛋白含量分别为62.68 μg·g-1FW 和3.97 μg·g-1FW。无论在叶片还是茎秆中,旱恢3CA的Cry2A蛋白含量与亲本T2A-1相比均无显著差异。
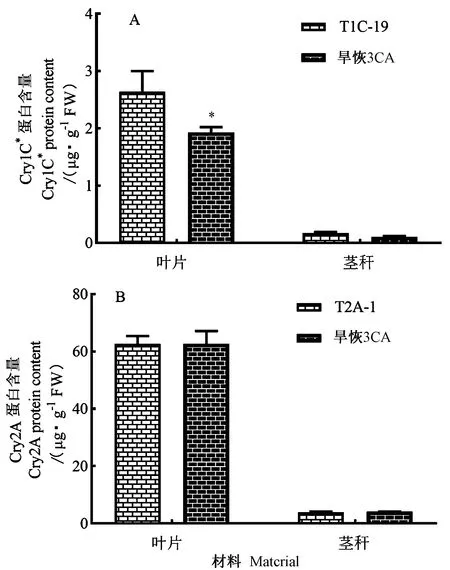
注:*表示旱恢3CA和T1C-19在P<0.05水平存在显著差异。Note: * indicates significant difference at 0.05 level between Haihui 3CA and T1C-19 materials.图4 水稻旱植株的Cry1C*和Cry2A蛋白含量测定结果Fig.4 Determination of Cry1C*and Cry2A protein content of leaves and stems in rice plants
2.4 正常打药条件下的旱恢3CA和母本旱恢3号的农艺性状比较
在正常水肥管理和打药条件下,旱恢3CA和旱恢3号的生育期无明显差异,且在株高、单株有效穗数、穗长、每穗粒数、结实率、千粒重及单株产量均无显著差异(P>0.05,表2),表明经过多代回交后,Cry1C*和Cry2A蛋白的转入对旱恢3号的农艺性状无显著影响。
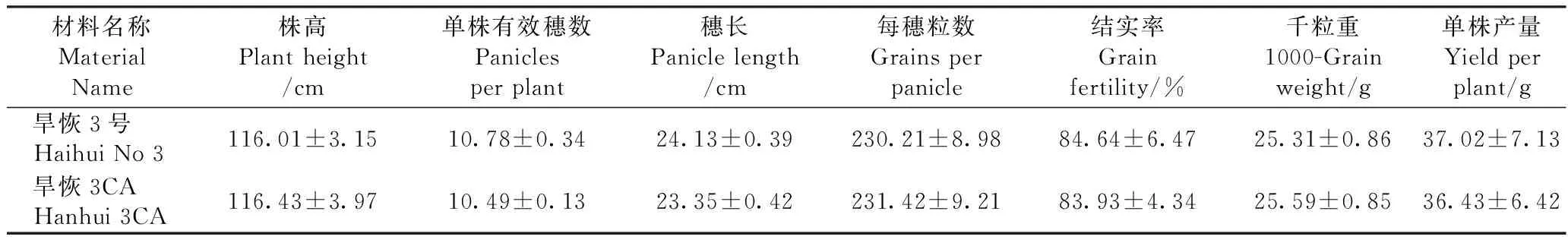
表2 旱恢3CA和旱恢3号的主要农艺性状比较Table 2 Agronomic traits of Hanhui 3CA and Hanhui No 3
2.5 田间自然条件下的抗虫性鉴定
在保证正常水肥,全生育期不防治螟虫的大田管理条件下,双价抗虫材料旱恢3CA表现出对稻纵卷叶螟的高抗性,分蘖期叶片正常,未见卷叶,成熟期也未有白穗出现;而对照品种旱恢3号在分蘖期有83.2%的植株受到稻纵卷叶螟为害,叶片内卷,且有肉眼可见的白丝、虫粪或有长短不一的条状白斑(图5-A、B)。在成熟期旱恢3CA无白穗,而30.2%的旱恢3号植株有白穗出现(图6-A、B)。剥开茎秆观察,旱恢3CA的茎秆光滑,无缺口和虫粪,而被卷叶螟为害的旱恢3号植株茎秆有明显的咬口,茎秆内有虫粪(图6-C、D)。

注:A:旱恢3号卷叶细节图;B:旱恢3号(左)和旱恢3CA(右)植株在分蘖期的田间抗性表现。Note: A: The details of Hanhui No 3 plant rolled leaf. B: The field resistance performance between Hanhui No 3 (left) and Hanhui 3CA (right) plants at tillering stage.图5 恢复系在田间的抗虫性表现Fig.5 Insect resistance of rice restorer lines under field

注:A、B分别为旱恢3CA和旱恢3号植株成熟期的田间抗性表现;C、D为旱恢3CA(左)和旱恢3号(右)植株茎秆比较。Note: A and B showed the field resistance performance of Hanhui 3CA and Hanhui No 3 plants at maturity, respectively. C and D showed the comparison of stems between Hanhui 3CA (left) and Hanhui No 3 (right).图6 旱恢3CA和旱恢3号成熟期植株在田间的抗虫性表现Fig.6 Insect resistance of Hanhui 3CA and Hanhui No 3 at maturity under field
3 讨论
现阶段在农业生产上,害虫防治主要采用农药喷施方法,不利于环境保护和人类健康。随着分子生物学和基因工程技术的发展,利用Bt基因创制培育抗虫水稻新材料的技术已经十分成熟。然而,根据Bt棉商业化结果显示,单价的Bt基因作物的大面积推广种植,减少了化学杀虫剂的使用,但同时迫使靶标害虫长时间处于单一的选择压力下,容易导致害虫抗性种群的产生[30-31]。
T1C-19和T2A-1分别携带cry1C*和cry2A基因,特异毒杀水稻鳞翅目虫,效果显著。为延缓螟虫对Bt蛋白产生抗性,本研究将cry1C*和cry2A基因同时导入节水抗旱稻恢复系旱恢3号,获得双价聚合抗虫新材料旱恢3CA,在分蘖期,旱恢3CA的Cry1C*蛋白含量较T1C-19有所下降,推测可能与Ubiquitin启动子的同源性有关。因为T1C-19和T2A-1两个供体材料中的cry1C*和cry2A基因均由Ubiquitin启动子驱动,可能会引起基因沉默,与前人研究结果一致[29]。分子标记辅助选择主要通过PCR技术对导入基因进行鉴定,但由于PCR技术过于灵敏,容易出现假阳性结果。因此,在PCR初期筛选的基础上,采用Bt试纸条进行阳性复核,提高了目标植株的筛选准确度。挑选与轮回亲本长势相似的阳性材料进行回交,在选育流程中进行全生育期不打药管理,剔除出现虫斑、白穗的植株,加速了选育材料纯合[32]。通过农艺性状鉴定,旱恢3CA和轮回亲本无显著差异,可直接用于组合配制。
4 结论
本研究以T1C-19和T2A-1为供体,分别获得含cry1C*基因的旱恢3号和含cry2A基因的旱恢3号中间材料,进一步通过杂交选育,获得双价Bt基因聚合新材料。通过田间自然条件下的抗虫性鉴定,选育出对稻纵卷叶螟具有高度抗性的水稻新材料旱恢3CA,其基本农艺性状与轮回亲本旱恢3号无显著差别,为培育既节水抗旱又高抗螟虫的水稻品种奠定了材料基础。

