手掌参多糖对60Co-γ射线辐射小鼠造血和抗氧化功能损伤的治疗作用研究
冯洋洋 李杭雨 张琳梓 刘前虔 吴代燕 梁海川 封海波
(西南民族大学畜牧兽医学院, 四川 成都 610041)
手掌参(Gymnadeniaconopsea)生长在海拔3 000~4 000 m的高原地带,在川藏等地分布广泛,藏药名称为“旺拉”,属兰科手参属植物手参或粗脉手参的块根。手掌参所含营养成分主要为糖类、粗纤维以及蛋白质,其中总糖含量可达39.27%[1]。手掌参具有诸多药用活性,在中药、蒙药、藏药中都是极为珍贵的药材[1-2],主要用于治疗肾虚、体虚、腰酸腿疼、机体疲劳等症状,同时手掌参多糖在抗氧化衰老、理气和血、提高机体免疫力、止痛等方面的功效也逐渐被发现[3],为辐射损伤的治疗提供了基础。随着电离辐射在周围环境中的不断渗透,辐射损伤已经给人们带来巨大的困扰[4]。电离辐射可造成机体骨髓造血功能障碍,外周血淋巴细胞和白细胞减少,以及免疫器官损伤,导致免疫功能下降,并引起脂质氧化反应并产生自由基,总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase, SOD)活性下降,骨髓嗜多染红细胞(polychromatic erythrocyte, PCE)微核数目增多甚至染色体发生畸变,导致机体各种损伤和疾病,严重时还可诱发癌变[5]。现有抗辐射药物多以化学药物为主,存在毒副作用大、应用性低等缺点,因此开发高疗效、低副作用的天然辐射防治药物具有良好的应用前景。藏药是中华民族的瑰宝,许多藏药中的多糖类或黄酮类等物质可以清除自由基,保护造血系统,提高机体的免疫力和抗氧化能力[6]。
本试验在前期研究基础上,进一步研究了不同剂量的手掌参多糖对60Co-γ辐射损伤的治疗作用。通过对一定辐射剂量的小鼠灌胃手掌参多糖提取物,研究其对造血系统、抗氧化能力和免疫力的影响,以期为手掌参及其提取物的深入研究与开发提供依据。
1 材料与方法
1.1 仪器和试剂
UV-5100紫外可见分光光度计,上海元析仪器有限公司;LH750型全自动血细胞分析仪,美国Beckman Coulter公司;RE-5203旋转蒸发仪,上海亚荣生化仪器厂;FACScan流式细胞仪,美国Becton-Dickinson公司;RE-5203循环水式多用真空泵,郑州长城科工贸有限公司;Nicolet iS50红外光谱仪,赛默飞世尔科技(中国)有限公司。
蛋白定量(total protein, TP)试剂盒(双缩脲法)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)试剂盒(羟胺法)、总抗氧化能力(total antioxidant capacity, T-AOC)试剂盒(比色法)、丙二醛(malondialdehyde, MDA)试剂盒(TBA法)均购自南京建成生物研究所;小牛血清,美国HyClone公司;大鼠抗小鼠 CD3+-PE、CD4+-FITC和 CD8+-FITC抗荧光染料,美国Biolegend 公司;甲醇、无水乙醇、冰醋酸、二甲苯,分析纯,成都市科隆化学品有限公司。
1.2 辐射处理
60Co-γ射线辐射在四川省农业科学院辐照中心进行。辐射剂量率为0.8 Gy·min-1,单次均为全身照射。
1.3 试验动物
昆明小鼠购自四川成都达硕生物科技有限公司。48只健康雌性昆明小白鼠(6~8周龄,体重20~25 g),给予小鼠正常饮食饮水,适应性饲养7 d。试验过程中对动物的操作和处置严格遵循动物伦理学相关要求。
1.4 试验方法
1.4.1 手掌参多糖的提取 将手掌参块茎粉碎,粉末用75%乙醇以1∶15体积比在60℃条件下水浴4 h,4 000 r·min-1离心去上清液,粉末再提取一次,然后收集残渣在60℃干燥箱中干燥,再在研钵中将已处理好的手掌参研磨成细小粉末,过筛,并将其收集备用。称取10 g手掌参粉末,加入200 mL无水乙醇于圆底烧瓶中80℃加热回流,进行脱脂。样品干燥后,加入250 mL蒸馏水将其溶解,100℃加热回流,提取2次,合并2次提取液并在旋转蒸发仪上浓缩至100 mL。加3倍体积无水乙醇静置过夜,离心取沉淀,加入250 mL三氯乙酸(10%)使沉淀溶解脱蛋白。依次用无水乙醇、丙酮反复洗涤3次。40℃烘干后磨成粉即得手掌参多糖样品[7]。
1.4.2 手掌参多糖含量及结构的测定 称取适量葡萄糖,置于 105℃干燥箱中干燥使之达到恒重,然后用去离子水制备成浓度为0.1 mg·mL-1的葡萄糖标准溶液。分别取0、0.4、0.8、1.2、1.6、2.0 mL上述标准溶液,用去离子水将其定容到2 mL,分别加入1 mL苯酚溶液(5%),再分别缓慢加入5 mL浓硫酸,将混合物摇匀后,室温下静置20 min,用紫外可见分光光度计在490 nm波长处检测吸光度值,以葡萄糖标准溶液所测得的吸光度(y)为纵坐标,其相应浓度(x)为横坐标,拟合回归方程和相关系数。
精确称取1.4.1所得手掌参多糖样品,用去离子水制备成0.1 mg·mL-1的多糖溶液,测得的吸光度值(方法同上)代入对应的方程式中,按照以下公式计算样品手掌参多糖含量:
手掌参多糖含量=(C×V×D)/(W×106)×100%
式中,C:对应方程式上糖的浓度,μg·mL-1;V:定容体积,mL;D:稀释倍数;W:手掌参样品取样质量,g。
将手掌参多糖置于研钵中,加入少许溴化钾(KBr)粉末与之混合,研磨成均匀细粉。取适量粉末压片,将压好的薄片在4 000~400 cm-1范围内采用红外光谱仪进行扫描,并记录相关数据。
1.4.3 试验动物分组 本研究选用48只健康雌性昆明小白鼠(6~8周龄,体重25~30 g),随机分为8组,每组6只。空白组和手掌参多糖低、中、高给药组不照射,空白组灌胃生理盐水0.5 mL,给药组每日分别灌胃浓度为 150、300和600 mg·kg-1手掌参多糖0.5 mL;辐射组及辐射手掌参多糖低、中、高给药组用5 Gy60Co-γ 射线(剂量率0.8 Gy·min-1) 进行照射,辐射组在辐射后与空白组同时灌胃生理盐水;辐射给药低、中、高剂量组在照射后与相对应的不同剂量给药组同时灌胃手掌参多糖0.5 mL;以上灌胃均连续5 d。第6天测量小鼠体重,眼底静脉采血以待血常规检测,小鼠颈椎脱臼处死,剖取相应器官待测。
1.4.4 外周血细胞计数和分类检测 小鼠眼底静脉采血,于全自动血细胞分析仪上测定小鼠外周血中红细胞、白细胞和淋巴细胞等血细胞水平。
1.4.5 脾脏指数测定 小鼠颈椎脱臼处死,解剖取脾脏,去除黏附组织及血液,吸水纸吸干称重,按照以下公式计算脾脏指数:
脾脏指数=脏器质量(mg)/动物体质量(g)。
1.4.6 T淋巴细胞亚群测定 制备脾组织匀浆2 mL,尼龙布过滤,加入预冷的红细胞裂解液2 mL,2 min后加入2 mL PBS终止反应,4 000 r·min-1离心2 min,PBS洗涤,2 mL PBS冲悬,取300 μL悬液加入300 μL 5%脱脂奶粉封闭,每个样品取2份,放入冰盒内摇床摇30 min,2 mL PBS终止反应,离心洗涤2次,分别加入CD3+-PE、CD4+-FITC和CD3+-PE、CD8+-FITC各25 μL,冰盒内避光冰摇30 min,加2 mL PBS终止反应,洗涤,过400目尼龙网。加入PBS调整细胞浓度(约 1×106mL-1),流式细胞仪检测脾 T 淋巴细胞亚群。
1.4.7 骨髓嗜多染红细胞微核数目和DNA含量测定 小鼠颈椎脱臼处死后,取两侧股骨,将肌肉等组织去除剔净,用生理盐水洗净擦干、称重。取一侧股骨剪掉骨头两端股骨头,用生理盐水冲取骨髓,吹打混匀。1 000 r·min-1离心弃上清液,加入一滴无菌胎牛血清,进行骨髓推片,干燥后放入甲醇溶液中固定5 min,吉姆萨染色按试剂盒说明操作。染色结束立即用 1/15 mol·L-1磷酸盐缓冲液冲洗。油镜下计数具有微核(micronuclens, MN) 的嗜多染红细胞,结果以千分率(‰)表示。将另一侧股骨用10 mL CaCl2溶液冲洗骨髓至离心管中,置于4℃环境中30 min。3 500 r·min-1离心15 min,去上清液,向沉淀物中加入5 mL 0.005 mol·L-1HClO4溶液,吹打均匀,95℃水浴加热15 min后,流水冷却,2 500 r·min-1离心10 min。测上清液在268 nm处的吸光值,按照以下公式计算DNA系数:
DNA系数=A268 nm/股骨重(g)
1.4.8 抗氧化能力测定 取肝组织在预冷的生理盐水中制备10%肝组织匀浆,2 500 r·min-1离心10 min取上清液,测定蛋白含量(双缩脲法)、T-SOD活性(羟胺法)、T-AOC(比色法)及MDA含量(TBA法)。具体方法和结果计算参照相应的试剂盒说明书。
1.5 数据处理与分析
本试验数据统计及制图采用GraphPad Prism 8软件,结果分析采用SPSS 20.0软件。小鼠多组间单因素差异性采用Dunken新复极差法进行比较,P<0.05为差异有统计学意义。
2 结果与分析
2.1 手掌参多糖的提取与检测结果
如图1所示,试验中葡萄糖标准品浓度(x)与吸光度(y)的线性关系良好,关系式可表示为:y=0.014 8x+ 0.018 8,两变量间相关系数R2=0.999 3。通过测量手掌参多糖溶液的吸光值,代入公式可得到样品中手掌参多糖含量为89.3%。

图1 葡萄糖含量标准曲线Fig.1 Standard curve of glucose content
多糖的红外光谱(infrared spectroscopy,IR)分析结果如图2所示,该多糖具有典型的多糖吸收峰,将提取的手掌参多糖在4 000~400 cm-1的波段内进行红外光谱扫描,在3 323 cm-1处为O-H的伸缩振动[8],2 887 cm-1处为CH3、CH2、CH等的C-H伸缩振动[9]; 1 649 cm-1处为酰胺基-CONH2的伸缩振动,1 018、478 cm-1处为吡喃糖环;873 cm-1处为β-吡喃环中C-H的变角振动,807 cm-1处为呋喃环中C-H变角振动吸收峰[10]。由此可知,手掌参多糖是含有吡喃糖和呋喃环的酸性多糖。
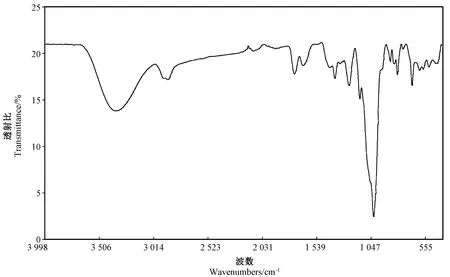
图2 手掌参多糖的红外光谱分析Fig.2 Infrared spectroscopy analysis of gymnadenia conopsea polysaccharide
2.2 手掌参多糖对小鼠外周血细胞计数和分类的影响
由图3可知,手掌参多糖对小鼠的血红蛋白含量影响有限,与空白组相比,手掌参多糖中、高剂量组(300、600 mg·kg-1)对淋巴细胞百分率、红细胞和白细胞计数有明显增加作用,特别是对白细胞计数增加效果显著;小鼠受辐射后,辐射组外周血血红蛋白含量和红细胞计数显著降低,白细胞计数和淋巴细胞百分率显著降低,与辐射组相比,手掌参多糖辐射给药组血红蛋白含量、淋巴细胞百分率、红细胞和白细胞计数均不同程度增加,中、高剂量组增加显著(P<0.05),血红蛋白含量和红细胞计数趋于正常水平。表明手掌参多糖可促进辐射后造血系统和免疫系统损伤的修复。
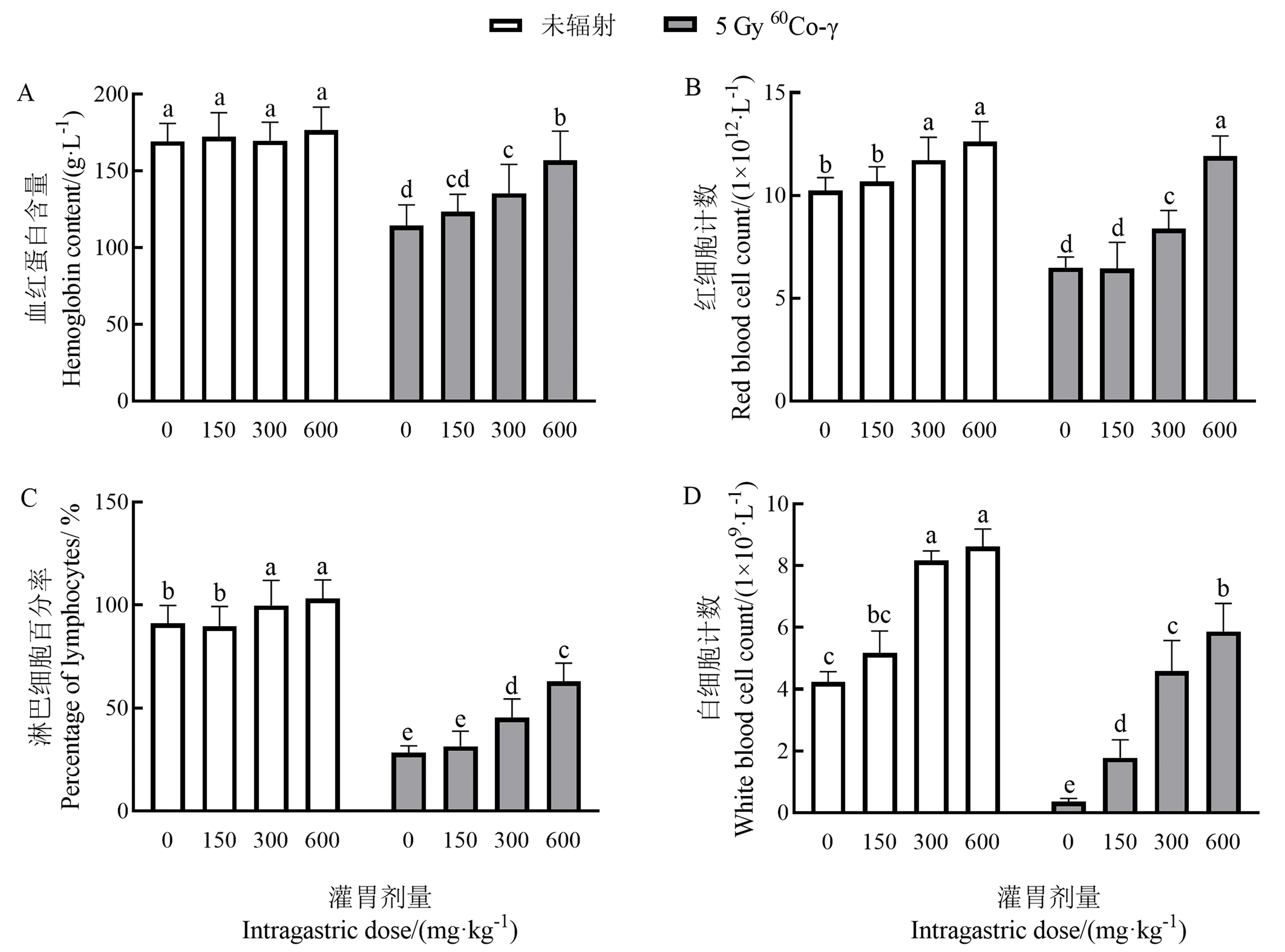
注:不同字母表示差异显著(P<0.05)。下同。Note: Data with different letters indicate significant difference at 0.05 level. The same as following.图3 手掌参多糖对小鼠外周血的影响Fig.3 Effect of gymnadenia conopsea polysaccharide on peripheral blood of mice
2.3 手掌参多糖对小鼠脾脏指数的影响
由图4可知,灌胃手掌参多糖可以提高正常小鼠脾脏指数,也可提高辐射后小鼠的脾脏指数,且在一定范围内与给药剂量呈正相关。经5 Gy60Co-γ射线辐射后,辐射组小鼠脾脏指数显著下降,显著低于空白组(P<0.05),灌胃手掌参多糖可以提高辐射组小鼠脾脏指数,并恢复至正常水平。本试验还对小鼠的胸腺进行称重对比,辐射后胸腺急剧萎缩,解剖后难以寻找和分离,称重存在较大误差,故未作统计,但给药组有不同程度的改善,说明辐射对小鼠的免疫器官有较大的影响,手掌参多糖对小鼠的免疫系统有较好的治疗和恢复作用。
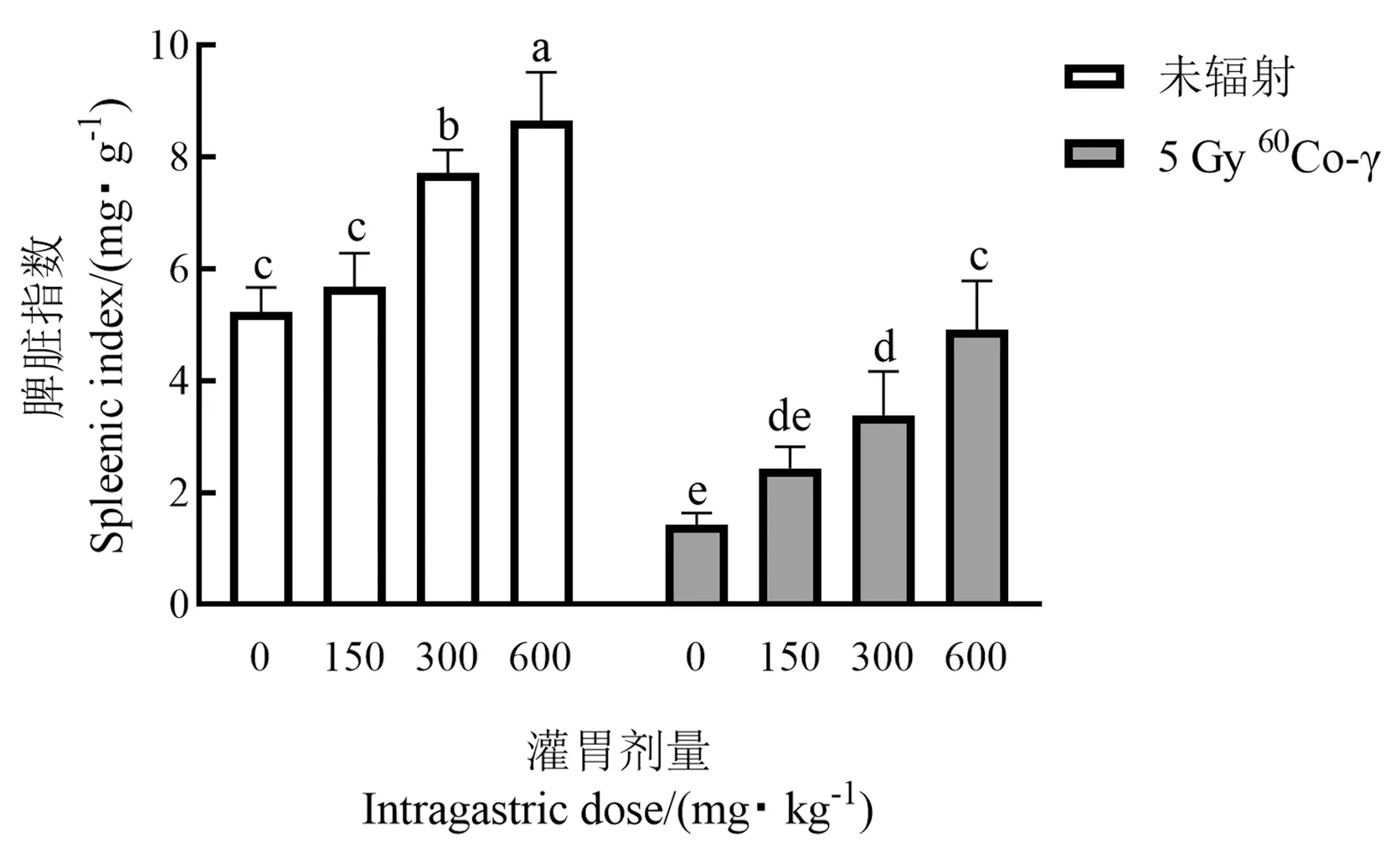
图4 手掌参多糖对小鼠脾脏指数的影响Fig.4 The effect of gymnadenia conopsea polysaccharide on the spleen index of mice
2.4 手掌参多糖对小鼠脾T淋巴细胞亚群的影响
如图5所示,与空白组相比,不同剂量给药组CD3+、CD4+、CD8+T淋巴细胞比例均不同程度升高,辐射组CD3+、CD4+、CD8+T淋巴细胞比例均显著降低;灌胃手掌参多糖后,300、600 mg·kg-1剂量辐射给药组的 CD3+、CD4+、CD8+T淋巴细胞比例均显著高于辐射组(P<0.05)。
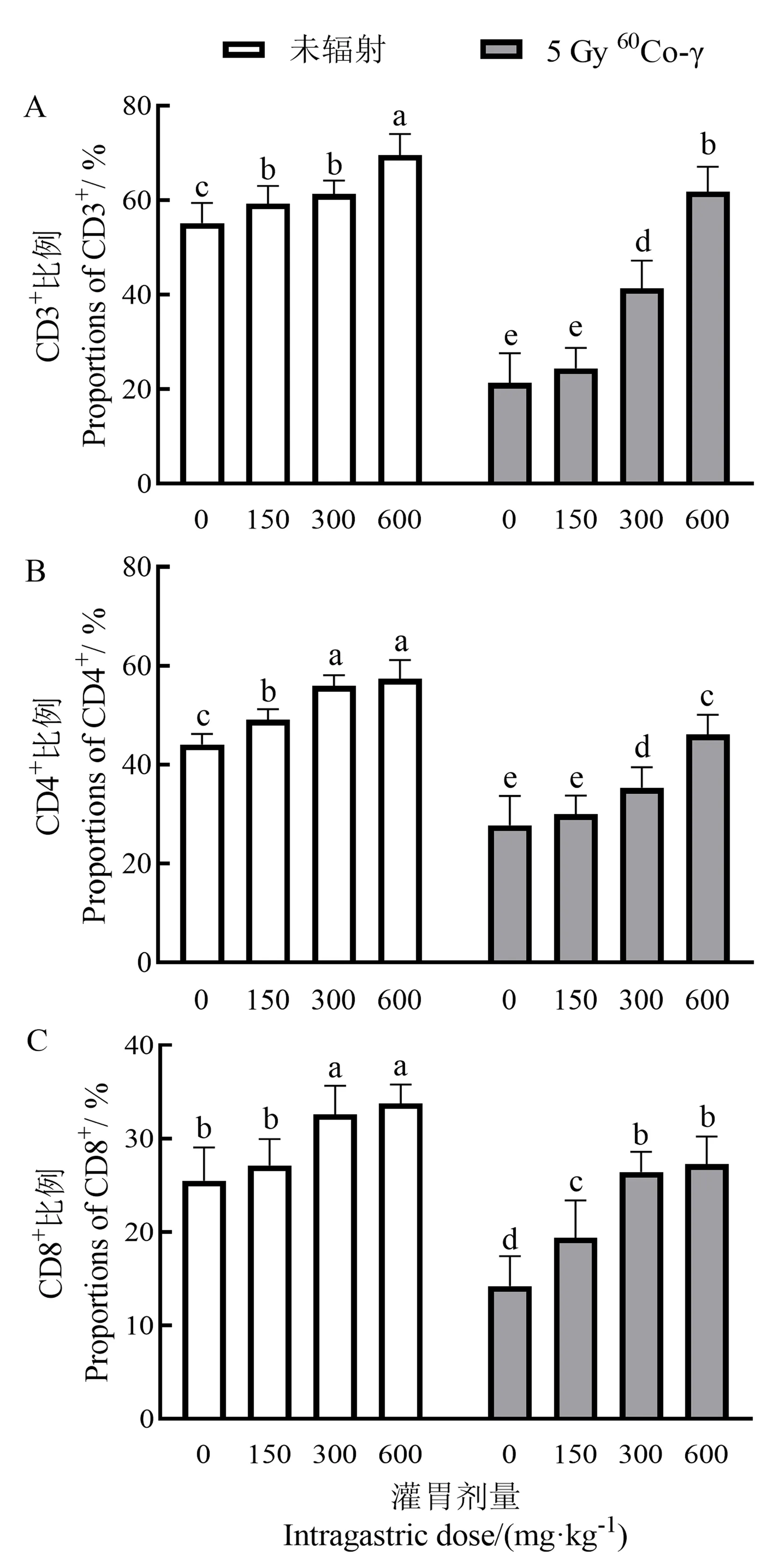
图5 手掌参多糖对小鼠脾脏 T 淋巴细胞亚群的影响Fig.5 Effect of gymnadenia conopsea polysaccharide on mouse spleen T lymphocyte subsets
2.5 手掌参多糖对小鼠骨髓微核数目和DNA含量的影响
由图6-A可知,手掌参多糖中、高剂量给药组对正常小鼠微核数目有显著降低作用,但经5 Gy60Co-γ射线辐射后小鼠微核数目增多,说明辐射造成了小鼠染色体损伤,PCE分裂过程受到影响,从而使微核数目增加[11]; 辐射给药组微核数目相比辐射组显著减少(P<0.05),这可能与手掌参多糖的抗氧化作用有一定关系。
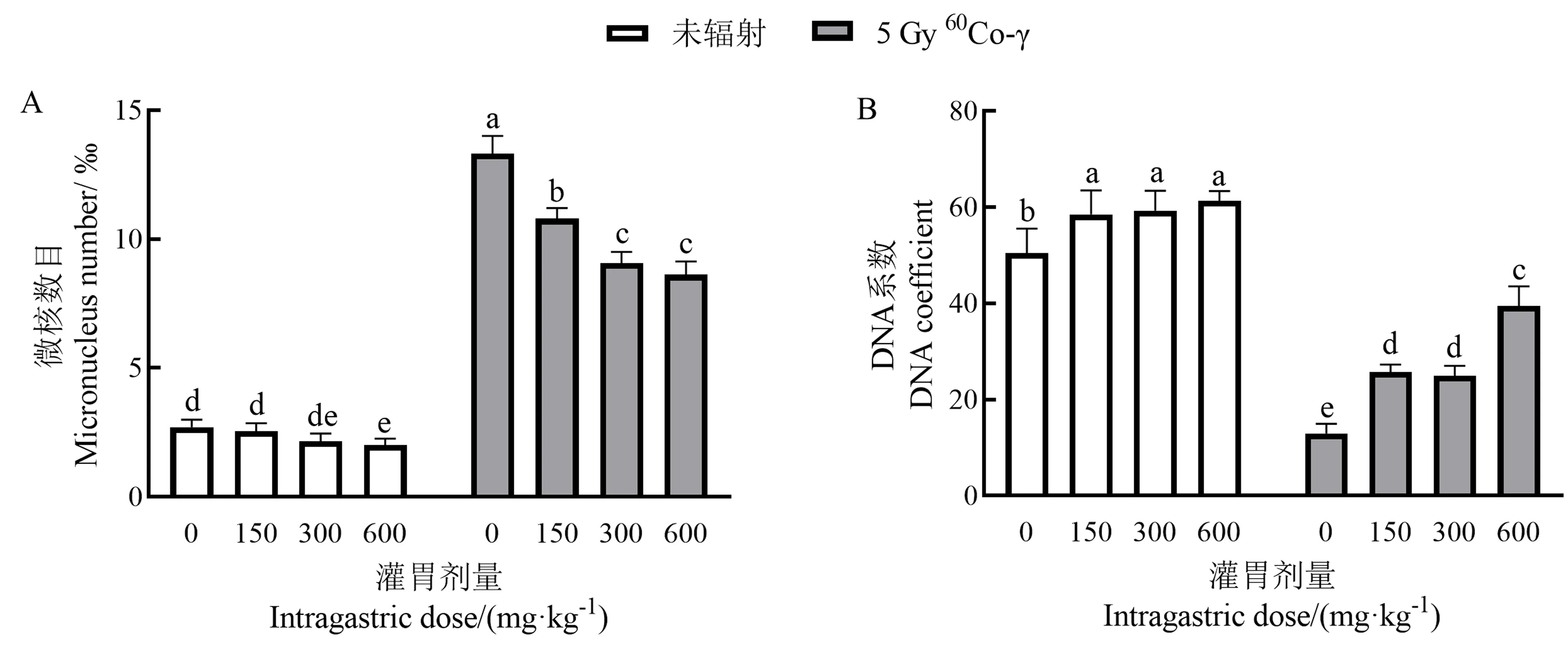
图6 手掌参多糖对小鼠PEC微核数目(A)和骨髓DNA系数(B)的影响Fig.6 Effect of gymnadenia conopsea polysaccharide on mouse Number of PECmicronuclears (A) and Bone marrow DNA coefficient(B)
如图6 B,与空白组相比,给药组正常小鼠骨髓DNA显著增加,但不随给药剂量增加变化;γ射线作用后,小鼠骨髓DNA含量显著降低;辐射给药组小鼠骨髓DNA含量不同程度上得到改善,但与空白组有显著差异(P<0.05),这表明手掌参多糖对机体DNA有一定保护作用,但本试验未能使DNA含量恢复至正常水平,需进行进一步探讨。
2.6 手掌参多糖对小鼠抗氧化能力的影响
由图7可知,灌胃手掌参多糖后,低剂量给药组对正常小鼠T-AOC 能力没有明显提升,但中、高剂量给药组对小鼠的抗氧化能力有显著提升,同时也使小鼠机体内MDA含量显著降低,说明手掌参多糖对小鼠机体的抗氧化能力有一定提高作用;5 Gy60Co-γ射线辐射后辐射组小鼠肝脏中T-SOD活性和T-AOC能力显著降低,MDA含量显著升高(P<0.05),说明小鼠抗氧化能力受到严重损害;辐射后手掌参多糖高剂量给药组小鼠T-SOD活性和T-AOC能力相比辐射组显著提高,MDA含量也大大降低,且都能恢复至正常水平甚至更优于正常水平,其中T-AOC能力在低剂量给药组即可得到显著提高(P<0.05);虽辐射给药中、低剂量组T-SOD活性未有明显改善,但高给药量组T-SOD活性显著提高且能恢复到正常水平,T-AOC能力在辐射低给药量组即可恢复正常水平,表明手掌参多糖可以提高小鼠的抗氧化能力,并对电离辐射产生的抗氧化能力损伤有一定治疗作用,保护机体减少氧化损伤。γ射线辐射的小鼠灌胃手掌参多糖后,中、高剂量组MDA水平显著降低,且可以恢复至正常水平,表明手掌参多糖可清除机体内自由基含量,减轻氧化损伤。
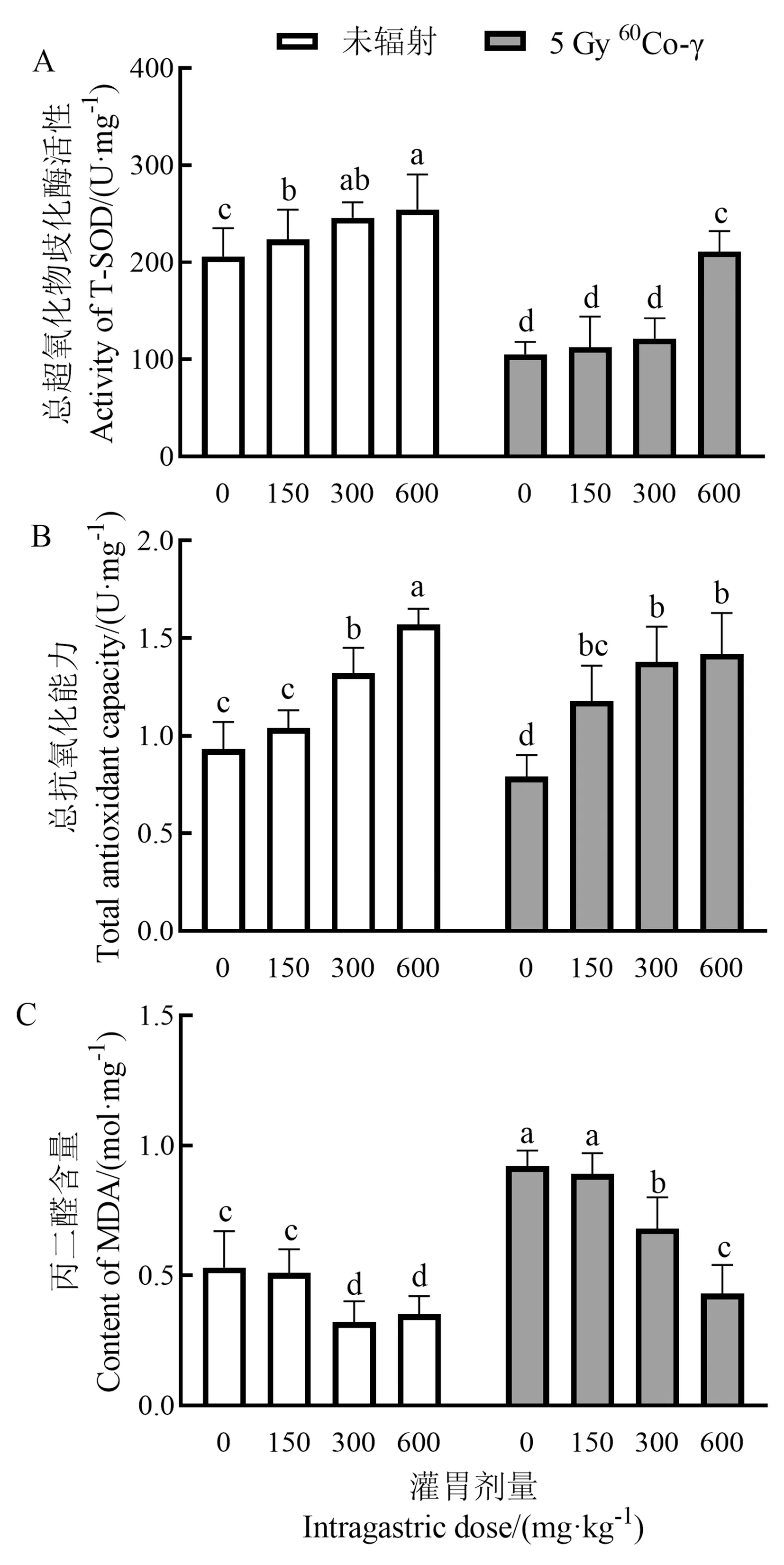
图7 手掌参多糖对小鼠肝脏超氧化物歧化酶(T-SOD)活性(A)、总抗氧化能力(T-AOC)(B)、丙二醛(MDA)含量(C)的影响Fig.7 Effects of palm ginseng polysaccharides on superoxide dismutase (T-SOD) activity (A), total antioxidant capacity (T-AOC) (B), malondialdehyde (MDA) content (C) in mice liver
3 讨论
科技的快速发展使电离辐射危害得到更多的关注,研究表明电离辐射既可通过能量传递直接作用于生物大分子,如DNA螺旋结构改变、染色体畸变等;也可作用于水分子使之发生辐解反应,产生自由基并间接作用于生物大分子,造成辐射损伤,甚至导致细胞死亡[12-13]。Wu等[14]研究表明机体辐射损伤主要集中在分化程度较低的系统,所以辐射对造血系统、免疫系统、遗传物质和抗氧化能力有较大影响。
机体经电离辐射后造血系统最早出现变化,电离辐射损伤的早期标志之一是外周血象的改变[15-17]。电离辐射可导致细胞的新陈代谢受阻或停滞、染色体畸变及有丝分裂停止等,主要表现为各类血细胞水平下降及造血微循环障碍等,可能是通过抑制或破坏造血干细胞和增殖细胞的增殖能力从而导致造血系统损伤[4,18]。本试验结果显示,5 Gy60Co-γ射线辐射后,外周血中淋巴细胞百分率、白细胞计数、辐射组小鼠红细胞计数和血红蛋白含量显著下降,其中淋巴细胞下降幅度最大,耿艳艳等[19]也得到了类似的结果,这可能是电离辐射导致小鼠机体造血系统损伤,进而抑制造血干细胞增殖、分化能力[19-20]。与之相对应的手掌参多糖辐射给药组,小鼠外周血中各类血细胞水平下降得到缓解,并在一定范围内与手掌参多糖剂量呈正相关,表明手掌参多糖对辐射造成的造血系统损伤具有一定的治疗作用。电离辐射可导致免疫器官萎缩,骨髓、胸腺等造血器官中免疫细胞凋亡、增殖和分裂受阻,进一步造成外周血免疫细胞减少[21-22]。脾脏指数是反映脾脏免疫功能的重要指标,辐射往往能造成脾脏指数的显著下降,其机制可能是射线辐射导致内质网凋亡途径下游的促凋亡蛋白的表达不同程度的降低,因此诱导经射线辐射的小鼠脾细胞凋亡[23]。本试验中,小鼠受5 Gy60Co-γ射线辐射后,脾脏指数急剧下降,外周血中免疫相关细胞水平显著降低,说明辐射能对机体的免疫系统造成严重损伤。另外,本研究发现辐射给药组小鼠的脾脏指数显著高于辐射组,高剂量给药组脾脏指数可以恢复至正常水平,表明手掌参多糖对免疫器官和外周血免疫细胞具有一定的保护作用。T 淋巴细胞是机体内数量最庞大且功能最复杂的免疫活性细胞,因其表面标志物的不同可分为多个亚群[24]。CD3+细胞可与 T 细胞抗原受体结合,传递抗原信号至细胞内[25]。CD4+细胞可通过多肽抗原反应被激活,进而分泌白介素(interleukin,IL)、干扰素(interferon, IFN)等淋巴因子,起辅助协调作用,是免疫应答反应的重要组成[26]。CD8+细胞可通过组织相容复合体与抗原结合,直接杀伤靶细胞[27]。本试验使用流式细胞仪测定了小鼠脾脏 T 淋巴细胞亚群,结果显示,γ射线辐射后,小鼠脾脏CD3+、CD4+、CD8+T 淋巴细胞比率均显著降低,说明辐射对 T 淋巴细胞造成损伤。而手掌参多糖可显著提高受γ射线辐射小鼠 CD3+、CD4+、CD8+T 淋巴细胞比例,表明其可减轻辐射对 CD3+、CD4+、CD8+T淋巴细胞的影响,这与黑大蒜多糖[22]、灵芝多糖[24]的研究结果相似,多糖可以促进 T 细胞增殖,有助于减轻辐射对T 淋巴细胞的损害。
电离辐射可使机体内水分子发生电离并产生自由基,进一步引发氧化级联反应造成DNA的损伤,同时还可诱发微核的形成,影响细胞的增殖分化,对机体产生多维度的毒害作用[28]。骨髓DNA含量是反映骨髓造血细胞增殖、分化和成熟的重要指标[29]。小鼠骨髓嗜多染红细胞中的微核数目是染色体及DNA 受损伤程度的重要标志[30]。本试验发现,灌胃手掌参多糖可使辐射小鼠PCE微核数量显著降低,DNA含量显著增高,说明手掌参多糖对辐射损伤有一定的治疗作用,其机理可能是手掌参多糖清除自由基并中断其引发的链式反应,降低辐射对DNA分子的损伤,这可能与手掌参多糖的体内抗氧化活性有关[31]。SOD是一种稳定性高、分布广泛的特异性酶,可以清除体内超氧阴离子自由基,保护机体免受超氧阴离子自由基损伤,具有抗氧化和抗衰老的作用;T-AOC反映了机体的抗氧化状态;MDA是一种脂质过氧化物,可反映细胞和组织受自由基损伤的程度[32]。在本试验中,灌胃手掌参多糖能够提高正常小鼠体内T-SOD和T-AOC能力,促进辐射损伤小鼠体内T-SOD与T-AOC能力的恢复,其中600 mg·kg-1给药组的效果较显著;辐射组MDA水平均显著增高,灌胃手掌参多糖可降低小鼠肝脏中的MDA含量,其中300、600 mg·kg-1灌胃手掌参多糖组的效果较好。由此可见,手掌参多糖可以提高小鼠机体抗氧化能力,清除电离辐射产生的自由基并阻断自由基链的传递从而降低MDA含量,减少SOD的消耗[3]。
本研究仅以600 mg·kg-1为最大给药剂量进行试验观察,更高剂量的手掌参多糖对辐射损伤疗效果还需继续探讨,同时手掌参多糖对5 Gy60Co-γ 射线辐射损伤小鼠具有一定的治疗作用,但对于不同程度的辐射损伤,所需手掌参多糖的最佳用量有待进一步研究。在此基础上将继续深入分析精确辐射剂量区间,以及缓解不同程度辐射损伤的最佳给药剂量区间,并深入探究手掌参多糖缓解辐射损伤的具体机理。
4 结论
本试验表明,灌胃不同剂量的手掌参多糖可以不同程度地提高小鼠外周血白细胞计数、红细胞计数、淋巴细胞百分比和血红蛋白含量的水平,改善脾脏、骨髓辐射损伤,减轻细胞膜脂损伤,提高 T-SOD活性和T-AOC能力,减少MDA 的产生,提高辐射小鼠T淋巴细胞比例。综上,手掌参多糖可以提高小鼠的体内抗氧化能力、免疫力及造血能力,并对60Co-γ射线辐射造成的小鼠造血、抗氧化功能损伤具有治疗作用。

