牦牛转移因子对藏绵羊外周血淋巴细胞转化功能的影响
常建军,文 英,李 莉
(青海大学农牧学院,西宁 810016)
0 引言
转移因子(Transfer Factor,TF)因其具有安全、作用迅速、效果显著、无药物残留、无抗原性、无毒副作用、无种属差异性等优点,而成为学者们研究的一种理想的动物细胞免疫增强剂。李相安等[1]研究发现,鸡脾TF可显著提高雏鸡免疫器官脾脏和腔上囊的相对重量。黄建文等[2]试验表明,用鸡传染性喉支气管炎灭活疫苗免疫鸡的同时,肌肉注射TF,淋巴细胞转化率升高,这表明蛋鸡的细胞免疫机能增强。张广英[3]报道猪TF能显著增加受体猪的外周血T细胞比值,王建文[4]报道鸡TF除对仔鸡的法氏囊、脾脏等免疫器官增重作用明显外,还具有促生长发育作用。马志勇[5]等报道犬TF可使小鼠E玫瑰花环形成细胞显著增加。
机体免疫系统中淋巴细胞增殖是机体对非己抗原刺激发生免疫应答过程中的重要阶段,淋巴细胞的增殖结果表现为效应淋巴细胞的产生,并发挥其清除非己抗原的作用,以维持体内内环境的稳定,而效应淋巴细胞的数量,决定了机体免疫应答的强度,在评价机体免疫功能方面具有重要意义[6]。现国内外对动物外周血淋巴细胞自身增殖功能的研究多见于鸭[7]、番鸭[8]、雏鸡[9]、犬[10]、大鼠[11]、鲟鱼[12]等动物。针对新型免疫增强剂的报道多见于多糖[13-15]、中药[16]、植物提取物[17]等制剂,而相关动物TF的报道不多。孔庆波等[18]研究不同浓度犬、猪转移因子对犬外周血淋巴细胞增殖的影响,发现同源或异源TF对犬淋巴细胞增殖均有良好的刺激效果;文英等[19]研究报道,用牦牛TF单独或协同ConA刺激小鼠淋巴细胞后,均可提高各种细胞因子的分泌能力,但尚未见牦牛TF对藏绵羊外周血淋巴细胞转化功能的研究报道。
本试验主要目的是通过研究牦牛TF对藏绵羊外周血淋巴细胞体外增殖的影响,进而对其免疫调节作用机制进行研究,为增强藏绵羊细胞免疫功能提供更为准确的方法和手段。
1 材料与方法
1.1 实验动物
6~8月龄健康藏绵羊12只,购于青海省大通县某养殖场。
1.2 主要试剂
RPMI-1640培养基,购自宜兴市赛尔生物化工厂;台盼蓝、塞唑蓝(MTT),购自北京中生瑞泰公司;二甲基亚砜(DMSO)、刀豆蛋白(ConA)、犊牛血清(FCS),均购自北京中生瑞泰公司;淋巴细胞分离液,购自北京索莱宝科技有限公司;牦牛TF冻干粉,由实验室自制保存。
1.3 主要仪器设备
超净工作台(AC2-4S1),购自北京五洲东方科技发展有限公司;水平离心机(LD4-2A型),购自北京医用心机厂;CO2培养箱(Model TC2323),购自CE公司;酶标分析仪(DNM-9602),购自北京普朗新技术有限公司。
1.4 主要培养基和溶液
不完全RPM I-1640培养液;无Ca2+、Mg2+PBS液、ConA应用液、MTT应用液、转移因子应用液、台盼蓝等。
1.5 藏绵羊淋巴细胞悬液的制备
无菌采取抗凝血,与等量无Ca2+、Mg2+PBS混匀后,叠加于等体积淋巴细胞分离液上,2000 rpm离心20 min,轻轻吸取淋巴细胞层(即中间的云雾层),用无Ca2+、Mg2+PBS洗涤3次,每次1000 rpm离心10 min,用台盼蓝染色计数,保证活细胞数在95%以上。用RPMI-1640培养液将淋巴细胞分别调至为1.35×106个/mL(C1)、2.70×106个/mL(C2)、5.40×106个/mL(C3)3个浓度的细胞悬液。
1.6 藏绵羊淋巴细胞体外转化增殖最优条件确定
设计FCS含量、淋巴细胞浓度、ConA浓度3个因素。FCS设3个水平,分别为5%、8%和10%;淋巴细胞悬液设3个浓度(见淋巴细胞悬液的制备);ConA设3个浓度,分别为 1 μg/mL(A1)、2 μg/mL(A2)、2.5 μg/mL(A3),在96孔细胞培养板上进行淋巴细胞转化增殖试验。
试验设3个组,1个试验组,淋巴细胞+ConA;1个对照组,淋巴细胞;1个空白组,完全RPMI-1640 200 μL,每个样品设3个重复孔。淋巴细胞加入量为100 μL,ConA 和 TF 加入量为 50 μL,每孔总量为200 μL,不足的用完全RPMI-1640补足。试验结果用MTT法测定[11-13]。测出OD值后,计算出刺激指数(SI,stimulate index),选出各因素最佳值。SI的计算见公式(1)。

1.7 牦牛TF对藏绵羊淋巴细胞转化增殖的影响
1.7.1 体外培养淋巴细胞中加入牦牛TF在最优条件下设3个TF浓度,分别为0.5 mg/mL(T1)、1.5 mg/mL(T2)、2.5 mg/mL(T3),寻求牦牛TF的最佳刺激量。试验共设4个组,淋巴细胞+ConA+TF组、淋巴细+TF组;淋巴细胞+ConA组、淋巴细胞组,每个样品设3个重复孔。方法同2.2。
1.7.2 牦牛TF体内注射 皮下注射牦牛TF,分1 mL、2 mL、3 mL 3个剂量组,对照组注射生理盐水,3只/组,连续注射3天,并在注射后第3、5、7天采血并分离淋巴细胞进转化增殖试验,方法同体外试验。注射所用TF浓度为体外试验确定的最佳刺激浓度。
1.8 统计结果
用SPSS统计软件分析实验数据,结果用“平均值±标准差”表示。
2 结果
2.1 藏绵羊淋巴细胞体外转化增殖最佳浓度确定
试验用含5%、8%及10%FCS的完全RPMI-1640,在相同浓度FCS的条件下,确定最佳淋巴细胞及ConA浓度。按FCS浓度统计SI值,结果见表1~3。结果表明,当FCS浓度为8%,淋巴细胞浓度为5.40×106个/mL,ConA浓度为1 μg/mL时促进藏绵羊淋巴细胞增殖的效果显著优于其他2个浓度组(P<0.05)。
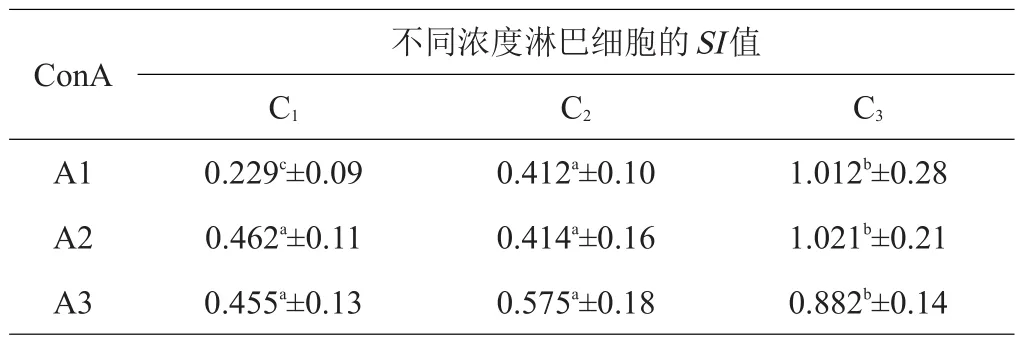
表1 5%FCS对羊淋巴细胞增殖影响的测定
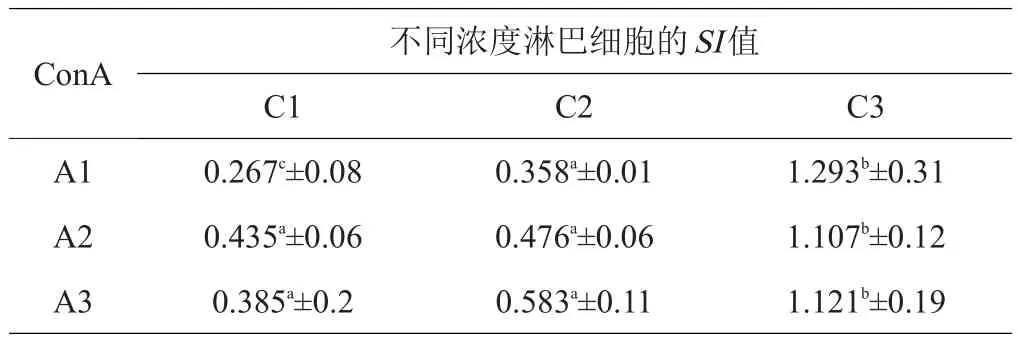
表2 8%FCS对羊淋巴细胞增殖影响的测定
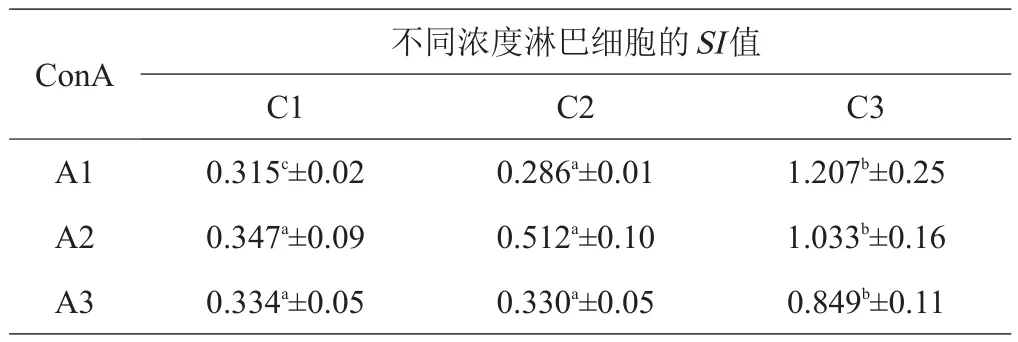
表3 10%FCS对羊淋巴细胞增殖影响的测定
2.2 牦牛TF对藏绵羊淋巴细胞转化增殖的影响
2.2.1 体外培养细胞中加入牦牛TF结果显示,在0.5~2.5 mg/mL浓度范围内,TF单独或协同丝裂原均可刺激藏绵羊外周血淋巴细胞的增殖,且浓度为1.5 mg/mL时,对淋巴细胞的转化增殖的效果明显,差异显著(P<0.05)。结果见表4。
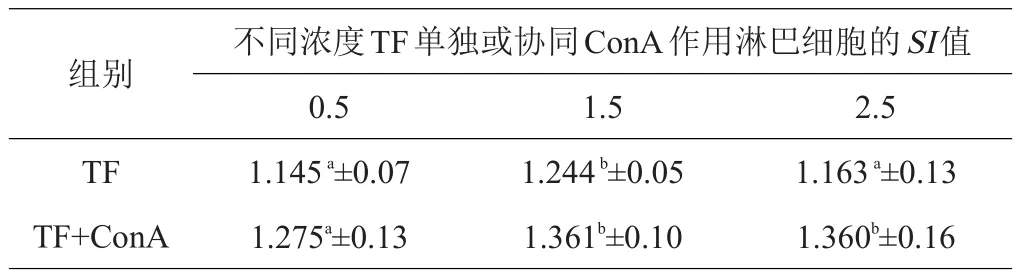
表4 不同浓度TF协同丝裂原对羊淋巴细胞增殖的影响
2.2.2 牦牛TF体内注射 结果显示,各剂量组在注射TF第3天时,淋巴细胞再次受到TF单独或协同ConA刺激时,其增殖效果与细胞组单独增殖效果比较,差异不显著(P>0.05),至第5~7天时,淋巴细胞再次受到TF单独或协同ConA刺激时,淋巴细胞增殖效果明显高于细胞组,差异显著(P<0.05)。注射2 mL剂量组其转化增殖效果优于1 mL剂量组和3 mL剂量组,差异显著(P<0.05)。测定结果见表5~7。

表5 注射1 mL TF对羊淋巴细胞增殖的影响

表6 注射2 mL TF对羊淋巴细胞增殖的影响
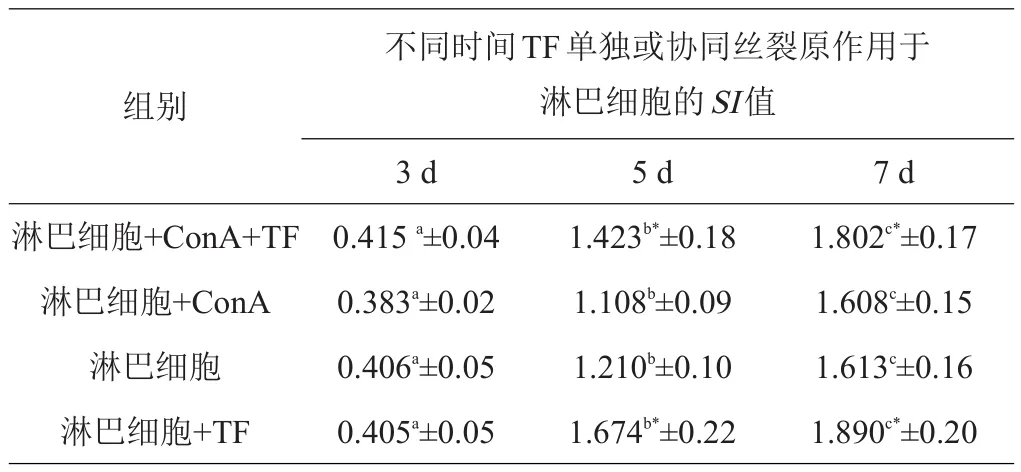
表7 注射3 mL TF对羊淋巴细胞增殖的影响
3 讨论
3.1 MTT法确定羊外周血淋巴细胞增殖条件
淋巴细胞增殖反映的是机体免疫应答的过程,增殖效果越好,说明机体的免疫状态越好。一般淋巴细胞的增殖能力就是通过测定淋巴细胞的转化增殖指数来说明。淋巴细胞转化试验方法有形态学检查法、同位素标记物掺入转化法(3H-TdR掺入转化法)、MTT法等。MTT法具有快速、简便、准确、灵敏等优点,可用于分析体外培养的淋巴细胞受特异性刺激时增殖能力的变化情况从而反映出机体细胞免疫功能的状态[20-22]。故本试验选择MTT法。但由于MTT法的高灵敏度,也决定其在试验中会受到很多因素的影响,所以要严格把握试验条件[23]。淋巴细胞存活率和浓度是影响MTT法的主要因素[24],当培养条件如血清、培养液、MTT等不能满足增殖需要时细胞间将会相互拮抗;相反,过少或存活力较低的细胞会因死亡和沉积,影响其他活细胞的增殖和干扰比色,因此试验应严格控制细胞密度,以保证细胞的存活率在95%以上。其次,要控制血清浓度,血清浓度不足时细胞会产生竞争性代谢抑制;而过量的血清与细胞碎片混合会出现浑浊。再者,在评价淋巴细胞免疫功能时,培养时间不宜过长,因细胞存活力、增殖力等与其也有直接关系。因此对这些因素进行摸索并找出其在淋巴细胞转化增殖试验中的最佳值,可保证试验结果充分反映机体的细胞免疫状态。
本次试验摸索出最佳条件为,FCS浓度为8%,淋巴细胞浓度为5×106个/mL,ConA浓度为1μg/mL,此时所得到的SI值结果最理想,促进藏绵羊淋巴细胞增殖的效果优于其他2个浓度组,差异显著(P<0.05)。试验确定的ConA浓度(1 μg/mL)与孔庆波[25]所用ConA浓度(2.5 μg/mL)及金扩世等[26]所用ConA浓度(20 μg/mL)有一定差别,是否与使用的产品和实验动物不同有关,有待进一步研究。
3.2 牦牛TF对藏绵羊淋巴细胞转化增殖的影响
细胞免疫主要通过T淋巴细胞介导,而TF具有活化T淋巴细胞,刺激并促进干扰素和白细胞介素产生,进而活化巨噬细胞的效应[27-28]。吴德华等[29]在犬口服或注射TF后用酯酶染色法检测了犬外周血T细胞比值变化,检测结果表明犬T细胞数量明显升高。何孟莲等[30]研究了不同动物来源TF对肉仔鸡T细胞免疫功能及免疫器官指数的影响,结果发现不同来源的TF对T细胞转化增殖作用显著,促免疫器官生长发育作用也显著,TF通过促T细胞转化增殖作用和促免疫器官生长发育,可显著提高肉仔鸡免疫功能。文英等[19]研究报道,用牦牛TF刺激小鼠淋巴细胞后,IL-12、IL-1、IL-4、IFN-γ等细胞因子的分泌能力均有提高。除了增强细胞免疫外,罗俊崇等[31]也报道羊胎盘转移因子能够在一定时间内提高仔猪血清中IgM和IgG的含量,对仔猪的体液免疫能力有增强作用。全炳昭等[32]发现犬TF能够犬淋巴细胞转化率,且TF促进犬淋巴细胞转化效应的大小与TF浓度密切相关。浓度高或低时,均可影响淋巴细胞的转化。
试验结果显示,牦牛TF在0.5~2.5 mg/mL浓度范围内,牦牛TF单独或协同丝裂原均可刺激藏绵羊外周血淋巴细胞的增殖,且浓度为1.5 mg/mL时,对淋巴细胞的转化增殖的效果明显。各剂量组体内注射牦牛TF后,在7天内淋巴细胞再次受到TF单独或协同ConA刺激时其增殖能力呈现上升趋势,与孔庆波[33]“注射猪TF的犬淋巴细胞增值能力早期(4~6天)呈下降趋势,6天后受到抑制”的结果不同,这或与TF种类不同有关。牦牛TF对藏绵羊而言属于非特异性免疫增强剂,能够促进藏绵羊非特异性淋巴细胞的增殖,从而改善藏绵羊的非特异性细胞免疫功能。藏绵羊注射异种TF后,在一定时间内,淋巴细胞增殖能力呈增强的特点,体现了免疫增强剂的本质,这为非特异性TF在藏绵羊疾病防治的临床应用提供了理论依据。至于牦牛TF作用于藏绵羊外周血淋巴细胞时其增殖能力何时下降或受到抑制,有待进一步研究。不同剂量组间比较发现,注射2 mL剂量组其转化增殖效果优于注射1 mL组和3 mL组,差异显著(P<0.05)。此结果可为临床治疗提供一定的理论依据。
4 结论
从试验结果可知,当FCS浓度为8%、藏绵羊淋巴细胞浓度为5×106个/mL、ConA浓度为1 μg/mL时,所得SI值结果最理想,即藏绵羊淋巴细胞的增殖效果最佳,因此该条件可做为MTT法检测藏绵羊外周血淋巴细胞转化的最佳条件,可用于实践中对藏绵羊免疫功能的检查。
在0.5~2.5 mg/mL浓度范围内,牦牛TF单独或协同丝裂原均可刺激藏绵羊外周血淋巴细胞的增殖,且浓度为1.5 mg/mL时,对淋巴细胞的转化增殖的效果明显,差异显著(P<0.05)。各剂量组体内注射牦牛TF后,在7天内淋巴细胞再次受到TF单独或协同ConA刺激时其增殖能力呈现上升趋势,不同剂量组间比较发现,注射2 mL剂量组其转化增殖效果优于注射1 mL组和3 mL组,差异显著(P<0.05)。说明牦牛TF能较好的增强机体免疫功能。

