玉米芯降解复合菌剂的构建及其发酵效果初探
韩晓云,胡长林,许 可,郑桂华,郭宇豪,孙庆申
(1黑龙江大学 农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院黑龙江省普通高等学校分子生物学重点实验室,哈尔滨 150080;3黑龙江大学生命科学学院黑龙江省普通高等学校微生物重点实验室,哈尔滨 150080)
0 引言
农业废弃物如玉米芯、秸秆等是重要的生物质资源,对其进行深度开发利用具有重要的理论意义及实践价值[1]。黑龙江省是农业大省,每年秋季产生大量包括玉米芯在内的农业废弃物[2],这些玉米芯除了少部分被回收利用生产吸附剂、餐具、多酚、纳米纤维素、催化剂、糠醛及糠醇[3-8],大部分都被焚烧掉,不仅造成环境污染,而且燃烧释放的氮、硫氧化物对人体健康也构成威胁[9]。随着人们对环境保护意识的增强,以焚烧包括玉米芯在内的农业废弃物已经被严令禁止,因此,寻求快速降解玉米芯的方案,提高其生物可利用性是迫切需要解决的问题。
玉米芯主要由木质素和纤维素组成,结构坚实,难降解[10],为此,目前采用化学、生物学方法来降解纤维素。其中生物法,特别是微生物降解法因其对环境友好,不会造成二次污染而备受青睐[11]。在生物法降解纤维素木质素方面,目前用的较多的是各种真菌如嗜热毛壳菌[10],利用其产酶性来降解木质纤维素[1,10-14]。基于微生物降解木质纤维素的优良特性,本课题组自2013年开始开展了以牛粪玉米芯为发酵基质,培育巴西菇项目的研究,并获得国家技术发明专利一项[15]。但是牛粪富集、晒干,再与玉米芯混合发酵,过程繁琐,且也存在着污染环境的问题。牛属于反刍动物,牛瘤胃的微生物大多都是细菌,本研究是从牛粪体系中筛选出纤维素降解菌,研制出可有效降解玉米芯的复合菌剂,代替牛粪发酵降解玉米芯的纤维素、半纤维素,从而提高其生物利用度。
1 材料与方法
1.1 材料与试剂
本实验所用到的牛粪和玉米芯均来自黑龙江省银沐生物科技有限公司。实验试剂:羧甲基纤维素钠,北京奥博星生物技术有限责任公司;其他试剂均为分析纯。实验在黑龙江大学工业发酵分析实验室,于2019年12月—2020年11月进行。
1.2 菌株的富集培养
按照本课题组专利[15]的方法制备牛粪玉米芯发酵料,采用二次发酵法,即分别于37℃培养箱中发酵3天,57℃发酵2天,每隔36 h进行翻堆和补水。将37℃发酵3天、57℃发酵2天的牛粪玉米芯发酵料以及干牛粪各5 g,分别加入95 mL的无菌生理盐水制成悬液,分别利用PDA平板和LB平板进行菌落计数。
1.3 纤维素降解菌株的筛选及鉴定
初步形态学观察,确定上述纯化菌株为细菌,将上述纯化菌株用LB液体培养基,37℃,120 r/min摇床培养12 h待用。
1.3.1 初筛 参考文献[16-17],使用刚果红法对菌株进行初筛。
1.3.2 复筛 采用改良后的滤纸酶活法[18]对初筛结果中具有纤维素酶活的菌株进行复筛,参考文献[19]的方法制备液体产酶培养基,将初筛得到的菌株以滤纸酶活为指标测定菌株的纤维素酶活力。
1.3.3 菌株鉴定 将复筛后得到的目标菌株接种于LB平板上,在37℃的恒温培养箱倒置培养24 h,观察记录菌落形态、颜色等特征,革兰氏染色后在显微镜下观察菌体形态。并根据《伯杰氏细菌鉴定手册》[20]及《常见细菌系统鉴定手册》[21],设计了甲基红实验,淀粉水解实验,吲哚实验,V-P实验,过氧化氢实验和糖酵解实验对菌株进行初步鉴定。最后将纯化的目标菌株样本送至生工生物工程(上海)股份有限公司进行鉴定,所得序列提交NCBI网站进行Blast比对,并获得NCBI序列号。
1.4 复合菌剂构建
1.4.1 菌株拮抗实验 将复筛获得的菌株于LB平板上两两相交划线,37℃倒置培养24 h,观察菌株相交处是否有菌落生长,菌落生长完好表示菌株间没有拮抗作用,可进行复合菌剂的制备。
1.4.2 复合菌剂酶活力测定 根据前期平板菌落计数结果,将没有拮抗作用的目标菌株以等菌落数加入至50 mL的LB液体培养基中进行复配,参照文献[18]的方法对优势降解菌单一菌株和复合菌剂分别进行羧甲基纤维素酶(CMCase)、β-葡萄糖苷酶(β-Gase)和滤纸酶活(FPA)测定。
1.5 复合菌剂对玉米芯的发酵效果评价
1.5.1 牛粪玉米芯发酵料的制备 参考本实验室的方法[15]进行。
1.5.2 复合菌剂玉米芯发酵料的制备 对牛粪玉米芯发酵料配方进行改良,因使用了复合菌剂代替牛粪,本实验将其他配料加入量修改为:玉米芯88.24%、复合菌剂为10.59 log CFU/g、石膏1.18%、石灰1.18%、尿素0.47%和麸皮8.93%,混合后,加水搅拌,用力握紧发酵料有水从指缝渗出,然后放入37℃培养箱中进行发酵,每间隔36 h进行翻堆和补水。
发酵料的取样采样点为堆料的四角和中心点处,采样点的深度为3~4 cm,各点取样50 g混匀。每隔6天取样,每个样品3个生物学重复。
1.5.3 纤维素降解率测定 使用纤维素测定仪(SLQ-202型,上海纤检仪器有限公司)测量样品中的纤维素含量并计算其降解率。试样中的纤维素含量,按公式(1)进行计算。

式中:CF—纤维素的百分含量(%);A1—坩埚+纤维+残渣及灰分质量(g);A2—坩埚+残渣及灰分质量(g);S1—试样质量(g)。
然后按照公式(2)计算纤维素降解率。

式中Y—纤维素降解率(%);X0—初始玉米芯纤维素含量;X1—试样中玉米芯纤维素含量。
1.5.4 木质素降解率测定 使用范式测定法[22]测定样品中木质素含量,按公式(3)进行计算。

式中:X—试样中木质素的含量(g/100 g);m1—烘干恒重后的试样和滤纸质量(g);m2—滤纸质量(g);m3—试样的质量(g);100—单位换算系数。
1.5.5 发酵料的结构表征测定 X-Ray分析将发酵后发酵料粉碎,过60目筛,利用D/max-r B型X射线衍射仪(D/max-r B型,日本理光光学电机公司)测定其X-射线衍射图谱。根据衍射图谱强度,利用高度法计算纤维素结晶度,见公式(4)。

式中I002—002晶面衍射强度;Iam—无定型区衍射强度。
红外光谱检测称取发酵后发酵料粉末2 mg,与200 mg在105℃条件下烘干至恒重的溴化钾粉末混合均匀,研磨后压片,利用傅里叶红外光谱仪(Magna-560型,美国尼高力公司),扫描范围为4000~370 cm-1,得到红外光谱图。
扫描电镜观察将发酵前后的玉米芯颗粒水洗至表面没有杂质,将玉米芯颗粒切成0.3 mm厚的均匀薄片,贴在导电胶上,加速电压为15 kV,样品表面进行60 s喷金处理,采用QUANTA200扫描电镜(QUANTA200型,荷兰FEI公司),观测发酵前后玉米芯表面结构的破坏程度和结构的变化情况。
1.6 数据分析
使用Origin 8.0软件进行数据统计与分析。
2 结果与分析
2.1 菌株筛选结果
本研究中利用PDA平板从干牛粪中分离到4株菌(BC-1、BC-6、BC-8和BC-9),从牛粪和玉米芯37℃发酵料和57℃发酵料中分别分离到9株和4株菌,但是在之后的形态学观察(镜检)和革兰氏染色后,初步判定都是细菌,所以后来培养都采用LB培养基,不再使用PDA培养基。对干牛粪,37℃发酵3天牛粪玉米芯发酵料和57℃发酵2天的牛粪玉米芯发酵料分离纯化得到菌株56株,将干牛粪中分离出的菌株编号为BC,37℃发酵3天牛粪玉米芯发酵料命名为B1,57℃发酵2天的牛粪玉米芯发酵料命名为B2。其中有17株其菌落较为干燥,39株较为湿润;14株菌落颜色为黄色或深黄色,42株为乳白色。
2.1.1 纤维素降解菌筛选结果 如图1刚果红培养基初筛结果所示,56株菌中,能产生透明圈的菌株共35株,可以证明这35株菌株都能产生纤维素酶,属于纤维素降解菌。

图1 纤维素降解菌利用刚果红培养基初筛结果
2.1.2 滤纸酶活复筛结果 在初筛所筛选出的35株菌株中有14株菌株的滤纸酶活力均在9.0 U/mL以上,分别为BC-2W,BC-2Y,BC-7W,BC-7Y,BC-12W,BC-12Y,BC-15W,BC-15Y,B1-2,B1-11,B2-1,B2-7,B2-8,B2-9。其中最高为B2-9,酶活为18.40 U/mL。在接下来的复合菌剂的制备中,将以这14株菌株作为目标菌株。
2.2 纤维素降解菌株鉴定结果
2.2.1 形态学与生理生化鉴定 如图2和表1所示,除BC-12Y和BC-15Y为革兰氏阳性菌(G+)外,其余菌株均为革兰氏阴性菌(G-)。菌体大小(μm)范围在(0.8±0.65)×(0.60±0.04)~(3.48±0.78)×(0.86±0.07)之间。生理生化实验结果表明,初步判断B1-2、B1-11、B2-7、B2-8、B2-9、BC-2Y、BC-2W、BC-7Y、BC-7W、BС-12W、BC-15W和B2-1为肠杆菌科(Enterobacteriaceae),BC-12Y和BC-15Y为微小杆菌科(Microbacillaceae)。
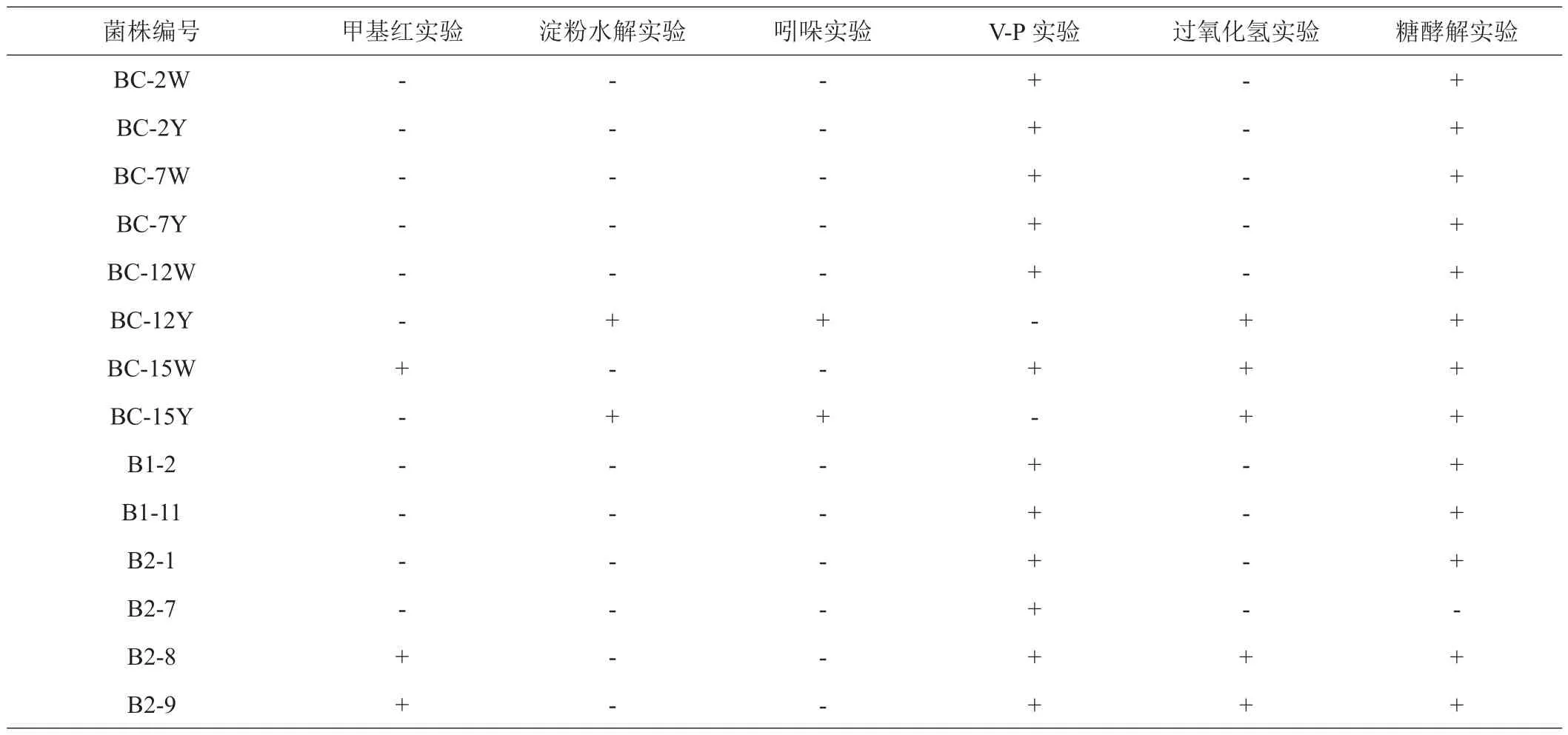
表1 纤维素降解菌生理生化鉴定结果

图2 纤维素降解菌革兰氏染色图片(1000×)
2.2.2 分子生物学鉴定结果 分子生物学鉴定结果如表2所示。菌株B1-2、B1-11、B2-7、B2-8、B2-9、BС-2W、BС-2Y、BС-7W、BС-7Y、BС-12W、BС-15W均属于肠杆菌属,同源序列相似性达到99%,结合菌株形态学特征和生理生化特征及系统进化树分析,最后确定菌株B1-2、B1-11、BС-2W、BС-2Y、BС-7W、BС-7Y为阿氏肠杆菌(Enterobacter asburiae);B2-7为路德维希肠杆菌(Enterobacter ludwigii);B2-8、B2-9、BC-15W为霍氏肠杆菌(Enterobacter hormaechei),BС-12W为阴沟肠杆菌(Enterobacter cloacae)。与B2-1相似性最高的菌株属于克雷伯氏菌属,同源序列相似性达到99%,结合菌株的形态学特征和生理生化特征及系统进化树分析,最后确定菌株B2-1为肺炎克雷伯氏菌(Klebsiella pneumoniae)。BС-12Y和BС-15Y与微小杆菌属相似性最高,结合菌株的形态学特征和生理生化特征及系统进化树,最后确定菌株BC-12Y为微小杆菌(Exiguobacterium),BС-15Y 为 乙 酰 微 小 杆 菌(Exiguobacterium acetylicum)。因为 BС-12W,B2-1为致病菌,因此在复合菌剂的制备中不使用此两株菌株。

表2 菌株16S rDNA序列比对结果
2.3 复合菌剂构建结果
2.3.1 菌株拮抗实验结果 为了得出各个菌株之间的拮抗作用,用平板划线法将不同的菌株进行两两相交划线,然后得到菌株之间的拮抗关系,结果见图3。在3个划线交点处都可见菌落正常生长,没有空斑出现,表明两两菌株相遇后其生长不受抑制,从而证明所选12株菌株相互之间均没有拮抗作用,它们均可以进行下一步复配实验。

图3 部分菌株划线拮抗实验结果
2.3.2 复合菌剂酶活力测定结果 复合菌剂CM与单菌株酶活力测定结果见图4,复合菌剂CM的滤纸酶活(FPA)、β-葡萄糖苷酶活(β-Gase)和羧甲基纤维素酶活(CMCase)分别为15.72±0.37 U/mL、1.26±0.20 U/mL和2.61±0.20 U/mL。其中FPA活力均显著高于其他单菌株酶活力(P<0.01),结果表明复合菌剂CM的3种酶活强于其他单菌株酶活,证明复合菌剂构建有效。
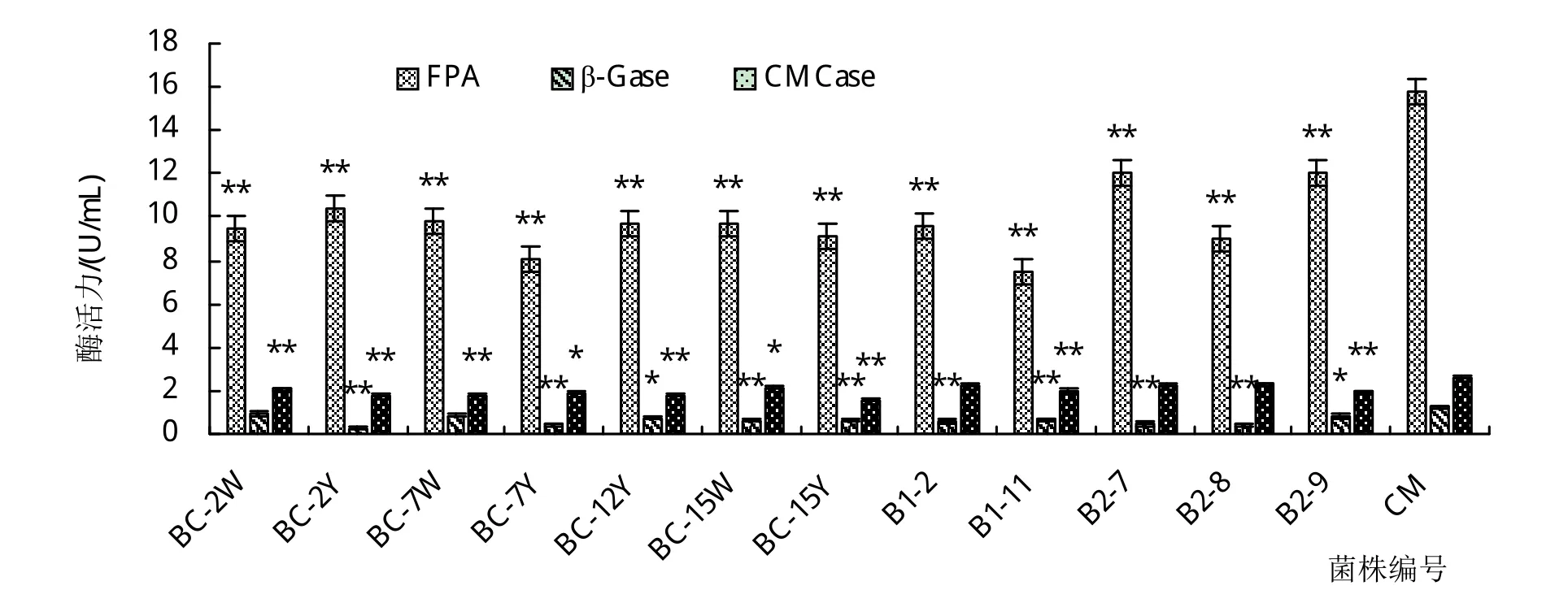
图4 单一菌株与复合菌剂CM酶活比较图
2.4 复合菌剂对玉米芯的发酵效果
2.4.1 纤维素及木质素降解率测定结果 发酵料中玉米芯纤维素与木质素降解率测定结果见图5。

图5 玉米芯纤维素及木质素降解率
在整个发酵过程中,复合菌剂对纤维素的降解效果均高于牛粪,复合菌剂发酵后的纤维素降解率为(55.63±2.21)%,牛粪发酵后的纤维素降解率为(51.34±0.60)%。说明复合菌剂CM可有效降解玉米芯。
3组样品在相同条件下发酵,木质素降解率随着时间的增加呈现上升趋势。发酵终点时,复合菌剂发酵玉米芯后木质素降解率(41.56±4.17)%,高于牛粪发酵玉米芯后木质素降解率(38.90±2.57)%,通过对木质素的测定可知,复合菌剂CM可以有效降解木质素。有研究显示,木质素酶通过首先降解木质素,使得纤维素酶更能够靠近底物,从而促进纤维素的降解[14]。因此,对于玉米芯等农业废弃物,木质素与纤维素的降解存在一定的协同作用,在降解这类生物质能源时,需要降解菌剂能够对木质素和纤维素进行联合作用[1],这也是本研究的主要依据之一。
2.4.2 发酵料的结构表征测定 化学结构的改变是反应木质纤维素降解过程的直观表现[1],因此,本研究对不同处理玉米芯材料的降解效果通过不同的结构表征手段进行了分析,如图6所示。

图6 发酵料X-射线衍射、FTIR及扫描电镜结果
X-射线衍射检测结果纤维素由结晶区和无定形区构成,而半纤维素和木质素均为无定形区。结晶区占纤维素整体的百分率称作结晶度,它反映了纤维素聚集时形成结晶的程度[23]。一般认为,在22°出现的衍射峰代表纤维素结晶区的晶面衍射强度峰,而在18°左右的峰代表的是无定形区衍射强度峰。经计算,发酵前的玉米芯,结晶度为33.13%;自然发酵的玉米芯,结晶度为31.20%;经牛粪发酵后的玉米芯,结晶度为29.29%;经复合菌剂发酵后的玉米芯结晶度为28.30%。由于结晶纤维素大分子排列紧密,水分子一般不能进入。水分子只能进入到结构松散的无定形区,又因为水分子有一定的极性,所以与无定形区中的羟基以氢键结合,发生结晶区之间的润胀。导致发酵前的玉米芯在22°与18°的相对衍射强度均较高。玉米芯经发酵后,对于纤维素的作用主要集中于无定型区,对于纤维素结晶区的破坏程度很有限,远远小于非结晶区的降解,因而结晶度下降程度不明显。相比较,复合菌剂对于玉米芯纤维素结晶区的破坏作用略高于牛粪。
结果表明,在3413 cm-1处为玉米芯中—OH的伸缩振动峰,在2920 cm-1处为CH3的对称伸缩振动峰,在1637 cm-1处为C=C的伸缩振动峰。在1377、1733 cm-1处的振动峰分别属于纤维素与半纤维素C-H变形键和木聚糖C=O键特征峰[1],经过不同发酵处理的玉米芯在1733 cm-1处的振动峰都完全消失,表明木聚糖被完全降解。经复合菌剂发酵后的玉米芯在1637 cm-1处的C=C伸缩振动峰相对增强,这是由玉米芯中C—C键断裂形成C=C键所致,表明复合菌剂降解玉米芯中木质纤维素的C—C键,形成不稳定的C=C键,从而有效降解玉米芯。上述结果表明玉米芯中半纤维素和纤维素都得到了不同程度地降解。
扫描电镜观察可以更为直观地反应出明显的降解效果[1],对不同处理的发酵后的玉米芯进行电镜扫描观察,结果如图6所示。发酵前的玉米芯有较完整的外壁结构,呈现有规律的孔状网格结构,孔洞紧密排列,玉米芯自然发酵后孔洞变得疏松,外壁结构变薄。经过复合菌剂发酵后的玉米芯外壁结构基本被破坏裂解,说明微生物对玉米芯起到了降解作用,且比牛粪发酵后的玉米芯表面结构破坏更加明显。
3 讨论与结论
玉米芯的结构致密,主要由木质素、纤维素及半纤维素组成,难于降解,利用度低,为此,本课题组前期利用牛粪通过二次发酵法降解玉米芯,效果好[15]。由此推测,牛粪中的微生物对玉米芯的降解起到关键的作用。因为利用牛粪直接发酵需要对牛粪进行收集、晾晒、保存等,操作复杂,而将牛粪中的微生物分离出来,基于其对木质素和纤维素的降解能力对其进行初筛,再将筛选到的菌株进行复配,实现不同菌株在降解玉米芯方面的优势互补,具有重要的理论及应用价值。
为此,本研究从牛粪与牛粪玉米芯发酵料中分离纤维素降解菌,其中从干牛粪中分离到了微小杆菌(BC-12Y),乙酰微小杆菌(BC-15Y),霍氏肠杆菌(B2-8、B2-9、BC-15W),和阿氏肠杆菌(B1-2、B1-11、BС-2 W、BС-2Y、BС-7W、BС-7Y),与前人[24-28]分别从板栗苞壳堆积物,土壤中,白蚁体内,腐木、稻杆堆积的土壤,猪床40 cm垫料样品中分离得到的菌株相同。但与文献报道的菌株相比,本实验中阿氏肠杆菌,微小杆菌及霍氏肠杆菌的纤维素降解能力较低,而路德维希肠杆菌的FPA酶活较高,可能是因为微生物生长环境不同,底物不同,其产酶能力不同。本研究从牛粪及牛粪玉米芯发酵体系中分离纤维素降解菌,因此所筛选出的菌株可能更适用于降解玉米芯。
对生物质材料如秸秆、玉米芯等进行生物处理不仅对环境友好,而且成本低,所以已成为对生物质原料进行转化的首选[1]。大多数研究采用真菌来降解木质素,如Xu等[1]利用桦褐孔菌产木质素酶来降解秸秆生物质。而本研究采用的菌株均为细菌,且复配后的复合菌剂对玉米芯木质素降解率可达(41.56±4.17)%,对玉米芯的纤维素降解率为(55.63±2.21)%,高于黄颖婕等[29]与刘晓飞等[30]分别从牛粪堆肥与寒地黑土中分离出的解淀粉芽孢杆菌与放线菌GS-3-39的纤维素降解率。这可能因为单菌株酶活有限,而复合菌剂由不同微生物复配到一起,协同分泌纤维素酶来降解,此外,复合菌剂的加入,会使发酵基质的pH进一步降低,有利于纤维素的降解[14]。
本实验复合菌剂发酵后的玉米芯结晶度降低,玉米芯的纤维素、木质素、半纤维素特征峰相对吸光度减弱,外壁结构基本被破坏,这与孙玲等[31],刘晓飞等[30]所做研究结果一致,证明本研究中所复配的复合菌剂可有效降解玉米芯。
本实验以牛粪及牛粪玉米芯发酵料为菌源进行分离纯化,最终鉴定14株纤维素降解菌株,分别属于7个菌种,这些菌株酶活力范围在(9.15±0.81)U/mL~(12.06±1.43)U/mL之间。将其中12株菌种等菌落数复配,获得的复合菌剂纤维素酶活力为(15.72±0.37)U/mL,对玉米芯纤维素降解率为(55.63±2.21)%,木质素降解率为(41.46±0.87)%,有较强的纤维素及木质素降解能力。结构分析结果证明复合菌剂发酵后的玉米芯结晶度最低,玉米芯的纤维素、木质素、半纤维素特征峰相对吸光度减弱,破坏程度最明显,外壁结构基本被破坏。本研究为新型玉米芯降解菌剂的开发奠定了理论基础,也为后续复合菌剂的优化与研发提供了理论依据。但是本研究中仅对具有降解纤维素和木质素能力的菌株进行等比例复配,初步验证了这些菌株之间的协同作用,后续将进一步研究这些菌株中降解纤维素和木质素的关键菌株,并根据降解贡献率优化复配比例。

