烟草NtMYB4a基因酵母双杂交诱饵载体的构建及互作蛋白的筛选
谢瑞莹 曾露桂 姜超英 聂 琼,,*
(1贵州大学烟草学院,贵州省烟草品质研究重点实验室,贵州 贵阳 550025; 2贵州大学农学院,贵州 贵阳 550025;3贵州省烟草公司 贵州 贵阳 550081)
转录因子(transcription factor,TF)指能够与真核基因的顺式作用元件发生特异性相互作用,并对基因的转录有激活或抑制作用的DNA结合蛋白[1]。转录因子一般含有DNA结合结构域和转录激活结构域,前者可识别DNA上的特异序列,并使转录激活结构域定位于所调节的基因上游,后者可同转录复合体的其他成分作用,启动转录激活结构域所调节的基因进行转录[2]。MYB转录因子(MYB transcription factor)家族被认为是植物中最大的一类转录因子,广泛参与植物次生代谢、细胞分化、细胞周期调控、激素和环境因子的应答等生物学过程[3],在植物抗逆应答过程中起着关键的调控作用[4]。此外,MYB转录因子通常与其他蛋白相互作用形成转录复合体共同调控各种代谢、发育过程或抗逆反应[5-6]。
酵母双杂交系统利用杂交基因激活报告基因的表达,从而探测蛋白之间的相互作用[7]。该技术灵敏度高、功能强大、适用范围广,现已被应用于多个研究领域。在植物抗逆机制研究中,利用酵母双杂交系统从cDNA文库中筛选到9类与四季秋海棠(Begoniasemperflorens)BsMYB62互作的蛋白、2个与木薯(ManihotesculentaCrantz)MeMYB2互作的蛋白,并推测BsMYB62与这9类蛋白相互作用响应低温和高光胁迫[8],MeMYB2与MeNPH3互作参与光信号调节、与MePetB互作参与气孔调节[9]。
烟草(Nicotianatabacum)是重要的经济作物,也是重要的模式作物。探讨烟草转录因子响应非生物胁迫的调控机制,对培育烟草抗逆品种具有重要意义。本课题组前期克隆了NtMYB4a(MN178131),该基因具有2个典型的MYB结构域和35个磷酸化位点,属于R2R3 MYB转录因子亚家族,该基因参与烟草绿原酸、花青素的合成,对干旱、低温和盐胁迫等也有明显的响应[10]。而NtMYB4a参与调控这些次生代谢的合成或响应抗逆反应的转录调控机制仍有待研究。因此,本研究拟构建NtMYB4a基因酵母双杂交诱饵载体,从烟草cDNA文库中筛选其互作蛋白并验证,以期为进一步研究NtMYB4a参与响应非生物胁迫的分子调控机制提供依据和参考价值。
1 材料与方法
1.1 试验材料和试剂
试验材料为贵州大学烟草学院烟草品质研究重点实验室保存的自育烟草品系GDH88、烟草酵母双杂交cDNA文库、pGBKT7载体;AH109和DH5α感受态购自上海唯地生物技术有限公司;琼脂糖凝胶DNA回收试剂盒(DP209-02)、质粒提取试剂盒(DP112)、酵母质粒提取试剂盒(DP103)、RNAprep pure Plant Kit总RNA提取试剂盒(DP432)、反转录试剂盒 FastKing一步法除基因组cDNA第一链合成预混试剂(KR118)、荧光定量试剂盒Talent qPCR PreMix(SYBR Green)(FP209)等购自天根生化科技(北京)有限公司;X-α-gal(10903ES71)、Axygen(AxyPrep DNA)凝胶回收试剂盒购自贵州明涵生物科技公司。
1.2 试验方法
1.2.1 诱饵载体pGBKT7-NtMYB4a的构建 利用基因合成技术通过引物合成、PCR的方法将基因序列融合并克隆入pGBKT7载体进行pGBKT7-NtMYB4a诱饵载体的构建。利用Primer Primer5软件设计目的基因的引物(表1)。

表1 目的基因合成相关引物Table 1 Objective gene synthesis related primers
全长第一轮PCR反应体系(50 μL):DNA聚合酶(PV2)0.5 μL、5×PV2 Buffer 10 μL、10 mmol·L-1dNTP 1 μL、引物0.5 μL、ddH2O 38 μL。反应程序:95℃预变性3 min;95℃变性25 s,62℃退火20 s,72℃延伸40 s,25个循环;72℃延伸1 min,4℃保存。
全长第二轮PCR反应体系(50 μL):第一轮PCR产物0.3 μL,DNA聚合酶(PV2)0.5 μL、5×PV2 Buffer 10 μL、10 mmol·L-1dNTP 1 μL、引物1 0.5 μL、引物12 0.5 μL、ddH2O 37.2 μL。同上一步反应程序。
胶回收第二轮PCR产物,流程参照Axygen凝胶回收试剂盒说明书进行。
用双酶切pGBKT7质粒的NdeI、BamHI酶切位点,并进行胶回收,流程参照Axygen凝胶回收试剂盒说明书进行。
重组连接反应体系:目的基因胶回收产物4 μL、pGBKT7质粒3.5 μL、重组酶2.5 μL;置于50℃水浴25 min,放置2~3 min使温度降低至室温。
大肠杆菌的转化:从-80℃超低温冰箱取出DH5α感受态后,置于冰上融化,约15 min,待感受态融化后用移液枪吸取10 μL重组连接产物加入其中,冰浴15 min后42℃热激90 s,立即进行冰浴2 min,然后加入1 mL的LB液体培养基,置于37℃、220 r·min-1温浴摇床培养1 h,之后将转化产物涂布于LB固体平板上(含卡那抗性),再放于37℃恒温培养箱中倒置过夜培养。
从过夜培养后的平板上挑取单菌落于装有1 mL LB液体培养基的无菌离心管中,培养8~12 h后用pGBKT7的通用引物(T7/3′BD)进行菌液PCR,然后利用凝胶电泳鉴定阳性克隆,随机挑选4个阳性菌用5 mL LB液体培养基于37℃、200 r·min-1的摇床进行扩繁培养,然后抽提质粒进行测序。最后将测序得到的序列利用DNAMAN软件进行比对,若显示目的片段NtMYB4a成功插在正确的序列位置,则说明诱饵载体pGBKT7-NtMYB4a构建成功。
1.2.2 pGBKT7-NtMYB4a诱饵载体毒性和自激活性检测 取3管100 μL AH109酵母感受态细胞于冰上融化,分别加入诱饵重组质粒和猎物空载质粒各5 μL,Carrier DNA 10 μL(95~100℃水浴5 min,重复1次),PEG/LiAc 500 μL,并用移液枪轻柔的吸打混匀,30℃水浴30 min(中途后翻转6~8次混匀);将离心管置于42℃水浴15 min(中途翻转6~8次混匀),然后取出置于离心机5 000 r·min-1离心40 s,弃上清,用400 μL ddH2O重悬,5 000 r·min-1离心30 s后弃上清,最后用200 μL ddH2O重悬,之后涂布于DDO、DDO/X、TDO平板上观察菌株生长情况,由此判定诱饵的毒性和自激活检测。若pGBKT7-NtMYB4a诱饵载体有一定的本底表达,可通过使用3′AT抑制剂抑制其自激活性。
1.2.3 酵母双杂交文库筛选及阳性克隆的鉴定 将SD/-Trp平板上长至直径2~3 mm的重组诱饵载体转化菌落接种于50 mL SD/-Trp的液体培养基中,在30℃、250 r·min-1的摇床中培养直至菌液OD600=0.8。将菌液1 000×g离心5 min后,去除上清,用5 mL SD/-Trp 液体培养基进行重悬,获得诱饵菌液。将 1 mL cDNA文库和5 mL诱饵菌液接种于45 mL 2×YPDA液体培养基,于30℃、50 r·min-1条件下培养20 h,镜检结合生长子的产生。培养结束后将杂交菌液 1 000×g 离心10 min,去除上清,用10 mL 0.9% NaCl溶液重悬菌体。将菌液按每板200 μL涂布于150 mm TDO/X平板,倒置于30℃培养箱培养3~5 d。增大筛选压力排除假阳性,将直径大于2 mm的蓝色菌落全部点种至QDO/A/X平板上培养,倒置于30℃培养箱培养3 d,观察互作情况。挑选蓝斑克隆接种于3 mL QDO液体培养基,抽提酵母质粒,操作方法参照天根酵母质粒提取试剂盒(DP112)进行,并送至上海生物工程有限公司测序。采用BLAST进行序列比对。
1.2.4 回转酵母验证 以猎物质粒载体PGADT7的通用引物进行PCR扩增鉴定。将AH109酵母感受态细胞置于冰上融化,向30 μL酵母感受态中分别加入诱饵质粒和猎物质粒各5 μL,Carrier DNA 10 μL(95~100℃水浴5 min,重复1次)和500 μL PEG/LiAc,并使用移液枪轻柔的吸打混匀,30℃水浴30 min(中途翻转6~8次混匀);将离心管置于42℃水浴15 min(中途翻转6~8次混匀),5 000 r·min-1离心40 s,去除上清,用400 μL ddH2O重悬,5 000 r·min-1离心30 s后弃上清,用200 μL ddH2O重悬,最后将重悬菌液涂布于SD/-Leu/-Trp平板,倒置平板于29℃培养箱培养3~5 d。挑取长至2~3 mm的白色菌体,放于2 mL SD/-Leu/-Trp的液体培养基中,29℃、200 r·min-1培养16~18 h,当OD600达到0.2左右时,按1∶10∶100稀释菌液,各取5 μL分别点种于SD/-Leu/-Trp、 SD/-Ade/-His/-Leu/-Trp、 SD/-Ade/-His/-Leu/-Trp/X平板上,平板在超净工作台内充分吹干后,将平板倒置于29℃培养箱中培养3~4 d,观察互作情况。
1.2.5 候选互作蛋白的表达分析 将长势一致的烟草幼苗在相对湿度65%~75%、温度25℃、14 h光照/10 h 黑暗的人工智能气候箱中培养,当烟苗生长至5叶时进行4℃低温处理,以25℃为对照,分别在处理0、6、12、24、36、48、72 h后取第2、第3片展开叶,迅速用液氮处理后放于-80℃冰箱保存备用。每3株混匀作为1个样品,各3个生物学重复用于实时荧光定量PCR(quautitative real-time PCR, qRT-PCR)。
样品总RNA用RNAprep pure Plant Kit总RNA试剂盒提取,用FastKing一步法除基因组cDNA第一链合成预混试剂反转录得到的cDNA;根据候选蛋白的cDNA序列,利用Primer Primer5软件设计荧光引物(表2),用荧光定量试剂盒Talent qPCR PreMix(SYBR Green)对候选蛋白进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测,步骤参照试剂盒说明书。

表 2 荧光定量PCR引物Table 2 Primer used for real-time PCR
qRT-PCR反应体系为25 μL:2×Talentl qPCR PreMix 12.5 μL、正向引物(10 μmol·L-1)0.75 μL、反向引物(10 μmol·L-1)0.75 μL、cDNA模版2 μL、RNase-free ddH2O 9 μL。qRT-PCR反应程序:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸35 s,34个循环;72℃延伸5 min,55~94℃进行溶解曲线分析。采用2-ΔΔCt法计算NtMYB4a及候选蛋白基因的相对表达量。利用DPS7.5软件完成差异显著性分析,相关分析由R语言软件完成。
2 结果与分析
2.1 诱饵载体pGBKT7-NtMYB4a的构建
将合成的NtMYB4a连接到载体pGBKT7上,重组载体质粒转入DH5α大肠杆菌感受态细胞中,并对所得单克隆进行菌液PCR鉴定,结果如图1所示,目的片段与基因片段(746 bp)大小一致。抽提大肠杆菌质粒后进行测序,测序结果比对正确,说明pGBKT7-NtMYB4a诱饵载体构建成功。

注:1~8:随机挑选的8个克隆;5 000bp DNA Ladder Marker.Note: 1~8:Randomly picked 8 clones. 5 000bp DNA Ladder Marker.图1 阳性克隆菌液PCR电泳检测Fig.1 PCR electrophoresis detection of positive clone solution
2.2 pGBKT7-NtMYB4a诱饵载体自激活性及毒性检测
将pGBKT7-NtMYB4a诱饵重组质粒和猎物空载转化酵母感受态细胞,涂布于DDO、DDO/X、TDO平板进行毒性和自激活检测,结果如图2所示。酵母在DDO平板上能正常生长,说明诱饵pGBKT7-NtMYB4a+pGADT7已成功转入宿主菌中且对宿主菌无毒性;酵母在DDO/X平板能生长且变蓝,说明诱饵pGBKT7-NtMYB4a+pGADT7有自激活现象,能够激活宿主菌报告基因MELl的表达,从而使X-α-gal变蓝。酵母能在TDO平板生长,说明诱饵pGBKT7-NtMYB4a+pGADT7有自激活现象,激活了HIS3报告基因。将pGBKT7-NtMYB4a诱饵载体涂布于TDO/3′AT平板,酵母在5 mmol·L-1的TDO/3′AT平板上能够生长,说明5 mmol·L-13′AT不能抑制HIS3报告基因的背景表达;酵母在10 mmol·L-1的TDO/3′AT平板上不能生长,说明10 mmol·L-13′AT能够抑制HIS3报告基因的背景表达,后续可用TDO/X/3′AT(10 mmol·L-1)进行文库筛选。
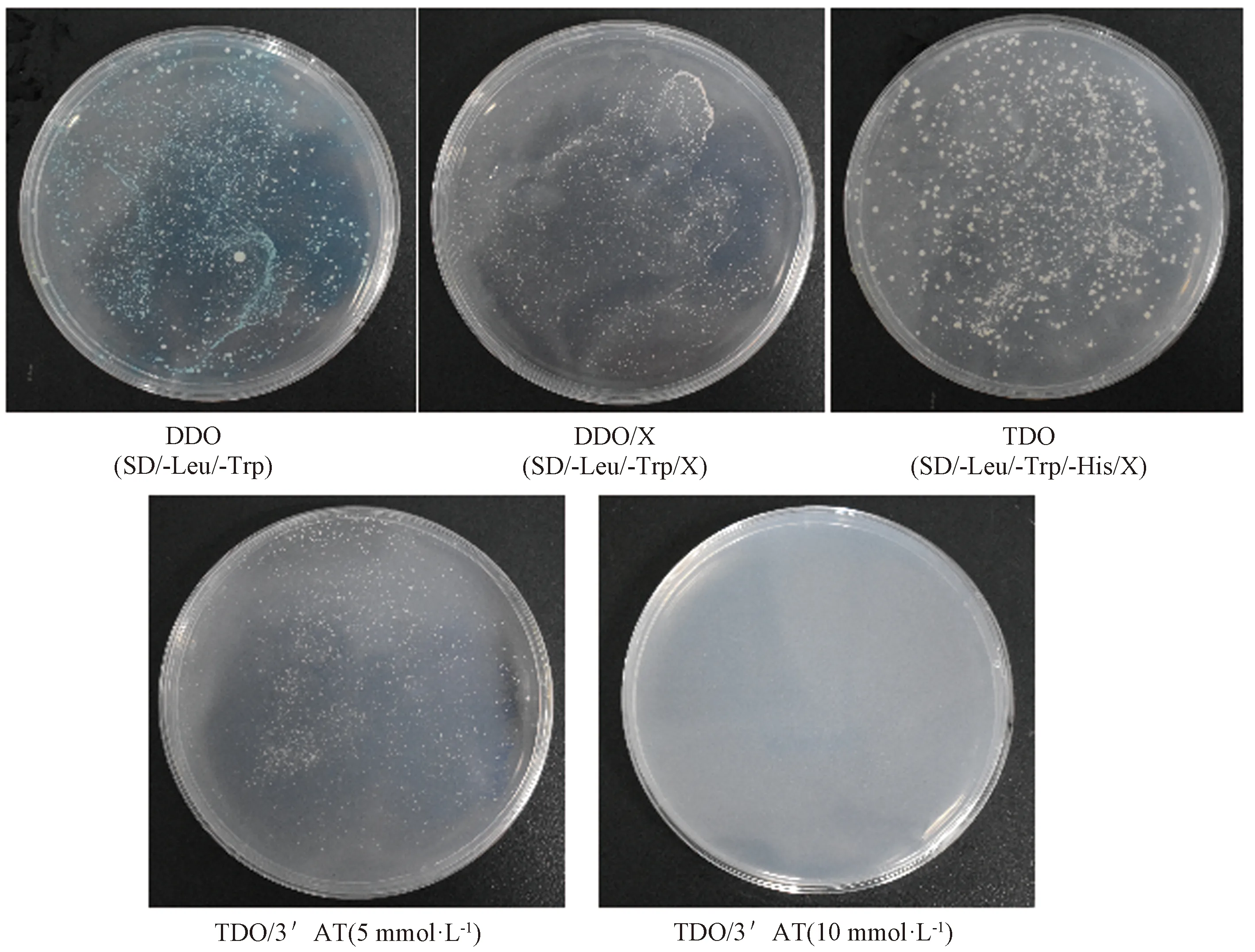
图2 pGBKT7-NtMYB4a诱饵载体自激活性及毒性检测Fig.2 Detection of self-activation and toxicity of pGBKT7-NtMYB4a bait vector
2.3 酵母双杂交筛选NtMYB4a的互作蛋白
将pGBKT7-NtMYB4a诱饵载体AH109酵母和cDNA文库Y187酵母进行杂交,利用显微镜观察杂交液中结合生长子的产生情况(图3-A),酵母杂交液中有三叶草结构的形成,说明酵母细胞杂交成功。将结合生长子进行加压培养,在TDO/X/3′AT(10 mmol·L-1) 平板上酵母正常生长(图3-B);再进一步加压培养,将TDO/X/3′AT平板上的78个单克隆全部点种在QDO/A/X平板上进行第2次筛选,观察菌落的生长情况(图3-C),在QDO/A/X平板上有72个蓝色菌斑正常生长。
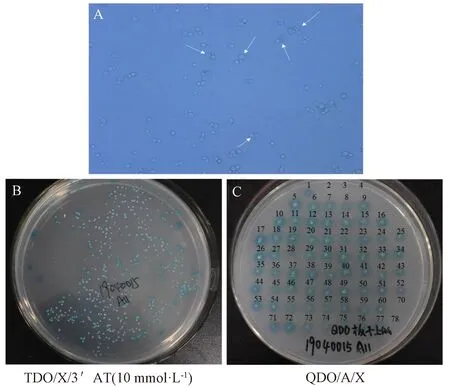
注:A:结合生长子镜检图;B:杂交液TDO平板培养;C:单克隆QDO平板培养。Note:A: Combined with growth microscopy. B: Plate culture of hybrid liquid TDO. C: Monoclonal QDO plate culture.图3 酵母细胞结合生长图Fig.3 Diagram of yeast cell binding growth
将经过QDO/A/X培养筛选所得的72个蓝色菌株抽提质粒,利用pGADT7通用引物对质粒进行PCR检测验证,对表现为阳性所对应的质粒进行测序(图4),其中部分蛋白存在高级结构,测序失败。将测序结果在NCBI数据库中进行BLAST比对,合并重复序列,去掉载体序列,初步获得39个可能与NtMYB4a互作的候选蛋白,包括天冬氨酸蛋白酶、N-α-乙酰转移酶、RALF蛋白质、果糖二磷酸醛缩酶、核糖体蛋白、过氧化氢酶同工酶、锌指AN1、转运蛋白SEC13、液泡分选蛋白、B2蛋白、应激增强蛋白等(表3)。
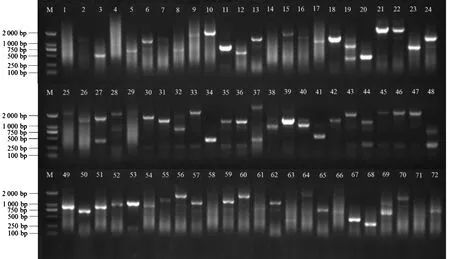
图4 互作阳性克隆PCR检测Fig.4 PCR detection of interaction positive clones
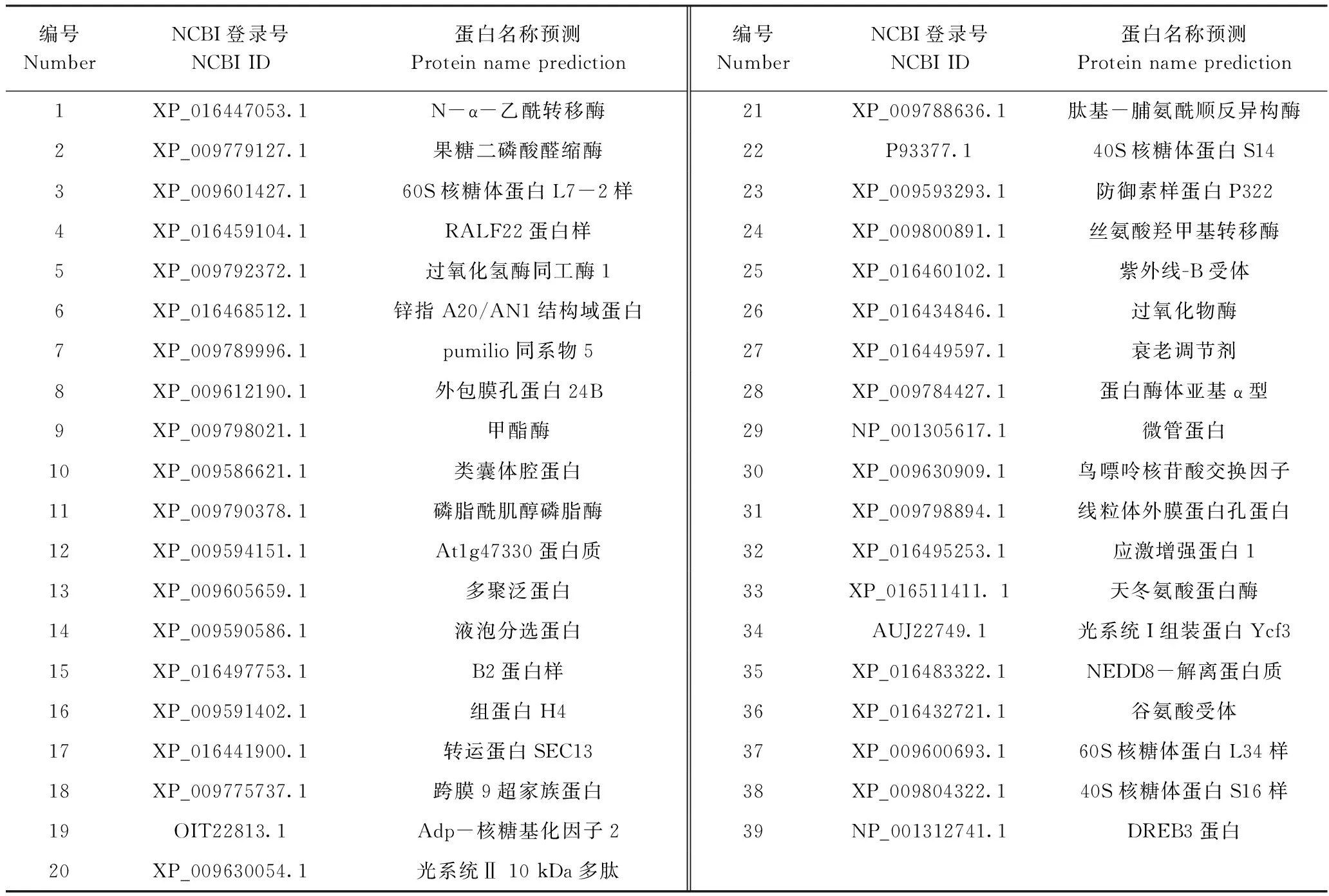
表 3 酵母双杂交筛选的候选NtMYB4a互作蛋白Table 3 Candidate NtMYB4a-interacting proteins screened by Y2H
2.4 回转验证互作蛋白
将猎物质粒转化入大肠杆菌并抽提质粒,然后再将猎物质粒与诱饵质粒共转化入AH109酵母感受态细胞中,进行酵母回转验证。共转化的酵母菌在 SD/-Leu/-Trp 平板上生长良好(图5)。将长至2~3 mm的阳性克隆进行1∶10∶100稀释后,进行加压培养,发现4、6、14、15、32和33号靶蛋白在缺陷培养基 SD/-Leu/-Trp、 SD/-Ade/-His/-Leu/-Trp和SD/-Ade/-His/-Leu/-Trp/X平板上均能正常生长,并能在SD/-Ade/-His/-Leu/-Trp/X 平板上长出蓝色菌落(图6),说明4、6、14、15、32和33号靶蛋白排除了假阳性的可能,与烟草NtMYB4a具有相互作用。
图5 共转化酵母SD/-Leu/-Trp平板生长情况Fig.5 Growth of SD/-Leu/-Trp plates of co-transformed yeast
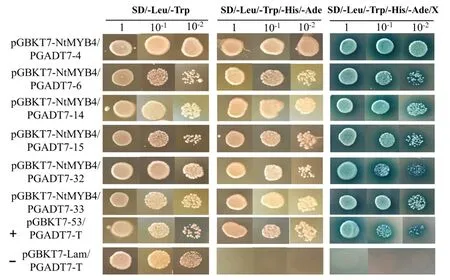
图6 回转验证互作蛋白Fig.6 Rotation verification of interacting proteins
2.5 与NtMYB4a互作的候选蛋白的功能预测
测序经BLAST比对及酵母回转验证后,最终获得6个与NtMYB4a互作的阳性靶蛋白,其功能预测如表4所示。
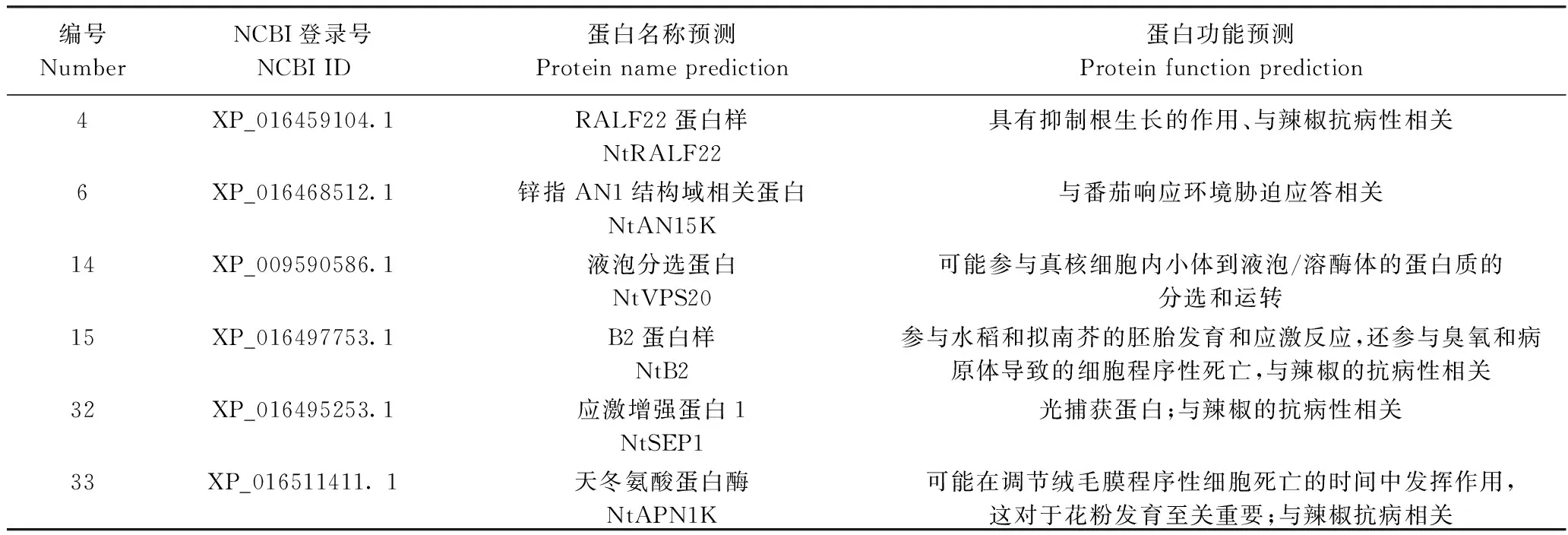
表4 酵母双杂交筛选的候选NtMYB4a互作蛋白功能预测Table 4 Candidate NtMYB4a-interacting proteins and its functional prediction screened by Y2H
2.6 低温胁迫下NtMYB4a与候选蛋白基因的表达分析
由图7所示,NtB2、NtSEP1、NtVPS20与NtMYB4a的表达模式一致,呈倒“V”型,表现为0至24 h逐渐增加,并在24 h时达到最大值,36 h时降到最低值;而NtAN15K、NtRALF22和NtAPN1K基因的表达变化模式相似,呈“N”型,不同的是NtAN15K在12 h时增加到最大值后降低,而NtRALF22在24 h时增加到最大值后降低,三者都在36 h时降低,48 h时显著升高。
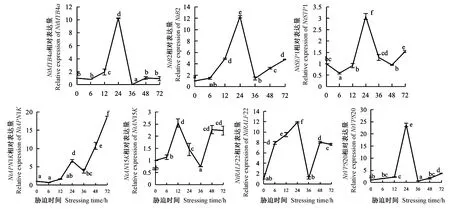
图7 低温胁迫下相关蛋白基因的动态变化模式Fig.7 Dynamic change patterns of related protein genes under low temperature stress
NtMYB4a、NtB2、NtAN15K、NtRALF22和NtVPS20这5个基因表达水平在12、24 h都较0 h显著增加。综上所述,在低温胁迫下,6种候选蛋白基因和NtMYB4a基因的表达均整体呈增加—降低—增加的变化趋势。
基因表达相关性分析(图8)表明,NtVPS20和NtB2与NtMYB4a呈显著正相关关系;NtRALF22和NtSEP1与NtMYB4a呈正相关关系;NtAN15K和NtAPN1K与NtMYB4a呈较弱负相关关系。NtRALF22和NtB2与其他5种蛋白互为正相关关系;NtAN15K与NtSEP1、NtVPS20呈负相关关系。

注:无圆圈方格表示各指标间无显著性差异,蓝色表示正相关,红色表示负相关;圆圈越大、颜色越深表示指标间相关性越显著。Note: Uncircled squares indicate that there is no significant difference among indicators, blue indicates positive correlation, red indicates negative correlation. The larger the circle and the darker the color, the more significant the correlation between indicators.图8 低温胁迫后NtMYB4a与互作蛋白基因表达的相关性分析Fig.8 Correlation analysis of NtMYB4a and interacting protein gene expression under low temperature stress
3 讨论
酵母双杂交技术的产生是基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究[7]。该技术在核酸水平上操作,避免了蛋白质的分离和纯化过程,保证了蛋白质的活性,也能够直接真实地反映蛋白之间的互作用。因此,酵母双杂交技术具有灵敏度较高、操作简洁,且在一定程度上体现了细胞内部情况[2]的特点。但此方法具有一定的局限性,如假阳性和假阴性率较高。屈莹[8]通过酵母双杂交初步筛选到40个蛋白与BsMYB62互作,验证后得到12个候选互作蛋白。杨洁[9]通过酵母双杂交初步筛选到236个与SmMYB36互作的蛋白,分析验证后得到28个候选互作蛋白。若诱饵蛋白和猎物蛋白单独或结合后存在毒性,酵母细胞的正常生长会受到影响,引起假阴性现象;若诱饵蛋白存在自激活性,猎物蛋白与之结合后同样存在自激活性,可激活报告基因,从而引起假阳性现象[10]。目前通常通过配置不同浓度的缺陷培养基、回转验证互作蛋白等试验方法降低假阳性现象。刘静等[11]选用含45 mmol·L-13-AT的SD/-Trp/-Leu/-His/-Ade缺陷培养基进行文库筛选,可抑制pGBKT7-BsMYB62的自激活现象;张竹君等[12]筛选后使用0.2 mg·L-1ABA浓度下的SD/-Leu-Trp/X-α-Gal/AbA缺陷培养基对pGBKT7-RhRD22诱饵蛋白无自激活效应,并用其进行文库筛选。本研究构建的诱饵载体pGBKT7-NtMYB4a无毒性但有自激活现象,经过筛选发现10 mmol·L-13′AT的SD/-Trp/-Leu/-His/X-α-Gal缺陷培养基可抑制pGBKT7-NtMYB4a的自激活现象。利用该培养基对烟草cDNA文库进行筛选,初步获得39个可能与NtMYB4a互作的候选蛋白。为进一步降低假阳性的概率,采用回转验证方法进一步筛选,得到6个阳性蛋白,分别是RALF-like 22蛋白、锌指A20/AN1结构域蛋白、液泡分选蛋白、天冬氨酸蛋白酶、B2蛋白和应激增强蛋白。
采用qRT-PCR技术分析以上6个基因在4℃低温胁迫下的表达模式,发现上述基因均与NtMYB4a的表达模式相似,其中NtVPS20和NtB2的表达与NtMYB4a的表达呈显著正相关关系。液泡分选蛋白(Vacuolar sorting protein, Vps)是一类介导细胞器间物质转运的蛋白[13],参与植物的生长发育、应答生物与非生物胁迫等。如油茶(CamelliaoleiferaAbel)CfVPS26参与调控果生刺盘孢生长发育[14];黄瓜(CucumissativusL.)CmVPS参与黄瓜花叶病(CucumberMosaicVirus,CMV)的调控,有抑制CMV表达的作用[15];拟南芥(Arabidopsisthaliana)AtVPS25参与调控主根发育[16]。低温胁迫下AtVPS28A和AtVPS28B参与质膜上的生长素运输载体蛋白PIN1的表达,调节相关代谢物的平衡,从而增强植物的耐寒性[17],因此,结合前人发现和本研究结果推测,NtMYB4a可能与NtVPS20互作,影响生长素对低温的应答。而B2蛋白是一个由RNA3编码的含有106个氨基酸的小蛋白,在辣椒[18]中具有抗病性,小麦[17]中通过改变脱落酸的信号传导响应干旱胁迫,从而调控植物生长。但NtMYB4a与NtB2是否形成复合蛋白来响应环境胁迫有待进一步研究。
其余4个候选互作蛋白基因虽然在低温胁迫下的表达与NtMYB4a的相关性不显著,但也有相关研究表明他们参与植物生长发育、应答生物或非生物胁迫等过程。快速碱化蛋白(Rapid alkalinization factors,RALFs)是近年来新发现的一种植物多肽类信号分子,具有参与植物生长发育调控的生理作用[20],如阻止根系生长和发育[21]、参与调控植物花粉与雌蕊之间的互作[22]等。A20/AN1型锌指蛋白(Zinc-finger proteins, ZFPs)是一类含有A20锌指、AN1锌指或二者并存的蛋白质[23],在植物中有参与非生物胁迫应答的功能[24],如水稻OsSAP[25-26]和番茄SAP[27]参与响应干旱、低温、盐等逆境胁迫。天冬氨酸蛋白(Aspartic proteinase)参与了植物体内细胞器的降解、蛋白质的加工和降解过程及激素调控的衰老机制等过程[28],还参与植物逆境胁迫反应,响应干旱胁迫的应答[29-30]。烟草应激增强蛋白1来源于叶绿体,但关于其功能方面的研究较少。本课题组前期研究发现NtMYB4a基因参与响应PEG、盐、低温和MeJA等非生物胁迫的响应,还参与花青素、绿原酸的合成[31]。本研究仅采用qRT-PCR验证了这6个基因在低温下与NtMYB4a的共表达情况,无显著相关性的4个候选蛋白可能与NtMYB4a互作参与调控烟草的生长发育过程,或响应除低温胁迫外的非生物胁迫。后期将通过免疫共沉淀和双分子荧光互补等技术进一步证实6个候选互作蛋白与NtMYB4a的互作关系,并对其进行功能验证,为揭示NtMYB4a与其互作参与调控烟草响应非生物胁迫或参与花青素合成的分子机制提供依据。
4 结论
本研究通过构建PGBKT7-NtMYB4a诱饵蛋白,利用酵母双杂交技术,从烟草cDNA文库筛选到6个与NtMYB4a互作的蛋白,分别是烟草RALF-like 22(NtRALF22,XP_016459104.1)、烟草锌指A20/AN1结构域(NtAN1,XP_016468512.1)、烟草液泡蛋白分选蛋白(NtVPS20,XP_009590586.1)、烟草天冬氨酸蛋白酶(NtAPN1K,XP_016511411.1)、烟草B2蛋白(NtB2,XP_016497753.1)和烟草应激增强蛋白1(NtSEP1,XM_016495253.1)。qRT-PCR分析结果表明低温胁迫下这6个候选互作蛋白的基因表达模式与NtMYB4a表达相似,其中NtVPS20和NtB2的表达与NtMYB4a的表达呈显著正相关,推测NtMYB4a可能与这2种蛋白互作参与烟草低温响应。
——一道江苏高考题的奥秘解读和拓展

