苦瓜果实酵母双杂交文库构建及McRPF互作蛋白筛选
郭金菊 史亮亮 王茹芳 曹海顺 谭德龙 赵俊宏 张长远
(广东省农业科学院设施农业研究所,广东 广州 510640)
苦瓜(MomordicacharantiaL.)是重要的岭南特色瓜类蔬菜,主要以膨大中后期绿果为食用器官,药膳兼用,不仅营养丰富,还具有降糖、降脂、抗癌、防衰老等功能[1],深受广大消费者喜爱,具有较高的经济和社会价值。
苦瓜属于典型的呼吸跃变型果实,商品果采后3~5 d会逐渐变黄、软化甚至腐烂,严重影响其商品品质和货架期,从而造成较大的经济损失[2]。果实的成熟是一个复杂而精密的调控过程,受基因调控、激素调节以及温度、光照等各种因素影响[3-4]。目前人们仍未能完全揭示其调控机制,而对苦瓜果实成熟的调控机制研究更是鲜有报道。
NAC转录因子是植物特有的、数量众多的转录因子家族,参与植物生长发育、胁迫应答、激素调节等多种生物学过程[5]。近年来,有许多关于NAC转录因子调控果实成熟的报道。例如,在番茄果实成熟调控通路中,NOR[6]、SlNAC1[7]和SlNAC4[8]等NAC转录因子是位于乙烯信号上游的调控果实成熟关键因子[9];番茄nor自然突变体由于NOR基因第3个外显子区域缺失2个连续的碱基导致移码突变,造成NOR蛋白翻译提前终止,最终抑制果实成熟[10];SlNAC1为果实成熟的负调控因子,依赖乙烯和ABA信号途径影响果实成熟[7];SlNAC4为果实成熟的正调控因子,SlNAC4基因下调会延迟果实成熟,显著抑制乙烯合成、叶绿素降解以及类胡萝卜素积累[8,11]。但由于NAC转录因子的种类和功能的多样性,其调控果实成熟的分子机制仍有待研究。其中NAC转录因子McRPF为本研究前期筛选到的苦瓜果实成熟关键因子,但对其调控果实成熟的分子机制尚不清楚。利用酵母双杂交等技术筛选McRPF的互作蛋白,对阐明McRPF调控苦瓜果实成熟的分子机制具有重要意义。鉴于此,本研究构建苦瓜果肉组织酵母双杂交cDNA文库,并利用该文库初步筛选到12个可能与McRPF互作的蛋白,以期为进一步研究McRPF调控果实成熟的分子调控机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 以苦瓜自交系E12201-e1为材料,于2021年3月种植于广东省农业科学院白云试验基地,常规管理,在盛花期对开花当天子房(幼果)进行挂牌标记。采集处于绿熟期(18 days after pollination, DPA)、破色期(20 DPA)、转色期(22 DPA)和完熟期(24 DPA)4个不同成熟阶段的苦瓜果肉组织,液氮速冻,于-80℃冰箱保存备用。
1.1.2 试验试剂 Oligotex mRNA Kits、高纯度质粒大提试剂盒购自天根生化科技(北京)有限公司;Superscript®Double-Stranded cDNA Kit、UltraPureTMPhenol∶Chloroform∶Isoamyl∶Alcohol(25∶24∶1, v/v/v)购自美国Invitrogen公司;Trimmer-2 cDNA normalization kit购自俄罗斯Evrogen公司;FastPfu DNA Polymerase购自北京全式金生物技术有限公司;Sfi I限制性内切酶购自立陶宛Fermentas公司;质粒小量抽提试剂盒、胶回收试剂盒购自美国Axygen公司;DNA Ligation Kit购自日本TOYOBO公司;酵母质粒小量提取试剂盒购自北京索莱宝科技有限公司;酵母缺陷型培养基购自美国Clontech公司。
1.2 试验方法
1.2.1 RNA提取与mRNA分离提纯 取不同成熟期苦瓜果肉组织等量混合,利用Trizol法提取总RNA,使用Oligotex mRNA Kits分离纯化样本mRNA,通过1%琼脂糖凝胶电泳观察检测目的片段的完整性与片段长度,用于后续的文库构建。
1.2.2 cDNA文库构建 按照Superscript®Double-Stranded cDNA Kit试剂盒说明书,将纯化后的mRNA进行反转录,合成双链cDNA,加5′接头(3个读码框,每个读码框连接一份,共3份),并进行均一化处理。使用1%浓度的低熔点琼脂糖胶,电泳cDNA产物,切胶回收1 000 bp以上的目的片段。采用同源重组方式,使用All direct重组酶将上述cDNA分别与经酶切处理线性化的pGADT7载体连接,电转化大肠杆菌感受态细胞。取转化后原液10 μL稀释1 000倍后,从中吸取10 μL涂布于LB平板(含氨苄青霉素),进行库容鉴定。挑取平板上的单克隆,进行PCR扩增,电泳检测cDNA文库片段长度及重组率。库容(colony-forming units, CFU)鉴定公式如下:
库容量(CFU·mL-1)=平板上的克隆数/10 μL×1000倍×1×103μL
(1)
文库总CFU=文库滴度(CFU·mL-1)×文库菌液总体积(mL)
(2)
阳性率计算公式如下:
阳性率=重组成功数量/克隆总数×100%
(3)
将上述步骤验证合格(文库库容量>1×107CFU,平均插入片段>1 200 bp,阳性率>95%)的酵母双杂交文库,采用铺板培养方式,涂布于25 cm的平板,每板涂布3万个左右克隆子,于37℃过夜培养,第2天使用LB培养基洗脱克隆,利用高纯度质粒大提试剂盒抽提质粒。
1.2.3 pGBKT7-McRPF诱饵载体构建 在McRPF基因的cDNA序列两端添加Sfi I的酶切位点设计引物,进行目的片段扩增。将扩增的目的片段和诱饵载体pGBKT7分别利用Sfi I内切酶(Fermentas)进行双酶切,连接后将连接产物转化至大肠杆菌Top10感受态。对转化后的大肠杆菌进行菌落PCR扩增。反应体系为20 μL:Premix Taq 10 μL,20 μmol·L-1McRPF-F和McRPF-R引物各1 μL,ddH2O 8 μL,挑取菌落为模板;反应程序为:98℃变性10 s,55℃退火30 s,72℃延伸1 min, 30个循环。PCR产物通过1%琼脂糖凝胶电泳检测,并对菌落进行测序,获得阳性克隆,进行后续试验。设计的引物序列如下:
McRPF-F:5′-A A G G C C A T T A C G G C C A T G G G T C T A C G A G A C A T C G GA-3′McRPF-R:5′-C C G G C C G A G G C G G C C T C A A G C A A C A A A A T A G T C A A A A TG-3′
1.2.4 诱饵蛋白自激活检测 参照MatchmakerTM GAL4 Two-Hybrid System 3 & Libraries(Clontech)试验方法,将表1组合分别转化到AH109酵母感受态细胞中。每个转化用200 μL无菌水悬浮菌体,温和混匀,涂布于二缺培养基(SD/-Leu-Trp),30℃恒温培养 4 d, 观察生长状况。从pGADT7与pGBKT7-McRPF共转化AH109长出的酵母转化子中,随机挑取6个菌落点板至四缺培养基(SD/-Leu-Trp-His-Ade),30℃恒温培养4 d,观察其生长状况。
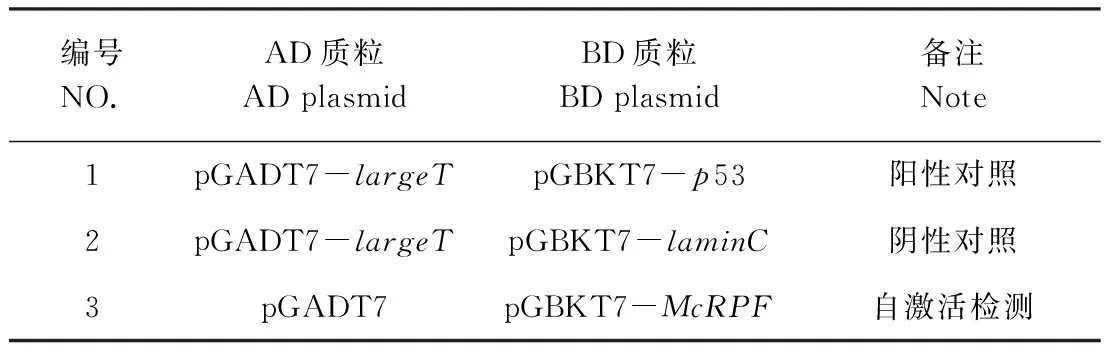
表1 不同重组质粒组合Table 1 Different combinations of recombinant plasmids
1.2.5 McRPF互作蛋白筛选 用含有正确pGBKT7-McRPF诱饵质粒的AH109酵母转化子作为受体菌制备感受态,将pGADT7文库质粒转入其中,按照1∶10、1∶100和1∶1 000分别涂布于SD-Trp-Leu-His+5 mmol·L-13AT平板,30℃恒温培养3~4 d,观察转化结果,记录转化效率。为了消除背景生长菌落的干扰,在培养至第3天时,用无菌绒布对筛库平板进行影印清除后,继续培养7~14 d。至影印清除后继续培养7 d,从筛库平板中挑取长出的阳性克隆单菌落,转接至 SD/-Leu-Trp 培养基继续培养2~3 d。将上述SD/-Leu-Trp培养基上长出的初始阳性克隆转化子分别用无菌水稀释后点种至SD/-Leu-Trp + X-α-Gal和SD/-Leu-Trp-His-Ade 培养基上进行HIS3、ADE2和MEL1报告基因检测,30℃恒温培养3~4 d。
将以上阳性克隆菌株分别接入SD/-Leu-Trp液体培养基,振荡培养过夜后抽提酵母质粒,转化大肠杆菌Top10感受态细胞进行扩增。将含有阳性克隆的Top10转化子转接至LB液体培养扩增后抽提质粒,对质粒进行DNA测序和BLAST比对。
将阳性克隆回转至含有pGBKT7-McRPF诱饵质粒的AH109酵母感受态细胞中,涂布于SD/-Leu-Trp培养基。再将上述SD-TL缺陷型平板上长出的转化子分别用无菌水稀释后点种至SD/-Leu-Trp和 SD/-Leu-Trp-His-Ade+X-α-Gal 培养基,30℃恒温培养3~4 d,进行回转验证。
2 结果与分析
2.1 总RNA提取与mRNA分离纯化
将处于不同成熟期的苦瓜果肉组织等量混合,提取总RNA。1%琼脂糖凝胶电泳结果(图1-A)表明,RNA主带清晰,完整性好,无降解,可用于cDNA文库构建。使用Oligotex mRNA Kits试剂盒分离纯化样本mRNA。获得mRNA总量为3.2 μg,电泳检测结果(图1-B)显示,mRNA条带清晰,呈1条均匀集中的弥散条带,质量完好,无降解,满足建库需要。
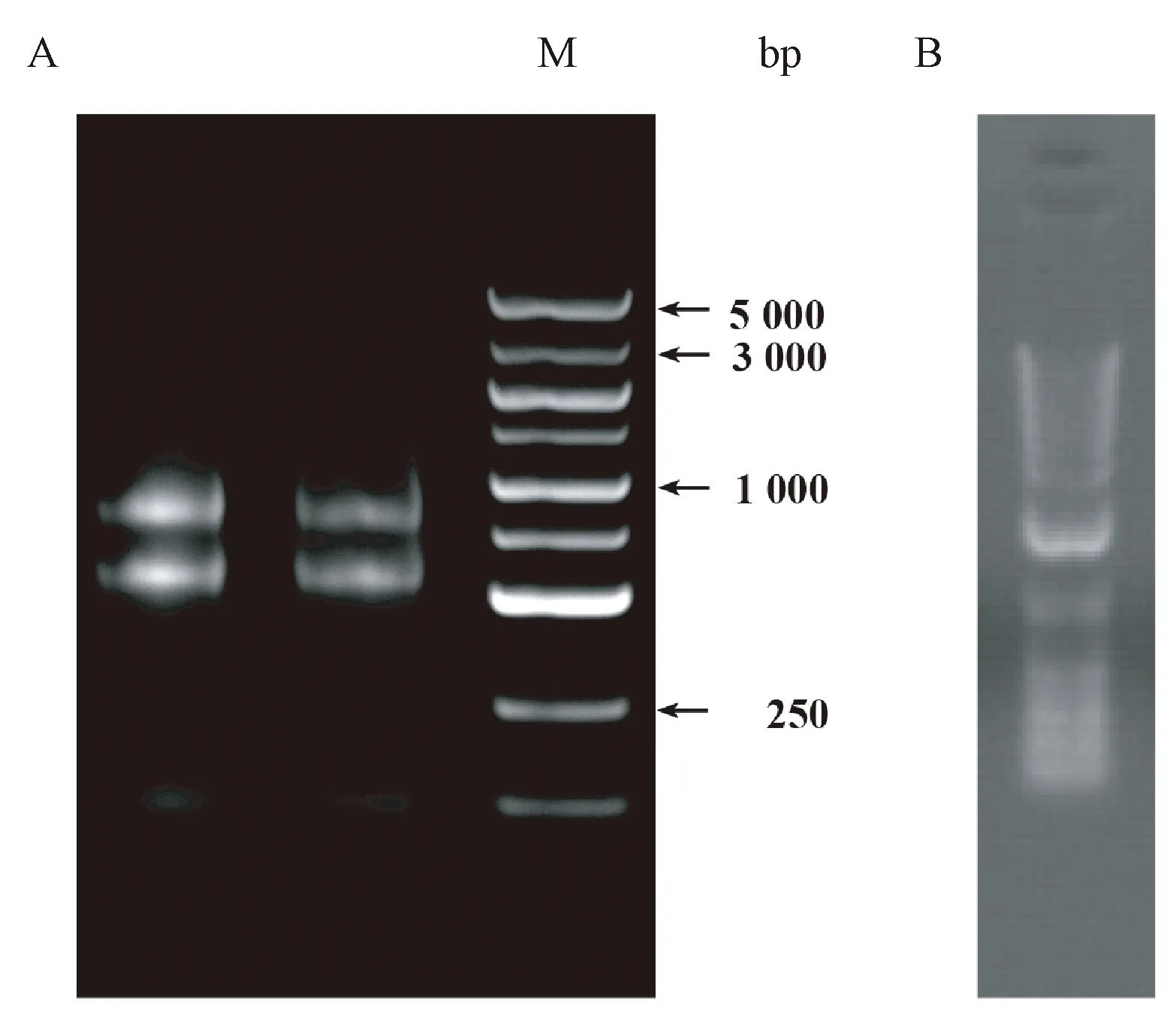
注:A:总RNA电泳图;M为5 kb DNA marker; B:mRNA电泳图。Note: A: The agarose gel electrophoresis of total RNA. M: 5 kb plus DNA marker. B: The agarose gel electrophoresis of mRNA.图1 苦瓜果肉组织RNA电泳图Fig.1 The agarose gel electrophoresis analysis of RNA extracted from bitter gourd flesh tissue
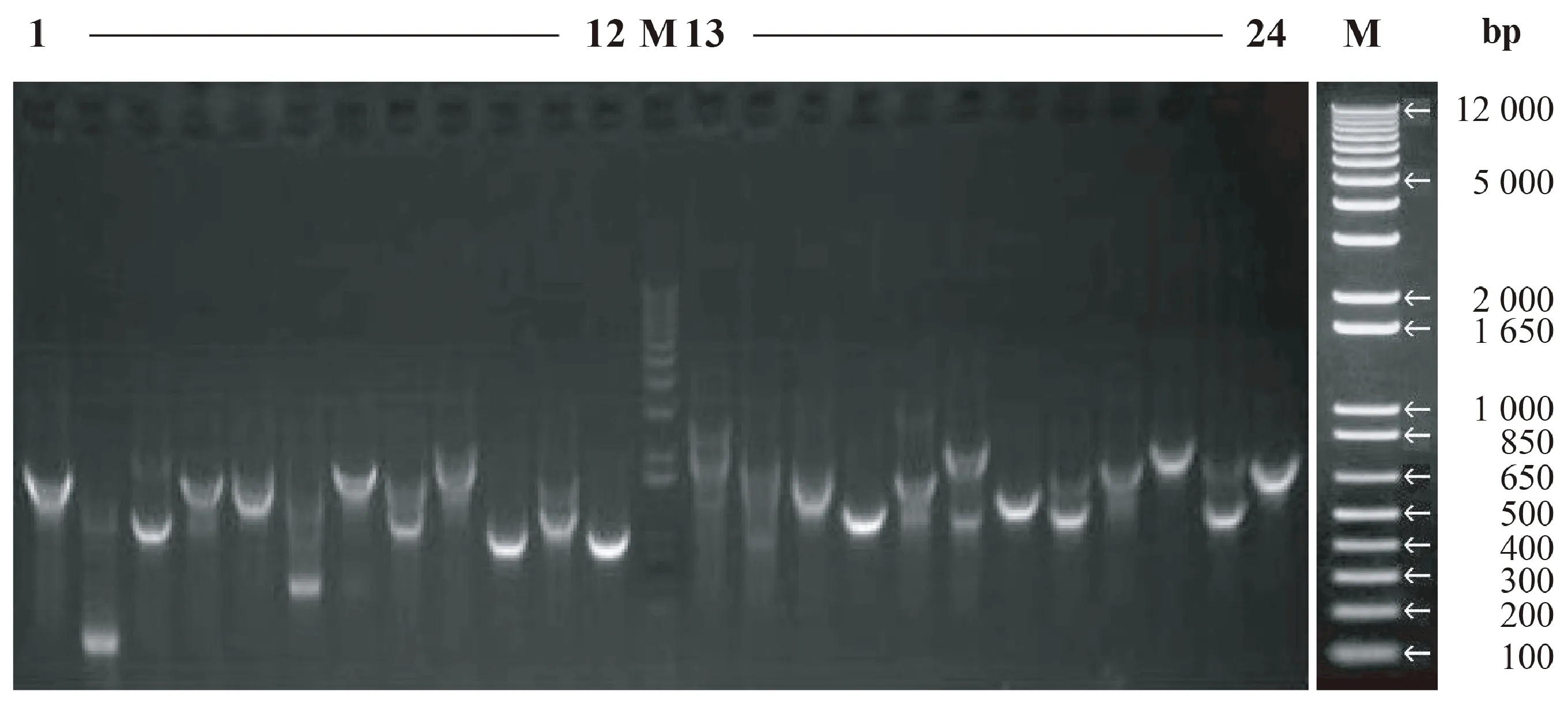
注:M:1 kb plus DNA marker。1~24: PCR产物。Note: M: 1kb plus DNA marker. 1~24: PCR products.图2 cDNA文库插入片段和重组率检测结果Fig.2 Identification of insertion fragment size and recombination rate of cDNA library
2.2 cDNA文库构建与质量鉴定
取10 μL原始电转化菌液稀释1 000倍后,取10 μL涂布于LB平板(含氨苄青霉素),共长出约250个克隆子,计算得到文库库容量约为1.25×107CFU。为检测文库重组序列的完整性,随机挑取24个克隆进行菌落PCR鉴定。由图2可知,插入片段主要分布在800~2 000 bp,且平均长度大于1 200 bp,阳性率为100%,文库质量较高,符合筛库标准。
2.3 诱饵载体构建与自激活检测
以苦瓜果肉组织cDNA为模板,利用高保真酶FastPfu DNA Polymerase扩增McRPF的编码区序列,1%琼脂糖凝胶电泳检测结果显示,目的条带大小约为500 bp,与预期片段大小一致(图3-A)。将回收后的目的条带与pGBKT7用Sfi I进行酶切,用T4-DNA连接酶连接后转化至大肠杆菌Top10感受态,并进行菌落PCR(图3-B)和测序鉴定,PCR扩增条带与目的条带大小一致,且测序序列与目的扩增序列一致,表明成功构建了pGBKT7-McRPF诱饵载体。
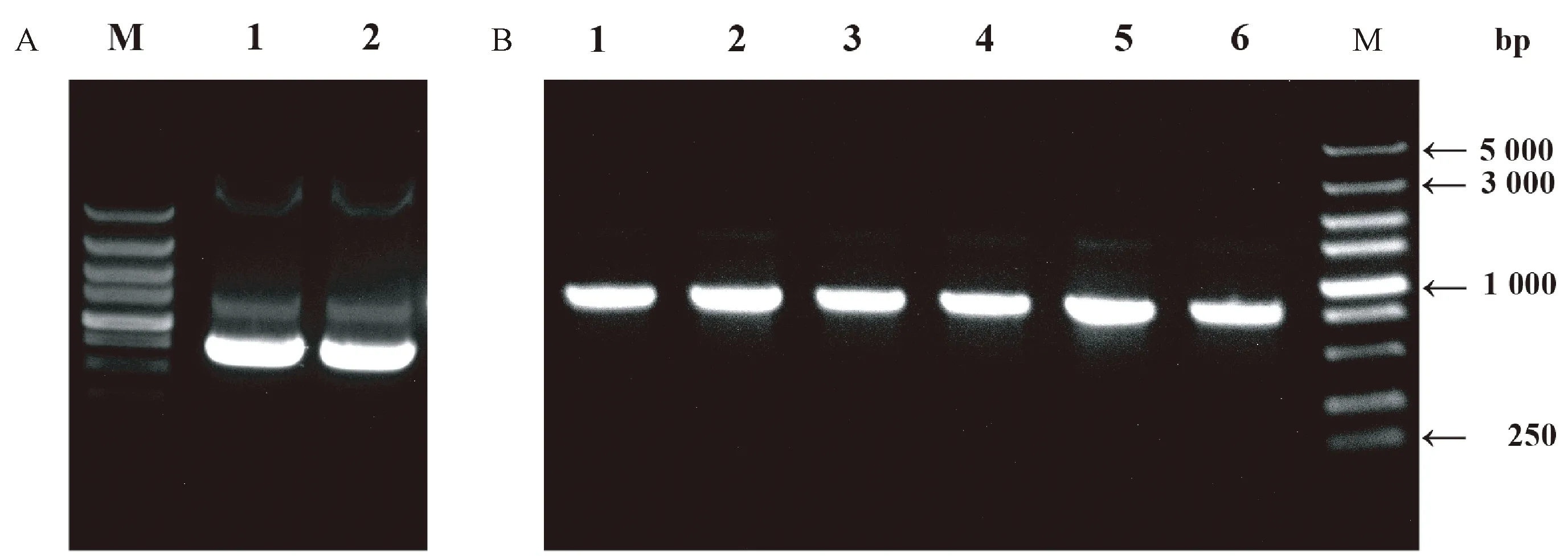
注:A:1~2:McRPF扩增产物;B:1~6:阳性克隆菌落PCR鉴定结果。M:DL5000 DNA marker。Note: 1~2: A: Amplified products of McRPF. B: 1~6: Identification of the positive clones by PCR. M:DL5000 DNA marker.图3 诱饵载体构建与菌落PCR鉴定Fig.3 Construction and identification of bait recombinant vector
将pGADT7/pGBKT7-McRPF、pGADT7-LargeT/pGBKT7-p53(阳性对照)、pGADT7-LargeT/pGBKT7-LaminC(阴性对照)分别转化AH109酵母感受态细胞,涂布于SD/-Leu-Trp平板培养基上,30℃恒温培养3~4 d。长出的酵母转化子中,随机挑取6个菌落接种至SD/-Leu-Trp-His-Ade培养基。结果显示,3组菌株在SD/-Leu-Trp平板培养基上均能正常生长,仅有阳性对照可在SD/-Leu-Trp-His-Ade培养基上生长(图4),说明该诱饵蛋白无自激活活性,可进行筛库试验。

图4 诱饵载体pGBKT7-McRPF的自激活检测Fig.4 Self-activation detection of the bait vector pGBKT7-McRPF
2.4 McRPF互作蛋白筛选
将文库质粒转入含有诱饵质粒的感受态中,按3种浓度稀释,涂布平板,分别获得712、94和14个克隆,文库转化效率为1.62×104μg-1(图5-A)。挑取阳性克隆单菌落分别接种至SD/-Leu-Trp+X-α-Gal和SD/-Leu-Trp-His-Ade缺陷平板上,共获得29个初始阳性克隆,且均能同时激活HIS3、ADE2和MEL1报告基因(图5-B)。将筛选到的29个阳性克隆进行DNA测序,并与GenBank数据库中的序列进行BLAST比对分析,初步获得13个不同的蛋白编码基因(表2)。将这13种阳性克隆与McRPF诱饵克隆共转化酵母细胞进行回转验证检测,结果显示有12个阳性克隆能激活HIS3、ADE2和MEL1报告基因(图5-C)。

注:A:文库转化效率鉴定;B:文库筛选获得的阳性克隆,其中“+”为阳性对照,“-”为阴性对照;C: 候选互作蛋白的回转验证。Note: A: Library transformation efficiency identification. B: Positive clones obtained by library screening, ‘+’ is the positive control, ‘-’ is the negative control. C: Retest of candidate interacting proteins.图5 cDNA文库筛选结果Fig.5 Results of cDNA libary screening
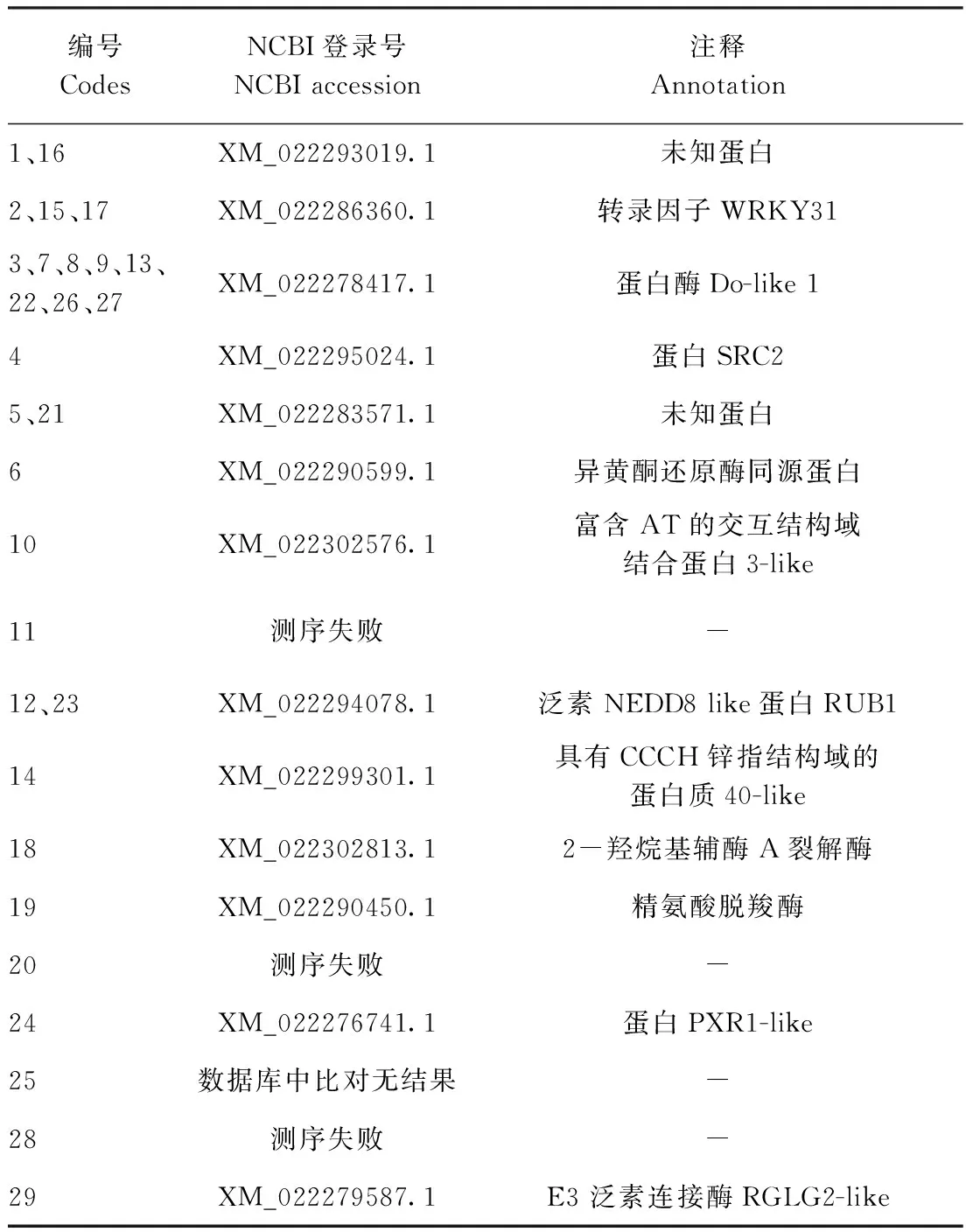
表2 McRPF互作蛋白比对结果Table 2 Blast results of McRPF interacting proteins
3 讨论
酵母双杂交系统是研究蛋白质间相互作用的一种便捷、有效的方法,而高质量cDNA文库的构建是利用酵母双杂交系统筛选互作蛋白的重要前提[12-13]。随着分子生物学研究的不断深入,目前已经获得了很多物种的酵母双杂交cDNA文库,并在此基础上筛选获得目标蛋白的互作蛋白[14-18]。苦瓜为岭南特色瓜类蔬菜作物,基础研究起步较晚,截至目前鲜有关于苦瓜酵母双杂交文库的相关报道。本研究利用All-Direct技术,通过同源重组方法建立了苦瓜不同成熟期果肉组织cDNA文库,文库库容为1.25×107CFU,插入片段平均长度大于1 200 bp,阳性率为100%。评价cDNA文库质量的关键指标主要是文库库容、空载率和插入片段平均长度[10,14]。本研究构建的文库质量达到了酵母筛选文库标准,为进一步开展互作蛋白筛选和新基因的挖掘工作奠定了基础。
果实成熟是高度协调、复杂的生物学过程,受自身基因和外界环境条件等各种因素影响,涉及色泽、质地等外部形态变化,以及细胞壁降解、糖类、有机酸和芳香化合物代谢等内在生理生化变化[3-4]。近年来,通过对番茄、拟南芥和水稻等模式植物的研究发现,转录调控在果实成熟过程中发挥着重要作用,并相继从番茄[19]、猕猴[20]、香蕉[21]等果实中分离鉴定出EIN3/EIL、AP2/ERF、MADS-box、NAC、WRKY等许多与果实成熟相关的转录因子。本研究利用构建的酵母双杂交文库,对苦瓜果实成熟关键因子McRPF的互作蛋白进行筛选,初步筛选获得13个可能与McRPF互作的蛋白,并通过回转验证最终获得12个候选靶标蛋白。通过基因功能注释和相关文献报道,发现12个候选靶标蛋白涉及多种生物学过程,例如,WRKY31可能参与各种生物和非生物胁迫应答[22]、糖代谢[23]、果实的成熟衰老[21,24]等;蛋白酶Do-like 1(Protease Do-like 1,DEG1)参与光系统Ⅱ(Photosystem Ⅱ,PSⅡ)复合物反应中心D1蛋白的降解,从而在PSⅡ复合物的修复循环和功能维护中发挥重要作用[25];异黄酮还原酶(isoflavone reductase, IFR)是异黄酮分解途径的关键酶之一,在调控异黄酮含量及成分方面发挥着重要作用[26];泛素NEDD8-like蛋白Rub1是最重要的类泛素化蛋白之一,被鉴定为细胞氧化还原稳态的关键调节因子[27];精氨酸脱羧酶(arginine decarboxylase, ADC)是多胺合成途径中的关键酶,能通过调节活性氧的积累增强植物的对逆境胁迫的耐受能力[28-30]。E3泛素连接酶RGLG2(E3 ubiquitin-protein ligase RGLG2)是蛋白质泛素化反应的关键酶,广泛参与植物生长发育、胁迫响应和信号转导等生命活动,如拟南芥RGLG1和RGLG2与AtERF53相互作用负调控拟南芥的旱胁迫响应[31-33]。由此推测MCRPF通过与WRKY31互作调控苦瓜果实的成熟,为进一步揭示McRPF调控苦瓜果实成熟的分子机制奠定了基础。
4 结论
本研究构建了不同成熟期苦瓜果肉组织酵母双杂交文库,该文库库容为1.25×107CFU,平均插入片段大于1 200 bp,阳性率为100%,文库质量较高,为果实成熟相关基因筛选提供了资源。此外,利用该文库筛选获得12个与苦瓜果实成熟关键调控蛋白McRPF互作的蛋白,比对结果发现12个候选靶标蛋白涉及光系统修复、异黄酮分解、植物生长发育和胁迫响应等多种生物学过程,为深入解析McRPF调控苦瓜果实成熟的分子机制奠定了基础。
——一道江苏高考题的奥秘解读和拓展

