miR-375靶向锌指蛋白470对人牙周膜干细胞成软骨分化的调控作用
王艳华,袁淑静,潘裕兴,华烨,李世英,王天
天津市人民医院口腔科,天津 300121
间充质干细胞(MSCs)具有组织再生潜能,可诱导分化为成骨细胞、软骨细胞、肌细胞和脂肪细胞[1]。人牙周膜干细胞(hPDLSCs)是从牙齿周围组织中分离出来的一种MSCs,具有一定的组织修复潜能,可诱导动物模型中新骨、新牙骨质和功能性牙周韧带的形成[2-4]。近年来,诱导hPDLSCs 成软骨分化已成为软骨损伤相关疾病的一种有前景的治疗策略。然而,精确调节hPDLSCs 成软骨分化的分子机制尚不十分清楚。既往研究报道,微小RNA(miRNA)可在MSCs 成软骨分化中发挥不同的作用。我们通过前期研究发现,miR-375 具有促进hPDLSCs成骨分化的作用[5],而其在成软骨分化中是否发挥作用尚不清楚。基于已发表文献和miRNA 靶基因数据库预测结果,我们发现锌指蛋白470(ZNF470)可能是miR-375 的候选靶基因。2019年9月—2021年8月,本研究初步探讨了miR-375 靶向ZNF470 对hPDLSCs 成软骨分化影响并分析其调控机制,现将相关研究结果报道如下。
1 材料与方法
1.1 主要材料 hPDLSCs 为天津市人民医院口腔科制备。miR-375激动剂(miR-375-ago)、miR-375突变激动剂(miR-375-mut-ago)及对照激动剂(NC-ago)购自广州锐博生物公司,ZNF470载体与空载购自苏州吉玛基因公司,诱导成软骨分化试剂购自上海埃泽思生物公司,阿尔新蓝染色试剂购自广州捷倍斯生物公司,lipofectamine 3000 转染试剂购自美国赛默飞世尔科技公司,α-MEM 细胞培养基购自武汉普诺赛生命科技公司,实时荧光定量PCR 试剂购自日本宝日医生物技术公司,ZNF470 一抗购自美国Novus 生物公司,软骨标志性基因[Ⅱ型胶原α1(COL2A1)、性别决定基因9(SOX9)、软骨可聚蛋白多糖(ACAN)、透明质酸合酶2(HAS2)]、β-Actin 一抗以及相应二抗均购自武汉爱博泰克生物公司。
1.2 细胞培养及成软骨分化诱导 采用α-MEM细胞培养基与10%胎牛血清培养hPDLSCs,添加2 mmol/L 谷氨酰胺、100 U/mL 青霉素和 100 μg/mL链霉素。取生长状态良好的hPDLSCs,采用2 mL诱导成软骨分化培养基重悬并以3×105/孔接种于6 孔板。自接种时开始计算,每2 d 更换新鲜的诱导成软骨分化培养基,共培养21 d。
1.3 细胞miR-375、ZNF470 mRNA表达检测 采用实时荧光定量PCR法。取诱导分化1、3、7、14、21 d时的hPDLSCs,常规提取细胞总RNA并反转录合成cDNA。miR-375 反转录引物为5'-CTCAACTGGTGTCGTG G A G T C G G C A A T T C A G T T G A G C T C A C G C-3'。随后以cDNA 作为模板,分别采用Mir-X miRNA qRT-PCR TB Green®试剂与 TB Green®Premix Ex Taq™Ⅱ试剂进行实时荧光定量PCR 检测miR-375 与 ZNF470 mRNA 表达。反应体系共 20 μL,其中包括1 μL cDNA、1 μL 引物(正向+反向)、10 μL TB Green®及8 μL 去离子水。反应温度与循环条件:95 ℃ 10 s、60 ℃ 30 s、72 ℃ 30 s,72 ℃ 5 min,4 ℃ 60 min,共 36 个循环。引物序列:miR-375 上游引物 5′-AGTTTGTTCGTTCGGCTC-3′、下游引物 5′-CTCAACTGGTGTCGTGGA-3′,内 参 U6 上 游 引 物 5′-CTCGCTTCGGCAGCACA-3′、下 游 引 物 5′-AACGCTTCACGAATTTGCGT-3′;ZNF470 上游引物 5′-AGCCATCGTAAATCCCTTACT-3′、下 游 引 物 5′-ACTGATGACTCTCCGGTATGA-3′,内参β-actin 上游引物5′-CATGTACGTTGCTATCCAGGC-3′、下 游 引 物 5′-CTCCTTAATGTCACGCACGAT-3′。以 U6、β-actin为内参,按照 2-ΔΔCt计算 miR-375、ZNF470 mRNA 的相对表达量。
1.4 miR-375 与ZNF470 的靶向调控关系分析 采用双荧光素酶报告基因检测法。通过TargetScan 数据库预测miR-375 的潜在靶基因,发现ZNF470 的3′-UTR 中“GAACAA”序 列 可 与 miR-375 中“CUUGUU”序列互补配对,ZNF470 为miR-375 的潜在靶基因。采用PrimeSTAR®Max DNA Polymerase试剂进行高保真PCR 扩增含有miR-375结合位点的ZNF470 3′-UTR 序列,命名为野生型(WT)序列。引物 序 列 :上 游 引 物 5′-AGCTTTGTTTAAACATTCAATCTCGTAAATGCTTCTAGC-3′、下游引物5′-CTAGACTAGTACTACTACCTACCCTGGT -TAGTCCT-3′。突变型(MUT)序列由上海生工生物公司以WT 序列为模版,采用基因定点诱变技术合成。WT 与MUT 序列经测序验证后,克隆到miRNA载体中,构建ZNF470-WT 与ZNF470-MUT 报告载体。将hPDLSCs 接种到12 孔板,接种24 h 后分为四部分,分别转染ZNF470-WT+miR-375-ago、ZNF470-WT+NC-ago、ZNF470-MUT+miR-375-ago、ZNF470-MUT+NC-ago,并同时转染0. 5 μg 表达海肾荧光素酶的pRL-CMV 载体。转染48 h后,检测各组萤火虫和海肾荧光素酶值。
1.5 细胞分组转染及成软骨分化诱导 取生长状态良好的的hPDLSCs 接种至6 孔板中,当融合度达到90%以上时,分为空白对照组、阴性对照组、miR-375 过表达组、对照+空载组、miR-375 过表达+空载组及miR-375 过表达+ZNF470 组,分别转染75 nmol NC-ago、75 nmol miR-375-mut-ago、75 nmol miR-375-ago、50 nmol NC-ago+0.5 μg 空载、50 nmol miR-375-ago+0.5 μg 空载以及 50 nmol miR-375-ago+0.5 μg ZNF470 载体。转染24 h 后收集各组细胞进行成软骨分化诱导,方法同“1.2”。
1.6 成软骨分化情况观察
1.6.1 软骨细胞活性 采用阿尔新蓝染色。收集“1.5”中成软骨分化诱导21 d 后的各组细胞,采用10%甲醛 4 ℃固定30 min。用PBS 洗涤3 次,利用1%阿尔新蓝溶液37 ℃染色60 min,用去离子水洗涤3 次。经不同浓度乙醇脱水处理后,二甲苯清洗3 次。中性树胶封片,显微镜观察、拍照阿尔新蓝染色结果,测定每组在600 nm波长时的吸光度(A)值,以A值表示软骨细胞活性。
1.6.2 软骨标志基因表达 采用实时荧光定量PCR 法。收集“1.5”中成软骨分化诱导21 d 后的各组细胞,实时荧光定量PCR 检测软骨标志性基因COL2A1、SOX9、ACAN、HAS2 mRNA 表达,方法同“1.3”。引物序列:COL2A1 上游引物 5′-TGGACGATCAGGCGAAACC-3′、下 游 引 物 5′-GCTGCGGATGCTCTCAATCT-3′,SOX9 上游引物 5′-CTCTGGAGACTTCTGAACGAG-3′、下游引物5′-CCTTGAAGATGGCGTTGGGG-3′;ACAN 上游引物 5′-CCACTGTTACCGCCACTT-3′、下 游 引 物 5′-GTAGTCTTGGGCATTGTTGT-3′,HAS2 上游引物 5′-CTCTTTTGGACTGTATGGTGCC-3′、下游引物 5′-AGGGTAGGTTAGCCTTTTCAC-3′。以 β-actin 为内参,按照2-ΔΔCt计算COL2A1、SOX9、ACAN、HAS2 mRNA 的相对表达量。
1.6.3 软骨标志蛋白表达 采用Western blotting法。收集“1.5”中成软骨分化诱导21 d 后的各组细胞,Western blotting 法检测软骨标志性基因COL2A1、SOX9、ACAN、HAS2蛋白表达,常规提取细胞中总蛋白并定量各组蛋白浓度。配制8%与12%十二烷基硫酸钠聚丙烯酰胺凝胶,每孔加入30 μg总蛋白。电泳结束后通过湿转膜法将蛋白转移至聚偏二氟乙烯膜膜,采用5%脱脂奶粉37 ℃封闭2 h,TBS-T 缓冲液洗涤 3 次。加入 COL2A1(1∶500)、SOX9(1∶1 000)、ACAN(1∶250)、HAS2(1∶250)以及β-Actin(1∶2 000)一抗4 ℃孵育过夜。将膜与相应二抗(1∶1 000)37 ℃孵育60 min,利用ECL 化学发光试剂盒进行显色。以β-actin 作为内参,以目的条带与内参条带灰度值的比值计算COL2A1、SOX9、ACAN、HAS2蛋白相对表达量。
1.7 统计学方法 采用SPSS27.0 统计软件。计量资料采用Shapiro-Wilk 进行正态性检验,服从正态分布的数据以-x±s表示,两组数据比较行t检验,多组数据比较行单因素方差分析,重复测量数据行重复测量方差分析。采用Spearman 相关性分析诱导hPDLSCs 成软骨分化中 miR-375 与 ZNF470 表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 诱导hPDLSCs 成软骨分化各时点miR-375、ZNF470 mRNA 表达比较 诱导hPDLSCs 成软骨分化 1、3、7、14、21 d 时 miR-375 mRNA 表达分别为1.00± 0.16、0.90 ± 0.11、0.75± 0.09、0.69 ± 0.07、0.44 ± 0.09,ZNF470 mRNA 表 达 分 别 为 1.00 ±0.13、1.52 ± 0.10、2.32 ± 0.28、3.05 ± 0.24、5.16 ±0.40,miR-375 mRNA 表达呈时间依赖性下调,ZNF470 mRNA表达呈时间依赖性上调(P均<0.05)。Spearman 相关性分析显示,诱导hPDLSCs 成软骨分化中miR-375 与ZNF470 表达呈负相关(r=-0.47,P<0.05)。
2.2 miR-375 与ZNF470 靶向调控关系 双荧光素酶报告基因显示,共转染ZNF470-WT+NC-ago、ZNF470-WT+miR-375-ago的hPDLSCs细胞荧光素酶活性分别为 1.00 ± 0.20、0.39 ± 0.04(P<0.05),共转染 ZNF470-MUT+NC-ago、ZNF470-MUT+miR-375-ago 的hPDLSCs 细胞荧光素酶活性分别为1.00 ±0.18、1.06 ± 0.22(P>0.05),提示miR-375可靶向负调控ZNF470。
2.3 miR-375 过表达对hPDLSCs 成软骨分化的影响 阿尔新蓝染色显示,与空白对照组及阴性对照组比较,miR-375 过表达组镜下蓝色视野较浅,成软骨分化程度减少(OSID码图1);空白对照组、阴性对照组、miR-375 过表达组A 值分别为(1.86 ± 0.23)、(1.92 ± 0.25)、(0.40 ± 0.07),miR-375 过表达组软骨细胞活性低于空白对照组及阴性对照组(P<0.05)。实时荧光定量 PCR 与 Western blotting 显示,与空白对照组及阴性对照组比较,miR-375 过表达组COL2A1、SOX9、ACAN、HAS2 mRNA 与蛋白表达均降低(P均<0.05),空白对照组与阴性对照组各软骨标志性基因表达差异无统计学意义。见表1。
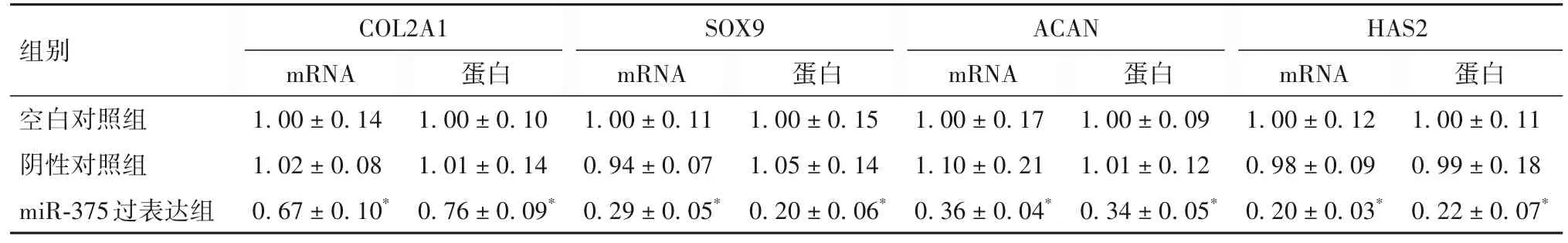
表1 miR-375过表达对hPDLSCs COL2A1、SOX9、ACAN、HAS2表达的影响(-x± s)
2.4 ZNF470 与 miR-375 共同过表达对 hPDLSCs 成软骨分化的影响 阿尔新蓝染色显示,与对照+空载组及miR-375过表达+ZNF470组比较,miR-375过表达+空载组镜下蓝色视野较浅,成软骨分化程度减少(OSID码图2),对照+空载组、miR-375过表达+空载组、miR-375 过表达+ZNF470 组 A 值分别为(2.01 ± 0.29)、(0.54±0.12)、(1.34±0.18),软骨细胞活性miR-375过表达+空载组<miR-375过表达+ZNF470组<对照+空载组(P均<0.05)。实时荧光定量PCR与Western blotting显示,COL2A1、SOX9、ACAN、HAS2 mRNA与蛋白表达miR-375 过表达+空载组<miR-375 过表达+ZNF470组<对照+空载组(P均<0.05)。见表2。
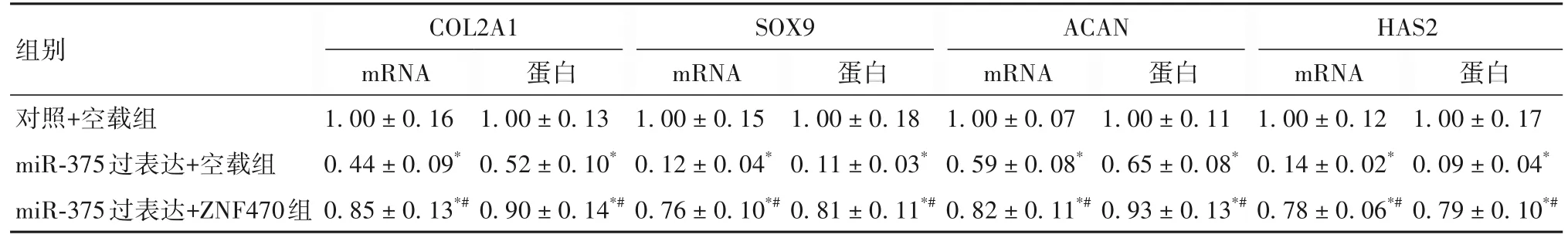
表2 ZNF470与miR-375共同过表达对hPDLSCs COL2A1、SOX9、ACAN、HAS2表达的影响(-x± s)
3 讨论
由于细胞密度低且增殖能力差,软骨细胞在受到损伤或退化时通常不能再生或自愈,容易造成软骨永久性损坏。目前,软骨组织再生和工程化是两种治疗软骨损伤的主要方法。近年来随着组织工程学的快速发展,诱导MSCs 成软骨分化显示出极大的临床应用前景。因此,如何精确调控成软骨分化过程成为了研究热点。PDLSCs 是一种牙齿周围组织来源的MSCs,可以较容易地从正畸过程中获得。LEE 等[6]研究发现,PDLSCs 成软骨分化潜能优于骨髓间充质干细胞(BMSCs),表明PDLSCs是软骨再生有前景的候选干细胞。本研究发现,miR-375 具有抑制hPDLSC 成软骨分化的作用,其机制与负性调控ZNF470表达有关。
作为表观遗传调控的一类关键分子,miRNA 参与诱导MSCs 成软骨分化的研究屡见不鲜,如miR-27b、miR-30a 以及 miR-134 可抑制成软骨分化,而miR-92a-3p、miR-199b-5p 以及 miR-218 可促进成软骨分化等[7-10]。SUN 等[11]分析了诱导人 BMSCs 成软骨分化过程中miRNA 表达谱变化,发现有35 个miRNA 表达上调,106 个 miRNA 表达下调,其中miR-320c过表达可促进BMSCs成软骨分化。YANG等[12]研究显示,miR-210-3p 在大鼠 BMSCs 中可促进成软骨分化并抑制与低氧诱导因子3α 信号相关的成脂肪分化。此外,miR-101 被报道在大鼠BMSCs成软骨分化过程中表达上调,miR-101 过表达能够促进成软骨分化[13]。miR-375位于人基因组2q35区域,最早被发现在胰岛组织高表达并可调节胰岛素分泌[14]。随后研究发现,miR-375 亦可参与其他病理生理过程,如葡萄糖稳态、黏膜免疫和肿瘤进展等[15]。ZHAO等[16]研究发现,抑制miR-375可改善氯胺酮诱导的人胚胎干细胞衍生神经元的神经毒性。我们的研究在诱导hPDLSCs 成软骨分化过程中发现,miR-375 表达呈时间依赖性下调。进一步研究miR-375在成软骨分化中的作用,发现miR-375过表达能够抑制hPDLSCs成软骨分化。
为了探索miR-375 调节hPDLSCs 成软骨分化的分子机制,我们基于已发表的文献和miRNA 靶基因数据库预测结果,将ZNF470 选为miR-375 的候选靶基因。ZNF470 定位于人基因组19q13.43 区域,是一种由17个锌指以及KRAB-A和KRAB-B基序的组成的分子量为64 kDa 的蛋白质。ZNF470 最初是从体外诱导分化为软骨细胞的间充质祖细胞中分离出来,在软骨形成过程中高表达,最大丰度峰值与COL2A1 表达上调一致[17]。本研究发现,ZNF470 在诱导hPDLSCs 成软骨分化过程中呈时间依赖性上调,与之前发表的报道一致,表明该结果可信。随后通过荧光素酶报告基因证实ZNF470 是miR-375 的靶基因,并且miR-375 负性调控ZNF47 的表达。此外,通过在miR-375 过表达的hPDLSCs 中给予ZNF470 过表达处理,发现ZNF470 过表达可部分逆转miR-375对hPDLSCs成软骨分化的抑制作用。
综上所述,miR-375 能够通过靶向负调控ZNF470 从而抑制hPDLSCs 成软骨分化,这提示miR-375 可能是调控hPDLSCs 成软骨分化的一个重要的分子靶点。由于本研究属于体外实验,存在一定的局限性,下一步将在动物模型中予以验证。

