包虫囊液干预的肝细胞Foxp3与IFITM3表达变化及其与干扰素刺激蛋白相关性分析
杨雨阳,蒙克嘎勒,阿不来提·阿合买提,屈晴 ,齐新伟,单骄宇
1 新疆医科大学基础医学院人体寄生虫学教研室,乌鲁木齐 830000;2 新疆医科大学第一附属医院中亚高发疾病发病机制与防治国家重点实验室;3 新疆地方病分子生物学重点实验室;4 新疆医科大学基础医学院生理学教研室;5 新疆医科大学基础医学院机能中心实验室
包虫病又称棘球蚴病,是由棘球绦虫幼虫寄生于人体及某些哺乳类动物体内所致的一种严重的人畜共患寄生虫病,可分为囊型棘球蚴病和泡型棘球蚴病[1]。多项研究表明,寄生虫虫源囊泡在宿主—寄生虫相互作用中具有复杂多样的免疫调节特性,包括免疫刺激和免疫抑制[2]。干扰素诱导跨膜蛋白(IFITM)属于干扰素刺激基因(ISGs),是涉及病毒感染免疫反应的一种蛋白,并可以抑制病原体活性[3]。人类的IFITM 家族由5 个成员组成,包括与免疫相关的IFITM1、IFITM2 和IFITM3 及在免疫中无已知作用的IFITM5 和IFITM10,其中IFITM3 已被多项研究证明在机体抗病毒及抗病原体方面发挥重要作用[4]。调节性T 细胞(Treg)是一类控制体内自身免疫反应性的T 细胞亚群,Treg 的特征基因表达和抑制功能在很大程度上依赖于Treg 细胞转录因子Foxp3 的稳定表达和活性[5]。在蠕虫感染期间,Foxp3 可以通过调控宿主体内炎症反应来使寄生虫逃避宿主的免疫攻击,从而延长寄生虫在宿主体内的生存时间[6]。本课题组在前期研究中发现,Foxp3在包虫病患者肝脏组织内表达量高于非包虫病患者。进一步对Foxp3I 与FITM3 进行生物信息学分析,发现IFITM3和Foxp3之间存在相关性,并且可在干扰素通路以及干扰素刺激基因15(ISG15)蛋白质结合方面发挥作用。通过使用STRING 数据库生成IFITM3 和FOXP3 及其相关蛋白质的蛋白质相互作用网络图并结合相关文献,我们选取了与寄生虫及抗病毒、病原体密切相关的ISGs(IFITM1、IFITM2、IFIT3 和 ISG15)进一步研究 IFITM3 和 Foxp3 之间的关系。2020年10月—2022年1月,我们通过对肝细胞进行包虫囊液干预,观察了Foxp3、IFITM3 与IFITM1、IFITM2、IFIT3 和 ISG15 的水平变化并分析其相关性,以期加深对包虫感染疾病相关作用机制的理解。
1 材料与方法
1.1 材料 人肝癌细胞系HepG2 购自武汉普诺赛生命科技有限公司。TRIzol试剂购自北京全式金生物技术有限公司,cDNA 逆转录试剂盒购自北京宝信生物工程有限公司,荧光定量PCR 试剂盒(TB GreenⓇPremix Ex TaqTM Ⅱ)购自北京宝信生物工程有限公司,BCA 蛋白定量试剂盒购自索莱宝生物科技有限公司,FOXP3 抗体购自美国Invitrogen 公司,IFITM3、ISG15、IFITM1、IFITM2、IFIT3 抗体购自美国Proteintech公司,引物由上海生工公司合成。
1.2 包虫囊液干预处理及分组 从包虫病羊的肝脏包囊中用注射器抽取囊液,离心后留上清备用。将 HepG2 细胞接种于培养基,置于 37 ℃、5% CO2培养箱中培养,待细胞融合度达80%以上时传代。将传代后的细胞以1×106/孔接种于6 孔板,待细胞生长14 h且状态良好时,将细胞随机分为高浓度组、中浓度组、低浓度组、对照组,分别加入 1∶10、1∶100和1∶1 000 浓度比例的囊液及不加囊液,另将低浓度组设2个复孔,对细胞干预72 h。
1.3 细胞 Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 蛋白表达检测 采用Western blotting 法。收集干预后的4 组HepG2 细胞,及低浓度组在干预后0、12、24、36、48、60、72 h 的细胞,用细胞裂解液(RIPA∶PMSF=100∶1)裂解细胞,用BCA 蛋白浓度定量试剂盒检测总蛋白的浓度。用12%十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGD)进行电泳,每个点样孔加 20 μg 总蛋白。80 V 电泳 30 min 后换为 120 V 电泳 1 h,冰上 120 V 电转 90 min。TBST缓冲液洗膜3 次,用5%脱脂奶粉封闭2 h,TBST 缓冲 液 洗 膜 3 次 ,分 别 加 入 IFITM3(1∶1 000)、Foxp3(1∶2 000)、IFITM1(1∶10 000)、IFITM2(1∶1 000)、IFIT3(1∶3 000)、ISG15(1∶1 000)以及β-actin(1∶5 000)一抗,4 ℃摇床孵育过夜。TBST 缓冲液洗膜3 次,用5% 脱脂奶粉稀释相应二抗(1:5 000),室温摇床避光孵育 1 h 后,用 TBST 缓冲液洗膜3 次。将ECL 化学发光溶液A 液和B 液等体积混合,将其覆盖在膜上,置于显色仪中显色,用Image J软件对条带进行灰度值扫描及分析。以β-actin 为内参,以目的条带与内参条带灰度值的比值计算Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 蛋白相对表达量。
1.4 细胞 IFITM3、Foxp3、IFITM1、IFITM2、IFIT3、ISG15 mRNA 表达检测 采用实时荧光定量PCR法。收集干预后的4 组HepG2 细胞,及低浓度组在干预后0、12、24、36、48、60、72 h的细胞,用TRIzol法提取细胞总RNA,使用反转录试剂盒反转录合成cDNA,条件为 37 ℃ 15 min,85 ℃ 5 s,产物-80 ℃保存。冰上操作,将cDNA 稀释5 倍,再将稀释好的cDNA 样品取1 μL 加入荧光定量试剂盒中的qPCR体系,于实时荧光定量PCR 仪上检测IFITM3、Foxp3、IFITM1、IFITM2、IFIT3、ISG15和GAPDH的相对表达量。循环条件:95 ℃ 30 s 预变性,95 ℃ 5 s,60 ℃ 30 s,共 40 个循环。按照 GenBank 中检索到的人IFITM3和Foxp3的基因序列设计引物,以人GAPDH作为内参基因。引物序列:IFITM3 上游引物5′-GCACGCTCATCTCAGATCTCC-3′、下 游 引 物 5′-TTTTGGCTTCTTCAATGTCCAG-3′,FOXP3 上游引物5′-TCCCAGAGTTCCTCCACAAC-3′、下 游 引 物 5′-ATTGACTGTCCGCTGCTTCT-3′,IFITM1 上游引物5′-GTTCAACACCCTCTTCTTGAAC-3′、下游引物 5′-CATCTTCCTGTCCCTAGACTTC-3′,IFITM2 上游引物5′-CATGTGGTCTGGTCCCTGTTCAAC-3′、下游引物5′-CGTCGCCAACCATCTTCCTGTC-3′,ISG15 上游引物5′-TGGACAAATGCGACGAACCTC-3′、下游引物5′-TTTCCCCCAGTGACTAGACTTC-3′;内参GAPDH上游引物5′-GAGTCAACGGATTTGGTCGT-3′、下游引 物 5′-GACAAGCTTCCCGTTCTCAG-3′。 按 照2-ΔΔCt计 算 IFITM3、Foxp3、IFITM1、IFITM2、IFIT3、ISG15 mRNA的相对表达量。
1.5 统计学方法 采用SPSS26.0 和GraphPad Prism 8 统计软件。计量资料的正态性分析采用Kolmogorov-Smirnov 检验,符合正态分布以表示,组间比较行独立样本t检验,组内不同时间点比较行重复测量方差分析,IFITM3、Foxp3 与 IFITM1、IFITM2、IFIT3、ISG15 的相关性采用 Spearman 相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 不同囊液浓度干预下HepG2 细胞Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15蛋白及mRNA表达比较
2.1.1 HepG2 细 胞 中 Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 蛋白 表 达比 较 IFITM1、IFITM2、IFITM3、Foxp3 及 ISG15 蛋白表达随着干预囊液浓度的降低逐渐增高,IFIT3蛋白表达中浓度组>低浓度组、高浓度组(P均<0.05)。见表1。
表1 各组Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15蛋白表达比较()

表1 各组Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15蛋白表达比较()
注:与对照组比较,*P<0.05;与高浓度组比较,#P<0.05;与中浓度组比较,△P<0.05。
组别低浓度组中浓度组高浓度组对照组ISG15 0.778±0.376*#△0.663±0.298*0.534±0.171*0.480±0.210 Foxp3 1.044±0.340*#△0.924±0.191*#0.698±0.189*0.536±0.133 IFITM3 0.827±0.154#△0.527±0.196*#0.414±0.202*0.720±0.111 IFITM1 1.115±0.077*△0.811±0.266#0.602±0.195 0.601±0.083 IFITM2 0.352±0.146#0.309±0.020*0.259±0.038*0.553±0.162 IFIT3 0.744±0.306*△0.931±0.117#0.631±0.114*1.112±0.217
2.1.2 HepG2 细 胞 中 Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 mRNA 表达比较 IFITM1、IFITM2、IFITM3、Foxp3 及 ISG15 mRNA 表 达 随着干预囊液浓度的降低逐渐增高(P均<0.05),IFIT3 mRNA 高、中、低浓度组差异无统计学意义。见表2。
表2 各组Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 mRNA表达比较()

表2 各组Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 mRNA表达比较()
注:与对照组比较,*P<0.05;与高浓度组比较,#P<0.05;与中浓度组比较,△P<0.05。
组别低浓度组中浓度组高浓度组对照组Foxp3 mRNA 2.061±0.420*#△1.421±0.416*#1.157±0.666 1.000±0.052 IFITM3 mRNA 2.300±0.198*#1.776±0.237*1.339±0.044 1.000±0.279 IFITM1 mRNA 2.006±0.273*#△1.872±0.241 1.140±0.150 1.000±0.209 IFITM2 mRNA 0.510±0.077*0.435±0.017*0.385±0.035*1.000±0.146 IFIT3 mRNA 0.008±0.013*0.006±0.014*0.009±0.001*1.000±0.215 ISG15 mRNA 1.707±0.148#△1.227±0.114*1.032±0.226*1.000±0.079
2.2 低囊液浓度干预下各时点HepG2 细胞Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15蛋白及mRNA表达比较
2.2.1 HepG2 细 胞 中 Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 蛋白表达比较 IFITM1、IFITM2及IFIT3蛋白表达随着囊液干预时间延长而降低,IFITM3、ISG15 蛋白表达随着囊液干预时间延长先升高后降低,Foxp3 蛋白表达随着囊液干预时间的延长而升高。见图1。
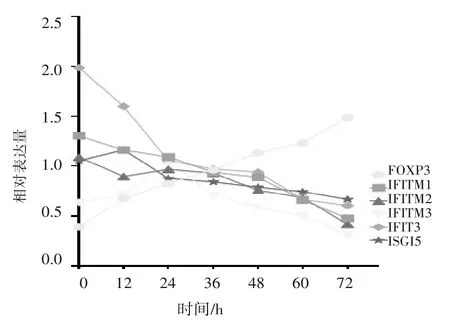
图1 低囊液浓度干预下各时点IFITM1、IFITM2、IFITM3、Foxp3、IFIT3、ISG15蛋白表达比较
2.2.2 HepG2 细 胞 Foxp3、IFITM3、IFITM1、IFITM2、IFIT3、ISG15 mRNA 表达比较 IFITM2、IFIT3及ISG15 mRNA 表达随着囊液干预时间延长而降低,IFITM3、IFITM1 mRNA 表达随着囊液干预时间延长先升高后降低,Foxp3 mRNA 表达随着囊液干预时间的延长而升高。见图2。
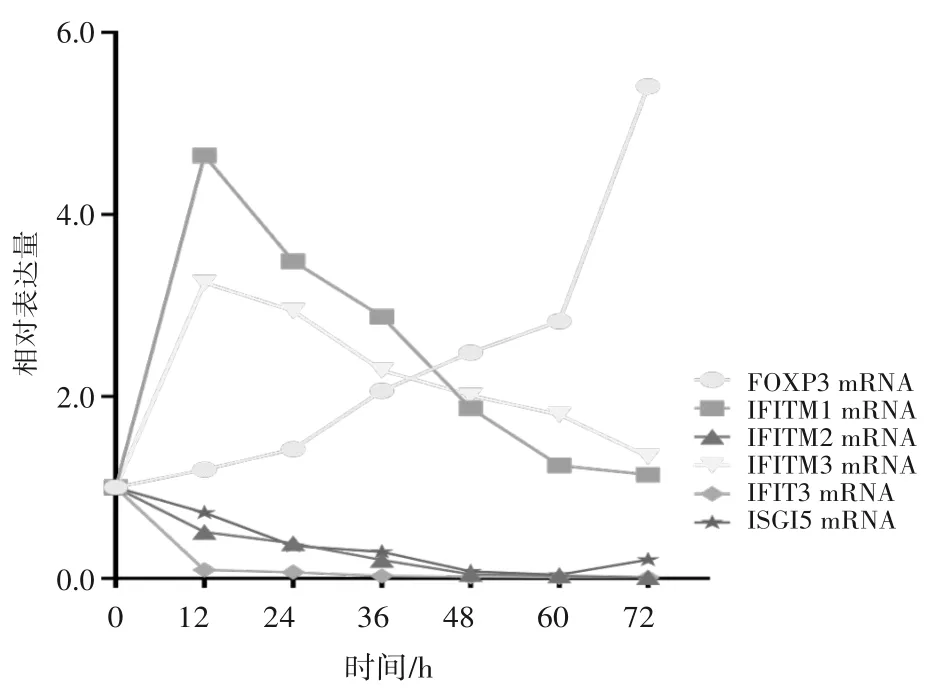
图2 低浓度组各时点IFITM1、IFITM2、IFITM3 Foxp3、IFIT3、ISG15 mRNA表达比较
2.3 Foxp3、IFITM3 与 IFITM1、IFITM2、IFIT3、ISG15的相关性分析
2.3.1 不同囊液浓度干预下HepG2 细胞Foxp3、IFITM3 mRNA 与 IFITM1、IFITM2、IFIT3、ISG15 mRNA 的相关性 相关性分析结果显示,不同囊液浓度干预下Foxp3 mRNA 表达与IFITM3 mRNA 表达呈正相关(r=0.508,P=0.004);Foxp3、IFITM3 mRNA 表达与 IFITM1、IFITM2、ISG15 mRNA 表达均呈正相关(P均<0.05),与IFIT3 mRNA 表达无相关性。见表3。

表3 不同囊液浓度干预下HepG2细胞Foxp3、IFITM3 mRNA与IFITM1、IFITM2、IFIT3、ISG15 mRNA的相关性
2.3.2 不同囊液浓度干预下HepG2 细胞Foxp3、IFITM3 与 IFITM1、IFITM2、IFIT3、ISG15 蛋白的相关性 相关性分析结果显示,不同囊液浓度干预下Foxp3 蛋白表达与IFITM3 蛋白表达呈正相关(r=0.889,P<0.001);Foxp3 蛋白表达与 IFITM1、ISG15 蛋白表达呈正相关(P均<0.05),与 IFITM2和IFIT3 蛋白表达无相关性;IFITM3 蛋白表达与IFITM1、IFITM2、ISG15 蛋白表达呈正相关(P均<0.05),与IFIT3 蛋白表达无相关性。见表4。

表4 不同囊液浓度干预下HepG2细胞Foxp3、IFITM3与IFITM1、IFITM2、IFIT3、ISG15蛋白的相关性
2.3.3 低囊液浓度干预下各时点HepG2 细胞Foxp3、IFITM3 与IFITM1、IFITM2、IFIT3、ISG15 的相关性 相关性分析结果显示,低囊液浓度干预下各时点Foxp3 mRNA及蛋白表达与IFITM3 mRNA及蛋白表达呈负相关(r=-0.562,P=0.012;r=-0.473,P=0.030);Foxp3 表达与 IFITM1、IFITM2、IFIT3、ISG15表达呈负相关;IFITM3 表达与 IFITM1、IFITM2、IFIT3、ISG15表达呈正相关(P均<0.05)。见表5、6。

表5 低囊液浓度干预下各时点Foxp3、IFITM3 mRNA与IFITM1、IFITM2、IFIT3、ISG15 mRNA的相关性
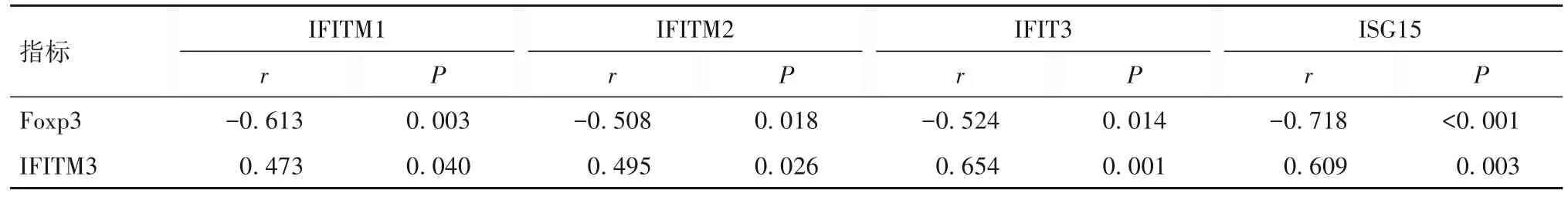
表6 低囊液浓度干预下各时点Foxp3、IFITM3与IFITM1、IFITM2、IFIT3、ISG15 蛋白的相关性
3 讨论
近年来,包虫病已成为严重危害全世界公共卫生健康的问题。包虫幼虫生长所需的营养依靠包虫囊液提供,但包虫囊液中的物质对人类机体来说属于外源性物质,具有免疫原性,可引发机体的免疫应答反应。在细粒棘球蚴感染过程中,包虫囊液所分泌的抗原物质会调节宿主局部及全身免疫反应,使虫体便于逃避宿主的免疫攻击,以保护棘球蚴在宿主体内的生长[7]。
本研究采用包虫囊液干预HepG2 细胞,通过使用Western blotting 和实时荧光定量PCR 检测相关因子的蛋白及 mRNA 发现,IFITM1、IFITM2、IFITM3、Foxp3 和ISG15 的表达量均随着囊液浓度降低而升高。这提示包虫囊液在相对较低的浓度下具有促进IFITM3、Foxp3、IFITM1、IFITM2和ISG5表达的作用,而在相对较高的浓度可下调或抑制IFITM3、Foxp3、IFITM1、IFITM2和ISG5在宿主体内的表达。我们研究结果同样显示,IFIT3 的相对表达量中浓度组>低浓度组、高浓度组,低浓度组虽然与高浓度组在统计学比较中没有显著差异,但在表达量上是高于高浓度组的,这也在一定程度上提示了较低囊液浓度对IFIT3的表达有一定促进作用。
我们在采用低囊液浓度干预HepG2 细胞时发现,IFITM1、IFITM2、IFITM3、IFIT3 及 ISG15 的表达量随着囊液干预时间的延长逐渐降低,而Foxp3 表达量随着囊液干预时间的延长逐渐增高。宿主对囊型棘球蚴病的免疫系统通常分为先天反应和适应性反应,IFITM 家族在免疫损伤和炎症感染中发挥的作用属于先天免疫,是抵御寄生虫的第一道防线,IFIT3 和ISG15 也与抗病毒和抗病原体的天然免疫有关,而Foxp3则与适应性免疫反应相关[8]。在感染包虫初始阶段,虫体所分泌的蛋白及抗原有利于激发宿主免疫系统对虫体发起攻击,宿主通过干扰素信号通路促进 IFITM1、IFITM2、IFITM3、IFIT3 和ISG15 表达增加,使其开始发挥抗病原体的作用,从而抑制虫体在体内的生长繁殖。随着感染时间推移,宿主的免疫反应又可分为Th1 型和Th2 型两大类[9]。在感染早期,宿主主要产生以Th1 型细胞及其产生的干扰素γ(IFN-γ)、白细胞介素2(IL-2)等有利于清除寄生虫的细胞因子;而在感染的中后期主要是以 Th2 细胞及其产生的 IL-10、IL-4、IL-5 等细胞因子参与的免疫反应为主,在此阶段宿主的免疫调控属于负免疫调控,不会有效抑制寄生虫的生长,反而有利于寄生虫的生长繁殖。随着宿主感染时间延长,T 细胞开始接受T 细胞受体(TCR)信号而被激活,分化为效应T细胞来诱导免疫应答[10]。因此,在感染前期,Foxp3 表达量较少,提示其没有开始发挥作用,但随着感染时间的延长,免疫类型开始向Th2型偏移,囊液抗原物质对细胞的刺激使Foxp3 表达增加,开始产生帮助虫体免疫逃逸的影响。
IFITM3和Foxp3在不同囊液浓度干预下呈正相关,且 IFITM3 与 IFITM1、IFITM2、ISG15 呈正相关,Foxp3 与 IFITM1、ISG15 也呈正相关,但 Foxp3 与IFITM2 之间没有相关性,因为相对于IFITM3 和IFITM1,在同一条件下IFITM2 的表达量是较低的,并且随着囊液浓度的变化,IFITM2 表达量的变化也不如 IFITM3 和 IFITM1 的明显,因此与 Foxp3 的相关性较低。在相同囊液浓度(低囊液浓度)干预下各时点 ,IFITM3 和 Foxp3 呈 负 相 关 ,并 且 IFITM3 与IFITM1、IFITM2、IFIT3 及 ISG15 呈正相关,而 Foxp3与 IFITM1、IFITM2、IFIT3 及 ISG15 呈负相关。我们据此推测,动物在感染细粒棘球蚴初期,包虫产生的囊液少、浓度低,这时与先天免疫有关的IFITM3、IFITM2、IFITM1、ISG15 和 IFIT3 开始发挥作用,为了防止寄生虫对人体的进一步入侵,IFITM3、IFITM2、IFITM1、ISG15 和IFIT3 的表达量增加。而因为包虫刚入侵宿主时囊液浓度低,Foxp3 又与IFITM1、IFITM3 及 ISG15 之间呈正相关,则 Foxp3 的表达会相应增高。随着病程的延长,Foxp3 表达逐渐升高,其开始发挥免疫耐受作用,再加上随着病程延长Foxp3 与 IFITM3、IFITM1、IFITM2、IFIT3 及 ISG15 之间的关系转为负相关,使得IFITM3、IFITM1、IFITM2、IFIT3 和 ISG15 的表达量逐渐降低,从而在细粒棘球蚴感染后期虫体得以逃避宿主的免疫攻击。
综上所述,我们使用不同浓度的包虫囊液干预HepG2 细胞,发现低浓度的囊液会促进IFITM1、IFITM2、IFITM3、Foxp3 和 ISG15 的表达且 IFITM3 与Foxp3 呈正相关;我们使用低浓度包虫囊液干预HepG2 细胞,发现随着干预时间的延长可降低IFITM1、IFITM2、IFITM3、IFIT3 和 ISG15 的表达,但会促进 Foxp3 的表达,并且 IFITM3 与 Foxp3 呈负相关。我们同时发现,IFITM3 作为抗病毒和抗病原体重要的蛋白,在包虫病感染后期表达量减少的一部分原因可能为IFITM3 和Foxp3 呈现负相关性,也可能是IFITM3 蛋白的翻译后修饰。IFITM3 受到多种翻译后修饰的调节,这些修饰决定了其细胞定位、活性和丰度,包括有棕榈酰化、泛素化、磷酸化和甲基化,而只有棕榈酰化对IFITM3 的调剂起促进作用,其他三种翻译后修饰会抑制IFITM3的抗病毒作用,使IFITM3应对虫体的攻击能力下降,从而虫体逃避宿主的免疫攻击[11]。因此,后期我们将进一步研究包虫感染过程中IFITM3 蛋白翻译后修饰所致免疫逃逸机制,为包虫感染疾病的作用机制和治疗提供新思路、新想法。

