银杏内酯B 对人结肠癌SW480 细胞恶性生物学行为及ROS/XIAP 信号通路的影响*
孙小虎,于 洪,王 璐,艾福录,白静慧
(中国医科大学肿瘤医院·辽宁省肿瘤医院,辽宁 沈阳 110042)
结直肠癌是全球第四大与癌症相关的死亡原因[1],化学药物治疗(简称化疗)常用于治疗直肠癌,但化疗副作用大,且癌细胞会产生耐药性[2]。有研究表明,银杏内酯B 对癌前病变、原位癌、浸润癌、转移及向远端播散阶段均显示出预防或治疗作用[3-4],且可抑制癌细胞的生长[5]。活性氧(ROS)可调节细胞生长、增殖、迁移,并可通过Thr308 磷酸化激活[6-7]。X 连锁凋亡蛋白抑制剂(XIAP)属凋亡抑制剂家族成员,位于细胞质中,可作为细胞凋亡的有效调节剂。XIAP 通过抑制半胱氨酸蛋白酶(caspase)- 3、caspase - 7 和caspase - 9 活性而发挥抗凋亡作用,且在癌症化学耐药性中起关键作用[8]。此外,ROS 活化可增强XIAP蛋白酶体表达从而促进癌细胞生长及增殖。本研究中探讨了银杏内酯B 对人结肠癌SW480 细胞恶性生物学行为及ROS / XIAP 信号通路的影响。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:Multiskan MK3 型酶标仪(美国Thermo Fisher Scientific 公司);Transwell 腔室(孔径8 mm,日本Costar公司,批号为56324132);VC - 4785 型显微镜(日本Olympus 公司);FACSCalibur™型流式细胞仪(日本Sysmex公司);AB7300型热循环仪(美国ABI公司);DY‑CZ-20H 型电泳仪(北京六一生物科技有限公司);723型紫外- 可见分光光度计(上海沪粤明科学仪器有限公司)。
试药:RPMI-1640 培养基(批号为202036269),胎牛血清(FBS,批号为23654.69),1%青霉素/ 链霉素(批号为41563.36),均购自赛默飞世尔科技(中国)有限公司;紫杉醇(批号为2148.68,含量99.5%),纤维素膜(批号为BV - 41526563.3),均购自美国Sigma 公司;银杏内酯B(批号为NM-36547,含量99.5%),SDS(批号为5256363.3),均购自美国Thermo Fisher Scien‑tific 公司;四唑盐(MTT,美国BioInnovatise 公司,批号为VB - 41563.36);基质胶Matrigel(美国BD Biosciences公司,批号为VC-152696.63);二甲基亚砜(DMSO,批号为BC-41521.3),膜联蛋白V-EGFP 细胞凋亡检测试剂盒(批号为SD - 236548.3),荧光染料DCFH -DA(批号为741589),均购自上海碧云天生物技术有限公司;Trizol 试剂(美国Invitrogen 公司,批号为BV -44588.36);HiScript Ⅱ试剂盒(南京诺唯赞生物科技股份有限公司,批号为DS - 47152.36);All - in - One™mRNA qRT-PCR 检测试剂盒(美国GeneCopoeia 公司,批号为521680);蛋白酶抑制剂混合物(美国Calbiochem公司,批号为XC - 4152336);BCA 试剂盒(德国Pierce公司,批号为415236.36);anti - XIAP 一抗(1︰1 000,批号为BH54263),GAPDH 一抗(1︰1 000,批号为BT48763),免疫球蛋白G 的山羊抗兔二抗(批号为SX-47152.36),均购自美国Santa Cruz Biotechnology 公司;ECL 化学发光试剂盒(美国CST 公司,批号为BD -47125.36),ROS 检测试剂盒(合肥莱尔生物科技有限公司,批号为LE-2130651)。
细胞:人结肠癌SW480 细胞(美国典型培养物保藏中心)。
1.2 方法
1.2.1 细胞培养及分组
取SW480 细胞适量,接种于含10%FBS 和1%青霉素/ 链霉素的RPMI - 1640 培养基中,在37 ℃、5%CO2条件下培养。实验分为模型组(培养基+SW480 细胞)、紫杉醇组(5 mg/L+培养基+SW480 细胞)[9],以及银杏内酯B 低、高剂量组(50,100 μmol/ L + 培养基+SW480细胞)[10],各组均培养72 h,每孔设6个平行样。
1.2.2 观察指标及检测方法
细胞存活率:采用MTT 法。取1.2.1 项下对数生长期细胞适量,以1 × 104个/ 孔的初始密度接种于平底96 孔细胞培养板中,培养48 h。每孔加入MTT,37 ℃、5%CO2条件下孵育4 h,除去培养基,加入DMSO,室温放置30 min,以酶标仪、于490 nm 波长处测定吸光度(OD),以蒸馏水为空白对照。存活率(%)=(OD用药组-OD模型组)/(OD用药组-OD空白对照)×100%。
细胞凋亡率:采用流式细胞术。取1.2.1 项下对数生长期细胞适量,以1.25 × 105mL-1的初始密度接种于6 孔板中,在37 ℃、5%CO2条件下培养72 h。用PBS洗涤,以初始的密度重悬于1×Annexin V结合缓冲液中。将100 μL 细胞悬液与5 μL 膜联蛋白(V - FITC)和5 μL碘化丙啶(PI)在黑暗中于室温下孵育15 min。孵育结束后添加400 μL 1×结合缓冲液后,采用流式细胞仪分析样品。凋亡率(%)=凋亡细胞数/总细胞数×100%。
侵袭迁移水平:采用Transwell 法。取1.2.1 项下对数生长期细胞适量,以2×104个/孔的初始密度接种于200 μL 无血清培养基中,后移至上腔室,并于底部腔室中加入含10%FBS 的培养基。上腔室涂有或不涂有Matrigel 用于入侵或迁移水平测定。在37 ℃、5%CO2条件下培养细胞48 h,后以棉签除去顶部小室中的细胞,并用甲醇固定下表面细胞,用0.1%结晶紫染色,显微镜下观察并拍照。
ROS 水平:采用荧光探针法。取样品、标准品和DCFH - DA 标记的检测抗体,依次添加到捕获抗体的包埋微孔中,温育并彻底洗涤后,用四甲基联苯胺着色液进行显色反应,用光度计在492 nm 波长处测定OD,根据标准品的浓度和每个孔的OD绘制标准曲线。
XIAP mRNA 表达水平:采用反转录聚合酶链反应法。取1.2.1项下对数生长期细胞适量,以Trizol法提取总RNA,反转录合成cDNA,以GAPDH 为内参。XIAP、GAPDH 引物由上海Sangon Biotech 公司合成,序列如下,XIAP 正向,5' - CGTAGCTAGCTAGTAGTCGATC‑GATCGTAGCTAGCTAGCTAGC - 3';反向,5' - CG‑TAGCTAGTCAGTCGATCGATCGATGCTAGCTAGCTAG‑TCGTG - 3'。GAPDH 正向,5' - CGTAGCTAGCTAGTC‑GATCGTAGCTAGCTGACTGTGATCG - 3';反向,5' -CGTAGCTAGCTAGTCGATCGTAGCTAGCTGATCGATC‑GC - 3'。PCR 总反应体系(10 μL)为,SYBR Premix Ex Taq 4 μL,cDNA模板1 μL,上下游引物各0.5 μL,去离子水4 μL。反应程序为,96 ℃10 min;95 ℃10 s,60 ℃30 s,72 ℃10 s,40 个循环。读取循环阈值(Ct值),以2-ΔΔCt表示目的基因mRNA 的表达量。每组平行实验3次。
XIAP蛋白表达水平:采用Westernblot法。取1.2.1项下对数生长期细胞适量,加入1 mL RIPA 蛋白裂解液,以BCA 法测定XIAP 蛋白含量。10% SDS - PAGE 电泳后电转,4 ℃下与一抗孵育过夜,弃一抗;室温下与免疫球蛋白G 的山羊抗兔二抗孵育1 h。加入ECL 化学发光试剂,将PVDF 膜放入暗盒中,压上X 胶片,取出胶片后显影、定影、清洗。以Image J软件将条带灰度值数字化,目的条带与内参条带灰度比值为各目的蛋白相对表达量。
1.3 统计学处理
采用SPSS 24.0 统计学软件分析。计量资料以±s表示,两两比较行SNK -q检验,多组间比较行单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞存活率
与模型组比较,紫杉醇组及银杏内酯B 低、高剂量组细胞存活率显著降低(P<0.05)。详见表1。
2.2 细胞凋亡率
与模型组比较,紫杉醇组及银杏内酯B 低、高剂量组细胞凋亡率显著升高(P<0.05)。详见表1及图1。
2.3 细胞侵袭迁移水平
与模型组比较,各用药组细胞穿膜数显著减少(P<0.05)。详见表1。
2.4 各组细胞ROS 水平
与模型组比较,紫杉醇组与银杏内酯B 低、高剂量组细胞ROS水平显著降低(P<0.05)。详见表1。
2.5 细胞XIAP mRNA 及蛋白表达水平
与模型组比较,紫杉醇组与银杏内酯B 低、高剂量组细胞XIAP mRNA 及蛋白表达水平显著降低(P<0.05)。详见表1。
表1 各组观察指标比较(±s,n=6)Tab.1 Comparison of observed indexes in each group(±s,n=6)
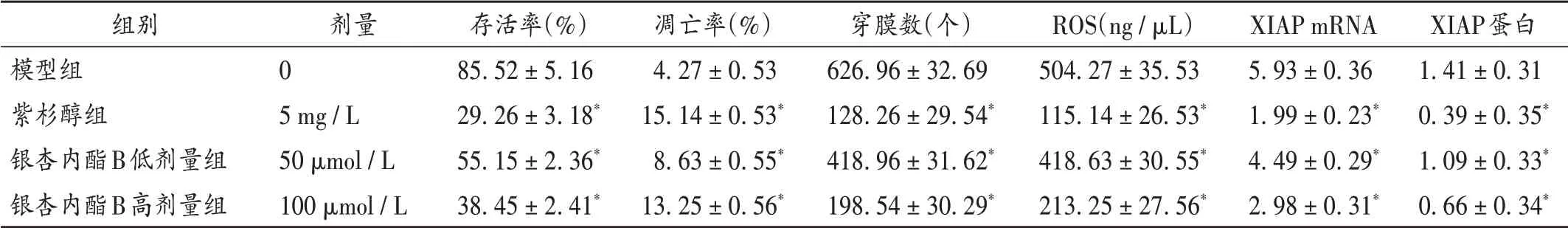
表1 各组观察指标比较(±s,n=6)Tab.1 Comparison of observed indexes in each group(±s,n=6)
注:与模型组比较,*P < 0.05。Note:Compared with those in the model group,*P < 0.05.
组别模型组紫杉醇组银杏内酯B低剂量组银杏内酯B高剂量组剂量0 5 mg/L 50 μmol/L 100 μmol/L存活率(%)85.52±5.16 29.26±3.18*55.15±2.36*38.45±2.41*凋亡率(%)4.27±0.53 15.14±0.53*8.63±0.55*13.25±0.56*穿膜数(个)626.96±32.69 128.26±29.54*418.96±31.62*198.54±30.29*ROS(ng/μL)504.27±35.53 115.14±26.53*418.63±30.55*213.25±27.56*XIAP mRNA 5.93±0.36 1.99±0.23*4.49±0.29*2.98±0.31*XIAP蛋白1.41±0.31 0.39±0.35*1.09±0.33*0.66±0.34*
3 讨论
结直肠癌发现时常表现为肿瘤转移,术后易局部浸润和肿瘤复发。银杏内酯B 属内酯类生物碱,可通过减弱肝癌细胞中p38 信号通路的活性来阻止细胞的增殖和侵袭[11],也可通过肺癌细胞中Akt 途径的失活而抑制细胞增殖并诱导其凋亡[12]。本研究结果显示,50 μmol/ L 和100 μmol/L 的银杏内酯B 可显著抑制SW480细胞的增殖、迁移和侵袭,并促进其凋亡。
本研究中,与模型组比较,紫杉醇组及银杏内酯B低、高剂量组细胞ROS、XIAP mRNA 和蛋白表达水平均显著降低,与已有文献结论一致[13]。生物信息学预测分析认为,XIAP 是基于序列互补的ROS 可能的靶标[14]。ROS 在各种癌症中异常表达,并促进了乳腺癌、前列腺癌、肺癌的发生与发展,溴结构域和植物同源结构域的手指转录因子可作为核因子κB(NF - κB)途径的转录调节因子,并增强肺癌细胞中ROS 的转录,最终导致预后不良[15]。另一项关于三阴性乳腺癌的研究表明,ROS表达上调是因为着丝粒蛋白U(有丝分裂必要的着丝粒成分)抑制了泛素化和蛋白酶体降解,此外,间质相互作用分子1(STIM1)可能通过增强ROS的表达和升高前列腺素E2的水平来促进结肠癌细胞的迁移,而短发夹RNA 消耗STIM1 则抑制了结直肠癌细胞的迁移[16]。XIAP是位于ROS启动子区域的反义蛋白,XIAP 被认为是通过隔离其抑制剂,p50 同源二聚体和螯合剂来激活NF - κB 信 号 传导。这又 将NF - κB 亚基p65 募集到XIAP 启动子并增强了XIAP 转录。有研究表明,XIAP 与ROS mRNA 的表达高度相关,而XIAP 的异常表达可调节人巨噬细胞对脂多糖刺激及恶性造血的分化,XIAP 也可通过前列腺素的生物合成促进肿瘤发生[17],其在人肺癌细胞中高表达,并多与预后不良相关[18]。临床研究表明,miR - 451 抑制了肝癌细胞的增殖,其上调抑制了XIAP 表达,并且XIAP 还可激活Wnt 通路。同时,转录共激活子YAP 可通过与XIAP 启动子中的TEAD 结合位点相互作用,增强XIAP mRNA的表达,从而介导癌细胞耐药性[19-20]。

A.模型组 B.紫杉醇组 C.银杏内酯B低剂量组 D.银杏内酯B高剂量组图1 流式细胞图A.Model group B.Paclitaxel group C.Ginkgolide B low-dose group D.Ginkgolide B high-dose groupFig.1 Flow cytometry
综上所述,银杏内酯B 可有效抑制SW480 细胞的迁移和侵袭并诱导其凋亡,其机制可能与抑制ROS/XIAP信号通路的激活有关。

