广西药物临床试验发展情况分析*
潘晓艳,伦新强,凌 峰
(1.广西科技大学第一附属医院药学部,广西 柳州 545002; 2.广西科技大学经济与管理学院,广西 柳州 545006)
为解决药品注册积压并释放临床试验资源,2019年8 月十三届全国人大常委会修订通过《中华人民共和国药品管理法》,明确规定药物临床试验机构实行备案管理;开展药物临床试验,应按规定如实报批,药品监督管理部门应自受理临床试验申请之日起60个工作日内决定是否同意并通知临床试验申办者,逾期未通知的,视为同意[1]。为具体落实此项规定,国家药品监督管理局联合国家卫生健康委员会于2019 年11 月29 日发布《药物临床试验机构管理规定》,宣布自2019年12月1日起药物临床试验机构实行备案制管理;二级甲等资质以上的医疗机构和省级以上疾病预防控制机构符合相关条件后均可备案成为药物临床试验机构[2]。本研究中通过比较广西壮族自治区在备案制实施前后机构备案和承接项目的变化,分析现阶段广西壮族自治区的药物临床试验改革成果和存在问题,探讨问题解决方法,以期提高广西壮族自治区药物临床试验机构的履职能力,促进药物临床研究事业健康发展。现报道如下。
1 资料与方法
查阅国家药品监督管理局药物临床试验备案管理信息系统和药物临床试验登记与信息公示平台,收集与广西壮族自治区药物临床试验机构和项目相关的数据。收集时间为2018年至2021年,其中2018年至2019年为备案制实施前周期,2020 年至2021 年为备案制实施后周期。比较广西壮族自治区在备案制实施前后机构备案和承接项目的变化,分析现阶段该区药物临床试验的改革成果和存在的问题。
2 结果
2.1 机构备案情况
2.1.1 数量及地域分布
目前全区共备案药物临床试验机构22 家,除备案制实施前通过资格认定的13 家机构外,新增备案9 家,增幅69.23%。除广西壮族自治区疾病预防控制中心(简称区疾控中心)外,已完成备案的机构均为公立三级医院,其中三级甲等专科医院4 家,包括妇幼保健院2 家(新增)、肿瘤医院1 家、其他专科医院1 家(新增);三级甲等综合医院16 家,包括综合性医院13 家(新增4 家)、中医医院2 家(新增1 家)、中西医结合医院1 家;三级未定等1 家(新增)。地域分布,玉林市与贵港市各1家,桂林市3家,柳州市4家,南宁市12家。详见图1。
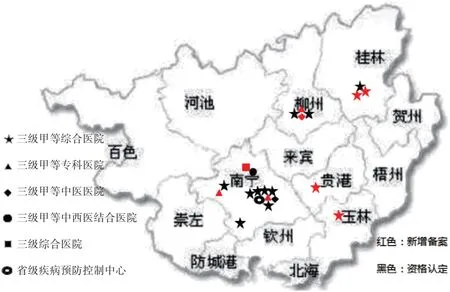
图1 广西壮族自治区药物临床试验机构分布图Fig.1 Distribution of drug clinical trial institutions in Guangxi Zhuang Autonomous Region
2.1.2 备案专业
全区备案专业数量累计246个,较备案制实施前新增37 个,增幅17.70%;去重后全区备案专业64 个,新增1 个。备案专业类型变化较小,西医专业34 个(53.13%),中医专业(包括1 个中西医结合专业)20 个(31.25%),妇产科专业5 个(7.81%),儿科专业4 个(6.25%),疾病预防控制中心专业1个(1.56%)。备案专业数量超过15 个的机构有8 个,均为三级甲等综合医院,除专科医院和区疾控中心外,备案制实施前就获得资格认定的机构的备案专业均不少于10 个,而新机构除桂林市人民医院备案10 个专业外,其他均在1~5 个之间,说明备案专业数量与医疗机构的业务水平和服务范围呈正相关[3]。除疾控中心外,备案肿瘤专业的机构最多,这与近年来抗肿瘤药是创新药开发的热门领域、临床试验需求量大有关[4]。其他超过10 家机构备案的专业均属内科,与我国药物临床试验机构专业分布基本一致[3]。我区备案专业虽较齐全,但有22 个专业只有1 家机构备案,集中在外科的器官移植、烧伤、整形、产科、儿科及中医科。详见表1。

表1 广西壮族自治区药物临床试验机构备案专业(n=246)Tab.1 Record-keeping majors of drug clinical trial institutions in Guangxi Zhuang Autonomous Region(n=246)
2.1.3 备案主要研究者
主要研究者是指一项临床试验项目的主要实施者,对临床试验质量和安全负主要责任。全区各专业备案主要研究者(PI)共559人,有项目结题或在研的270人(48.30%),备案制实施前承接项目的为155 人(27.73%),备案制实施后为219人(39.18%);全区承接项目数超过10 项的有19 人(3.40%),承接项目数最多的超过30 项,同时间段在研项目超过5 项。这些承接项目较多的PI 均为区内外该领域影响力较强的专家,基本集中在全区医疗水平和实力较强的几个头部医疗机构,说明申办者的选择倾向于大型医院的知名专家。肿瘤专业备案PI人数最多(112人),这与全区规模最大的肿瘤专科医院(广西医科大学附属肿瘤医院)备案人数较多有关,也与备案该专业的机构较多有关,肿瘤专业PI承接项目的比例为69.64%,远超平均水平。
2.2 承接项目情况
2.2.1 数量
除主动终止或暂停项目外,4 年间全区机构承接药物临床试验累计944 项,其中备案制实施后增长了208 项,增幅56.52%,这些项目在新备案机构开展仅20 项(2.12%)。承接的项目中国际多中心项目116 项(12.29%),担任组长单位的大部分承接的是生物等效性(BE)试验和疫苗试验(121 项,12.82%)项目。详见图2。
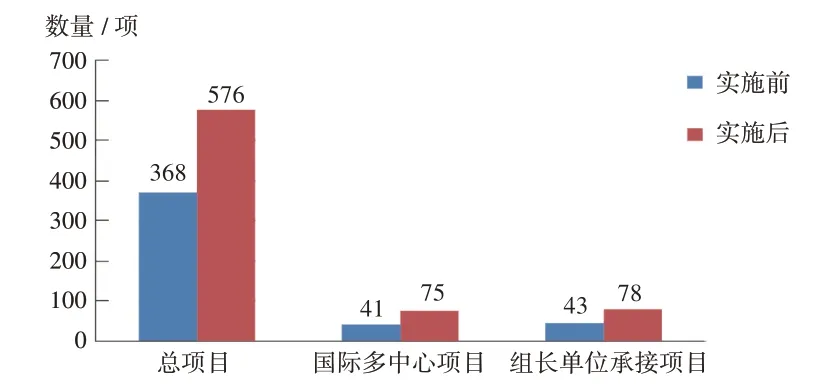
图2 备案制实施前后广西承接药物临床试验项目数量Fig.2 Number of drug clinical trial projects in Guangxi Zhuang Autonomous Region before and after the implementation of the record-keeping system
2.2.2 专业
备案制实施后全区承接的项目涵盖了内外妇儿中医共48个专业,与实施前(34个专业)比较覆盖面更广,但各专业间项目数量差异较大。4 年间肿瘤专业的临床试验项目数始终居首位,占总数的42.90%(增幅52.17%);内科大部分专业、妇科、耳鼻咽喉科、麻醉科、传染科项目数为20~40 项;33 个专业承接的项目数少于10项;有12个专业在4年间仅开展了1个项目;有16个专业4 年间未承接过项目,多集中在外科、儿科及中医科。详见表2。

表2 广西壮族自治区药物临床试验各专业承接项目数量Tab.2 Number of projects undertaken by each major of drug clinical trials in Guangxi Zhuang Autonomous Region
2.2.3 药物类型及试验分期
试验药物类型:化学药物类临床试验数量增长较快,其在备案制实施前后均占据主导地位(477 项,50.53%);生物制品类总数为427 项(45.23%),增加了77 项;中药/ 天然药物类较少(40 项,4.24%),仅增长6项。
试验分期:全区药物临床试验以Ⅲ期为主(513 项,54.34%),备案制实施后增长105项,增幅51.47%;Ⅱ期临床试验数量虽不占优势(25.42%),但增幅较大(100.00%);Ⅰ期创新药及BE 项目数量也稳步增长,其他分期和Ⅳ期项目数量分别占2.75%及2.54%,备案制实施后承接数量减少。详见图3。
2.2.4 申办者
药物临床试验申办者,位列前3的分别是江苏恒瑞医药股份有限公司(84 项)、正大天晴药业集团股份有限公司(41项)、复宏汉霖生物制药公司(38项)。2021年中国医药创新企业百强榜前两个梯队的50 家药企[5]发起了498 项药物临床试验(498/944,52.75%),国外药企发起85 项(9.00%)。全区本土仅发起两项,提示创新力有待提高。
3 讨论
3.1 广西壮族自治区药物临床试验改革情况
因备案制的实施,释放临床试验资源已初见成效,全区在借鉴邻近省份先进经验的基础上推陈出新,致力于激发各机构参与意识,构建良好的临床试验学术氛围,使备案制实施后承接项目数量和覆盖面均有较大改观,2021 年全区共12 家药物临床试验机构入榜全国药物临床试验质量管理规范(GCP)机构药物临床试验量值排行榜[6]。
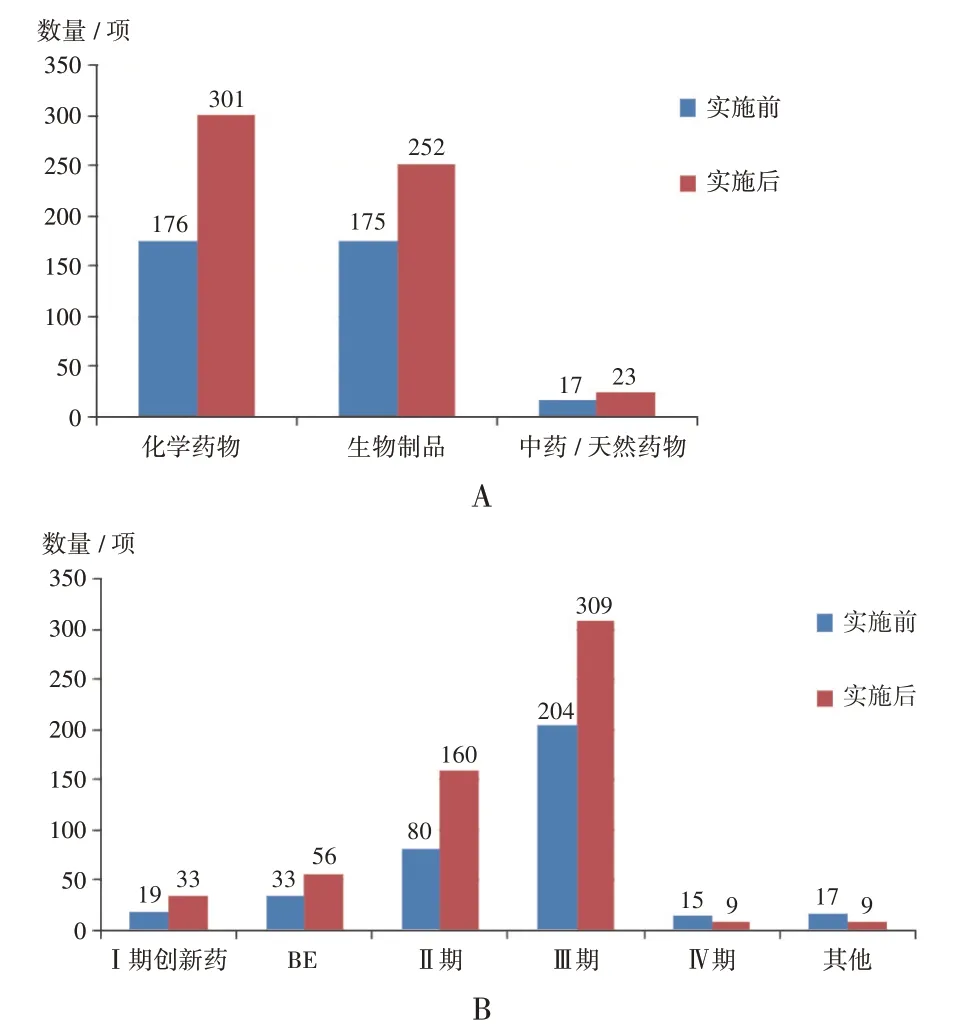
A.药物 B.试验分期图3 备案制实施前后广西承接药物临床试验的药物类型及试验分期A.Drug B.Stage of the trialFig.3 Drug types and trial stages of drug clinical trials in Guangxi Zhuang Autonomous Region before and after the imple⁃mentation of the record-keeping system
成立广西药物临床试验专业委员会:2020 年是备案制实施元年,在广西壮族自治区药品监督管理局的支持下,12 月11 日广西药学会药物临床试验专业委员会(简称专委会)成立。专委会成立以来,积极开展多种学术活动,以举办全区范围的药物临床试验培训、邀请业界专家讲座、学术报告的形式促进区内药物临床试验机构交流与协作,共享最新药物临床试验方法和信息,探讨在实际工作中遇到的各种问题,大幅提升了全区药物临床试验的能力。
建立多个国家药物临床试验培训进修基地:为满足全区药物临床试验系统化培训的实际需求,2021 年我区建立多个国家药物临床试验培训基地,填补了西南地区在该领域的空白,培训基地常年招收药物临床试验机构、伦理委员会及临床专业组学员,且不收取进修费用。据统计,2021年,完成进修的学员超60名,培养符合GCP 要求的研究者超30 名,实现了优质临床试验资源的最大化共享,提高了临床试验的规范化水平,有力推动了全区的新机构建设。
出台药物临床试验相关考核细则:为激励医疗机构参与生物医药研发,广西壮族自治区卫生健康委员会落实国家卫生健康委员会《三级医院评审标准(2020年版)》文件精神,将药物临床试验机构列为重点支持建设对象,出台《广西壮族自治区三级综合医院评审标准实施细则》[7],临床试验机构建设纳入三级甲等医院考核条款,“科研教学与图书管理”项总分11分,其中临床试验相关条款5分,将临床试验项目经费列入医疗机构每百人专业技术人员科研经费考核,提升了临床试验机构在医院建设中的地位。
3.2 不足与建议
近年来,尤其是备案制实施后,全区药物临床试验取得了长足发展,但目前仍存在不少问题。
临床试验资源发展不均衡:全区目前有5个城市备案了药物临床试验机构,在14 个下辖市中市场占有率为35.71%,大部分位于南宁市,柳州市及桂林市次之,机构分布情况与城市经济发展水平及地区累计生产总值成正比[8]。临床试验资源分布极不均衡,且药物临床试验机构除区疾控中心外均为三级医疗机构,仍是公立医院主战场,多元化临床试验资源体系尚未形成,临床试验资源发展失衡是很多地区在机构建设中遇到的不可避免的共性问题。备案制实施后,随着对临床试验认知程度的提升,鼓励符合条件的医疗机构积极进行药物临床试验机构备案的政策引导,以及现有机构对临床试验力量薄弱地区的引导和帮扶,相信局面会很快改善。
与发达省市横向比较,我区机构履职能力弱:广东省与我区毗邻,是开展药物临床试验最早的省份,截至2021年年底,广东省已备案药物临床试验机构108 家,是我区的5倍,近3年开展的项目超过2 000项,是我区的3倍。据统计,我区承接项目数在全国排名约22位[9],处于中下游水平。要提升我区临床试验核心竞争力,必须充分整合我区医疗资源,调动区内各家药物临床试验机构的力量。可借鉴日本的相关经验构建若干区域性分级药物临床试验机构体系,每个体系纳入三层试验机构,第一层是负责设计、管理和统筹药物临床试验的核心机构,第二层是进行高质量药物临床试验的执行机构,第三层是负责受试者招募和随访的基层药物临床试验机构[10]。各层机构各司其职,相互配合,可充分发挥各自优势,高效运转,解决目前机构超负荷运转或空置的问题,受试者的招募范围还可更广。目前,我国已经对Ⅰ期药物临床试验实行分类管理,在以验证性研究为基础的临床试验机构中选拔一批管理严格、技术规范的机构开展创新药物的探索性研究,形成Ⅰ期药物临床试验专业管理新格局[11]。
民族医药临床试验优势资源挖掘不充分:民族医药是我国中医药的重要组成部分,是各族人民与疾病斗争的智慧结晶,包括藏医、蒙医、苗医、壮医、瑶医、彝医等。我区地处南疆,独特的自然环境孕育了丰富的药材资源,是壮药、苗药、瑶药等民族药集中地[12],被称为中国的“天然药库”,为发展中医药产业特别是民族医药提供了有利条件。但我区尚无民族医学药物临床试验备案机构,被已有相关专业备案的蒙医和藏医逐渐拉开差距,壮苗瑶医药研发、产业化发展之路受到制约。建议设立中西部民族医药研发专项基金,扶持民族医院药物临床试验机构建设,打造具有广西壮族自治区民族特色的临床试验品牌,积极推动广西壮族自治区中医药产业规模发展。
缺乏职业化、专业化的药物临床试验专职技术人才队伍:备案制实施后,新政策更强调对药物临床试验项目质量的全过程监管,对研究者提出了更高要求,一项高质量的药物临床试验,其本质是涵盖了医学、药学、伦理学及统计学等多门学科的临床科研协作[13],需要建立一支复合型专业技术人才队伍,国家虽已出台相关文件,将临床试验能力作为创新型高科技产业内容给予支持[14],但药物临床试验机构在当前医疗体系的组织架构中并未以专业科室的形式进行单独管理,而是挂靠在药学部或教学科研部,工作人员职称晋升也无临床试验序列,还需按医学、药学、护理等序列执行,且在职务聘任、编制考核时与临床专业技术人员竞争处于弱势地位,导致人员流动频繁、人才流失严重,长此以往,不利于药物临床试验事业的可持续发展。针对此类行业共性问题,建议出台详细的技术指导细则,在医疗机构的科室设置中给予临床试验机构相应地位[15],并设置临床试验职称评审序列,以稳定和发展临床试验人才队伍。
当前正值我国药物创新改革的发力阶段,备案制的实施使药物临床试验机构得以在医药研发链上重新定位。国家与地方政府相继出台激励政策支持生物医药研发,在发展和建设临床试验机构过程中,只有始终秉持创新变革、协同发展理念,加强交流,不断提升眼界和能力,才能为助推“健康中国”战略作出更大贡献。

