不同类型桃果实内酯芳香物质构成与重要性评价
张圆圆,刘文敬,2,张斌斌,蔡志翔,宋宏峰,俞明亮,马瑞娟
不同类型桃果实内酯芳香物质构成与重要性评价

1江苏省农业科学院果树研究所/江苏省高效园艺作物遗传改良重点实验室,南京 210014;2江苏大学食品与生物工程学院,江苏镇江 212013
【目的】分析不同类型成熟桃果实的内酯芳香物质构成,并评价其对于桃果实芳香的重要性。【方法】以涵盖不同果肉质地、果肉颜色、果实成熟期等的多品种桃果实为试材,采用顶空固相微萃取-气相色谱质谱联用体系检测样品的芳香物质,通过精确的定性和定量分析,明确内酯芳香物质的构成,并结合芳香物质的气味活性值分析评价其重要性。【结果】内酯芳香物质存在于本研究全部桃品种的成熟果实中,样品中共检测到10种内酯芳香物质,包括-己内酯、-辛内酯、-庚内酯、-癸内酯、5-羟基-2, 4-癸二烯酸--内酯、-癸内酯、-十一内酯、-辛内酯、茉莉内酯、顺式-4-羟基-6-十二烯酸内酯。各内酯物质具有特定的气味属性,主要散发果香(桃/椰子)、甜香、奶油香、焦糖香、花香和草本味等气味。不同品种的桃果实共有的内酯物质是-己内酯,较为普遍存在的内酯物质包括-癸内酯和-癸内酯,部分品种存在特有的内酯物质,如‘深州蜜桃’果实中的顺式-4-羟基-6-十二烯酸内酯。果实成熟期时,溶质‘白花水蜜’‘深州蜜桃’‘橙香’‘奉化玉露(晚)’‘肥城红里大桃’等品种中检测到较多种类的内酯芳香物质,硬质‘霞脆’‘秦王’‘华玉’等品种果实具有较少种类的内酯芳香物质。气味活性值分析表明,由于极低的气味阈值和较高的物质含量,-癸内酯存在于大部分品种中,且对于这些品种桃香气的形成具有重要贡献,使溶质‘深州蜜桃’‘橙香’‘奉化玉露(晚)’‘白花水蜜’等品种果实均具有较为强烈的典型的桃香气味,溶质‘阿初桃’和硬质‘华玉’品种的典型桃果芳香较淡,而未检测到该内酯的硬质‘秦王’‘霞脆’品种果实则没有典型的桃果芳香。此外,-辛内酯使部分品种(本研究中为‘橙香’和‘深州蜜桃’)桃果实呈现更为强烈的椰果味和非常甜的气味。【结论】内酯是桃果实挥发性芳香物质的一个重要类别,桃果实内酯物质构成丰富,成熟果实至少包含10种内酯芳香物质。内酯物质类别和含量的差异是不同品种尤其是不同果肉质地的桃果实芳香特征的一个重要体现,而不同果肉颜色或成熟期品种的内酯芳香无显著差异。-己内酯是品种之间共有的内酯物质,-癸内酯和-癸内酯是品种之间较为普遍存在的内酯,顺式-4-羟基-6-十二烯酸内酯等是部分品种特有的内酯物质。-癸内酯和-辛内酯等内酯对于品种的典型桃香气以及独特芳香气味的形成具有重要贡献。
桃;芳香物质;内酯;气味活性值;芳香特征;果肉质地
0 引言
【研究意义】桃(L.)起源于中国,在中国已有数千年的栽培驯化历史,是具有重大经济价值和食用价值的世界性水果。桃果实的品质性状表现出丰富的多样性,其中芳香品质是一项重要构成。芳香物质通过与人们的嗅觉相互作用影响果实的气味,进而影响消费者偏好[1-3]。芳香物质的鉴别与评价对于果实芳香性状的挖掘、利用和改良具有重要意义。【前人研究进展】前人研究表明,桃果实的挥发性芳香物质多达百种,包括醇、酯、萜烯、内酯等类别[4-5]。一些种类的芳香物质对于桃果实芳香的形成具有重要贡献,其中内酯类物质-癸内酯赋予了果实“桃子样的芳香”,是桃果实重要的特征性芳香物质之一[6-9]。桃果实中同时存在其他内酯,如-辛内酯、-己内酯、-庚内酯、-十二内酯、-癸内酯、5-羟基-2, 4-癸二烯酸--内酯等,为桃果实带来愉悦的果香等气息[4,9-11]。Xi等[12]在采后温度贮藏的桃果实中检测到5种内酯物质,包括-己内酯、-辛内酯、-癸内酯、-癸内酯和-十二内酯。近年来研究逐步深入,已开展内酯物质对于桃果实芳香重要性的相关分析。贾惠娟等[13]对‘白凤’桃的研究表明-己内酯、-辛内酯、-癸内酯3种内酯物质与具有桃芳香风味的特性呈正相关,且-辛内酯和-癸内酯是影响桃风味的主要内酯成分。Eduardo等[8]指出-癸内酯在桃果实果香特征的形成中发挥较为重要的作用。对贮藏处理的桃果实进行感官评价,回归分析显示桃果实风味与-辛内酯、-癸内酯、-十二内酯的含量相关[14]。【本研究切入点】前人研究主要明确了部分内酯尤其是-癸内酯对于桃果实芳香的重要性,但较少关注成熟桃果实的其他内酯物质或评价其对于桃果实芳香形成的贡献。本研究选取不同果肉质地、果肉色泽、果实成熟期的普通桃品种,对成熟阶段果实的芳香物质开展精准的定性和定量分析,并使用气味活性值分析各内酯在品种中的芳香重要性。【拟解决的关键问题】明确不同类型成熟阶段桃果实的内酯芳香物质的构成,基于气味活性值分析评价其对于桃果实芳香的重要性,为桃果实芳香品质的形成和调控提供科学依据。
1 材料与方法
试验于2020年在江苏省农业科学院进行。
1.1 植物材料
本研究以16个品种的桃果实为试验材料:‘橙香’‘银花露’‘珲春桃3号’‘湖景蜜露’‘锦园’‘阿初桃’‘奉化玉露(晚)’‘白花水蜜’‘霞晖8号’‘晚硕蜜’‘深州蜜桃’‘肥城白里大桃’‘肥城红里大桃’‘霞脆’‘秦王’‘华玉’。其中‘肥城白里大桃’‘肥城红里大桃’果实取自山东肥城,‘深州蜜桃’果实取自河北深州,其余品种取自国家果树种质南京桃资源圃。成熟期的各品种果实于2020年采收,并于当天运抵实验室。选择大小和色泽一致,无机械伤的果实用于研究。每个生物学重复选取6个果实,设置3组生物学重复。中果皮部位切碎后速冻于液氮,样品存放于-80℃冰箱备用。
1.2 芳香物质检测
使用顶空固相微萃取气相色谱质谱联用仪(SPME-GC-MS)对本研究成熟阶段的桃果实样品进行芳香物质的检测[4]。样品于液氮中研磨均匀,称取5 g样品于样品瓶内,30℃水浴2 min。随后向样品瓶内依次加入4 mL饱和氯化钠溶液和10 μL 2-辛醇(0.0819 μg∙μL-1,作为内标),涡旋混匀。样品芳香物质由65 μm聚二甲基硅氧烷-二乙烯苯(PDMS- DVB)萃取头(Supelco,美国)进行顶空固相微萃取。首先样品瓶在500 r/min和40℃条件下预热平衡30 min,随后保持同样条件进行芳香物质的萃取,时间30 min。样品萃取完成后,萃取头在进样口以不分流模式解吸附5 min。使用气相色谱质谱联用仪(安捷伦,7890A)分析样品。分离色谱柱为DB-wax毛细管色谱柱(30 m×0.32 mm×0.25 μm;J&W Scientific,美国),载气为氦气,流速1.6 mL∙min-1。色谱柱温箱的升温程序设定如下:34℃保持2 min,以2℃∙min-1的速率升温至60℃,以5℃∙min-1的速率升温至220℃,保持2 min。进样口与MS离子源的温度设置分别为250℃和230℃。电离电势为70 eV,由5975C质谱仪(安捷伦,J&W,美国)记录,每秒7次扫描。通过与NIST-8质谱库(NIST/EPA/NIH,美国)以及芳香物质标准品(Sigma,美国)比对物质的离子图谱和保留时间进行芳香物质的鉴别,通过内标的峰面积进行物质相对含量的计算。
1.3 统计分析与图表制作
标准误差与LSD值由Microsoft excel 2019(Microsoft Corporation,Redmond,177 WA,USA)计算。气味活性值(odor activity value)是芳香物质的含量与该物质的气味阈值的比值,数值大于1的物质对于气味的产生有贡献,且数值越高贡献越大;气味阈值参考Burdock等[15]的方法,其中-己内酯为1 600 μg∙kg-1,-辛内酯为7 μg∙kg-1,-庚内酯为400 μg∙kg-1,-癸内酯为1 μg∙kg-1,5-羟基-2, 4-癸二烯酸--内酯为150 μg∙kg-1,-癸内酯为100 μg∙kg-1,-十一内酯为60 μg∙kg-1。使用Origin 8.0(Microcal Software Inc.,Northampton,MA,USA)作图。
2 结果
2.1 桃果实试材
选取成熟阶段的共16个品种的桃果实作为本研究的试验材料(图1)。
16个品种均为普通桃,果肉质地包含溶质和硬质两种类型,果实成熟期涵盖早、中、晚和极晚熟,果肉颜色包含白色和黄色两种(表1)。采集相应的成熟果实进行后续试验分析。
2.2 桃果实内酯分布
本研究成熟桃果实中共检测到10种内酯芳香物质:-己内酯、-辛内酯、-庚内酯、-癸内酯、5-羟基-2, 4-癸二烯酸--内酯、-癸内酯、-十一内酯、-辛内酯、茉莉内酯、顺式-4-羟基-6-十二烯酸内酯(表2)。
不同的内酯赋予桃果实不同的芳香特征,主要包括果香(桃/椰子)、甜香、奶油香、焦糖香、花香和草本味等气味[15]。-癸内酯、-癸内酯、-十一内酯、茉莉内酯具有桃或者类似桃的芳香;-己内酯、5-羟基-2, 4-癸二烯酸--内酯、-辛内酯、顺式-4-羟基-6-十二烯酸内酯等4种内酯均具有奶油香;椰香是内酯芳香物质之间具有较大共性的气味,包括-己内酯、-辛内酯、-庚内酯、-辛内酯、茉莉内酯等5种内酯。各内酯亦具有较为独特的气味特征,如-己内酯的烟草味,-庚内酯的草本味,5-羟基-2, 4-癸二烯酸--内酯的蘑菇味,-十一内酯较为辛辣的特征,-辛内酯的热带气味以及茉莉内酯的花香。

图1 桃果实试材图片
表1 桃果实试材
DAFB:盛花后天数 Days after full bloom

表2 本研究中桃果实的内酯芳香物质
本研究全部桃品种的成熟果实中均检测到了内酯芳香物质(表3)。内酯物质在不同品种中的分布与果肉质地存在紧密联系,而在不同果肉颜色或成熟期的品种间无显著差异。
检测到较多内酯的品种,如‘深州蜜桃’‘白花水蜜’‘奉化玉露(晚)’‘橙香’‘肥城红里大桃’等,均为溶质桃。溶质‘白花水蜜’和‘深州蜜桃’中检测到最多种类(9种)的内酯芳香物质,‘白花水蜜’中未检测到的内酯物质是顺式-4-羟基-6-十二烯酸内酯,而‘深州蜜桃’中未检测到的内酯物质是5-羟基-2, 4-癸二烯酸--内酯。硬质和部分果肉硬度较高的溶质桃果实含有较少种类的内酯芳香物质:硬质‘霞脆’和‘秦王’果实仅含有1种内酯芳香物质(-己内酯),硬质‘华玉’果实仅含有2种内酯芳香物质(-己内酯和-癸内酯),溶质‘霞晖8号’果实中仅检测到3种内酯芳香物质(-己内酯、-癸内酯和-癸内酯),‘阿初桃’果实内酯的分布与‘霞晖8号’相同。-己内酯是本研究品种之间唯一共有的内酯物质,-癸内酯存在于所有溶质和硬质‘华玉’果实中,δ-癸内酯存在于本研究全部的溶质品种中,茉莉内酯存在于除‘阿初桃’‘霞晖8号’‘晚硕蜜’之外的溶质品种中,顺式-4-羟基-6-十二烯酸内酯仅在溶质‘深州蜜桃’果实中检测到,是该品种特有的内酯物质。
黄肉‘橙香’果实的内酯种类丰富,仅次于白肉‘白花水蜜’和‘深州蜜桃’,含有除5-羟基-2, 4-癸二烯酸--内酯和顺式-4-羟基-6-十二烯酸内酯之外的8种内酯物质。‘橙香’与白肉‘奉化玉露(晚)’的内酯数目相同但类别有所区分,‘奉化玉露(晚)’含有5-羟基-2, 4-癸二烯酸--内酯,但未检测到-辛内酯。黄肉‘锦园’果实含有6种内酯物质,数目与白肉‘银花露’和‘晚硕蜜’相同,但3个品种的类别存在差异。‘锦园’果实中未检测到-十一内酯、-庚内酯、-辛内酯、顺式-4-羟基-6-十二烯酸内酯,‘银花露’果实中未检测到-辛内酯、-十一内酯、-辛内酯、顺式-4-羟基-6-十二烯酸内酯,而‘晚硕蜜’果实中未检测到茉莉内酯、-辛内酯、-庚内酯、顺式-4-羟基-6-十二烯酸内酯。
内酯物质的种类在不同成熟期,以及相同成熟期的不同品种果实中的分布均存在较大差异。早熟品种果实中检测到6—8种,中熟品种果实中检测到1—5种,晚熟品种果实中检测到1—9种,而极晚熟品种果实中检测到5—7种内酯物质。早熟‘橙香’和晚熟‘奉化玉露(晚)’分别检测到8种内酯芳香物质。极晚熟‘肥城红里大桃’检测到7种内酯芳香物质,比极晚熟‘肥城白里大桃’多检测到2种内酯物质—-十一内酯和-辛内酯。早熟‘银花露’、晚熟‘锦园’和晚熟‘晚硕蜜’果实中均检测到6种内酯芳香物质。

表3 桃果实的内酯分布
+:检测到;nd:未检测到
+: Present in the corresponding peach cultivar; nd: Not detected in the corresponding peach cultivar
2.3 桃果实内酯物质含量
如图2所示,‘深州蜜桃’是本研究中唯一含有顺式-4-羟基-6-十二烯酸内酯的品种,而其他内酯物质在品种之间均具有共性。在10种内酯芳香物质中,有8种的最高含量检测于‘深州蜜桃’果实,包括顺式-4-羟基-6-十二烯酸内酯(0.00333 µg∙g-1)、-辛内酯(0.00447 µg∙g-1)、-庚内酯(0.00421 µg∙g-1)、-辛内酯(0.0194 µg∙g-1)、茉莉内酯(0.00441 µg∙g-1)、-己内酯(0.0240 µg∙g-1)、-癸内酯(0.352 µg∙g-1)、-癸内酯(0.0744 µg∙g-1)。5-羟基-2, 4-癸二烯酸--内酯的最高含量检测于‘珲春桃3号’果实,为0.0193 µg∙g-1。所有内酯中含量最高的物质是-癸内酯。
本研究的硬质以及部分溶质品种果实的内酯芳香物质含量都显著较低。硬质‘华玉’‘秦王’‘霞脆’以及溶质‘阿初桃’和‘霞晖8号’果实中-己内酯的含量分别为0.00161、0.00236、0.000981、0.00322和0.00438 µg∙g-1,而其他溶质品种果实中该内酯的含量是上述含量的1.5—19.7倍。‘华玉’果实中-癸内酯的含量为0.00217 µg∙g-1,而溶质果实中该内酯的含量是其1.6—162.2倍。多数溶质果实,如‘深州蜜桃’‘白花水蜜’‘奉化玉露(晚)’‘橙香’‘肥城红里大桃’等的内酯含量均显著较高。
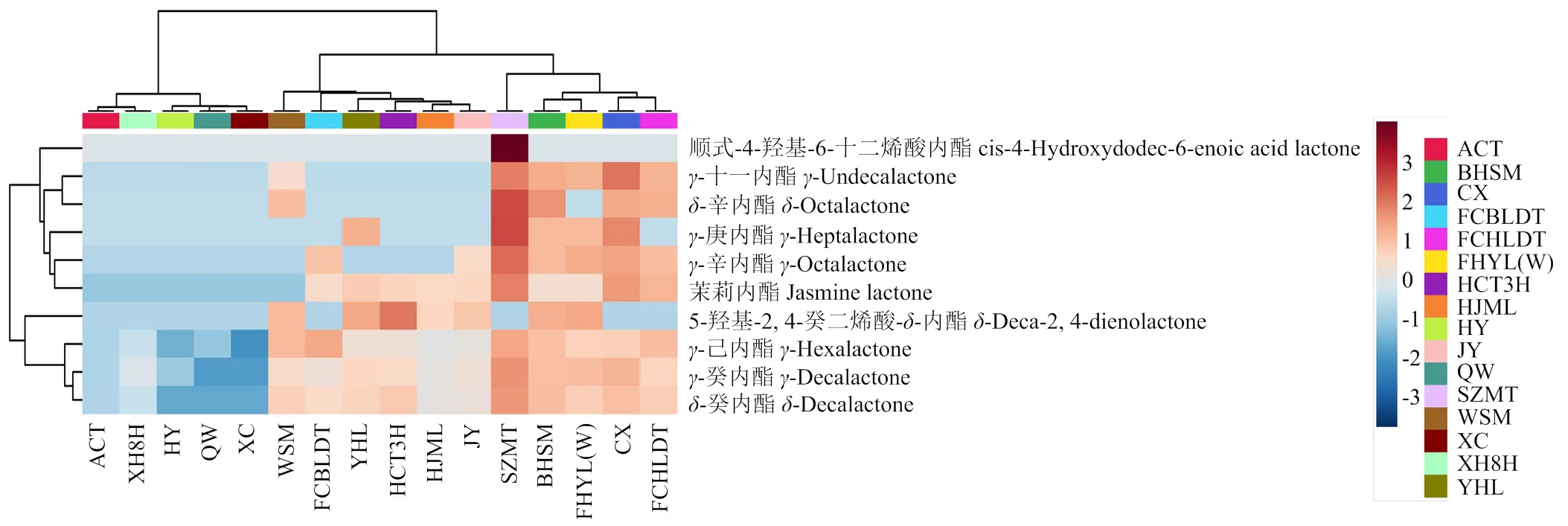
图2 桃果实内酯物质含量热图
内酯物质的含量在不同肉色的果实之间没有显著差异。相比白肉果实,黄肉‘橙香’果实含有最高含量的-十一内酯(0.0293 µg∙g-1),而黄肉‘锦园’果实中未检测到该内酯;‘橙香’果实中-辛内酯、-庚内酯、-辛内酯、茉莉内酯的含量都较高(分别为0.00130、0.00194、0.00784和0.00302 µg∙g-1),而‘锦园’果实中未检测到上述内酯或含量较低;‘锦园’果实中5-羟基-2, 4-癸二烯酸--内酯的含量居中,而‘橙香’果实中未检测到该内酯;两种黄肉果实中-己内酯、-庚内酯和-癸内酯的含量居中。
相较于其他成熟期的品种,中熟品种‘珲春桃3号’‘湖景蜜露’‘霞脆’果实中未检测到-十一内酯、-辛内酯、-庚内酯、-辛内酯。其他内酯物质含量在不同成熟期品种间没有显著差异。
2.4 桃果实内酯气味活性值分析与重要性评价
根据各内酯芳香物质的气味阈值及其在各品种果实中的含量,计算获得气味活性值并展开分析。本研究中气味活性值大于1的内酯物质有-辛内酯和-癸内酯两种(表4),相较于其他内酯,这两种内酯物质对于桃果实更具有芳香重要性。-辛内酯是黄肉‘橙香’果实和白肉‘深州蜜桃’果实的重要内酯物质(气味活性值>1),而在其他黄肉和白肉品种果实中的气味活性值均未达到1。-癸内酯是其他黄肉和除‘霞脆’‘秦王’之外的白肉品种果实中重要的内酯物质。在不同成熟期品种间,-辛内酯和-癸内酯的气味活性值分布无显著差异。
-辛内酯在‘橙香’和‘深州蜜桃’两种溶质桃果实中的气味活性值均大于1,且在‘深州蜜桃’果实中的气味活性值更高,赋予‘深州蜜桃’果实更为强烈的椰果味和非常甜的气味。-癸内酯在‘秦王’‘霞脆’两种硬质桃之外的所有品种果实中的气味活性值均大于1,对不同品种桃果实怡人的、果香的、桃子般的气味的形成发挥关键作用。比较各品种果实-癸内酯的气味活性值,可知溶质桃‘深州蜜桃’‘橙香’‘奉化玉露(晚)’‘白花水蜜’等品种果实均具有较为强烈的典型的桃香气息,溶质桃‘阿初桃’和硬质桃‘华玉’的桃香气息较淡,而未检测到该内酯的硬质桃‘秦王’‘霞脆’果实则没有典型的桃果芳香。

表4 桃果实内酯气味活性值
<:表示气味活性值小于1
<: The value of odor activity value was below 1
进一步比较上述两种重要内酯在不同品种桃果实中的含量。‘深州蜜桃’果实中两种内酯的含量均显著高于其他品种果实,-辛内酯含量为0.0194 µg∙g-1,-癸内酯含量为0.352 µg∙g-1,赋予该品种果实较为浓郁的甜香、桃香和椰子香味。‘深州蜜桃’之外共有6个品种的果实中检测到-辛内酯,其中‘橙香’果实中该内酯的气味活性值大于1,物质含量的平均值为0.00784 µg∙g-1。硬质桃3个品种的果实中均未检测到-辛内酯(图3)。‘秦王’‘霞脆’之外的其他品种果实中均检测到-癸内酯,且气味活性值均大于1。部分品种果实中-癸内酯的含量较低,如‘阿初桃’果实的-癸内酯含量均值为0.0034 µg∙g-1,硬质桃‘华玉’果实的-癸内酯含量均值为0.0022 µg∙g-1,但气味活性值大于1表明该内酯对于果实的桃香气味仍发挥作用。

误差为3个生物学重复的计算值,LSD值为P=0.05的计算值
3 讨论
3.1 气味活性值在果实重要芳香物质鉴别中的应用
气味活性值在芳香活性物质的鉴别中受到广泛关注。在墨西哥本地果实choch(Standley)中,Pino等[16]通过气味活性值分析确认了6种气味活性值大于1的芳香物质,其中气味活性值最高的物质为反-3-戊烯-2-酮,其他重要的气味活性化合物包括反-β-石竹烯、3-甲硫基丙醛、3-甲基丁醛等。Kim等[17]报道了五味子(Baillon)果实中2种高气味活性值的芳香物质,4-松油醇和-萜品醇。Liu等[18]分析了不同品种芒果果实的芳香特征,通过气味活性值分析,在‘Jinmang’‘Qingmang’‘Guifei’‘Hongyu’‘Tainong’果实中分别鉴定获得11、9、9、8、17种芳香物质对于相应品种的整体芳香具有重要贡献。Niu等[19]基于感官分析等综合策略鉴别出‘Yulu’桃的主要芳香物质,并在此基础上使用气味活性值分析其中最为重要的芳香物质。
本研究分析了内酯在各品种桃果实中的气味活性值,明确了-癸内酯和-辛内酯两种内酯物质在特定品种桃果实中的重要性。-癸内酯具有极低的气味阈值,使得该物质即使在较低含量水平下也可贡献桃的芳香,如‘华玉’果实的γ-癸内酯含量仅为0.0022 µg∙g-1,可知-癸内酯对于不同桃品种形成一样的芳香具有普遍重要性。相较而言,其他内酯可能含量较高但并未呈现较高的气味活性,如‘肥城红里大桃’中-辛内酯含量达到0.0045 µg∙g-1,但气味活性值小于1;-己内酯是本研究所有品种之间共有的内酯物质,如‘白花水蜜’中-己内酯含量达到0.0160 µg∙g-1,但由于其气味阈值较高,在所有品种中的气味活性值均未达到1。除了对于大部分品种具有普遍重要性的内酯物质,桃果实芳香中也存在对于特定品种具有芳香重要性的内酯物质,如本研究中‘橙香’和‘深州蜜桃’果实的-辛内酯。-辛内酯在桃之外的诸多果实中具有芳香重要性。Yilmaztekin[20]通过气味活性值对灯笼果(L.)果实的有效香气化合物展开分析,发现在果肉的芳香物质中,-辛内酯的气味活性值达46.9,对于果实的芳香具有最大的贡献。葡萄品种‘小芒森’(L.)在半甜葡萄酒和甜葡萄酒的生产中广受欢迎,其中-辛内酯对于‘小芒森’甜葡萄酒的香气具有重要影响[21]。
3.2 不同肉色果实的芳香物质
较多研究关注不同肉色果实的芳香物质差异,如番茄[22-23]、西瓜[23]、枇杷[24]、柑橘[25]等。Vogel等[22]和Lewinsohn等[23]的研究表明不同肉色的番茄和西瓜中芳香物质的差异积累具有相似性:含-胡萝卜素的番茄和西瓜的芳香物质主要是-紫罗兰酮、二氢猕猴桃内酯、-环柠檬醛,黄肉番茄突变体和黄肉西瓜品种‘Early Moonbeam’中没有降异戊二烯衍生物和香叶醛;与‘Ailsa Craig’番茄相比较,肉色突变体、、中的类胡萝卜素衍生芳香物质的含量发生了改变,包括-紫罗兰酮、香叶基丙酮、香叶醛、6-甲基-5-庚烯-2-酮等。Sun等[24]比较了白肉和红肉枇杷的芳香物质,发现仅可在红肉品种中检测到-紫罗兰酮和-环柠檬醛,白肉品种‘Huayu Seedless 1’的萜烯物质含量低于其他品种,白肉枇杷相较于红肉具有更高含量的醛类物质。Li等[25]分析了‘Niurouhong’橘子以及肉色改变的野生突变体‘Zhuhongju’的芳香物质,发现‘Niurouhong’果实萜烯类芳香物质的总含量是‘Zhuhongju’的1.27倍,且二者迥异的香气与-柠檬醛、-柠檬醛、2-环己烯-1-酮等物质的含量差异相关。
色泽与芳香也是桃果实研究的热点[26-29],但其中涉及内酯物质比较的研究相对较少。本研究中黄肉和白肉桃果实的内酯芳香物质并未呈现显著差异,这与严娟等[30]利用电子鼻技术分析不同肉色桃果实香气的结论相一致。严娟等[30]对获得的电子鼻传感器响应值开展数据分析,发现线性判别法无法区分不同肉色的桃,各传感器响应值差异不显著。朱运钦等[29]分析了黄肉和白肉油桃果实的芳香物质,表明白肉油桃品种‘中油桃9号’和黄肉突变体果实在成熟期具有较大的香气成分差异,黄肉突变体含有特有的内酯物质5-乙基呋喃酮内酯。此外,有研究指出红肉和白肉桃果实的芳香物质包括内酯物质的含量存在差异,-己内酯在红肉品种中的含量更高[27]。
3.3 不同质地果实芳香物质的差异
相较于果肉色泽和品种的成熟期,本研究显示内酯芳香物质的构成和含量在溶质桃与硬质桃果实之间差异显著,溶质桃品种倾向于含有更为丰富的内酯芳香物质。‘霞晖8号’是本研究的溶质桃中少有的内酯物质种类较少且含量低的品种,该品种的果肉硬度高[31-32]。本研究中‘阿初桃’的内酯物质含量较低的结果与Peng等[33]的试验结果一致,该品种在前期研究中用于分析桃果实低-癸内酯积累的分子机制。硬质是由Yoshida[34]报道的一种肉质类型,桃果实在成熟期及采后均不变软[34]。根据Pan等[35]、曾文芳等[36]和Tatsuki等[37]的报道,桃硬质性状的形成是由于其催化合成生长素的一个关键酶基因(类黄素单加氧酶基因)的启动子区域相比溶质桃具有转座子插入,从而导致生长素的合成受阻以至无法诱导乙烯的合成。生长素和乙烯决定了桃果实的成熟进程,而内酯的合成与果实成熟密切相关,基于本研究中溶质桃和硬质桃果实的内酯物质具有极大差异的结果,认为内酯的合成可能与生长素和乙烯的作用密切相关,可以作为后续研究的重点。
芳香物质在不同肉质桃之间的差异不仅存在于成熟果实阶段。根据范霞等[38]的研究,在采后贮藏期间不同肉质桃挥发性风味物质的发展变化也存在差异:20℃的采后贮藏期间,硬质‘霞脆’检测到最多种类的芳香物质,溶质‘霞晖6号’检测到中等数目的芳香物质,而‘湖景蜜露’检测到最少种类的芳香物质。在其他果实中也有研究讨论果肉质地与芳香物质之间的关系。以苹果果实为例,‘乔纳金’及其脆肉芽变果实的各类挥发性化合物的种类数目与含量都存在明显差异[39]。基于本研究的结果,后续可深入解析果实肉质与芳香特性之间的紧密联系,为不同肉质桃品种的芳香性状的形成和调控提供理论依据。
4 结论
成熟桃果实内酯芳香物质丰富,含有-己内酯、-辛内酯、-庚内酯、-癸内酯、5-羟基-2, 4-癸二烯酸--内酯、-癸内酯、-十一内酯、-辛内酯、茉莉内酯、顺式-4-羟基-6-十二烯酸内酯等。品种之间共有的内酯物质是-己内酯,较为普遍存在的内酯物质包括-癸内酯和-癸内酯等,部分品种存在特有的内酯物质,如‘深州蜜桃’果实含有顺式-4-羟基-6-十二烯酸内酯。溶质桃与硬质桃果实内酯物质的类别和含量呈现显著差异,溶质桃倾向于含有更多种类和更高含量的内酯物质,体现了不同质地果实差异化的芳香特征。内酯在不同肉色和不同成熟期品种的果实之间没有呈现显著的差异。通过气味活性值分析特定桃品种的内酯构成可以明确重要的内酯物质,如-癸内酯和-辛内酯对于果实典型桃香气息和独特芳香特征的形成发挥着重要作用。
[1] STEINGASS C B, DELL C, LIEB V, MAYER-ULLMANN B, CZERNY M, CARLE R. Assignment of distinctive volatiles, descriptive sensory analysis and consumer preference of differently ripened and post-harvest handled pineapple ([L.] Merr.) fruits. European Food Research and Technology, 2016, 242(1): 33-43. doi: 10.1007/s00217-015-2515-x.
[2] LIANG Z J, FANG Z X, PAI A, LUO J Q, GAN R Y, GAO Y, LU J, ZHANG P Z. Glycosidically bound aroma precursors in fruits: a comprehensive review. Critical Reviews in Food Science and Nutrition, 2022, 62(1): 215-243. doi: 10.1080/10408398.2020. 1813684.
[3] FAN Z, HASING T, JOHNSON T S, GARNER D M, BARBEY C R, COLQUHOUN T A, SIMS C A, RESENDE M F R, WHITAKER V M. Strawberry sweetness and consumer preference are enhanced by specific volatile compounds. Horticulture Research, 2021, 8: 66.
[4] ZHANG B, SHEN J Y, WEI W W, XI W P, XU C J, FERGUSON I, CHEN K S. Expression of genes associated with aroma formation derived from the fatty acid pathway during peach fruit ripening. Journal of Agricultural and Food Chemistry, 2010, 58: 6157-6165.
[5] LI X W, JIANG J, ZHANG L P, YU Y, YE Z W, WANG X M, ZHOU J Y, CHAI M L, ZHANG H Q, ARÚS P, JIA H J, GAO Z S. Identification of volatile and softening-related genes using digital gene expression profiles in melting peach. Tree Genetics & Genomes, 2015, 11(4): 1-15. doi: 10.1007/s11295-015-0891-9.
[6] HORVAT R J, CHAPMAN G W, ROBERTSON J A, MEREDITH F I, SCORZA R, CALLAHAN A M, MORGENS P. Comparison of the volatile compounds from several commercial peach cultivars. Journal of Agricultural and Food Chemistry, 1990, 38(1): 234-237. doi: 10.1021/jf00091a051.
[7] JIA H J, OCAMOTO J. Distribution of volatile compounds in peach fruit. Journal of the Japanese Society for Horticultural Science, 2001, 70: 223-225.
[8] EDUARDO I, CHIETERA G, BASSI D, ROSSINI L, VECCHIETTI A. Identification of key odor volatile compounds in the essential oil of nine peach accessions. Journal of the Science of Food and Agricultural, 2010, 90: 1146-1154.
[9] SÁNCHEZ G, BESADA C, BADENES M L, MONFORTE A J, GRANELL A. A non-targeted approach unravels the volatile network in peach fruit. PLoS One, 2012, 7: e38992.
[10] AUBERT C, MILHET C. Distribution of the volatile compounds in the different parts of a white-fleshed peach (L. Batsch). Food Chemistry, 2007, 102: 375-384.
[11] WANG Y J, YANG C X, LI S H, YANG L, WANG Y N, ZHAO J B, JIANG Q. Volatile characteristics of 50 peaches and nectarines evaluated by HP-SPME with GC-MS. Food Chemistry, 2009, 116: 356-364.
[12] XI W P, ZHANG B, LIANG L, SHEN J Y, WEI W W, XU C J, ALLAN A C, FERGUSON I B, CHEN K S. Postharvest temperature influences volatile lactone production via regulation of acyl-CoA oxidases in peach fruit. Plant, Cell and Environment, 2012, 35(3): 534-545.
[13] 贾惠娟, 冈本五郎, 平野健. 桃果实品质形成成分与其风味之间的相关性. 果树学报, 2004, 21(1): 5-10. doi: 10.3969/j.issn.1009-9980. 2004.01.002.
JIA H J, Okamoto G, PING Y J. Studies on the sensory evaluation of juice constituents of peach fruit. Journal of Fruit Science, 2004, 21(1): 5-10. doi:10.3969/j.issn.1009-9980.2004.01.002. (in Chinese)
[14] CANO-SALAZAR J, LóPEZ M L, ECHEVERRíA G. Relationships between the instrumental and sensory characteristics of four peach and nectarine cultivars stored under air and CA atmospheres. Postharvest Biology and Technology, 2013, 75: 58-67.
[15] BURDOCK G A. Fenaroli's handbook of flavor ingredients (6th ed.). CRC PRESS, TALOR & Francis Group. 2010.
[16] PINO J, MOO-HUCHIN V, SOSA-MOGUEL O, SAURI-DUCH E, CUEVAS-GLORY L. Characterization of aroma-active compounds in choch (Standley) fruit. International Journal of Food Properties, 2017, 20: S444-S448. doi: 10.1080/10942912.2017. 1297954.
[17] KIM M K, JANG H W, LEE K G. Characterization of key aroma-activecompounds isolated from omija fruit treated differently based on odor activity values and descriptive sensory analysis. Foods, 2020, 9: 638.
[18] LIU H C, AN K J, SU S Q, YU Y S, WU J J, XIAO G S, XU Y J. Aromatic characterization of mangoes (L.) using solid phase extraction coupled with Gas Chromatography-Mass Spectrometry and olfactometry and sensory analyses. Foods, 2020, 9: 75.
[19] NIU Y M, DENG J M, XIAO Z B, ZHU J C. Characterization of the major aroma-active compounds in peach (L. Batsch) by gas chromatography-olfactometry, flame photometric detection and molecular sensory science approaches. Food Research International, 2021, 147: 110457.
[20] YILMAZTEKIN M. Characterization of potent aroma compounds of cape gooseberry (L.) fruits grown in Antalya through the determination of odor activity values. International Journal of Food Properties, 2014, 17(3): 469-480. doi: 10.1080/ 10942912.2011.642446.
[21] LAN Y B, GUO J X, QIAN X, ZHU B Q, SHI Y, WU GF, DUAN C Q. Characterization of key odor-active compounds in sweet Petit Manseng (L.) wine by gas chromatography-olfactometry, aroma reconstitution, and omission tests.Journal of Food Science, 2021, 86: 1258-1272.
[22] VOGEL J T, TIEMAN D M, SIMS C A, ODABASI A Z, CLARK D G, KLEE H J. Carotenoid content impacts flavor acceptability in tomato (). Journal of the Science of Food and Agriculture, 2010, 90: 2233-2240.
[23] LEWINSOHN E, SITRIT Y, BAR E, AZULAY Y, MEIR A, ZAMIR D, TADMOR Y. Carotenoid pigmentation affects the volatile composition of tomato and watermelon fruits, as revealed by comparative genetic analyses. Journal of Agricultural and Food Chemistry, 2005, 53(8): 3142-3148. doi: 10.1021/jf047927t.
[24] SUN H Y, CHEN W W, JIANG Y, HE Q, LI X L, GUO Q G, XIANG S Q, XI W P, LIANG G L. Characterization of volatiles in red- and white-fleshed loquat () fruits by electronic nose and headspace solid-phase microextraction with gas chromatography- mass spectrometry. Food Science and Technology, 2020, 40: 21-32. doi: 10.1590/fst.27318.
[25] LI W Y, LIU C H, HE M, LI J Q, CAI Y Q, MA Y H, XU J. Largely different contents of terpenoids in beef red-flesh tangerine and its wild type. BMC Plant Biology, 2017, 17: 36.
[26] RAFFO A, NARDO N, TABILIO M R, PAOLETTI F. Effects of cold storage on aroma compounds of white- and yellow-fleshed peaches. European Food Research and Technology, 2008, 226(6): 1503-1512. doi: 10.1007/s00217-007-0682-0.
[27] XIN R, LIU X H, WEI C Y, YANG C, LIU H R, CAO X M, WU D, ZHANG B, CHEN K S. E-Nose and GC-MS reveal a difference in the volatile profiles of white- and red-fleshed peach fruit. Sensors (Basel), 2018, 18: 765.
[28] 周慧娟, 杜纪红, 苏明申, 陈翅宏, 张夏南, 叶正文, 李雄伟. 水蜜桃果皮中色素和芳香物质变化与其内在品质的相关性. 经济林研究, 2019, 37(1): 1-10. doi: 10.14067/j.cnki.1003-8981.2019.01.001.
ZHOU H J, DU J H, SU M S, CHEN C H, ZHANG X N, YE Z W, LI X W. Relationship of content changes of pigments and aromatic compounds in pericarp with internal quality of honey peach fruits. Non-Wood Forest Research, 2019, 37(1): 1-10. doi: 10.14067/j.cnki. 1003-8981.2019.01.001. (in Chinese)
[29] 朱运钦, 李庆伟, 曾文芳, 牛良, 潘磊, 蔡祖国, 鲁振华, 崔国朝, 王志强. 白肉型油桃中油桃9号及其黄肉芽变的挥发性香气物质分析. 江苏农业科学, 2018, 46(13): 172-177. doi: 10.15889/j.issn. 1002-1302.2018.13.041.
ZHU Y Q, LI Q W, ZENG W F, NIU L, PAN L, CAI Z G, LU Z H, CUI G C, WANG Z Q. Analysis of volatile aromatic compounds of CN9 nectarine and its yellow-fleshed mutant. Jiangsu Agricultural Sciences, 2018, 46(13): 172-177. doi: 10.15889/j.issn.1002-1302.2018. 13.041. (in Chinese)
[30] 严娟, 蔡志翔, 张明昊, 徐子媛, 沈志军, 马瑞娟, 俞明亮. 利用电子鼻评价桃果实香气. 植物遗传资源学报, 2021, 22(1): 274-282. doi: 10.13430/j.cnki.jpgr.20200616002.
YAN J, CAI Z X, ZHANG M H, XU Z Y, SHEN Z J, MA R J, YU M L. Evaluation of aroma in peach fruit by electronic nose. Journal of Plant Genetic Resources, 2021, 22(1): 274-282. doi: 10.13430/j.cnki. jpgr.20200616002. (in Chinese)
[31] 俞明亮, 马瑞娟, 许建兰, 沈志军, 宋宏峰, 蔡志翔, 张妤艳, 张斌斌, 杜平. 晚熟桃新品种‘霞晖8号’. 园艺学报, 2014, 41(3): 593-594. doi: 10.16420/j.issn.0513-353x.2014.03.020.
YU M L, MA R J, XU J L, SHEN Z J, SONG H F, CAI Z X, ZHANG Y Y, ZHANG B B, DU P. A new late-ripening peach cultivar ‘Xiahui 8’. Acta Horticulturae Sinica, 2014, 41(3): 593-594. doi: 10.16420/ j.issn.0513-353x.2014.03.020. (in Chinese)
[32] 侯佳迪, 朱丽娟, 王军萍, 刘少伟, 郁志芳. 1-MCP处理期不同成熟度‘霞晖8号’桃果实贮藏中品质和生理生化特性的影响. 食品工业科技, 2021, 42(17): 326-334. doi: 10.13386/j.issn1002-0306. 2020110201.
HOU J D, ZHU L J, WANG J P, LIU S W, YU Z F. Effect of 1-MCP on peach fruit quality and physio-biochemical characteristics of ‘Xiahui 8’ with different maturity during storage. Science and Technology of Food Industry, 2021, 42(17): 326-334. doi: 10.13386/j. issn1002-0306.2020110201. (in Chinese)
[33] PENG B, YU M L, ZHANG B B, XU J L, MA R J. Differences in PpAAT1 activity in high- and low-aroma peach varieties affect γ-decalactone Production1. Plant Physiology, 2020, 182(4): 2065- 2080. doi:10.1104/pp.19.00964.
[34] YOSHIDA M. Genetical studies on the fruit quality of peach varieties. 3: Texture and keeping quality. Bulletin of the fruit tree research station. Series A. Hiratsuka, 1976.
[35] PAN L, ZENG W F, NIU L, LU Z H, WANG X B, LIU H, CUI G C, ZHU Y Q, CHU J F, LI W P, FANG W C, CAI Z G, LI G H, WANG Z Q., a strong candidate gene for the stony hard phenotype in peach (L. Batsch), participates in IAA biosynthesis during fruit ripening. Journal of Experimental Botany, 2015, 66: 7031-7044.
[36] 曾文芳, 丁义峰, 潘磊, 王小贝, 牛良, 鲁振华, 崔国朝, 王志强. 桃硬质性状可能源于基因启动子区域CACTA型转座子的插入. 果树学报, 2017, 34(10): 1239-1248. doi: 10.13925/j.cnki. gsxb.20170060.
ZENG W F, DING Y F, PAN L, WANG X B, NIU L, LU Z H, CUI G C, WANG Z Q. A CACTA transposable element in agene promoter is associated with the stony hard phenotype in peach. Journal of Fruit Science, 2017, 34(10): 1239-1248. doi: 10.13925 /j.cnki.gsxb.20170060. (in Chinese)
[37] TATSUKI M, SOENO K, SHIMADA Y, SAWAMURA Y, SUESADA Y, YAEGAKI H, SATO A, KAKEI Y, NAKAMURA A, BAI S, MORIGUCHI T, NAKAJIMA N. Insertion of a transposon-like sequence in the 5'-flanking region of thegene causes the stony hard phenotype. Plant Journal, 2018, 96: 815-827.
[38] 范霞, 崔心平. 基于HS-SPME-GC-MS和电子鼻技术研究不同肉质桃子采后贮藏期的香气成分. 食品科学, 2021, 42(20): 222-229. doi: 10.7506/spkx1002-6630-20201026-261.
FAN X, CUI X P. Analysis of aroma compounds of different peach flesh types during postharvest storage by headspace solid-phase microextraction combined with gas chromatography-mass spectrometry and electronic nose. Food Science, 2021, 42(20): 222-229. doi: 10.7506/spkx1002-6630-20201026-261. (in Chinese)
[39] 陈学森, 宋君, 高利平, 冀晓昊, 张宗营, 毛志泉, 张艳敏, 刘大亮, 张芮, 李敏. ‘乔纳金’苹果及其脆肉芽变果实质地发育机理. 中国农业科学, 2014, 47(4): 727-735. doi: 10.3864/j.issn.0578-1752.2014. 04.013.
CHEN X S, SONG J, GAO L P, JI X H, ZHANG Z Y, MAO Z Q, ZHANG Y M, LIU D L, ZHANG R, LI M. Developing mechanism of fruits texture in ‘jonagold’ apple and its crisp flesh sport. Scientia Agricultura Sinica, 2014, 47(4): 727-735. doi: 10.3864/j.issn.0578- 1752.2014.04.013. (in Chinese)
Characterization of the Lactone Volatile Compounds in Different Types of Peach (L.) Fruit and Evaluations of Their Contributions to Fruit Overall Aroma

1Institute of Pomology, Jiangsu Academy of Agricultural Sciences/Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement, Nanjing 210014;2School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, Jiangsu
【Objective】 The objective of this study was to conduct a systematical analysis of the lactone volatile compounds in different types of ripe peach fruit (L.) and to evaluate the contributions of each lactone compound to peach fruit aroma. 【Method】 Multiple peach cultivars with different flesh textures, flesh colors and fruit growth periods were used in this study. The gas chromatography-mass spectrometry system was employed to identify and quantify the lactone volatile compounds in peach fruit, and the odor activity value was used to evaluate the contributions of each lactone compound to the fruit aroma of respective cultivars. 【Result】 Lactone volatile compounds were detected in ripe fruit of all peach cultivars, and a total of ten lactone volatile compounds were identified in peach fruit, including-hexalactone,-octalactone,-heptalactone,-decalactone,-deca-2, 4-dienolactone,-decalactone,-undecalactone,-octalactone, jasmine lactone, and cis-4-hydroxydodec-6-enoic acid lactone. Each lactone compound was of specific odor notes, and the lactone compounds predominantly emit fruity (reminiscent of coconut and peach), sweet, dairy, caramel, floral, and herbaceous smells. The common lactone compound shared by all cultivars was-hexalactone, the frequently detected lactone compounds were-decalactone and-decalactone, and some lactone compounds were specific to individual cultivars, such as cis-4-hydroxydodec-6-enoic acid lactone in Shenzhoumitao. Relatively higher numbers of lactone volatile compounds were detected in ripe fruit of melting peach cultivars, including Baihuashuimi, Shenzhoumitao, Chengxiang, Fenghuayulu (wan), and Feichenghonglidatao, while the lower numbers of lactone volatile compounds were present in stony hard peach cultivars including Xiacui, Qinwang and Huayu. The analysis of the odor activity values of the lactone volatile compounds revealed the universal contribution of-decalactone to the aroma of the majority of cultivars due to its low odor threshold value and high concentrations in fruit.-Decalactone conferred the strong characteristic peach-like odor to melting peach cultivars, including Shenzhoumitao, Chengxiang, Fenghuayulu (wan), and Baihuashuimi, while plain peach-like odor was observed in melting peach Achutao and stony hard peach Huayu due to the lower odor activity values of-decalactone, and the characteristic peach-like odor note was absent in stony hard peach Qinwang and Xiacui fruit as no-decalactone was detected. Besides,-octalactone contributed to the coconut and very sweet odors of specific cultivars, such as Chengxiang and Shenzhoumitao. 【Conclusion】 Lactones constituted an essential chemical group of the volatile compounds of peach fruit, and the mature peach fruit presented at least ten lactone volatile compounds. Various lactone volatile compounds and their different concentrations showed the aroma characteristics of different types of peach cultivars, especially the cultivars of different flesh textures, while not the ones of different flesh colors or fruit growth periods.-Hexalactone was the common lactone shared by all cultivars,-decalactone and-decalactone were frequently detected lactone compounds, and cis-4-hydroxydodec-6-enoic acid lactone and other lactones were specific to individual cultivars.-Decalactone,-octalactone and other lactones made important contributions to the characteristic peach-like odor and other unique odor notes in different peach cultivars.
peach; volatile compounds; lactones; odor activity values; aroma characteristics; flesh textures
2021-09-07;
2022-01-21
国家自然科学基金(32002020)、现代农业产业技术体系建设专项资金(CARS-30)、江苏省重大品种创制(PZCZ201727)
张圆圆,E-mail:20190021@jaas.ac.cn。通信作者马瑞娟,Fax:86-25-84391695;E-mail:marj311@163.com
10.3864/j.issn.0578-1752.2022.10.012
(责任编辑 赵伶俐)

