Alteromonas macleodii木聚糖酶XynZT-3序列分析及表达研究
石嘉宁, 徐 佳, 孔梦圆, 王宁宁, 田艳杰, 崔彩霞, 周晨妍
新乡医学院生命科学技术学院河南省合成生物学工程实验室,河南新乡 453003
在自然界的可再生资源中,木聚糖的含量仅次于纤维素[1-2]。作为半纤维素主要组成成分的木聚糖,由于其结构复杂,在自然条件下很难降解,它的降解需要多种酶的共同参与。木聚糖酶主要存在于植物、动物和微生物中,木聚糖酶通过随机的方式作用于木聚糖主链,将其降解为木糖和低聚木糖[3-6]。木聚糖酶在许多行业都有广泛的应用,包括食品工业[7-9]、动物饲料生产[10]和纸浆生物漂白[11-12]等。
CAZy数据库(http://www.cazy.org)分析显示,在糖苷水解酶(GH)第62、51、43、11、10、9、5等家族均有归类的木聚糖酶[13-14]。不同家族木聚糖酶在结构、酶学性质及适用领域上均存在较大差异[15],其中GH10家族由一个催化结构域和一个纤维素结合结构域组成,该结构域由pI在8.0~9.5之间的连接肽连接,在结构上呈“桶状”结构。
麦氏交替单胞菌(Alteromonas macleodii)是本实验室在烟台近海分离出的一株海洋微生物,课题组从麦氏交替单胞菌基因组中分析到木聚糖酶XynZT-3基因的存在,已将该基因序列在Genbank登录,登录编号为MT 814 837。本研究对木聚糖酶XynZT-3基因进行生物信息学分析及相应的表达条件优化,以期为该酶的进一步研究奠定基础。
1 材料与方法
1.1 材料与试剂
Alteromonas macleodii(麦氏交替单胞菌)HY35由实验室保存,克隆宿主Escherichia coli(大肠杆菌)DH5α购自Novagen公司,Pichia pastoris(毕赤酵母)GS115及pPIC9K表达质粒购买于Invitrogen公司。
T4DNA连接酶、限制性内切酶、E×Taq DNA聚合酶、DNA Marker、异丙基-β-D-硫代半乳糖糖苷(IPTG):TaKaRa生物技术有限公司;SanPrep柱式DNA胶回收试剂盒及DNA小量抽提试剂盒、卡那霉素:上海生工生物工程有限公司;根据Invitrogen公司毕赤酵母操作手册配制酵母培养基BMMY、BMGY、YPD、MD。
Tprofessional 96 PCR分析仪:德国Biometra公司;稳压稳流电泳仪(DYY-2):北京市六一仪器厂;电转化仪(GenePulserII):美国BIO-RAD公司;紫外可见分光光度计UV759:上海佑科仪器仪表有限公司低温恒温槽(DC-0506):上海比朗仪器有限公司。
1.2 序列分析
查阅网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)对酶蛋白二级结构进行预测。利用网站(https://swissmodel.expasy.org/)对酶蛋白三维结构进行预测。通过网站(http://pfam.xfam.org/search/#tabview=tab1)预测基因结构域。采用软件DNAMAN 9.0绘制进化树、分析同源序列。通过网站(https://web.expasy.org/protparam/)理论等电点常数(pI)和计算分子量(MW),利用NetNGlyc1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)对潜在的糖基化位点进行预测。
1.3 密码子优化及目的基因合成
不同物种对密码子的使用频率不同,为了将目的基因后期能在毕赤酵母中较好表达,通过网站(http://www.jcat.de/)对木聚糖酶基因序列进行密码子优化,原始序列中GC含量为45.8%,优化后GC含量为48.7%,交由苏州金唯智生物科技有限公司进行目的基因的合成。
1.4 引物设计
根据A.macleodii木聚糖酶基因序列xynZT-3,以及P.pastoris表达载体pPIC9K的多克隆位点,设计出两条引物。

1.5 重组载体的构建
以合成的目的基因为模板进行PCR扩增,扩增结束后,制备1%琼脂糖凝胶观察扩增情况,目的条带割胶回收、双酶切和连接[16]。连接液转化感受态E.coli DH5α,对长出的克隆子,提取质粒送至上海生工生物工程有限公司进行测序验证。
1.6 重组菌的构建
大量提取表达载体质粒DNA,SalⅠ线性化酶切后,通过1%琼脂糖凝胶电泳观察扩增情况,并割胶回收。将重组质粒电击转化到GS115感受态中,在含有不同浓度G418的YPD平板上进行重组菌的筛选。
1.7 重组菌摇瓶培养及诱导表达
挑选含有G418(终浓度为1.25 mg/mL)的YPD平板上菌落较大的克隆子[17],分别接种到30 mL BMGY培养基中,以含有GS115空载体的重组菌做对照,30℃,220 r/mim摇床培养,当细胞浓度达到A600=0.6左右时,离心收集沉淀;加入30 mL BMMY培养基发酵,30℃,220 r/mim摇床培养,每隔24 h加入150μL甲醇诱导,培养3~7 d,发酵液离心后取上清,测木聚糖酶活力。
1.8 木聚糖酶活力测定
采用DNS法[18]测定木聚糖酶活力。酶活力单位的定义:在pH 7.0、45℃的反应条件下以0.5%桦木木聚糖为底物,反应15 min,以每分钟产生1 μmoL木糖所需的酶量为一个酶活力单位。
1.9 木聚糖酶蛋白电泳分析
将2×SDS蛋白上样缓冲液加入到处理好的酶液中,混匀后,将其变性(煮沸10 min),离心(10 000 r/mim)10 min,SDS-PAGE电泳检测上清,染色1 h(考马斯亮蓝R-250),脱色后,观察目的条带。
1.10 发酵条件优化
选择诱导温度(12℃、16℃、20℃、24℃和28℃)、甲醇诱导剂的浓度(0.5%、1.0%、1.5%、2.0%、2.5%和3.0%)、种龄(16 h、20 h、24 h、28 h和32 h)、诱导时间(3 d、4 d、5 d、6 d和7 d)和诱导pH(pH 3、pH 4、pH 5、pH 6、pH 7、pH 8和pH 9)这几个因素,设计单因素实验[19-20],在单因素实验的基础上,对重组菌产酶能力采用四因素三水平N=29的Box-Behnken[21-22]响应面实验设计和研究,以诱导温度、甲醇浓度、种龄和pH为响应面自变量设计因素水平表(表1)。

表1 响应面因素水平表
2 结果与分析
2.1 木聚糖酶序列分析
麦氏交替单胞菌HY35基因组中的木聚糖酶XynZT-3基因序列在Genbank登录,登录编号为MT 814 837。xynZT-3序列全长为2970 bp,该序列成熟肽编码989个氨基酸(图1),没有内含子和信号肽区域,下划线标注的第29至第313氨基酸序列为编码的GH10家族结构域。xynZT-3预测等电点(pI)为4.15,分子量为107.74 kDa,分子式为C4827H7340 N1246O1535S11,预测存在7个潜在的N糖基化位点(N5AT,N97ET,N158IT,N563GS,N772YT,N878GS,N968GS)。

图1 木聚糖酶XynZT-3序列分析
2.2 木聚糖酶氨基酸序列比对分析
从NCBI中挑选出不同糖苷水解酶家族的木聚糖酶基因序列,利用DNAMAN9.0软件对XynZT-3进行系统进化树比对,由图2可以看出,XynZT-3与GH10家族的木聚糖酶序列属于一个分支,由此可进一步推断XynZT-3属于糖苷水解酶第10家族。

图2 XynZT-3氨基酸序列进化树分析
2.3 木聚糖酶三维结构建模
通过对蛋白质二级结构预测可知,木聚糖酶XynZT-3的二级结构主要由a-螺旋、无规则卷曲以及延展链构成,所占比例分别为22.55%、27.81%和41.66%。XynZT-3三维结构建模如图3所示,XynZT-3具有GH10家族典型的“桶状”结构特点。

图3 XynZT-3同源建模三维结构
2.4 重组菌木聚糖酶SDS-PAGE分析及酶活力检测
重组菌GS115/xynZT-3与预测目的蛋白分子量(107.0 kDa)相同位置处有明显条带,对照菌株GS115/pPIC9K在相应位置没有目的条带。发酵液酶活力检测,重组菌GS115/xynZT-3发酵液能明显检测出木聚糖酶活力,而对照菌株GS115/pPIC9K发酵液中未检测出木聚糖酶活力,说明重组菌成功表达了目的蛋白(图4)。
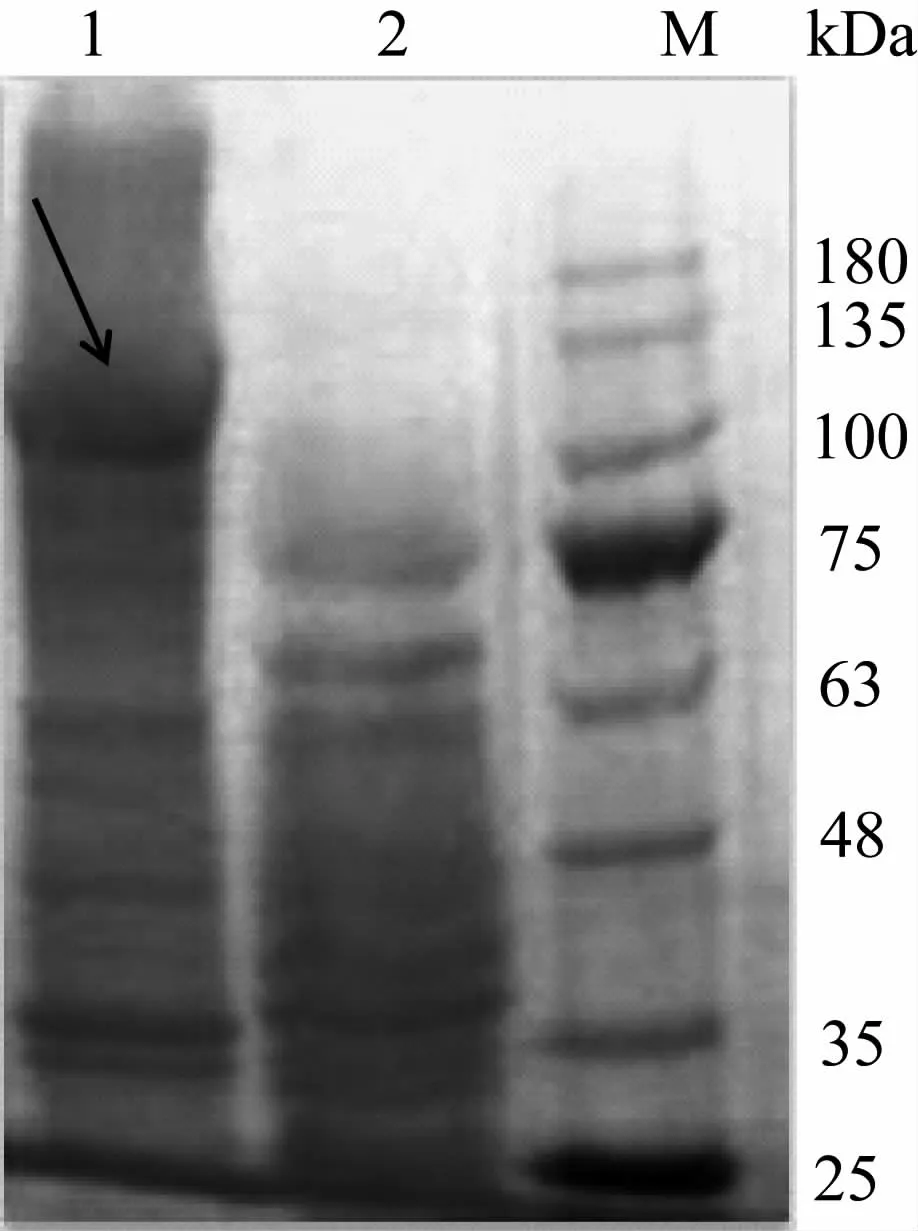
图4 重组菌木聚糖酶SDS-PAGE分析
2.5 重组菌发酵条件优化
图5a可以看出,重组菌GS115/xynZT-3在12 h~30 h时间处于对数生长期,此时菌体生长迅速。温度对重组菌相对酶活力的影响如图5b,木聚糖酶活力随着诱导温度的升高呈现先升高后降低的趋势。相对酶活力达到最高时,诱导温度为16℃;当诱导温度超过20℃时,重组酶相对酶活力急剧下降,仅能保持50%的相对酶活力。这可能由于低温对毕赤酵母发酵过程中细胞物质及能量代谢有促进作用,可提高胞内醇氧化酶活力及能量水平[23]。
图5c显示:甲醇诱导浓度为1.50%时,重组菌相对酶活力最高;当甲醇诱导浓度大于2%时,重组菌相对酶活力急剧降低。这可能由于pPIC9K载体中有醇氧化酶(AOX I)基因的启动子,属于可利用甲醇的正常型菌株,低浓度的甲醇对重组菌有激活作用,可使相对酶活力增加,高浓度的甲醇对重组菌有抑制作用,可使相对酶活力降低[24]。图5 d显示重组菌最佳种龄为28 h时,这与图5a生长曲线显示重组菌培养28 h为对数生长期的末期,此时菌体活力强,菌体浓度大,适宜接种,结果相一致。
图5e显示:当诱导时间为4 d时,相对酶活力最高,当诱导时间大于5 d时,相对酶活力逐渐降低。这可能因为诱导时间过长,使菌体发生自溶,导致胞内蛋白降解被释放出[25-27]。图5-f显示:重组木聚糖酶的相对酶活力随着培养基pH值的升高呈现先升高后降低的趋势。相对酶活力达到最高时,pH为4.0;当pH大于7.0时,相对酶活力急剧下降。这可能由于酶蛋白自身稳定性较差且在中性条件下酸性残基的表面的空间分布不同,从而使相对酶活力下降[28-30]。

图5 单因素优化最适条件
2.6 重组菌响应面实验优化
响应面结果如表2所示。利用Design Expert软件对响应面结果进行统计学分析,通过方差分析(表3)可知,在误差允许范围内,四个因素的影响P>F,因此四个因素的影响是显著的,具有统计学意义。通过最小二乘法法回归方程得到重组菌GS115/xynZT-3产木聚糖酶的相对酶活力(Y)对于诱导温度(X1)、甲醇浓度(X2)、种龄(X3)和pH(X4)的二次多项回归模型:相对酶活力(Y)=91.20-14.08X1-3.50X2-2.50X3+1.58X4-1.25X1X2+4.75X1X3-7.75X1X4+2.25X2X3+4.50X2X4+4.50X3X4-24.14X12+3.48X22-14.02X32-8.89X42。当变量为1时,线性拟合系数R2=0.823 9,误差平方和为0.647 9,拟合度良好。

表2 响应面实验计划表
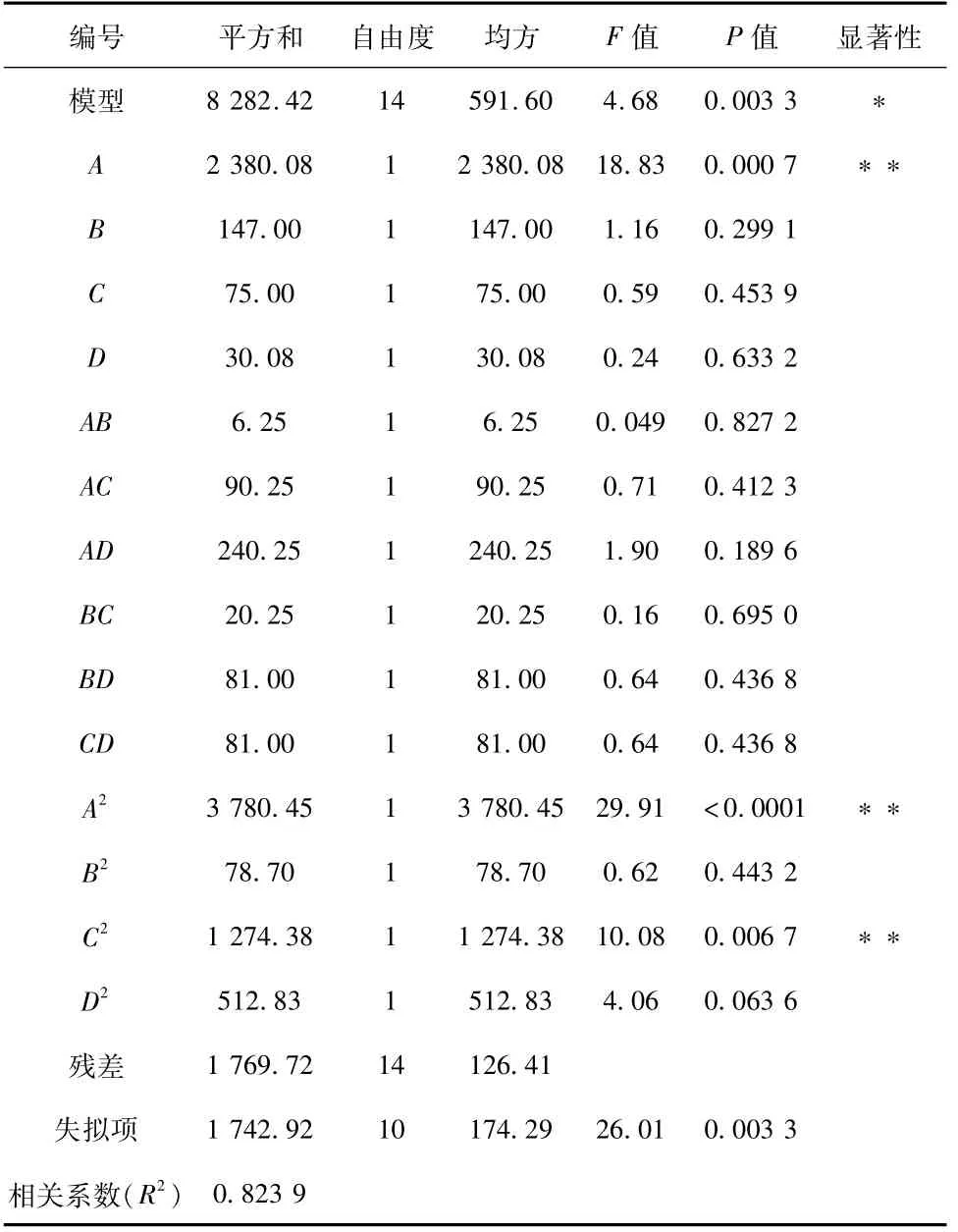
表3 回归模型方差分析结果
模型三维图如图6所示,四个因素在不同的水平对酶活力均能产生不同的影响,最大值处于三维图的中心,模拟获得最佳发酵条件诱导温度16℃、甲醇浓1.50%、种龄28 h、pH3.7。在优化条件下,实际酶活力为4.212 U/mL,为预测值的87.5%,说明此回归方程很好地反应了实际实验情况。

图6 响应面分析三维图
3 结论
对麦氏交替单胞菌中木聚糖酶xynZT-3基因进行序列分析,结果显示它属于GH10家族。XynZT-3基因在毕赤酵母GS115中成功实现异源表达。对重组菌P.pastoris GS115/xynZT-3经单因素优化及响应面分析,在实验室摇瓶条件下,重组菌最优表达条件为:诱导温度16℃、甲醇浓1.50%、种龄28 h、pH3.7,培养6 d,在该条件下,重组酶活力为4.212 U/mL。本实验是在实验室水平上进行的,后续研究可以考虑在发酵罐中扩大培养并进行产酶条件的进一步优化。后续研究也将进一步探究重组酶的酶学特性,采用基因工程研究手段对该酶分子进行进一步的改造研究,以期能够满足食品工业的应用需求。

