载药微球经导管肝动脉化疗栓塞治疗肝脏恶性肿瘤研究进展
王玉峰,何东风
哈尔滨医科大学附属肿瘤医院介入科,哈尔滨 150006
肝癌是世界上第六大常见恶性肿瘤,每年全球约有78万人死于肝癌,是癌症相关死亡的重要原因[1]。原发性肝癌的治疗方法包括肝切除术、肝移植、消融治疗、经导管肝动脉化疗栓塞(transcatheter hepatic arterial chemoembolization,TACE)、放射治疗、靶向治疗及免疫治疗等。肝移植及手术切除是可能根治原发性肝癌的治疗方法[2],但仅仅适用于约20%的早期患者。大多数肝癌患者确诊时已是中晚期,失去了手术的最佳时机,因此,局部治疗在肝癌的治疗中显得尤为重要。在控制局部肿瘤、抑制肿瘤进展、延长患者生命及控制患者病情方面,TACE已经被证实是有效且可靠的。巴塞罗那分期(BCLC)推荐TACE的适应证为:单个病灶且直径>5 cm,或有2~3个病灶且至少一个病灶直径>3 cm,或>3个病灶的BCLC-B期肝癌(表1)[1]。中国发布的《原发性肝癌诊疗规范(2019年版)》[3]中,TACE覆盖了Ⅰa-Ⅲb期肝癌的治疗(图1)。TACE包括传统TACE(C-TACE)与载药微球TACE(D-TACE)两种治疗手段,本文对其在肝脏恶性肿瘤治疗中的作用进行综述。

表1 肝癌巴塞罗那(BCLC)分期与临床治疗策略[1]Tab.1 BCLC stage and clinical treatment strategy of hepatocellular carcinoma[1]
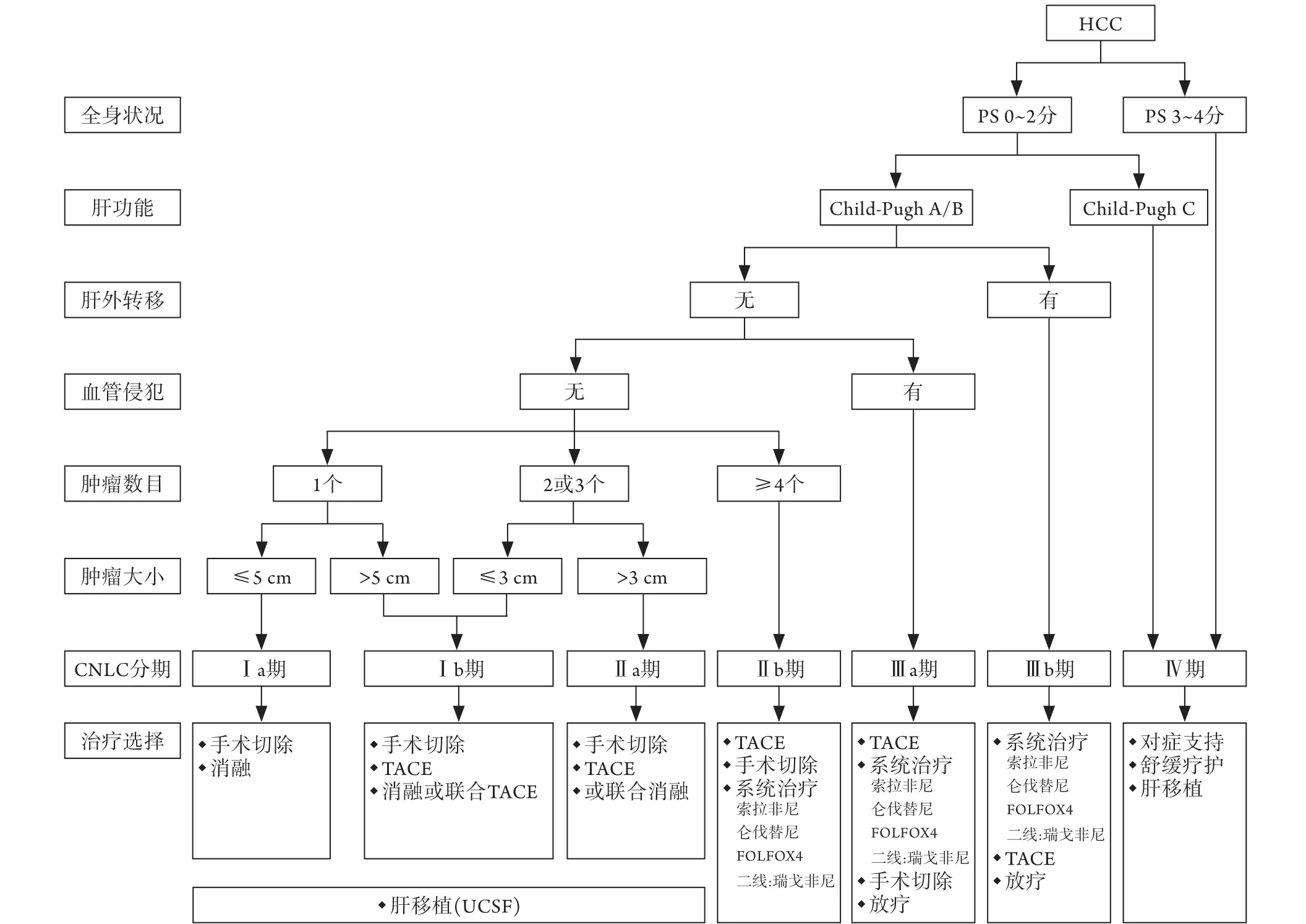
图1 中国肝癌临床分期及治疗路线图(引自《原发性肝癌诊疗规范(2019年版)》[3])Fig.1 Clinical staging and treatment road map of liver cancer in China (Quoted from《The Standard for Diagnosis and Treatment of Primary Liver Cancer (2019 Edition)》[3])
1 TACE
1.1 TACE的解剖及药代动力学基础 肝脏为双重供血器官,正常肝脏血供的70%~75%来源于门静脉,25%~30%来源于肝动脉;而肝细胞癌(hepatocellular carcinoma,HCC)血供的95%~99%来自于肝动脉,这是经肝动脉栓塞的解剖学基础。HCC的血供丰富,具有虹吸作用;肿瘤血管缺乏平滑肌;肿瘤组织无库普弗细胞,缺乏吞噬能力,有利于栓塞剂较长时间并特异性聚集在肿瘤血管及组织内,使其缺血、缺氧、坏死,而栓塞剂对正常肝组织的影响较小,此为经肝动脉栓塞的肿瘤生物学基础。阿霉素、丝裂霉素等化疗药物并无肝脏首过效应,且具有时间依从性、浓度依从性的特点,将碘化油与化疗药物混合并乳化,有利于药物缓慢释放,有助于提高肿瘤组织的局部血药浓度,增强化疗药物的生物利用度,提高治疗效果,此为TACE的药代动力学基础。
1.2 载药微球(drug-eluting bead,DEB)及其粒径选择 作为化疗药物的载体,DEB能加载化疗药物在肿瘤靶区,以可控的药代动力学特点缓慢释放,时间可持续7~14 d,并且DEB本身也可作为栓塞剂来栓塞肿瘤营养动脉,使之缺血、坏死。DEB具有将化疗药物浓聚于肿瘤局部、外周血液循环浓度较低及全身毒性反应较小等优点[4]。我国市场上的DEB主要是苏州恒瑞迦俐生生物医药科技有限公司生产的CalliSpheres载药微球。
CalliSpheres载药微球是以聚乙烯醇(PVA)为主链的大分子交联聚合体,以聚乙烯醇主链为骨架,以共价键形式与交联剂、活性蓝连接而成,通过利用含负电荷的有机小分子基团为微球引入负电荷,利用正离子交换机制实现对带正电荷抗肿瘤药物(如蒽环类、奥沙利铂、伊立替康等)的吸附。药物吸附过程是纯物理的可逆过程,除通过异电荷吸引形成离子键与分子间的氢键外,没有其他化学反应。微球及药物分子均稳定,均保持各自的物理化学特性,进入到病灶后在肿瘤靶区缓慢释放。
在一定范围内,DEB粒径越小,药物剂量越高,越能获得更高的肿瘤缓解率及更少的不良反应。因为较小微球的总表面积更大,能负载更多的药物,且粒径小的微球可以对小血管进行更彻底的远端末梢栓塞,确保对肿瘤供血动脉的永久、高度选择性闭塞[5]。
有研究发现,直径<150 μm的DEB(DCBeadM1®)在肝癌治疗方面显示出良好的效果,无明显肝毒性,但可引起肝内胆管扩张及肝脓肿[6]。Prajapati等[7]发现,与300~500 μm或500~700 μm的DEB相比,应用100~300 μm的DEB进行D-TACE治疗的不可切除肝癌患者具有更高的生存率及更低的并发症发生率。另一项比较100~300 μm与70~150 μm DEB临床效果的研究发现,使用70~150 μm DEB进行D-TACE治疗的患者1个月客观缓解率(objective response rate,ORR)更高,且两组不良反应发生率无明显差异[5]。在一组已接受多轮肿瘤治疗的中期肝癌患者中,300~500 μm与100~300 μm CalliSpheres的ORR相当,但100~300 μm组的并发症发生率较低[8]。一项多中心前瞻性研究指出,使用较小的微球(100 μm)及超选择性栓塞确实可以获得更高的ORR[9]。因此总体来说,粒径较小的DEB的可能临床获益优于粒径较大的DEB。
2 TACE在肝脏恶性肿瘤中的应用
2.1 在HCC患者中的应用 HCC的危险因素很多,常见的有肝硬化、乙型肝炎病毒(HBV)感染、丙型肝炎病毒(HCV)感染、酗酒及代谢综合征,其他的还有烟草吸入、黄曲霉毒素B1(一种存在于霉变食物中的真菌致癌物,与肿瘤抑制基因TP53的突变有关)等。最近研究发现,腺病毒2(AAV2)感染是HCC的一种新致病原因,尤其是在未发生肝硬化的人群中。《原发性肝癌诊疗规范(2019年版)》建议对高危人群每6个月进行一次超声检查监测[3]。HCC的预后与多种因素有关,包括肿瘤负担(病灶数目、大小、血管侵犯及肝外扩散),肝功能(Child-Pugh分级),肿瘤相关症状(ECOG表现状态),以及治疗方式的选择(包括肝切除、肝移植、消融治疗、TACE、全身治疗或最佳支持治疗)等。
2.1.1 早期HCC 对于早期HCC患者,肝移植、肝切除或局部消融治疗是可能根治的措施,不建议在早期阶段将TACE作为首选治疗方案。早期HCC血运不够丰富,且主要来自门静脉,随着肿瘤的生长,其血供越来越多地来自肝动脉,尤其是当病变的组织学分化良好时[10]。在实际临床应用中,对高龄、肝功能较差、合并严重并发症的患者不宜行手术治疗;肝捐献者过少限制了肝移植的开展;局部消融不适合于特殊部位如包膜下、穹隆处或位于主胆管、心脏大血管、肠环附近的肿瘤。在这些情况下,TACE也被应用于早期HCC患者,并且有研究报道了这些特殊人群行TACE后具有较高的应答率及良好的疗效[11-12]。有研究比较了TACE与射频消融术(radiofrequency ablation,RFA)治疗早期肝癌的临床效果,结果显示RFA组获得了更高的完全缓解率(complete response,CR)(94.1%vs. 71.6%)及5年无进展生存率(progression free survival,RFS)(35.8%vs. 17.0%),差异有统计学意义,而两组的3年及5年总生存期(OS)均无明显差异[13-14]。Adhoute等[12]比较了C-TACE与D-TACE治疗BCLC 0期或A期HCC的疗效,结果显示,两组患者的ORR无明显差异,但D-TACE组腹痛较轻,对谷草转氨酶(AST)及谷丙转氨酶(ALT)水平的影响较小。还有研究发现,TACE+RFA与手术切除具有相近的1年、3年OS及RFS,而手术切除具有更高的5年OS及RFS[15]。因此,D-TACE可作为临床上早期不宜手术切除及消融治疗的HCC的一种替代疗法。
2.1.2 中期HCC 无腹水、无血管侵犯或肝外扩散、无肿瘤相关症状的不能切除的肝癌被归为中期肝癌(BCLC-B期)。TACE是治疗中期肝癌的首选方法,最广泛使用的技术是C-TACE,即在HCC的供血动脉内注入含有细胞毒性药物及碘化油的乳剂,然后注入栓塞剂,如明胶海绵。然而,采用C-TACE治疗后,化疗药物会大量进入体循环,系统不良反应较强烈。为了克服这种负面效应,人们研发了DEB,后者能栓塞供血动脉,还能缓慢释放化疗药物进入肿瘤,造成持续的缺血并延长给药时间。
多项研究对C-TACE与D-TACE治疗HCC的效果包括患者的总生存率、肿瘤反应及不良反应等进行了比较。几项前瞻性研究结果显示,D-TACE与C-TACE治疗HCC的效果及安全性相当,但D-TACE术后的不良反应较轻;对于状态相对较差的患者,比如Child-Pugh分级为B级、ECOG评分为1分、伴有胆道疾病及复发的患者,D-TACE比C-TACE能显著提高患者的ORR,且耐受性良好,能明显减轻肝毒性及与化疗药物相关的不良反应[16-18]。也有规模较大的回顾性队列研究显示,C-TACE与D-TACE在改善HCC患者的OS方面无明显差别,但D-TACE治疗的次数少于C-TACE;对于先前未接受过治疗的HCC患者,D-TACE组的远期疗效优于C-TACE组,疾病进展时间(time to progress,TTP)也长于C-TACE组;对于先前接受过3~4次C-TACE治疗的HCC患者,再次使用D-TACE治疗比C-TACE治疗能获得更高的ORR[19-22]。先前接受过C-TACE治疗是存活率较差的一个预测因素。C-TACE治疗抵抗的概念最早出现在日本肝病学会(JSH)提出的临床实践指南中,是指一些既往有反复C-TACE治疗史的患者对C-TACE治疗产生抵抗,会对正常肝组织造成损害,并缩短生存时间[23]。Kobayashi等[24]研究发现,对于C-TACE治疗抵抗的HCC患者,D-TACE治疗后的抗肿瘤反应是有效的,相比于继续C-TACE治疗,D-TACE治疗能获得更乐观的ORR、PFS及OS,而与肝脏储备功能及肝内肿瘤是否进展无关。有研究采用D-TACE治疗Child-Pugh A级的HCC患者,结果发现肝动脉-门静脉分流形成的概率明显提高,提示Child-Pugh A级HCC患者应选择C-TACE,而D-TACE更适用于Child-Pugh B级的HCC患者[22]。复旦大学开展的一项回顾性研究发现,与C-TACE相比,D-TACE组的疾病控制率(disease control rate,DCR)更高(78.6%vs. 49.3%,P=0.03),所有患者均未出现与治疗相关的严重并发症,两组在栓塞后综合征、肝毒性及骨髓毒性方面无明显差异;亚组分析显示,若肿瘤直径<7 cm且肿瘤数量<3个,采用D-TACE治疗更具优势,若肿瘤直径>10 cm,则两种治疗方式的效果无明显差异[25]。
TACE的不良反应既可由手术本身引起,如手术引起的栓塞综合征、骨髓毒性等,也可由化疗药物引起,如阿霉素引起的脱发等。D-TACE与C-TACE常见的不良反应为术后1周内出现一过性的肝损伤,多在1~3个月内逐渐恢复;以及栓塞后综合征,如疼痛、发热、恶心及呕吐等,经常规的对症治疗后均可恢复。关于两种治疗方式的安全性,研究表明,D-TACE组的术后并发症发生率低于C-TACE组,且对于接受D-TACE治疗的患者,其术后1个月的ALT、AST及总胆红素(TBIL)升高水平明显低于接受C-TACE治疗的患者[17,26-27]。
TACE作为中期肝癌一线治疗方法的效果是毋庸置疑的。有研究比较了TACE联合RFA对比TACE用于中期肝癌首次治疗及切除后复发治疗的效果,结果显示二者的临床价值及安全性相当,但TACE联合RFA治疗组的3年OS、5年OS及5年FPS均较高,差异有统计学意义,早期尽早序贯RFA治疗比晚期后续的RFA联合治疗可以获得更好的DCR及远期生存获益,同时能减少TACE次数[28-30]。一项回顾性观察微波消融术(microwave ablation,MWA)对比索拉非尼用于TACE治疗无效且肿瘤最大径≤7 cm及病灶个数≤5的中期肝癌的研究结果显示,MWA组具有更长的中位OS(48.8个月vs. 16.6个月)及中位PFS(9.3个月vs. 2.8个月),差异有统计学意义(P<0.001)[31]。Chen等[32]比较了TACE联合RFA对比TACE联合125I粒子置入治疗中期肝癌的效果,结果显示两组的OS(41个月vs. 36个月)及PFS(18个月vs. 15个月)均无统计学差异,提示两种方法都可以作为中期肝癌的治疗选择。一项比较TACE+手术切除对比单纯手术切除治疗中期肝癌的研究发现,TACE+手术切除比单纯手术切除能获得更好的1、3、5年OS及1、2、3年RFS[33]。
TACE在中期肝癌的治疗中发挥了举足轻重的作用,对中期肝癌的管理应以TACE为中心并联合其他治疗手段,可以得到“1+1>2”的临床效果。在临床实际应用中,现有的研究由于种族差异、纳入标准不同、HCC的异质性、患者的具体情况不同,D-TACE和C-TACE的手术效果各有差异,但D-TACE并不一定优于C-TACE。对于二者疗效的优劣,仍需要开展多中心的前瞻性研究来证实。
2.1.3 晚期HCC 由于TACE治疗栓塞了肿瘤的供血动脉,导致肿瘤微环境发生改变,缺氧及pH值升高可通过低氧诱导因子1刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)的产生,VEGF与血管内皮细胞受体结合后驱动血管内皮细胞发生增殖,进而促进新生血管的形成[33]。这一过程使栓塞后的肿瘤向多血管肿瘤演变,导致肿瘤的快速生长以及侵犯、转移。而血管生成抑制因子能抑制血管内皮细胞的增生及迁移,抑制血管基底膜的合成及更新,从而防止多血管化,使血管发生退行性变,从而促使肿瘤缺血[34]。因此对于晚期肝癌,单独TACE发挥的作用比较局限,需要联合应用抗血管生成药物。BCLC分期中将索拉非尼或仑伐替尼列为晚期HCC的一线治疗,阿帕替尼为二线治疗。Cheng等[35]研究发现,与安慰剂组相比,索拉非尼组中位OS有所改善(10.7个月vs. 7.9个月),但是索拉非尼相关的药物反应较强,如手足皮肤反应,使很多患者无法耐受而不得不中断治疗。
仑伐替尼是一种小分子酪氨酸激酶抑制剂,可抑制血管内皮生长因子受体(VEGFR1-3)、成纤维细胞生长因子受体(FGFR1-4)、血小板衍生生长因子受体α(PDGFRα)、干细胞因子受体(KIT)的功能,从而抑制肿瘤血管生成。目前来看,在OS方面,仑伐替尼并不逊色,但并不优于索拉非尼。但与索拉非尼相比,仑伐替尼有更高的ORR,更长的PFS及TTP。仑伐替尼最常见的不良反应是高血压、腹泻、食欲下降及体重下降,总体上患者的耐受性尚可[36]。有研究比较了仑伐替尼与索拉非尼治疗TACE失败后不可切除肝癌的疗效及安全性,发现仑伐替尼组的中位PFS(4.97个月vs. 2.47个月)及ORR(25.6%vs. 3.6%)均高于索拉非尼组,差异有统计学意义;但两组的安全性无明显差异,表明在TACE治疗失败后使用仑伐替尼也是可行的[37]。晚期HCC患者存在较大的异质性,如门静脉癌栓(portal vein tumor thrombus,PVTT)形成及肝外转移情况各不相同。BCLC系统将PVTT形成视为手术或TACE的禁忌证,不考虑侵犯的程度直接划分为BCLC-C期,而选择采用索拉非尼或仑伐替尼治疗。目前,PVTT的分型包括国际上的Vp分型(表2)及中国的程氏分型(表3)。研究表明,程氏分型比Vp分型更适用于我国合并PVTT肝癌患者的病情评估、治疗选择及预后判断[38]。

表2 PVTT的国际分型Tab.2 International classification of PVTT
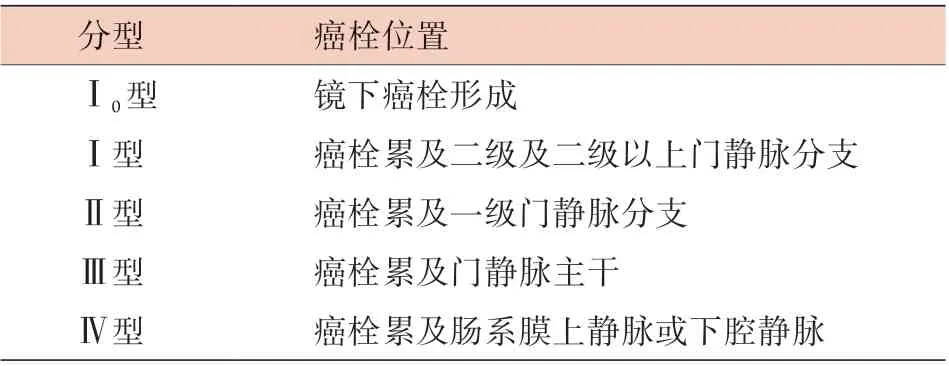
表3 PVTT的中国分型Tab.3 Chinese classification of PVTT
尽管指南推荐对于BCLC-C期的HCC患者采用靶向药物治疗,但在临床实践中,约有50%的BCLC-C期患者采用了TACE治疗。原因是PVTT附近形成的侧支循环使得肝功能有所保留,从而使TACE治疗Vp1-Vp3型或Ⅰ0-Ⅱ型PVTT患者成为可能[39]。TACE治疗多用于Child-Pugh A级患者,在Child-Pugh B级合并PVTT的患者中,TACE治疗的获益明显减少。肝功能情况是选择是否接受TACE治疗最重要的标准,TACE在Vp4型或Ⅲ/Ⅳ型PVTT中的作用仍存在较大争议。尽管随机对照研究表明TACE对提升该类患者的存活率有好处,但其OS(4~7个月)与索拉非尼等靶向药物相似,甚至更低[40]。对于Vp4型PVTT患者,采用门静脉支架联合125I放射性粒子置入及TACE联合索拉非尼均是安全可靠的方法,均能延长患者的TTP及OS[41]。
目前关于D-TACE在晚期肝癌中的应用研究较少,有学者比较了D-TACE联合阿帕替尼对比C-TACE联合阿帕替尼治疗BCLC-C期肝癌的效果,两组的中位OS及中位FPS无明显差异,但D-TACE组中无肝硬化病史患者的病死率高于C-TACE组,表明C-TACE联合阿帕替尼可能更适用于BCLC-C期且无肝硬化病史的肝癌患者[42-43]。
2.2 在胆管细胞癌中的应用 胆管细胞癌(CCA)约占原发性肝癌的10%,男性多于女性,按解剖位置可分为肝内胆管细胞癌(ICCA)、肝门周围胆管细胞癌(PCCA)及远端胆管细胞癌(DCCA),每种亚型的生物学特征、预后及治疗管理措施均不同,本文重点介绍ICCA。ICCA的危险因素与以慢性炎症及胆管上皮损伤为特征的病理改变有关,如原发性硬化性胆管炎、胆总管囊肿、Caroli病、肝内胆管结石及肝纤维化等。ICCA中结缔组织高度增生,细胞稀少,导致其细胞学及病理学诊断方法的敏感性较低。在对比增强影像上,ICCA常表现为边界不规则、动脉期外周边缘强化及延迟期肿瘤中央部分进行性强化的肿块,但较小的肿瘤可能无上述典型征象,很难与HCC区分,特别是在有慢性肝病基础疾病的患者中。此外,先进的细胞学技术,如荧光原位杂交(FISH)及突变分析已成为重要的诊断方式。手术是可能根治ICCA的选择,但只有27%~30%的患者适合进行手术治疗,且主要针对肝外肿瘤。不能切除的ICCA预后较差,中位生存期为3~6个月。其他治疗方式有肝移植、TACE、钇90微球放射栓塞、放疗、化疗及靶向治疗等。临床上TACE主要用于不可切除的ICCA患者,ICCA的血管形态与HCC不同,通常范围较大,对化疗药物的敏感性也不同,因此TACE治疗时需要高剂量的药物(阿霉素)。ICCA通常邻近两个肝段,需要栓塞很大一部分肝实质。因此在这些患者中,往往不需要进行超选,通常将药物注入近端的节段分支,栓塞剂即可扩散到两个肝段。对于病变范围较大的弥漫性病变,需要双侧分次治疗,治疗间隔15~20 d,以避免大范围栓塞导致的肝衰竭[44]。
全身化疗多采用以吉西他滨为基础的化疗方案,旨在抑制肿瘤生长,改善患者的生活质量。ICCA含有较多纤维组织,血供较HCC匮乏,到达肿瘤灶的血药浓度较低,故全身化疗效果不佳,OS约为1年。Konstantinidis等[45]及Cercek等[46]的研究证实,经肝动脉化疗药物灌注(hepatic arterial infusion chemotherapy,HAIC)联合系统化疗比单纯系统化疗能获得更高的疾病缓解率(59%vs.39%,P=0.11)及更长的OS(30.8个月vs. 18.4个月,P<0.01)。在一项针对67例ICCA患者的多中心前瞻性研究中,26例患者采用D-TACE治疗(负载伊立替康200 mg),10例患者采用C-TACE治疗(阿霉素混合碘化油,明胶海绵补充栓塞),31例患者采用吉西他滨联合奥沙利铂系统化疗,结果显示D-TACE组的PFS及OS分别为3.9、11.7个月,与系统化疗组相仿(6.2、11.0个月),而优于C-TACE组(1.8、5.7个月)[47]。在一项比较D-TACE联合阿帕替尼、C-TACE联合阿帕替尼与单独阿帕替尼治疗ICCA疗效及安全性的研究中,D-TACE联合阿帕替尼组的ORR及DCR分别为84.6%、100.0%,C-TACE联合阿帕替尼组为75.0%、91.7%,单独阿帕替尼组为40.0%、80.0%;3组的中位PFS分别为17、10.3、4.5个月,中位OS分别为19.3、14.0、6.5个月,差异有统计学意义(P<0.001);3组均出现了可耐受的栓塞后综合征[48]。Aliberti等[49]开展了一项比较不同栓塞材料的研究,旨在评估Dc-Beads微球与聚乙二醇载药微球治疗ICCA的临床疗效及安全性,结果显示,127例患者治疗3个月后,肿瘤部分缓解(PR)19例(15%),稳定(SD)101例(80%),进展(PD)7例(5%),聚乙二醇载药微球治疗后以PR为主,而Dc-Beads微球治疗后以SD为主,表明Dc-Beads及聚乙二醇载药微球在TACE中均安全有效,且聚乙二醇载药微球能够改善治疗结果。
2.3 在肝转移瘤中的应用 肝脏因其丰富的血供而成为各种癌症远处转移最常见的部位,相当数量的肿瘤会发生肝转移[50],包括50%的结肠癌,40%的胃癌,25%~50%的胰腺癌,以及肺癌、乳腺癌等。与未发生肝转移的患者相比,发生肝转移会显著降低患者的5年生存率。在每年159 000例新确诊的结直肠癌患者中,大约60%会发生结直肠癌肝转移(colorectal cancer liver metastases,CRLM)。对于只有肝转移的患者,公认的一线治疗方案是手术切除,然而只有20%~30%的患者适合切除,且这些患者中有70%~80%会在5年内复发。对于不可切除的结肠癌肝转移,标准的治疗方案是系统化疗方案——FOLFOX(亚叶酸钙、5-氟尿嘧啶、奥沙利铂)及FOLFIRI(亚叶酸钙、5-氟尿嘧啶、伊立替康),这些治疗方案能显著提高存活率,但起初对治疗有反应的患者最终仍会发生肿瘤进展,相当一部分患者对多线的系统化疗方案产生抵抗。有研究指出,系统化疗失败后,伊立替康载药微球栓塞(DEBIRI)仍可缓解CRLM患者的病情[51]。由于CRLM是乏血供肿瘤,碘化油乳剂沉积较差,因此C-TACE的治疗效果会大打折扣。在中国开展的一项多中心前瞻性队列研究纳入了55例继发性肝癌患者,均使用CalliSpheres®可载药栓塞微球进行D-TACE治疗,结果显示CR达12.7%,ORR达67.3%,这为继发性肝癌的治疗提供了一种新的思路[52]。一些前瞻性随机对照研究探讨了DEBIRI的作用,Martin等[53]比较了FOLFOX+贝伐单抗治疗与DEBIRI联合FOLFOX+贝伐单抗治疗CRLM患者的安全性及肿瘤缓解率,结果发现在治疗2、4及6个月时,DEBIRI联合FOLFOX+贝伐单抗组的ORR明显高于FOLFOX+贝伐单抗组(2个月:78%vs.54%,P=0.02;4个月:95%vs. 70%,P=0.03;6个月:76%vs. 60%,P=0.05),中位PFS也明显延长(15.3个月vs. 7.6个月,P<0.01)。Fiorentini等[54]比较了DEBIRI与FOLFIRI方案治疗CRLM患者的OS、ORR、复发率及生活质量,结果显示,随访50个月后,DEBIRI组的中位OS(22个月vs. 15个月)及中位PFS(7个月vs. 4个月)均长于FOLFIRI组,研究结束时,所有患者都出现了肝外进展,DEBIRI组的中位PFS(13个月vs. 9个月)及生活质量改善持续的中位时间(8个月vs. 3个月)均长于FOLFIRI组,差异均有统计学意义,表明DEBIRI治疗优于标准方案化疗。一项多国家、多机构参与的研究纳入了296例采用DEBIRI治疗系统化疗失败的CRLM患者,212例先前未接受过系统化疗,84例先前接受过1次以上的系统化疗,并据此分组。结果显示,接受过系统化疗的患者3、6、12个月的肿瘤反应率分别为44%、43%、44%,而未接受过系统化疗的患者分别为45%、40%、35%,差异无统计学意义;接受1、2及3次以上全身化疗后行DEBIRI治疗的患者6个月总生存率分别为93%、90%及90%,12个月时总生存率分别为71%、77%及87%,差异无统计学意义,而不良事件发生率分别为20.4%、9.7%及37.3%,差异有统计学意义(P<0.001)[55]。该结果表明在先前接受全身化疗的情况下,序贯DEBIRI治疗仍然可以保持比较可观的疗效及较低的严重不良事件发生率。Nishiofuku等[56]评估了24例使用可降解淀粉微球(DSM)负载顺铂进行D-TACE治疗FOLFOX方案失败后不可切除的继发性肝癌的Ⅰ/Ⅱ期临床研究结果:在Ⅰ期临床研究中,未出现与剂量有关的毒性,顺铂的推荐剂量定为80 mg/m2;在Ⅱ期临床研究中,肿瘤反应率为61.1%,中位PFS为8.8个月,中位OS为21.1个月。该结果表明,对于FOLFOX治疗失败后的继发性肝癌患者,用DSM负载80 mg/m2顺铂进行D-TACE治疗具有良好的耐受性、较高的应答率及较长的生存期。
DEBIRI治疗CRLM最常见的严重并发症是肝衰竭及胆囊炎,其他可能发生的并发症包括血压升高、白细胞减少、血小板减少、肝动脉分支血栓形成、胆管周围神经丛受损,并伴有胆管节段性扩张。最常见的不良反应有右上腹部疼痛、发烧、恶心及呕吐等。
对DEBIRI的操作水平,是选择大叶给药还是超选以进行节段性或亚节段性给药,目前尚存在争议。支持大叶给药的理由是:伊立替康需要通过正常肝实质进行水解,且此方法可以治疗影像上发现不了的隐匿病灶。支持节段性或亚节段性给药的理由是:超选可以使健康的肝实质较少暴露于伊立替康的毒性作用,并可使伊立替康浓聚在肿瘤灶内,提高局部的活性代谢物浓度,特别是在只有单个转移灶的情况下。Szemitko等[57]评估了不同部位TACE治疗的差别,结果显示,叶部、节段性及亚节段性栓塞组的严重并发症发生率无明显差异。与超选栓塞相比,叶部栓塞导致栓塞后综合征的发生率更高。在临床上,应根据患者的实际情况进行栓塞治疗,对于单个或较大的病变,可采用超选栓塞;对于多个病变,宜采用大叶栓塞。
3 总结与展望
在过去的几十年中,由于载药微球可控的药代动力学以及较轻的系统不良反应,使得D-TACE作为一种姑息治疗手段已使越来越多的肝癌患者获益,并逐渐应用于肺癌、宫颈癌及子宫肌瘤等肝外良恶性肿瘤的治疗。虽然D-TACE治疗在各种分型及分期的肝癌中均实现了初始缓解,但肿瘤复发仍然很常见。作为姑息疗法而非根治疗法,单独的D-TACE治疗并不能达到理想的远期效果。外科切除、冷热消融、TACE、HAIC、内外放疗、靶向治疗、免疫治疗等为肝癌的治疗提供了更多选择,联合治疗显得尤为重要,已成为未来发展的趋势,通常可以收获“1+1>2”的效果。针对肝癌这一异质性很强的疾病,治疗方案如何选择才能做到扬长避短、提高有效率是临床工作者必须重视的问题。同样亟待进一步研究的是D-TACE治疗后的生物学行为改变、肿瘤局部微环境变化以及分子、靶向、免疫机制变化,对这些问题进行深入研究可为肝癌治疗方案的科学决策和优化提供指导依据,对提高治疗效果、减少复发与转移、延长生存具有重要意义。

