PTEN对糖尿病肾病肾间质纤维化的作用及其机制
刘兴梅,沈燕,班晓霞,何玉,李红梅,何晓兰,张华*
1贵州省人民医院检验科,贵阳 550002;2贵州省人民医院肾内科,贵阳 550002;3贵州省人民医院病理科,贵阳550002
据估计,全世界糖尿病的患病人数到2045年将高达7亿[1]。糖尿病肾病(diabetic nephropathy,DN)是致死性最严重的糖尿病并发症,也是导致肾功能不全的主要原因[2-3],随着病情进展可发生肾小管间质纤维化。同源性磷酸酶-张力蛋白(phosphatase and tensin homolog,PTEN)可通过激活脂质磷酸酶使磷脂酰肌醇三磷酸去磷酸化转变为磷脂酰肌醇二磷酸而失活,负性调控PI3K/Akt通路,同时可激活蛋白磷酸酶活性,负性调控黏着斑激酶/P130信号来抑制细胞的存活、增殖,从而延缓肿瘤生长[4],涉及血管[5]、心脏[6]、肺[7]和肾脏纤维化[8]等领域。已有研究发现,PTEN可通过不同信号通路影响肾脏纤维化的进程[9-13]。自噬为溶酶体降解途径,可参与细胞质成分降解,以维持细胞功能和代谢的平衡[14-15]。微管相关蛋白1A/1B-轻链3(LC3)和P62分别是自噬起始和完成的标志物,且LC3 Ⅱ与LC3 Ⅰ的比值常用于监测自噬的激活[16]。激活转录因子4或嘌呤能受体可通过抑制自噬促进肾间质纤维化[17-18]。可见,PTEN、自噬均在DN的发病机制中扮演重要角色。然而,PTEN与自噬及肾间质纤维化三者间的相互作用机制尚不完全清楚。本研究旨在观察PTEN在高糖环境下对大鼠近端肾小管上皮细胞的作用,并探讨体外干预PTEN表达对自噬及肾间质纤维化的影响机制,以期为DN的临床治疗寻找新的有效靶点。
1 材料与方法
1.1 细胞及试剂 大鼠近端肾小管上皮细胞(NRK52E)购自美国ATCC细胞库。ClarityTMWestern ECL substrate购自美国Bio-Rad公司,DMEM培养基、胎牛血清购自美国Gibco公司,雷帕霉素购自美国MedChem Express公司,鼠抗β-actin单克隆抗体购自中国普美生物科技公司,兔抗PTEN和兔抗P62单克隆抗体购自英国Abcam公司,兔抗LC3A/B单克隆抗体购自美国CST公司,兔抗Ⅰ型胶原和Ⅲ型胶原蛋白单克隆抗体购自美国Sigma公司。自噬双标腺病毒mRFP-GFP-LC3质粒购自上海汉恒生物科技有限公司,过表达PTEN质粒(CKP04-PTEN)购自中国普美生物科技公司。
1.2 方法
1.2.1 细胞培养 大鼠近端肾小管上皮细胞N R K 5 2 E 用含1 0%胎牛血清及D M E M 培养基在37 ℃、5% CO2培养箱中培养,待细胞融合度达80%~90%时进行细胞传代。吸掉原培养液,PBS清洗,吸干PBS后加入1 ml 0.25%胰蛋白酶消化细胞,1:4传代。
1.2.2 Western blotting检测PTEN、LC3、P62、Ⅰ型和Ⅲ型胶原蛋白表达水平 将对数生长期NRK52E细胞随机分为3组:正常糖(NC,5.5 mmol/L葡萄糖)组、高糖(HG,30 mmol/L葡萄糖)组、高渗(MA,5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇)组。培养48 h后,吸弃各组细胞培养基,PBS洗3次,吸干后加入细胞裂解液1 ml (含RIPA裂解液980 μl/ml,PMSF 10 μl/ml,磷酸酶抑制剂10 μl/ml),充分裂解,用细胞刮刀刮下细胞,将蛋白质上清转至另一无菌1.5 ml EP管。BCA法进行蛋白样品定量,根据测得的蛋白浓度,加入2×SDS-PAGE蛋白上样缓冲液使各样品浓度为3 μg/μl,充分混匀,沸水煮开10 min,进行蛋白样品变性。然后依次进行制胶,电泳,转膜,封闭,洗膜,分别加入一抗PTEN(1:1000)、LC3(1:1000)、P62(1:1000)、Ⅰ型胶原蛋白(1:1000)、Ⅲ型胶原蛋白(1:800)和抗β-actin(1:4000),4 ℃冰箱摇床孵育过夜,洗膜,然后加入二抗(1:4000)孵育,洗膜,ECL液浸泡显色,Bio-Rad凝胶成像系统自动扫描胶片,检测PVDF膜上的目的蛋白,ImageJ软件分析条带强度。
1.2.3 激光共聚焦显微镜观察自噬流 将对数生长期NRK52E细胞随机分为3组:正常糖对照(NG)组、高糖对照(HG)组和高糖过表达PTEN(HG+pPTEN)组,然后各组转染自噬双标腺病毒mRFP-GFP-LC3质粒16 h,吸弃细胞培养基,换成含10% FBS的DMEN培养基,在HG+pPTEN组细胞中使用LipofectamineTM3000转染PTEN过表达质粒,同时每组细胞加入100 nmol/L的自噬诱导剂雷帕霉素,以提高整体自噬水平,便于观察各组间自噬的差异,共培养48 h,以复温的PBS(37 ℃)清洗2次,每孔加入200 μl 4%多聚甲醛,室温固定30 min后冷PBS洗3次,DAPI染核,室温10 min,冷PBS洗2次,留少许PBS,加入盖玻片封片,激光共聚焦显微镜观察自噬变化。采用自噬溶酶体(mRFP)标记及追踪LC3,mRFP呈红色斑点,红绿荧光(RFP+GFP)合并后呈黄色斑点即自噬体,通过不同颜色斑点计数可清楚观察自噬流。
1.2.4 荧光显微镜观察Ⅰ型和Ⅲ型胶原表达的变化
细胞分组同1.2.3。HG组细胞采用LipofectamineTM3000转染PTEN过表达质粒,6 h后去掉细胞培养基,换成含10% FBS的DMEN培养基,培养48 h,以复温的PBS(37 ℃)洗2次,每孔加入200 μl 4%多聚甲醛,室温固定30 min后,用冷0.2%聚乙二醇辛基醚洗3次,3% BSA封闭1 h,冷PBS清洗3次,加入最佳稀释比例PTEN抗体(1:200)、Ⅰ型胶原蛋白抗体(1:200)和Ⅲ型胶原蛋白抗体(1:200),4 ℃孵育过夜,冷PBS清洗,加入二抗(Cy3标记羊抗兔,稀释比例1:150)室温孵育3 h,冷PBS清洗,DAPI染核,室温10 min,冷PBS清洗,留少许PBS,加入盖玻片封片,荧光显微镜下观察胶原的染色变化。
1.3 统计学处理 采用SPSS 19.0软件进行统计分析。数据符合正态分布,且通过方差齐性检验,均以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 高糖培养NRK52E细胞中P TEN的表达Western blotting检测结果显示,与NG组比较,HG组PTEN表达水平明显降低(P<0.01),而MA组PTEN表达水平无明显变化,因而排除了渗透压对PTEN表达的影响(图1)。
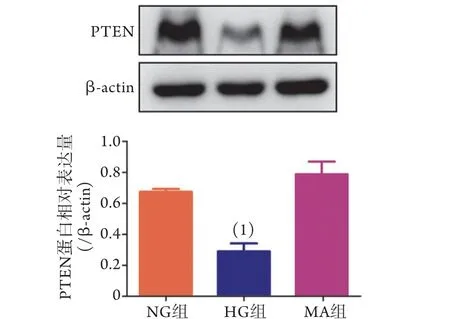
图1 各组NRK52E细胞PTEN蛋白的表达水平(Western blotting,n=3)Fig.1 Protein expression levels of PTEN in NRK52E cells of each group (Western blotting)(n=3)
2.2 高糖培养NRK52E细胞中LC3、P62、Ⅰ型和Ⅲ型胶原蛋白的表达 Western blotting检测结果显示,与NG组比较,HG组LC3表达降低(P<0.05),P 6 2、Ⅰ型和Ⅲ型胶原蛋白表达水平明显升高(P<0.05或P<0.01),而MA组LC3、P62、Ⅰ型和Ⅲ型胶原蛋白的表达水平差异无统计学意义(P>0.05)(图2)。

图2 各组NRK52E细胞中LC3、P62、Ⅰ型和Ⅲ型胶原蛋白的表达水平(Western blotting, n=3)Fig.2 Protein expression levels of LC3, P62, collagen-Ⅰ and collagen-Ⅲ in NRK52E cells (Western blotting, n=3)
2.3 激光共聚焦显微镜观察自噬流变化 激光共聚焦显微镜观察结果显示,与NG组比较,HG组红色斑点和黄色斑点数减少,HG+pPTEN组红色斑点变化不大,黄色斑点数有所增加。与HG组比较,HG+pPTEN组红色斑点和黄色斑点数明显增加(图3)。
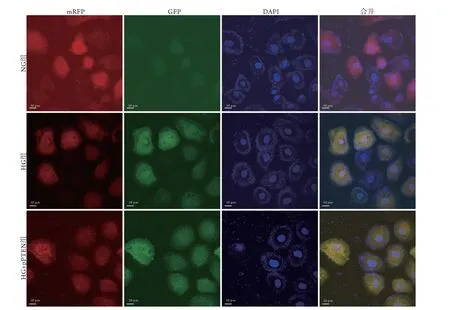
图3 激光共聚焦显微镜检测过表达PTEN后NRK52E细胞中自噬流变化Fig.3 Changes of autophagic flow in NRK52E cells analyzed by laser confocal microscopy, using pPTEN plasmid over-expressed PTEN
2.4 PTEN对胶原表达的影响 细胞荧光染色结果显示,与NG组比较,HG组PTEN红色荧光减弱,胶原荧光染色增强,HG+pPTEN组PTEN染色有所恢复,胶原染色无明显变化。与HG组比较,HG+pPTEN组PTEN红色荧光增强,胶原荧光染色减弱(图4)。
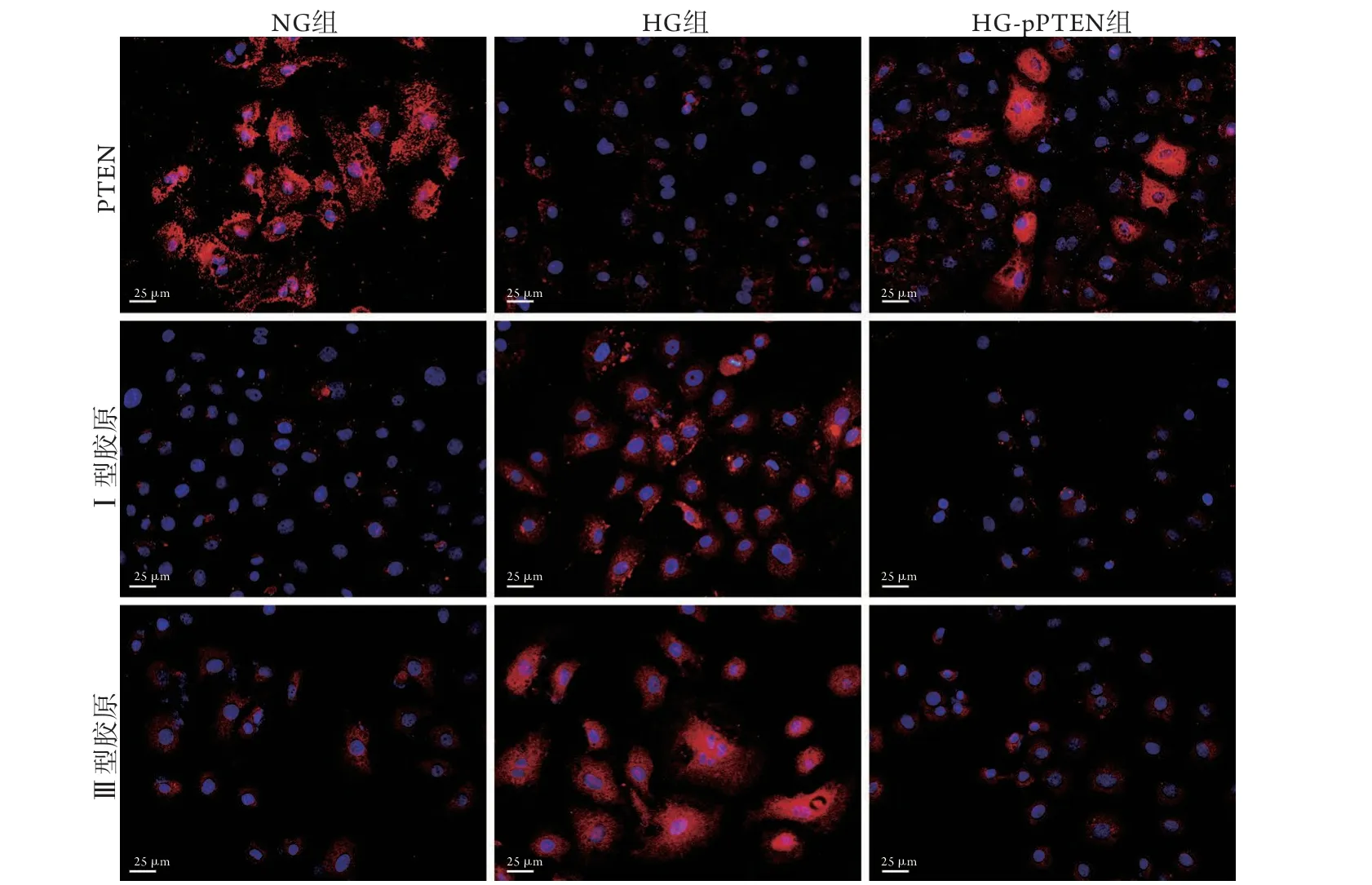
图4 NRK52E细胞PTEN及Ⅰ型和Ⅲ型胶原蛋白免疫荧光染色Fig.4 PTEN, collagen-Ⅰ and collagen-Ⅲ protein in NRK52E cells(Immunofluorescence staining)
3 讨 论
随着病程进展,DN将发展为慢性肾脏病,是终末期肾病(end-stage renal disease,ESRD)的主要原因[19]。DN的特征之一为细胞外基质(extracellular matrix,ECM)蛋白如肾小球和基底膜的系膜和肾小管间质中的胶原、层黏蛋白和纤维连接蛋白(fibronectin,FN)的沉积;ECM表达增加可使肾小球和肾小管基底膜增厚,系膜基质增多,最终导致肾小球硬化和肾小管间质纤维化[20]。在DN中,肾小管间质病变和间质纤维化一直备受关注[21]。高糖、蛋白尿和晚期糖基化终末产物具有固有的肾小管毒性,均可能触发间质性炎症并引起纤维化反应,从而导致肾间质纤维化[22]。有研究发现,PTEN去磷酸化并激活肌动蛋白解聚因子cofilin-1,导致F-肌动蛋白形成,促进肥胖相关的肾小球足细胞损伤引起肾小球病变[23]。通过抑制TGF-β和Notch信号通路,进而维持PTEN的表达,可有效减缓UUO模型中的肾脏纤维化[24]。显而易见,PTEN在肾脏纤维化过程中扮演着重要角色。本研究观察到高糖刺激NRK52E细胞后,胶原的表达增加并伴随PTEN的表达降低。以甘露醇作为高糖的渗透控制剂,结果显示MA组PTEN蛋白表达水平与NG组比较无变化,排除了高渗的影响,提示PTEN与肾小管间质纤维化存在一定的内在联系。有研究发现,链脲佐菌素诱导的糖尿病小鼠存在明显的PTEN蛋白下调,蛋白尿以及FN、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和Ⅰ型胶原等纤维化因子增加,肾脏间质纤维化加重;利用芒果苷治疗可预防肾间质纤维化,表现为FN、Ⅰ型胶原和α-SMA阳性表达减少,同时上调PTEN,并降低PI3K和Akt的磷酸化,提示芒果苷可能通过上调PTEN,并降低PI3K和Akt的磷酸化途径抑制Ⅰ型胶原、FN和α-SMA的升高,从而减轻DN中的炎症和氧化应激,最终抑制肾间质的纤维化[25]。然而,PTEN在糖尿病肾间质纤维化病理机制中如何发挥作用仍然不完全清楚。
自噬是真核细胞周期中一个高度保守的过程,通过降解细胞质中的细胞器、蛋白质和大分子以及降解产物的循环,在细胞的生长、增殖和维持细胞环境的稳定性中发挥重要作用[26]。自噬功能失调可能参与DN的发生发展[27]。肾脏细胞中基本水平的自噬对维持肾脏内环境平衡必不可少,但在外界压力下自噬将发生改变,一旦自噬失调,可诱导急性及慢性肾病的发生。足细胞自噬、近端肾小管上皮细胞中线粒体自噬的改变将导致肾功能变化[28]。UUO模型中特异性敲除远端肾小管上皮细胞Atg7基因后,自噬受到明显抑制,可进一步加重细胞凋亡与肾小管细胞纤维化[29]。用STZ诱导DN的动物研究中发现,敲除IL-17A可影响自噬形成过程,使细胞内稳态失衡,促进DN的发生发展[30]。本研究发现,高糖刺激近端肾小管上皮细胞后自噬被抑制,肾间质纤维化加重,提示在高糖环境下,PTEN介导的肾脏间质纤维化过程中自噬水平明显降低。
研究发现,自噬在DN的发病机制中具有重要作用[31-32],但目前尚不清楚PTEN、自噬与肾间质纤维化间的关系。Sun等[33]证实,抑制DN模型中的miR-217可靶向调控PTEN表达,进一步恢复足细胞自噬,从而拮抗足细胞损伤及胰岛素抵抗。Guo等[34]发现,二氢杨梅素在治疗DN时,可通过抑制PI3K/Akt/mTOR通路增强自噬水平,调节miR-155-5p/PTEN表达,从而缓解肾间质纤维化。Chen等[35]在齐墩果酸治疗DN的研究中也发现,齐墩果酸可通过抑制miR-142-5p促进PTEN表达和细胞自噬,进而抑制HG诱导的NRK52E细胞纤维化。可见,体外通过药物靶向提高PTEN和自噬相关蛋白的表达是治疗DN的关键点。本研究在高糖培养的近端肾小管上皮细胞中转染PTEN过表达质粒,使用RFP-GFP-LC3双标腺相关病毒感染NRK52E细胞,并在各处理组加入100 nmol/L的自噬诱导剂雷帕霉素以提高整体自噬水平,便于更好地观察各组自噬流的动态变化,结果发现,与NG组比较,HG组红色斑点和黄色斑点数减少,HG+pPTEN组红色斑点变化不大,黄色斑点数有所增加,而与HG组比较,HG+pPTEN组红色斑点和黄色斑点数明显增加,提示高糖刺激使自噬受到抑制,而高糖刺激后过表达PTEN可恢复自噬水平。
PTEN是一种肿瘤抑制基因,可负性调控磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/雷帕霉素(mTOR)途径[36]。mTOR信号传导图谱表明,mTOR能通过调节关键细胞过程(包括蛋白质合成和自噬)来控制生物能量积累和代谢,而mTOR蛋白复合体1可影响自噬激活激酶1和ATG13,抑制细胞成分的自噬分解[37]。在DN肾间质纤维化过程中,PTEN可能通过PI3K/Akt/mTOR通路,靶向调控自噬的发生、发展。本研究发现,与NG组比较,HG组PTEN红色荧光减弱,胶原荧光染色增强,HG+pPTEN组PTEN染色有所恢复,胶原染色无明显变化,与HG组比较,HG+pPTEN组PTEN红色荧光增强,胶原荧光染色减弱,提示高糖使细胞PTEN表达降低、胶原表达增加,而过表达PTEN可使高糖刺激下的自噬抑制被解除,并降低胶原的表达,因此,高糖培养近端肾小管上皮细胞转染PTEN过表达质粒后,可通过改变自噬水平缓解DN的纤维化进程。
综上所述,本研究发现,在DN的发生发展过程中,PTEN可通过恢复自噬缓解肾脏纤维化。然而,在高糖环境下过表达PTEN的干预实验中,我们没有进一步检测具体的PTEN蛋白、自噬相关蛋白、胶原的定量表达,并探讨更深层次的分子机制,因而存在一定的局限性。PTEN的调控机制复杂,今后需要有更多研究去揭示PTEN在DN中的调控作用,为PTEN用于DN的临床治疗提供理论基础。

