RACK1对人宫颈癌细胞增殖和凋亡的影响及其机制
李金秋,徐丽秀,朱佳瑜,夏依达·吐尔逊,阿仙姑·哈斯木
新疆医科大学基础医学院/新疆地方病分子生物学重点实验室,乌鲁木齐 836001
宫颈鳞癌(cervical squamous cell carcinoma,CSCC)是妇科常见的恶性肿瘤之一,其发病正逐渐年轻化(20~39岁),2020年的统计数据显示,中国宫颈癌新发病例达11万例,死亡病例约6万例,居恶性肿瘤第10位[1]。晚期宫颈癌患者死亡的主要原因为肿瘤细胞生长速度过快及难以控制的盆腔淋巴结转移[2]。肿瘤的发生发展是一个复杂的过程,而过度的细胞增殖及细胞凋亡程序的紊乱是造成恶性肿瘤发生的主要原因之一[3-4]。激活性蛋白激酶C受体1(receptor for activated C kinase 1,RACK1),是一种胞质内游离的支架蛋白,可与蛋白激酶C(PKC)及其他多种关键信号蛋白相互作用,进一步介导细胞内的信号转导,直接参与多个重要基因的表达调控,影响细胞增殖、凋亡及迁移[5]。目前已有研究发现,RACK1在多种恶性肿瘤中呈高表达并与患者的不良预后密切相关,已被确定为脂肪细胞分化和代谢紊乱所需的新基因[6]。但RACK1异常表达对宫颈癌细胞增殖及凋亡的作用机制仍不明确。本研究检测RACK1在宫颈癌组织中的表达水平,并通过构建慢病毒稳定转染细胞系验证RACK1对宫颈癌细胞恶性增殖及凋亡能力的影响,以期为明确宫颈癌发病机制及改善患者的预后提供一定的理论基础。
1 材料与方法
1.1 组织样本 收集新疆医科大学第一附属医院妇科2020年12月-2021年12月收治的24例CSCC患者的宫颈癌组织和24例无宫颈病变的正常宫颈组织。本研究获新疆医科大学第一附属医院伦理委员会批准(20180223-128)。所有患者均签署书面知情同意书。
1.2 细胞及试剂 宫颈癌SiHa、C33a细胞株及正常宫颈H8细胞株购自武汉普诺森生命科技有限公司。RACK1-siRNA慢病毒由上海吉凯有限公司构建。RIPA组织细胞裂解液、Trizol试剂购自北京索莱宝生物科技有限公司,c-myc、caspase-3、caspase-9、Bax、Bcl-2单克隆抗体购自美国CST公司,RACK1、磷酸化Janus激酶2(p-JAK2)、磷酸化细胞信号传导与转录活化因子3(p-STAT3)、JAK2、STAT3抗体购自美国Abcam公司,β-actin兔抗人多克隆抗体购自美国Protein Teach公司,QuantiNova SYBR Green PCR Kit试剂盒购自德国Qiagen公司,7AAD凋亡检测试剂盒购自美国BD公司。
1.3 方法
1.3.1 细胞培养、转染及分组 用含10%胎牛血清(FBS)及1%青链霉素双抗的DMEM高糖培养基培养SiHa、H8细胞,用含10% FBS及1%青链霉素双抗的DMEM中糖培养基并添加1%的谷氨酰胺培养C33a细胞。均放置在恒温、5% CO2培养箱中培养。显微镜下观察细胞密度达80%~90%时转染慢病毒。SiHa和C33a细胞均根据不同处理方法分为正常对照组(NC)、空载组(sh-NON)和沉默组1(shRACK1-1)、沉默组2(shRACK1-2)。具体转染步骤按照慢病毒构建公司说明书进行操作。转染24 h后,将部分细胞消化并均匀铺在激光共聚焦小皿内,待完全贴壁后,加入DAPI避光染细胞核15 min,PBS冲洗3次,每次15 min,将小皿放置于激光共聚焦显微镜下观察转染效率,拍照。qPCR验证转染后RACK1的表达情况。
1.3.2 宫颈组织RNA的提取 采用Trizol提取宫颈组织中的RNA,在液氮中取出癌组织以及正常组织,剪成1~2 mm的块状,放入2.0 ml U底管中,加入4 mm大型钢柱珠子1粒,3 mm小型钢珠2粒,盖上盖子放进液氮中冷冻60 s;取出2.0 ml U底管,加入1 ml Trizol溶液。设置研磨仪参数(频率60 Hz),研磨30 s。研磨充分后,采用Trizol法提取C33a、SiHa和H8细胞总RNA,根据RevertAid First Strand cDNA试剂盒说明书将RNA反转录合成cDNA。
1.3.3 qRT-PCR检测宫颈癌组织及C33a、SiHa细胞中RACK1、c-myc、caspase-3、caspase-9、Bax、Bcl-2mRNA的表达水平 根据QuantiNova SYBR Green PCR kit试剂盒说明,配制总反应体积为10 μl的反应体系,以β-actin作为内参照。检测CSCC组织、NC组织及H8细胞中RACK1mRNA的表达水平,以及CSCC组织内c-myc、caspase-3、caspase-9、Bax、Bcl-2mRNA的表达水平,并检测shRACK1-1、shRACK1-2、sh-NON组和NC组C33a、SiHa细胞中RACK1、c-myc、caspase-3、caspase-9、Bax、Bcl-2mRNA的相对表达水平。采用2–ΔΔCt法计算mRNA相对表达量,实验均重复3次。引物序列见表1。
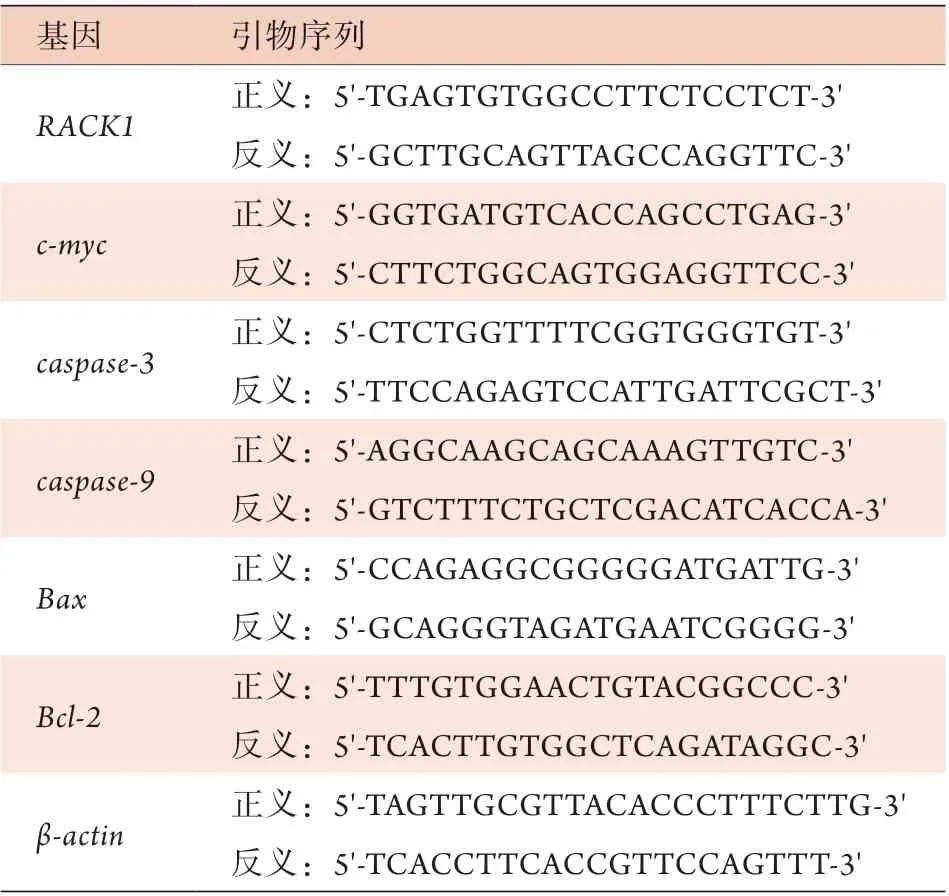
表1 qRT-PCR引物序列Tab.1 The qRT-PCR primer sequences
1.3.4 Western blotting检测RACK1、c-myc、caspase-3、caspase-9、Bax、Bcl-2、p-JAK2、p-STAT3、JAK2、STAT3蛋白表达水平 收集各组细胞沉淀加入RIPA细胞裂解液与PMSF(100:1),提取各组细胞总蛋白并使用BCA试剂盒检测蛋白浓度,根据蛋白浓度进行定量。高温变性后每组取30 μg蛋白进行80 min电泳分离,电转至PVDF膜上,室温用5%脱脂牛奶封闭2 h,4 ℃一抗孵育过夜,二抗(HRP标记)孵育2 h。采用ECL法显色,使用化学发光仪进行拍照并分析其灰度值,计算各蛋白相对表达量。
1.3.5 MTT实验检测细胞活性 采用MTT法检测各组C33a、SiHa细胞的增殖能力,分别在接种后第24、48、72 h检测OD值。将细胞以5×103个/150 μl密度接种于96孔板中,每组设3个复孔,每隔24 h取出,45°倾斜96孔板,将20 μl MTT溶液沿空壁加至培养基中,随后继续培养,4 h后弃去上清,沿孔壁缓缓加入150 μl二甲基亚砜(DMSO),酶标仪设定所需的程序后,振荡10 min,检测波长490 nm处的OD值。
1.3.6 平板克隆实验检测细胞集落形成能力 取各组对数生长期细胞,胰酶消化,将细胞吹散并悬浮于完全培养基中。每组细胞分别以103个/孔接种至6孔板中,每孔含2 ml完全培养基。37 ℃培养箱中培养2周,当出现肉眼可见的形似菌落时终止培养。弃上清,PBS洗3次,每次10 min,每孔加入3 ml固定液,常温固定30 min后,PBS洗2次,加800 μl结晶紫溶液浸染10 min,PBS冲洗至液体澄清,自然干燥。观察大体趋势后,显微镜下计数细胞团并拍照。
1.3.7 流式细胞术检测细胞凋亡水平 收集各组稳定转染的细胞株,PBS洗3次,胰酶消化后5000 r/min离心10 min,加入100 μl结合缓冲液,重悬细胞并将细胞密度调整为1×106/ml,加入5 μl Annexin V-FITC和PE,避光双染15 min,再次加入400 μl缓冲液,采用流式细胞仪检测细胞凋亡水平的变化。
1.4 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;RACK1mRNA与c-myc、caspase-9、caspase-3、Bax、Bcl-2mRNA表达水平的相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 RACK1在宫颈癌组织、正常宫颈组织和宫颈癌细胞中的表达情况 qRT-PCR检测结果显示,与正常宫颈组织(NC)相比较,宫颈癌组织(CSCC)中RACK1mRNA表达水平明显升高(P<0.001,图1A);且C33a、SiHa细胞中RACK1mRNA的表达水平明显高于H8细胞(P<0.001,图1B)。Western blotting检测结果显示,与H8细胞(0.4083±0.0931)相比,C33a(1.3697±0.0587)和SiHa(1.2848±0.0899)细胞中RACK1蛋白表达水平明显增高(P<0.001,图1C)。
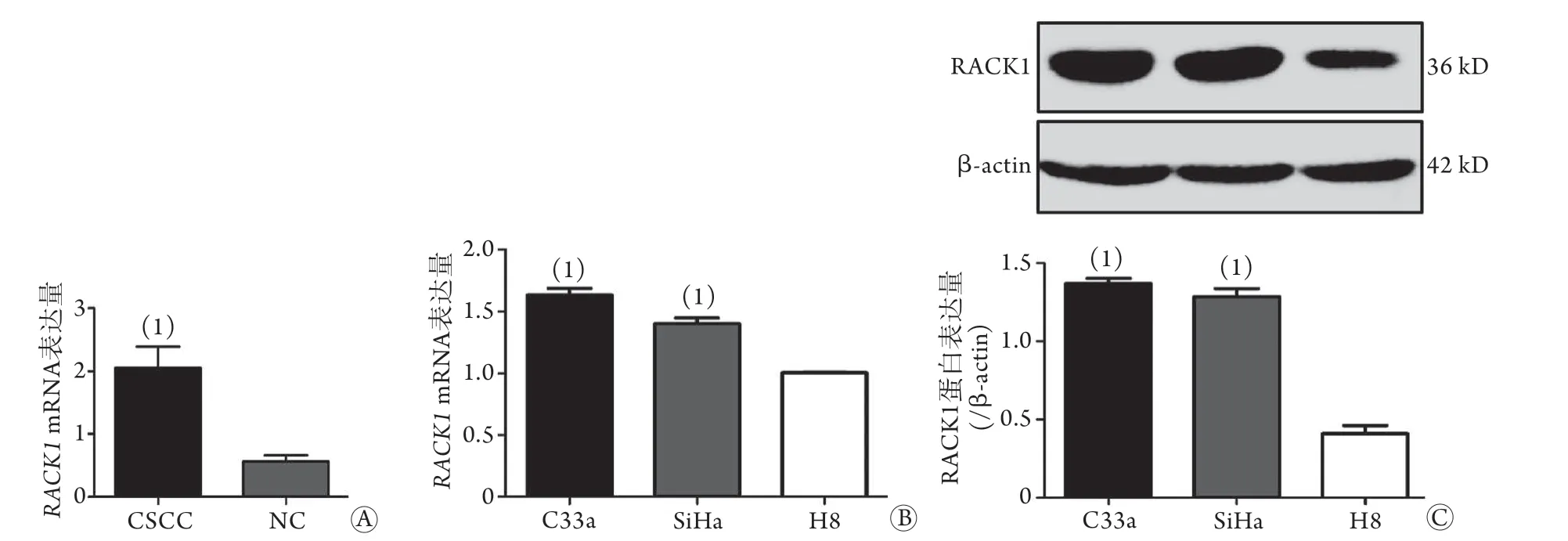
图1 RACK1在宫颈癌组织(CSCC)、正常宫颈组织(NC)和宫颈癌细胞中的表达Fig.1 Expression of RACK1 in cervical cancer and normal cervical tissues and cells
2.2 宫颈癌C33a和SiHa细胞转染慢病毒后RACK1mRNA和蛋白的表达情况 Western blotting检测结果显示,shRACK1-1组和shRACK1-2组C33a、SiHa细胞的RACK1蛋白表达水平较NC组、sh-NON组明显降低(P<0.001,图2A),而sh-NON组与NC组比较差异无统计学意义(P>0.05)。qRT-PCR检测结果与Western blotting检测结果一致(图2B)。故后续实验仅选用shRACK1-1、shRACK1-2和sh-NON组进行检测。
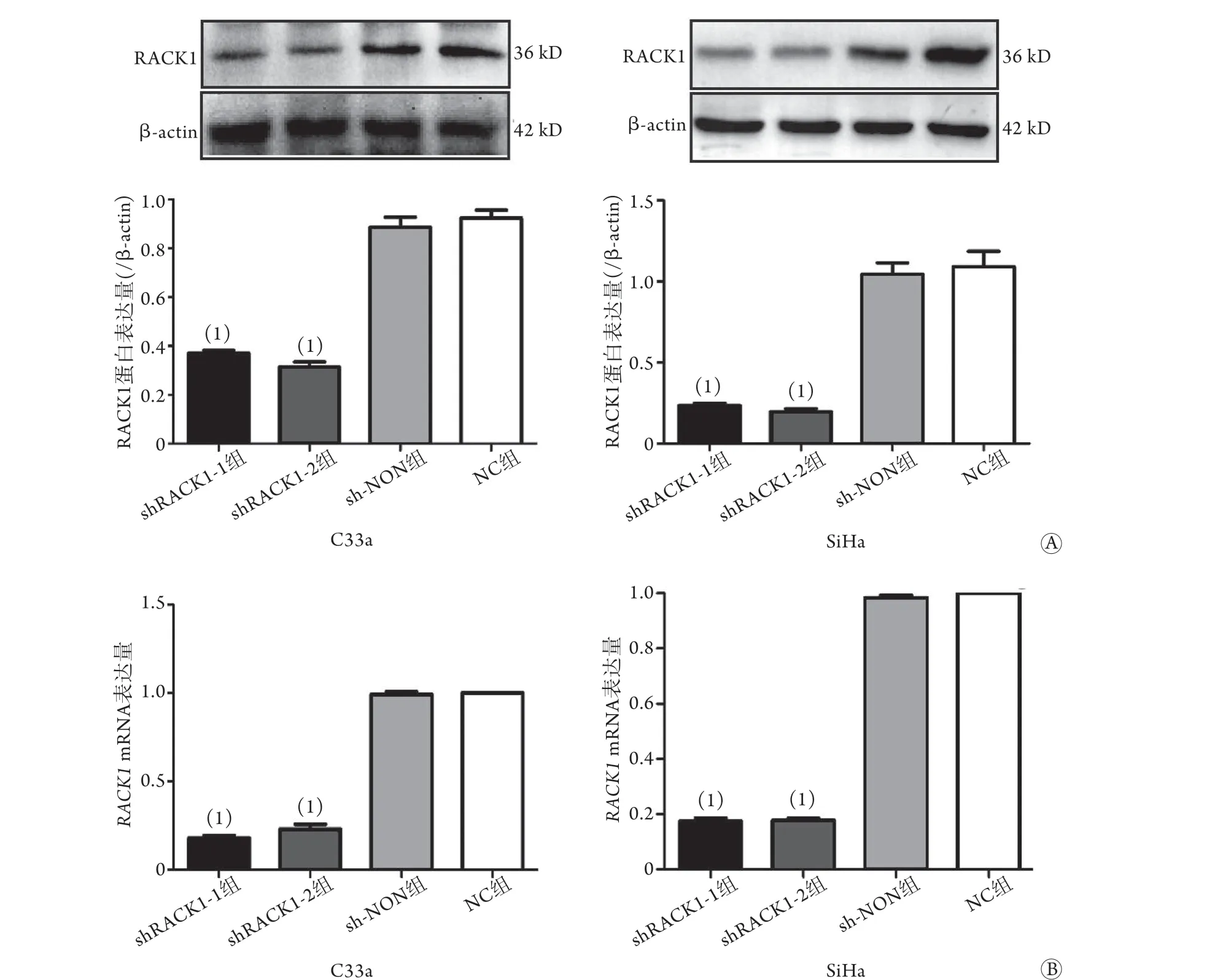
图2 慢病毒转染后各组宫颈癌C33a、SiHa细胞RACK1 mRNA及蛋白表达情况Fig.2 mRNA and protein expression of RACK1 in cervical cancer C33a and SiHa cells of each group after lentivirus transfection
2.3 沉默RACK1对宫颈癌细胞增殖能力的影响MTT法检测结果显示,shRACK1-1、shRACK1-2组C33a、SiHa细胞在24 h、48 h和72 h的生长速度均较sh-NON组明显降低(P<0.001,图3A)。平板克隆实验结果显示,与sh-NON组比较,shRACK1-1组和shRACK1-2组C33a、SiHa细胞的集落形成能力明显被抑制(图3B)。
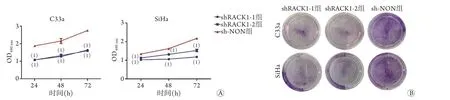
图3 沉默RACK1对宫颈癌C33a和SiHa细胞增殖及集落形成能力的影响Fig.3 Effect of RACK1 silencing on proliferation and colony formation of cervical cancer C33a and SiHa cells
2.4 沉默RACK1对宫颈癌细胞凋亡的影响 流式细胞术检测结果显示,shRACK1-1组及shRACK1-2组C33a、SiHa细胞总凋亡率均较sh-NON组明显增高(P<0.001)(图4)。
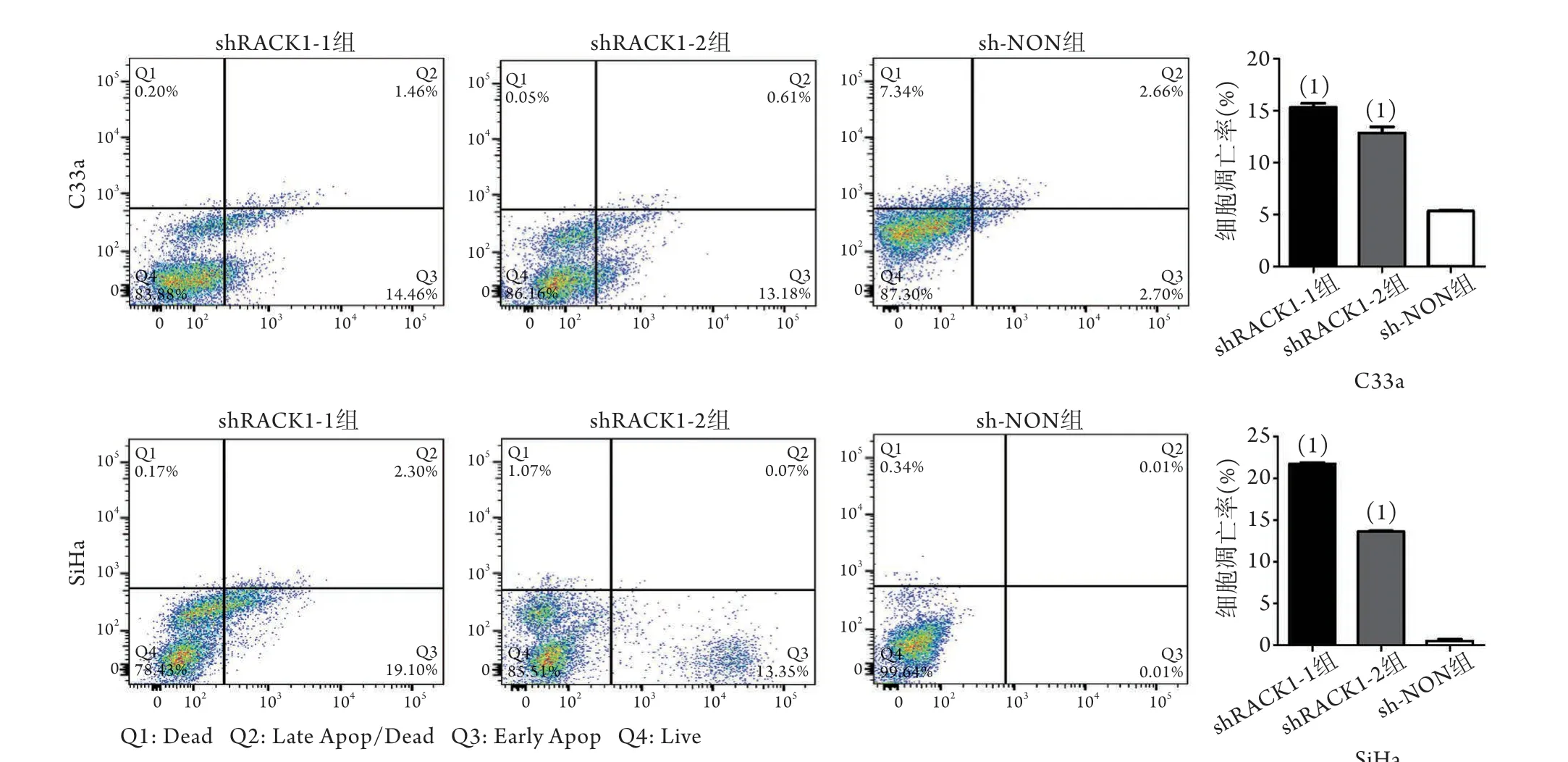
图4 流式细胞术检测沉默RACK1对宫颈癌C33a和SiHa细胞凋亡的影响Fig.4 Effect of RACK1 silencing on apoptosis of cervical cancer C33a and SiHa cells (Flow cytometry)
2.5 沉默RACK1对宫颈癌C33a和SiHa细胞增殖及凋亡相关蛋白表达的影响 Western blotting检测结果显示,沉默RACK1后,与sh-NON组比较,shRACK1-1组和shRACK1-2组C33a、SiHa细胞中增殖相关的关键蛋白c-myc和抗凋亡蛋白Bcl-2表达水平明显降低,而促凋亡蛋白caspase-3、caspase-9、Ba x的表达水平明显升高(P<0.001或P<0.01,图5A)。qRT-PCR检测结果与Western blotting检测结果一致(P<0.001,图5B)。
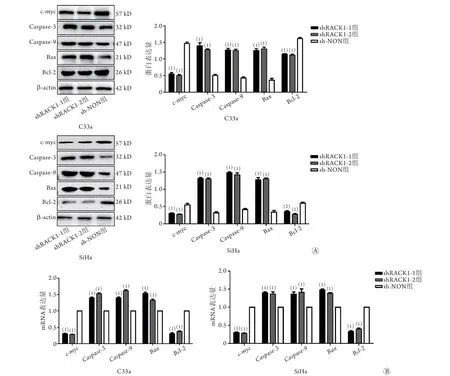
图5 沉默RACK1后各组C33a、SiHa细胞增殖、凋亡相关蛋白及mRNA的表达情况Fig.5 Proteins and mRNA expression related to proliferation and apoptosis in each group of C33a and SiHa cells after RACK1 silencing
2.6 宫颈癌组织中RACK1mRNA与增殖、凋亡相关基因表达的相关性 Spearman相关分析结果显示,宫颈癌组织中RACK1mRNA的表达水平与c-myc(r=0.713,P<0.001)、Bcl-2(r=0.846,P<0.001)mRNA呈明显正相关,而与caspase-3(r=–0.679,P<0.001)、caspase-9(r=–0.735,P<0.001)、Bax(r=–0.691,P<0.001) mRNA表达水平呈明显负相关(图6)。
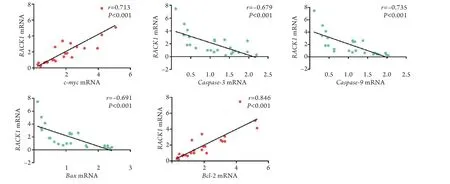
图6 宫颈癌组织中RACK1 mRNA与c-myc、caspase-3、caspase-9、Bax、Bcl-2 mRNA表达的相关性Fig.6 Correlation between mRNA expression of RACK1 and the mRNA expression of c-myc, caspase-3, caspase-9, Bax and Bcl-2 in cervical cancer tissues
2.7 沉默RACK1对宫颈癌细胞中JAK2/STAT3通路的影响 Western blotting检测结果显示,与sh-NON组比较,shRACK1-1组、shRACK1-2组C33a、SiHa细胞的非磷酸化JAK2和STAT3表达水平差异无统计学意义(P>0.05),而p-JAK2、p-STAT3表达水平明显升高,差异有统计学意义(P<0.001,图7)。
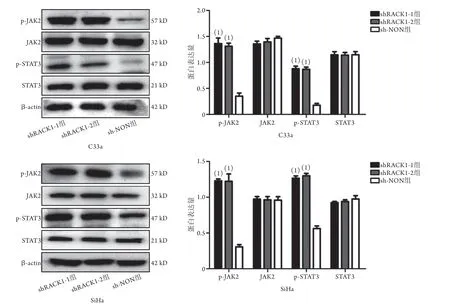
图7 沉默RACK1对宫颈癌细胞JAK2/STAT3通路的影响Fig.7 Effect of RACK1 silencing on JAK2/STAT3 pathway in cervical cancer cells
3 讨 论
宫颈癌作为妇科常见的恶性肿瘤,全球每年新增病例超过50万,而死亡人数高达30万,严重威胁患者的生命安全,并加重社会及家庭的经济负担[6]。宫颈癌发病的主要原因为人类乳头瘤病毒(HPV)持续感染,其次为多个性伴侣、性生活过早、吸烟等[7]。尽管随着早期筛查的普及和临床治疗方法的改进,宫颈癌发病率已大幅降低,但宫颈癌晚期转移仍是造成其预后不良的重要原因[8]。在我国,西部地区宫颈癌死亡率较沿海城市高,尤其在新疆地区,宫颈癌作为高发肿瘤严重影响当地女性患者的生活质量[9]。因此,明确肿瘤细胞增殖的分子机制,遏制细胞失控性增殖进而减缓肿瘤的恶性进展,对宫颈癌的临床治疗及患者的预后均具有积极意义。
RACK1是一种多功能支架蛋白,在细胞信号枢纽和蛋白活性调节中发挥重要作用,参与肿瘤细胞的增殖、迁移和侵袭。RACK1在乳腺癌[10]、口腔鳞状细胞癌[11]、非小细胞肺癌[12]、前列腺癌[13]等多种肿瘤中的表达明显增高,且与患者的不良预后密切相关。Liao等[14]发现,RACK1在宫颈癌中的表达明显升高,下调RACK1的表达可延缓宫颈癌细胞的恶性进展。Wang等[15]发现,RACK1可促进宫颈癌miR-302b/c/d-3p的表达,抑制细胞周期蛋白O(Cyclin O)的表达,并诱导细胞发生凋亡。近年来有研究发现,RACK1可与其他多种蛋白结合形成信号复合体参与肿瘤细胞的增殖及迁移,如RACK1与GNA14's相互作用后通过MAPK/JNK和PI3K/Akt信号通路抑制肝细胞癌的恶性进展[16]。2020年,Duan等[17]发现,RACK1可通过与NLRC3和NEK7相互作用,促进NLRP3炎性小体的组装,进而介导NLRP3炎性小体的活化。此外,还有研究发现,RACK1表达上调可抑制Wnt/β-catenin信号通路的激活,从而减缓胃癌细胞的生长和上皮-间质转化(EMT)的发生[18]。以上研究均提示,RACK1在肿瘤进展过程中扮演的角色并非一成不变,可能会受到组织特异性及地域环境等因素的影响。本研究检测了24例CSCC组织及24例NC组织RACK1mRNA的表达情况,以及两种宫颈鳞状癌细胞系(C33a和SiHa)和正常宫颈上皮细胞系(H8)中RACK1mRNA及蛋白的表达情况,结果发现RACK1在CSCC组织和C33a、SiHa细胞中均呈高表达,与上述文献报道一致,提示RACK1可能与宫颈癌的恶性进展相关。
肿瘤细胞的无限增殖和死亡抑制为肿瘤进展提供了潜在的动力。有研究发现,RACK1具有与几种促凋亡蛋白相互作用的能力。在结肠癌细胞中,RACK1可与凋亡蛋白Fem1b相互作用,并促进其泛素化,而下调RACK1则可导致Fem1b介导的细胞凋亡[19-20]。有研究提出,RACK1保护肿瘤细胞免于发生凋亡的作用主要与其调节BimEL的降解而产生的抗性有关[21]。本研究发现,RACK1沉默后,宫颈癌细胞SiHa、C33a的增殖能力明显下降,细胞凋亡率明显增高;增殖相关蛋白c-myc、抗凋亡蛋白Bcl-2表达明显降低,而与细胞凋亡密切相关的蛋白caspase-3、caspase-9和Bax表达明显增高。为进一步证实RACK1与宫颈癌细胞增殖及凋亡有关,本研究应用qRT-PCR方法检测宫颈癌组织中RACK1mRNA的表达水平,并分析其与增殖和凋亡相关基因表达的相关性,结果显示,在宫颈癌组织中,RACK1的表达与凋亡相关基因caspase-3、caspase-9和Bax呈明显正相关,而与c-myc、Bcl-2呈明显负相关。以上结果均提示,沉默RACK1可抑制宫颈癌细胞的增殖能力,促进肿瘤细胞发生凋亡。
JAK2/STAT3作为经典的信号转导通路,其异常活化往往涉及肿瘤细胞的多种生物学改变,包括促进肿瘤细胞增殖、转移、侵袭等[22-23]。Yuan等[24]发现,补体C3过表达可激活JAK2/STAT3通路加速胃癌进展。另有研究显示,circSPARC可通过调节JAK2/STAT3通路促进结直肠癌的恶性进展[25]。然而,RACK1对JAK2/STAT3通路的调控机制鲜有报道,Zhang等[26]发现,RACK1通过募集JAK2至核糖体来调控STAT3的活化,进而促进卵巢癌细胞的增殖。因此,RACK1促进肿瘤恶性进展的作用与JAK2/STAT3通路密切相关。本研究通过检测JAK2/STAT3信号通路蛋白的表达水平,进一步探讨了RACK1对宫颈癌细胞增殖与凋亡的可能作用。结果显示,JAK2/STAT3通路的关键蛋白(p-JAK2和p-STAT3)在shRACK1-1组、shRACK1-2组中的表达水平明显高于sh-NON组,而JAK2和STAT3蛋白表达未见明显改变,提示RACK1可通过JAK2/STAT3信号通路来调节宫颈癌细胞的增殖和凋亡。
综上所述,R ACK1在宫颈癌中呈过表达趋势,靶向沉默RACK1基因可有效降低增殖相关蛋白c-myc和抗凋亡蛋白Bcl-2的表达,增强促凋亡蛋白caspase-3、caspase-9、Bax的表达,该过程与JAK2/STAT3信号通路有关。但本研究仍存在不足之处,如对RACK1通过JAK2/STAT3信号通路调控细胞增殖与凋亡的探讨中缺少体内验证及通路恢复实验,因此,后续可进一步分析RACK1对JAK2/STAT3通路具体的分子调控机制,为RACK1作为评估宫颈癌生物学行为的潜在分子标志物提供理论基础。

