自噬在劳力性热射病大鼠急性肺损伤中的作用
江利亚,张玉想,张志华,王佳兴,毛汉丁
1河北北方学院研究生学院,河北张家口 075000;2解放军总医院第八医学中心重症医学科,北京 100091;3河北北方学院附属第一医院呼吸内科,河北张家口 075000;4解放军总医院第一医学中心重症医学科,北京 100853
热射病(heat stroke,HS)是中暑最严重的一种疾病状态,根据致热因素不同可分为经典型(非劳力性)及劳力性两种[1],其中劳力性热射病(exertional heat stroke,EHS)是一种致死性疾病,主要为高温环境下运动或劳作产生的内源性热所致[2]。EHS导致机体产热-散热失衡,引起体温迅速升高,甚至超过40 ℃。EHS是一种伴有中枢神经系统异常(主要为意识障碍)的多器官功能障碍(multiple organ dysfunction syndrome,MODS)致死性疾病,好发于夏季剧烈运动的青年人或在高温环境中工作的建筑工人等[3]。急性肺损伤(acute lung injury,ALI)及急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是EHS的常见并发症[4-5],但目前EHS相关肺损伤的发病机制仍不明确。
自噬是指在细胞代谢过程中依赖溶酶体途径将受损细胞器及异常蛋白质降解的过程,它受多种信号分子及信号通路的调节,是机体一种重要的自我防御及保护机制[6-7]。研究证实,自噬参与了脓毒症肺损伤的发生,而上调自噬则能减轻脓毒症小鼠的肺损伤[8-10]。在HS中,自噬与HS的心肌损伤及脑损伤有密切关系,适度上调自噬有助于减轻HS的心肌损伤及脑损伤[11-12]。但自噬改变是否参与了EHS肺损伤的发生目前鲜见报道。本研究通过建立EHS大鼠模型,探讨了自噬在EHS肺损伤中的作用,以期为EHS相关ALI的防治提供理论依据。
1 材料与方法
1.1 主要仪器与试剂 六道小动物跑台(XR-PT-10A,上海欣软信息科技有限公司)放置于透明模拟高温高湿环境实验舱中[13],该舱能精准控制舱内温度及湿度并维持恒定。巴弗洛霉素A1(bafilomycin A1,Baf A1)、伊文思蓝(Evans blue,EB)均购自美国MCE公司;雷帕霉素(rapamycin,RAPA)购自美国APExBIO公司;二甲基亚砜(DMSO)购自美国Sigma公司;兔抗大鼠微管相关蛋白1轻链3 (microtubuleassociated protein 1 light chain 3,LC3)抗体购自美国CST公司;磷酸甘油醛脱氢酶(glyceraldehyde phosphatedehydrogenase,GAPDH)单克隆抗体及兔单克隆抗体p62均购自英国Abcam公司;原位末端转移酶标记法(TdT-mediated dUTP nick-end labeling,TUNEL)试剂盒购自瑞士Roche公司;辣根过氧化物酶标记的山羊抗兔IgG、山羊抗小鼠IgG均购自北京中杉金桥生物技术有限公司;甲酰胺购自上海麦克林生化科技有限公司。
1.2 实验动物 健康清洁级成年Wistar雄性大鼠60只,体重300~350 g,购自斯贝福(北京)生物科技有限公司,许可证编号:SCXK(京)2019-0010。动物饲养于解放军总医院第八医学中心动物实验室(SPF级),温度25~26 ℃,相对湿度为50%~60%。实验动物相关方案通过解放军总医院第八医学中心动物伦理委员会批准。
1.3 研究方法
1.3.1 大鼠适应性跑步训练 在进行热打击之前,实验大鼠均在室温(25~26 ℃)下采用阶梯锻炼法进行为期1周的适应性训练。前3 d按以下程序进行:大鼠从饲养笼转移至实验舱后,以初始速度5 m/min开始跑步(坡度为0),每2 min增速1 m/min,20 min增速至15 m/min后维持匀速跑,直至出现疲劳状态(经轻推、噪声等无痛刺激驱赶后仍不能坚持跑步持续5 s以上),跑步时间不超过30 min。第4、5天,增速方案如前,但跑步时间延长至60 min。第6、7天为休息日,大鼠仅进行舱内环境适应,不进行跑步训练。训练期间大鼠自由进食、饮水。
1.3.2 EHS大鼠模型的建立 大鼠热应激实验前禁食12 h,饮水不限。在开始建模前30 min称重并禁止饮水。当实验舱温度达到(39.5±0.3) ℃、相对湿度为(55%±5%)时,将大鼠放入跑台[14-15],以5 m/min的初始速度开始跑步(坡度为0),每2 min增速1 m/min,20 min增速至15 m/min后保持恒定速度持续跑步,直到出现疲劳状态(适当驱赶后仍无法继续跑步)停止跑步。实验全程严密观察大鼠意识、精神变化,在大鼠达到EHS诊断标准后,将其从热舱中取出,停止热暴露,继续监测大鼠精神状态至建模后5 h。EHS的诊断标准为大鼠出现HS神经系统功能障碍表现,即无自主活动时间大于5 s(轻度无痛刺激不能驱赶动物爬行或改变位置)[16-17]。
1.3.3 实验动物分组 将60只健康清洁级雄性Wistar大鼠按照随机数字表法分为4组:正常对照组、EHS组、EHS+Baf A1组、EHS+RAPA组,每组15只。其中29只大鼠用于EB实验(正常对照组、EHS组和EHS+Baf A1组,每组7只),EHS+RAPA组为8只;剩余31只大鼠用于其余实验。正常对照组不做任何处理,EHS组建模成功后立即从热舱中取出,于室温(22~24 ℃)下放置自然降温,严密观察大鼠精神、意识变化。RAPA(规格:25 mg)、Baf A1(规格:1 mg)溶解于100% DMSO溶液中,配制浓度为2 g/L的原液,两种药物分别在大鼠建模前于每日同一时间点以1 mg/kg剂量连续腹腔注射4 d。各组大鼠均于建模后5 h处死,取肺等器官组织进行后续实验。
1.3.4 大鼠肺组织大体形态学观察 采用腹主动脉放血法处死大鼠,取大鼠双肺组织,肉眼观察双侧肺部的颜色、光泽、弹性、淤血及肿胀程度。
1.3.5 大鼠动脉血气分析 建模后5 h,大鼠经腹腔麻醉后开腹,分离附着于腹主动脉上的结缔组织,用肝素抗凝的1 ml动脉血气针经腹主动脉采集0.5 ml血液,使用PREMIER 4000动脉血气分析仪测定动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)。
1.3.6 大鼠肺系数测定 采用腹主动脉放血法处死大鼠后取双肺组织,PBS液反复漂洗,用滤纸吸干肺组织表面水分,称量全重,计算肺系数(lung weight/body weight,LW/BW)。LW/BW=肺湿重(mg)/大鼠体重(g)。
1.3.7 大鼠肺血管通透性测定 采用EB染色检测大鼠肺组织通透性[18]。将EB染料溶于生理盐水配制为2%的溶液,以2 ml/kg剂量从大鼠尾静脉注入,观察到大鼠眼睛、耳朵变蓝即可确认染料已被吸收并分布于大鼠体内。EB在体内循环2 h后,经腹腔麻醉开胸,剪开右心耳,经左心室注入10 ml PBS液,冲出循环系统中残留的EB,直至右心房流出的液体呈无色清亮状。取全肺组织,将肺组织及甲酰胺按照0.1 g∶1 ml的比例浸泡萃取,然后放置于60 ℃温箱中孵育16 h,待组织中色素全部浸出,取出组织,1 500 r/min离心10 min后取上清液,用分光光度计在620 nm波长处进行比色,测量吸光度值(A),并计算肺组织中的EB含量。
1.3.8 大鼠肺组织病理学观察 剪取各组大鼠右肺下叶组织小块,置于4%甲醛溶液固定,经过乙醇梯度脱水、常规石蜡包埋后切片(厚度4 μm),HE染色,中性树胶封片,光镜下观察肺组织病理学变化。根据Hong等[19]的标准进行肺组织病理学损伤评分,在倒置显微镜(200倍)下随机选取10个视野,观察肺组织病理学变化并进行评分。评分项目包括肺泡腔充血、中性粒细胞浸润、纤维蛋白渗出、肺泡间隔增宽,每项按损伤程度评为0、1、2、3分,分别为无损伤及轻度、中度、重度损伤,计算平均得分。
1.3.9 TUNEL法检测细胞凋亡情况 取肺组织石蜡切片,梯度乙醇脱蜡,自来水冲洗,滴入蛋白酶工作液,于37 ℃孵育20 min,PBS洗涤;滴加TUNEL溶液,于37 ℃孵育1 h,PBS洗涤;再滴加TUNEL溶液,室温孵育20 min,PBS冲洗后进行二氨基联苯胺(DAB)染色,苏木精复染,梯度乙醇脱水,透明、封片,光镜下观察。阳性细胞即凋亡细胞呈棕黄色,正常细胞呈蓝色。采用Image J图像分析软件对各组TUNEL染色切片图像进行分析,每张切片显微镜下随机选取5个视野(200倍),计算凋亡指数(apoptosis index,AI)。AI=阳性细胞数/总细胞数×100%。
1.3.10 Western blotting检测大鼠肺组织中LC3及p62蛋白表达量 将肺组织按比例加入预冷的组织裂解液中裂解,BCA法测定蛋白浓度,行12% SDSPAGE电泳,然后转移至PVDF膜,脱脂奶粉室温封闭1 h,分别加入一抗兔抗大鼠LC3抗体(1∶1000)及兔抗大鼠单克隆抗体p62(1∶1000),4 ℃孵育过夜,TBS-T洗涤,分别加入二抗(辣根过氧化物酶标记的山羊抗兔及山羊抗小鼠IgG,1∶2000),化学发光法显色。以GADPH作为内参照,采用IPP软件对扫描图像的目的条带进行灰度分析,并计算蛋白相对表达量。
1.4 统计学处理 采用GraphPad Prism 9软件进行统计分析。数据符合正态分布,均以±s表示,多组间比较采用单因素方差分析,两两比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肺组织大体形态学观察 正常对照组大鼠肺组织肉眼观呈粉红色,表面光滑,色泽光亮;EHS组大鼠肺组织肿胀明显,色泽暗淡,呈暗红色,且液体渗出较多。与EHS组比较,EHS+Baf A1组大鼠肺组织肿胀明显加重,整肺发生严重水肿,肺组织间隙聚积过多液体,由于重力影响使肺部不能保持正常形状,表面伴多处出血点,而EHS+RAPA组大鼠肺组织肿胀情况明显减轻,表面颜色近似粉红色,且渗出减少(图1)。
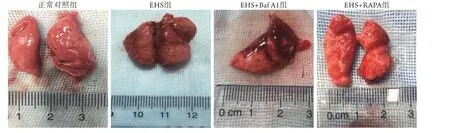
图1 各组大鼠肺组织标本肉眼观Fig. 1 Macroscopic view of lung tissue specimens of rats in each group
2.2 各组大鼠PaO2、PaCO2比较 与正常对照组比较,EHS组大鼠PaO2降低,PaCO2升高,差异有统计学意义(P<0.05)。与EHS组比较,EHS+Baf A1组PaO2下降,PaCO2升高,EHS+RAPA组PaO2升高,PaCO2降低,接近正常范围,差异均有统计学意义(P<0.05,表1)。
表1 各组大鼠PaO2、PaCO2比较(mmHg,±s, n=15)Tab.1 Comparison of PaO2 and PaCO2 of rats in each group(mmHg, ±s, n=15)
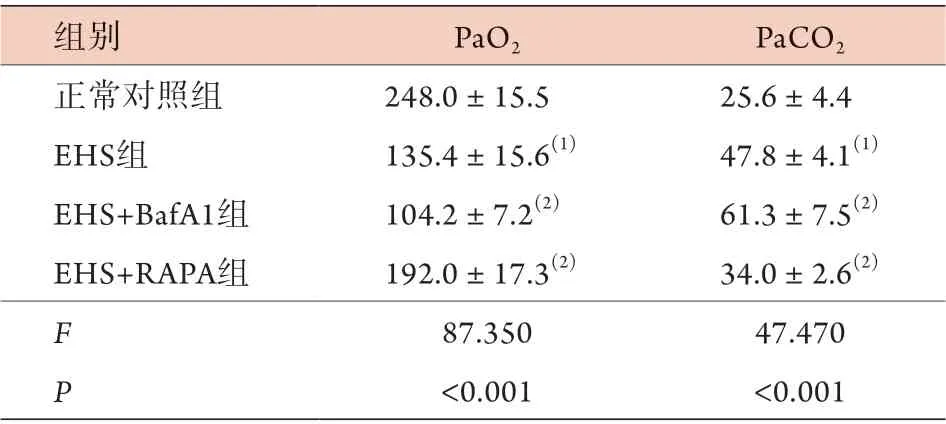
表1 各组大鼠PaO2、PaCO2比较(mmHg,±s, n=15)Tab.1 Comparison of PaO2 and PaCO2 of rats in each group(mmHg, ±s, n=15)
EHS. 劳力性热射病;Baf A1. 巴弗洛霉素A1;RAPA. 雷帕霉素;PaO2. 动脉血氧分压;PaCO2. 动脉血二氧化碳分压;与正常对照组比较,(1)P<0.05;与EHS组比较,(2)P<0.05
组别 PaO2 PaCO2正常对照组 248.0±15.5 25.6±4.4 EHS组 135.4±15.6(1) 47.8±4.1(1)EHS+BafA1组 104.2±7.2(2) 61.3±7.5(2)EHS+RAPA组 192.0±17.3(2) 34.0±2.6(2)F 87.350 47.470 P<0.001 <0.001
2.3 各组大鼠肺系数变化 与正常对照组比较,EHS组大鼠的肺系数增高[(4.5±0.3) mg/gvs.(3.6±0.2) mg/g],差异有统计学意义(P<0.05)。与EHS组比较,EHS+Baf A1组大鼠肺系数[(5.3±0.7) mg/g]增高,而EHS+RAPA组肺系数[(3.7±0.1) mg/g]降低,差异均有统计学意义(P<0.05,图2A)。
2.4 各组大鼠肺血管通透性的变化 与正常对照组比较,EHS组大鼠肺血管通透性明显增加,EB渗出量增多[(72.0±5.4) μg/gvs. (18.4±1.6) μg/g],差异有统计学意义(P<0.05)。与EHS组比较,EHS+Baf A1组大鼠的血管通透性进一步增加,EB渗出量进一步增多[(80.0±4.9) μg/g];而EHS+RAPA组大鼠肺血管通透性则明显下降,EB渗出量减少[(53.9±6.9) μg/g],差异均有统计学意义(P<0.05,图2B)。
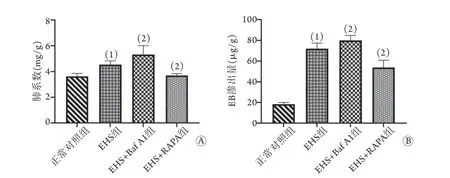
图2 各组大鼠肺系数(A)及EB渗出量(B)比较Fig.2 Comparison of pulmonary index (A) and EB content (B) of rats in each group
2.5 各组大鼠肺组织的病理损伤 HE染色结果(图3)显示,在无热打击情况下,正常对照组大鼠肺组织肺泡壁光滑,结构正常无破坏,且肺泡腔无液体渗出;与正常对照组比较,EHS组大鼠肺泡间隔及
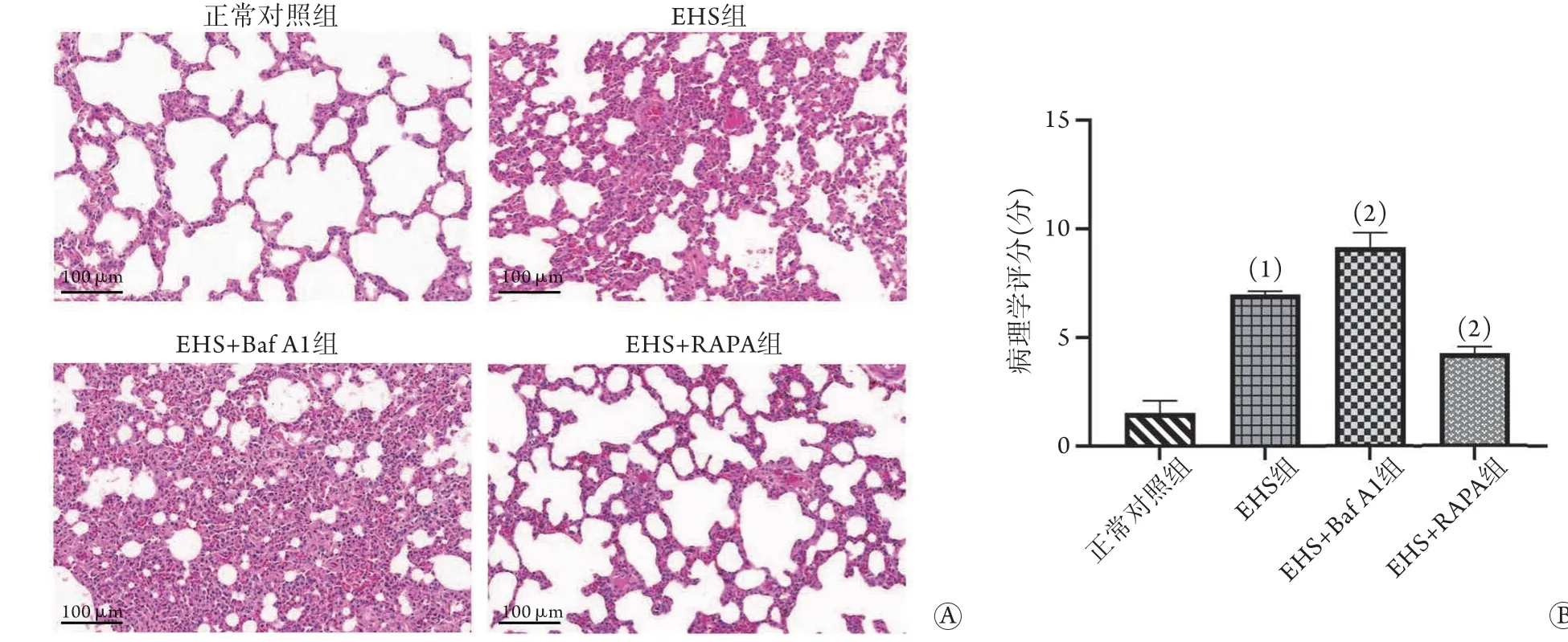
图3 各组大鼠肺组织病理学变化Fig.3 Pathological changes of rat lung tissue in each group
肺泡壁明显增厚不均,部分肺泡塌陷,肺泡腔出现大量红细胞、炎症细胞及血浆样物质渗出,肺组织病理学评分明显增加[(7.0±0.1)分vs. (1.5±0.6)分];与EHS组比较,EHS+Baf A1组大鼠肺组织液渗出、炎症浸润程度进一步加重,肺组织病理学评分明显增加[(9.2±0.7)分],而EHS+RAPA组大鼠肺组织液渗出及炎症浸润严重程度均不及EHS组,且出血减少,肺泡结构逐渐恢复,肺组织病理学评分明显降低[(4.3±0.3)分],差异均有统计学意义(P<0.05)。
2.6 各组大鼠肺组织细胞凋亡情况 与正常对照组比较,EHS组大鼠肺组织凋亡细胞数增多,AI明显升高(50.8%±5.6%vs. 8.0%±1.0%);与EHS组比较,EHS+Baf A1组大鼠肺组织凋亡细胞数进一步增多,AI明显升高(84.7%±3.4%),但EHS+RAPA组大鼠肺组织凋亡细胞数减少,AI明显降低(33.8%±2.3%),差异均有统计学意义(P<0.05,图4)。
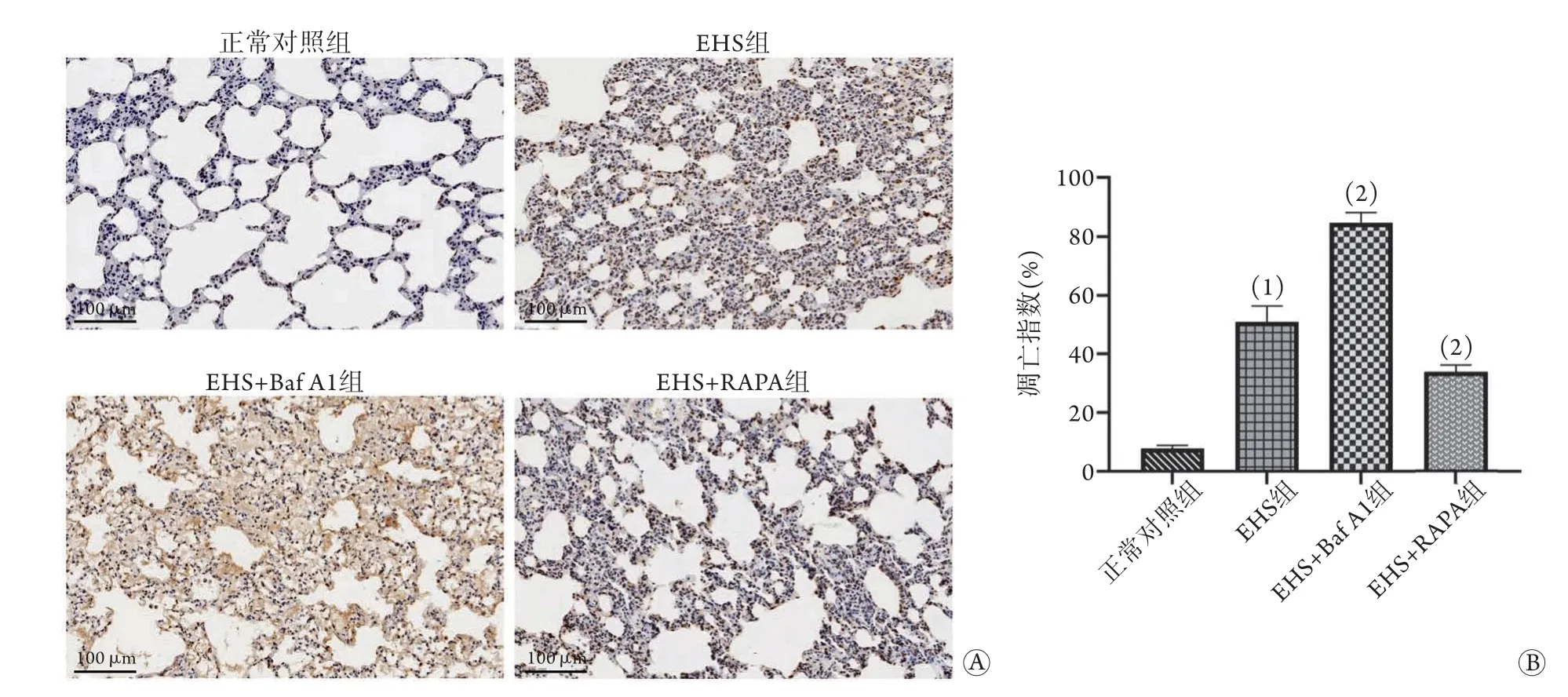
图4 各组大鼠肺组织凋亡情况比较Fig.4 Comparison of apoptosis of lung tissue of rats in each group
2.7 各组大鼠LC3及p62蛋白表达 与正常对照组比较,EHS组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ比值明显降低(0.3±0.1vs. 1.0±0.1),p62表达水平明显增高(1.4±0.2vs. 0.8±0.1)。与EHS组比较,EHS+Baf A1组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ比值降低(0.10±0.04),p62表达水平进一步升高(1.7±0.1),而EHS+R APA组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ比值明显升高(0.5±0.1),p62表达水平明显降低(1.1±0.1),差异均有统计学意义(P<0.05,图5)。
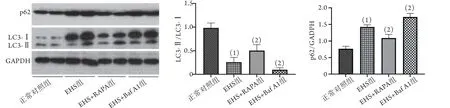
图5 Western blotting检测各组大鼠肺组织自噬水平Fig.5 Autophagy levels in lung tissues of rats in each group (Western blotting)
3 讨 论
EHS是热相关疾病最严重的一种表现,常导致多个脏器发生损伤,其中肺最易受累[3-4]。EHS引发的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)会引起肺内皮屏障功能障碍,诱导肺毛细血管通透性增加,最终导致肺组织结构破坏,部分肺泡呈实变状,肺间质弥漫性水肿,肺功能受损[20-21]。上述既往研究结果与本实验通过大鼠EHS模型观察到的EHS组大鼠肺组织肺泡间隔及肺泡壁明显增厚,肺泡腔出现大量的红细胞、炎症细胞及血浆样物质渗出等ALI病理变化,以及肺系数、肺组织凋亡细胞数、肺血管通透性、肺水含量增加,PaO2下降的结果相一致,表明热打击可引起肺水肿及肺组织细胞凋亡,最终导致肺损伤,提示EHS损伤模型建立成功。
细胞凋亡是多种因素如盲肠结扎穿孔、脂多糖、缺血缺氧等诱发ALI的病理生理机制之一。研究证实,细胞凋亡是导致ALI的途径之一,凋亡细胞越多,肺损伤越严重[22-23]。本研究结果显示,EHS组大鼠肺组织凋亡细胞增多,AI升高,提示热应激可促进细胞凋亡,而细胞凋亡可能是EHS肺损伤的发生机制之一。
自噬是存在于所有真核细胞中的一种高度保守的细胞生理学现象,能将体内受损的细胞器及各种错误折叠蛋白通过与溶酶体结合进行自我吞噬或降解,降解过程中产生的氨基酸及其他小分子物质可被机体再利用,维持细胞能量平衡,是机体在饥饿、创伤等多种应激条件下作出的适应性反应[24]。自噬可分为巨自噬、微自噬及分子伴侣介导的自噬3种类型,通常所说的自噬指巨自噬,也是目前研究最多的类型[25]。自噬与ALI的发生发展密切相关[26-27]。自噬与凋亡是细胞生命终点的不同表现形式,两者之间的功能关系错综复杂。研究表明,自噬能抑制细胞凋亡及坏死,从而保护细胞[28]。机体在应对多种刺激时,细胞将首先启动自噬机制,降解受损细胞器(如线粒体),从而防止触发凋亡途径,避免细胞凋亡或坏死[29]。EHS引起的病理生理变化类似于脓毒症[30],EHS导致的肺损伤也与脓毒症肺损伤极其相似。研究表明,激活自噬能减轻脓毒症导致的肺组织细胞凋亡,缓解脓毒症肺损伤[26,31],其激活机制可能与PI3K/Akt/mTOR信号通路及PINK1/Parkin信号通路有关[6]。本研究结果显示,经Baf A1预处理后,大鼠肺组织细胞自噬水平下降,凋亡细胞数及AI与EHS组比较进一步增高,而RAPA预处理后,大鼠肺组织细胞自噬水平升高,凋亡细胞数及AI均明显降低,表明热打击能促进细胞凋亡,降低大鼠肺组织细胞的自噬水平,从而加重肺损伤;通过上调自噬可以减轻此损伤。
此外,自噬还参与调节机体的炎症反应,并与慢性阻塞性肺疾病、肺炎、脓毒症等炎症性疾病相关[31-32]。研究表明,上调自噬能减轻机体的炎症反应,自噬可通过抑制炎症相关信号转导及T细胞分化、清除炎症介质、抑制炎症反应等减轻炎症损伤[33-34]。
LC3分为Ⅰ型、Ⅱ型,是酵母自噬相关基因8(autophagy-related gene 8,Atg8)在哺乳动物中的同源基因。未发生自噬时,可溶性的LC3-Ⅰ型蛋白分布于细胞表面;当自噬发生时,位于细胞表面的LC3-Ⅰ与磷脂酰乙醇胺耦联形成LC3-Ⅱ并附着在自噬体膜上,由于LC3-Ⅱ始终稳定地定位于自噬体膜上,直到与溶酶体融合,理论上可以通过计算LC3-Ⅱ或LC3-Ⅱ/LC3-Ⅰ的比值来评价自噬水平的高低。但有研究指出LC3-Ⅱ在自噬流受阻的情况下也可出现高表达[35],故单纯通过LC3-Ⅱ水平来判断自噬活性是非常武断的,而LC3-Ⅱ/LC3-Ⅰ的比值更能反映自噬的真实强度。p62被认为是选择性的自噬受体蛋白,能同时连接待降解的泛素化底物和LC3蛋白。当自噬被激活时,p62结合泛素化底物蛋白分子进入自噬小体,并与溶酶体结合形成自噬溶酶体,随后被溶酶体中的水解酶降解。p62作为自噬降解底物,其表达量与自噬活性成反比,含量越低意味着自噬下游越通畅[36]。本研究通过Western blotting检测了EHS相关ALI时自噬标志蛋白LC3及p62的表达情况,结果显示EHS组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ比值明显低于正常对照组,而p62表达增高,提示EHS大鼠肺组织中自噬小体形成发生障碍,自噬水平降低。
Baf A1可通过抑制H+-ATP酶而阻止自噬体与溶酶体之间的融合,从而实现对自噬过程的抑制,是一种自噬抑制剂。RAPA通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路来实现对自噬过程的激活,是一种自噬增强剂。本研究分别使用Baf A1及RAPA预处理大鼠,结果显示,与EHS组比较,Baf A1组大鼠肺组织损伤程度更严重,伴有肺水肿加重、肺血管通透性增加、肺细胞凋亡数增多等,病理学结果显示肺组织中有大量炎症细胞浸润,肺部出现明显的炎症反应,LC3-Ⅱ/LC3-Ⅰ比值明显降低,p62蛋白表达增加。相反,给予RAPA预处理后,大鼠肺部炎症明显缓解,肺组织凋亡细胞数减少,LC3-Ⅱ/LC3-Ⅰ比值明显升高,p62蛋白表达水平降低,即抑制自噬会加重EHS大鼠肺损伤,上调自噬水平可能有利于减轻EHS肺损伤,提示EHS导致的肺损伤可能与自噬成熟障碍有关。
综上所述,本研究证实EHS能导致肺损伤,肺组织自噬水平降低是EHS导致肺损伤发生的机制之一,上调自噬水平可减轻EHS大鼠的肺损伤,但其机制尚不清楚,未来仍需进一步深入研究。

