糖尿病合并肾功能不全患者HbA1c估算平均血糖校正模型的建立
刘肖肖,李书青,张倩,李强,何洪波,李英莎,祝之明,闫振成
陆军特色医学中心(大坪医院)高血压内分泌科/全军高血压代谢病中心/重庆市高血压研究所,400042 重庆
糖尿病已成为威胁人们健康的重大公共卫生问题,是成年终末期肾病(end-stage renal disease,ESRD)的首要病因[1-2]。良好的血糖控制是预防糖尿病肾病发生、延缓疾病进展的重要措施[3]。糖化血红蛋白(HbA1c)是糖尿病患者长期血糖控制的主要指标,目前,《中国2型糖尿病防治指南》推荐对合并ESRD的患者可放宽血糖控制标准至8.0%~8.5%[4]。然而,由于红细胞寿命缩短、血红蛋白(hemoglobin,Hb)结构改变等原因所致的慢性贫血以及血液透析等情况,ESRD患者的HbA1c水平常常被低估[5-6],而目前采用的HbA1c估算平均血糖的方法主要针对肾功能正常患者,明显低估了肾功能不全患者的血糖水平[7]。多项研究证实,ESRD患者的24 h平均血糖与HbA1c的相关性较差[8-9]。因此,在临床推荐的HbA1c控制标准下患者的真实血糖水平长期未能达标,可能是相关死亡事件风险增高的重要原因。目前国内外仍缺少肾功能不全患者HbA1c估算24 h平均血糖的临床评价模型。本研究拟通过分析肾功能不全不同阶段的糖尿病患者HbA1c、平均血糖、Hb与估算肾小球滤过率(estimated glomerular filtration rate,eGFR)之间的关系,建立糖尿病合并慢性肾功能不全患者HbA1c估算24 h平均血糖的新方法,从而为个体化制定HbA1c控制目标提供依据。
1 资料与方法
1.1 研究对象 收集2018年1月-2021年12月于陆军特色医学中心(大坪医院)高血压内分泌科住院治疗的329例2型糖尿病患者作为建模群,对其临床资料进行回顾性分析。其中,男196例、女133例,年龄(61.0±12.8)岁。根据1999年世界卫生组织(WHO)的糖尿病诊断标准[10]进行糖尿病的诊断:空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L,或口服葡糖糖耐量试验(oral glucose tolerance test,OGTT) 2 h血糖≥11.1 mmol/L。纳入标准:(1)年龄≥18岁,性别不限;(2)既往已诊断的糖尿病患者及新诊断的糖尿病患者;(3)住院期间完善OGTT。排除标准:(1)1型糖尿病患者;(2)存在糖尿病急性并发症(糖尿病酮症酸中毒、高血糖高渗状态等);(3)肝脏功能损害[谷丙转氨酶(ALT)或谷草转氨酶(AST)≥正常值上限3倍以上];(4)妊娠或哺乳期妇女;(5)2周内有脑梗死、心肌梗死、重大外伤或手术等应激状态;(6)血糖监测及OGTT期间采取限制性饮食、生酮饮食或地中海饮食。然后将所有患者参照肾脏病改善全球预后(kidney disease improving global outcomes,KDIGO)指南建议的慢性肾脏病分期标准[11]进行分期,并依据eGFR水平分为对照组[eGFR≥60 ml/(min.1.73 m2),n=165]与肾功能不全组[eGFR<60 ml/(min.1.73 m2),n=164]。另外收集2022年1-3月于陆军特色医学中心(大坪医院)高血压内分泌科住院治疗并符合纳入排除标准的合并肾功能不全的2型糖尿病患者29例作为验证群对该模型进行外部验证。本研究遵循赫尔辛基宣言及药物临床试验质量管理规范(GCP)指导原则,研究方案已获陆军特色医学中心(大坪医院)伦理委员会审查(医研伦审号2021-13),所有患者均已签署知情同意书。
1.2 收集资料 通过电子病历系统采集所有研究对象的相关资料,包括姓名、性别、年龄、糖尿病病程、体重指数(BMI)、收缩压、舒张压、FPG、OGTT 2 h血糖[12]、HbA1c、Hb、血清肌酐(Scr)、eGFR、尿素氮(BUN)、总胆固醇(TC)、三酰甘油(TG)、人血白蛋白(ALB)、ALT、AST。
1.3 指标分析 在建模群中,对对照组和肾功能不全组的基线资料(包括年龄、性别、糖尿病病程等一般资料和血糖、Hb、肾功能等实验室检查指标)进行统计学描述及对比。根据贾伟平教授团队应用HbA1c估算24 h平均血糖的数学模型[7]和应用本课题组前期研究得到的OGTT估算24 h平均血糖模型[13]两种方法计算对照组与肾功能不全组患者的24 h平均血糖水平,并得出两种计算方法得到的24 h平均血糖差值。进一步分析肾功能不全组HbA1c估算24 h平均血糖差值与Hb的相关性,得出平均血糖优化评估模型。在验证群采用拟合优度指标进行外部验证,以评估模型的可行性。

2 结 果
2.1 建模群一般资料比较 与对照组比较,肾功能不全组的糖尿病患者年龄大(P=0.001)、糖尿病病程长(P<0.001),HbA1c(P=0.034)、Hb(P<0.001)及A L B(P<0.0 0 1)水平降低,S c r(P<0.0 0 1)、BUN(P<0.001)水平升高;但两组的性别比例、FPG、OGTT 2 h血糖、收缩压、舒张压、BMI、TC、TG、AST、ALT差异均无统计学意义(表1)。
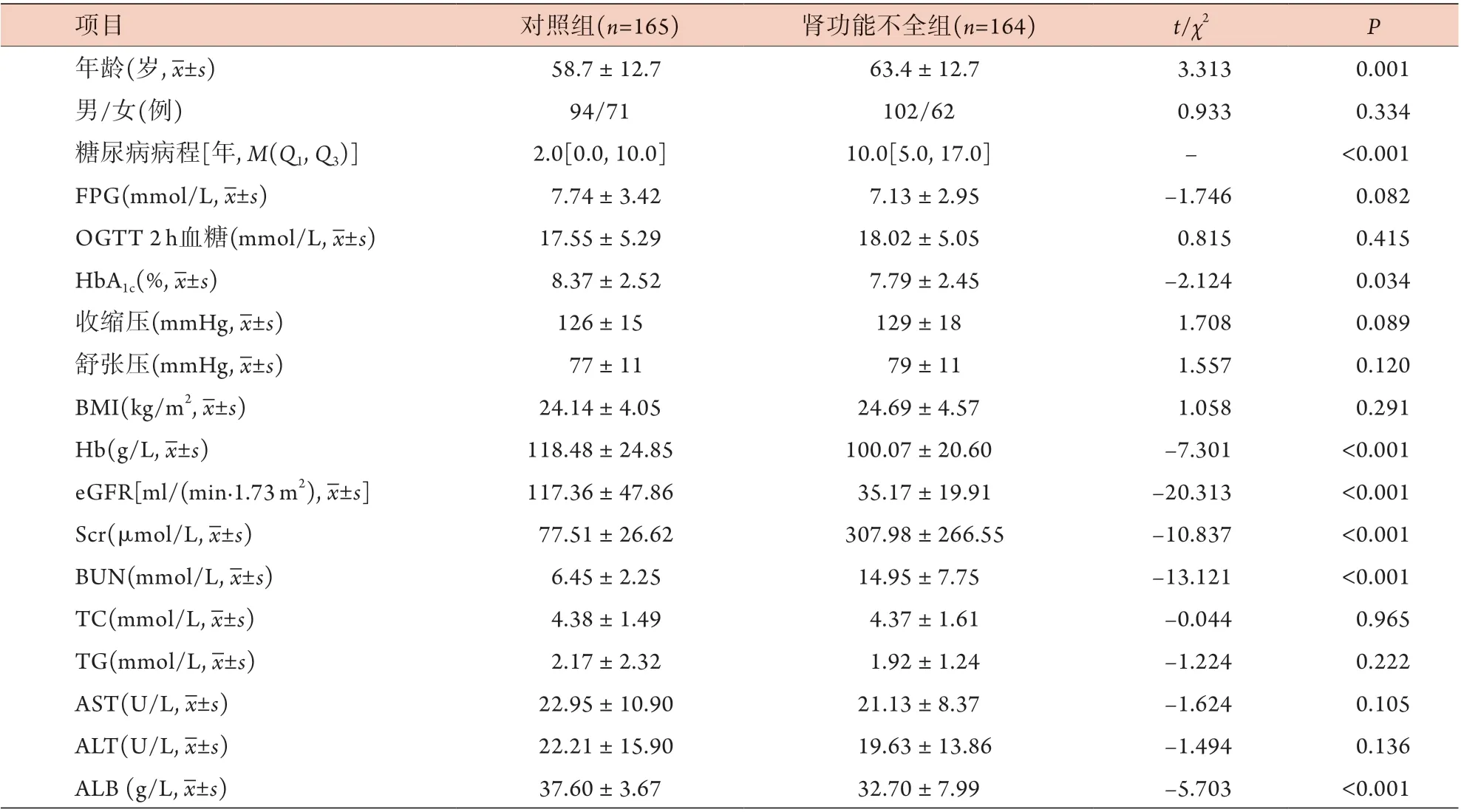
表1 对照组与肾功能不全组一般资料的比较Tab.1 Comparison of the general data between control group and renal insufficiency group
2.2 肾功能不全患者应用HbA1c估算24 h平均血糖差值与Hb的相关性 依据贾伟平团队HbA1c估算24 h平均血糖的数学模型计算两组患者24 h平均血糖,发现对照组平均血糖明显高于肾功能不全组[(10.72±4.00) mmol/Lvs. (9.48±3.30) mmol/L,P=0.002];应用OGTT估算24 h平均血糖模型计算对照组与肾功能不全组平均血糖未见明显差异[(10.63±2.41) mmol/Lvs. (10.36±2.49) mmol/L,P=0.3 3 1]。肾功能不全组2 4 h 平均血糖差值较对照组明显增高[(0.8 8±1.6 4) m m o l/Lv s.(–0.09±2.10) mmol/L,P<0.001](图1A);在所有纳入患者中,Hb≤90 g/L的糖尿病患者24 h平均血糖差值较Hb>90 g/L者明显增加[(1.13±1.74) mmol/Lvs.(0.21±1.95) mmol/L,P<0.001](图1B)。进一步的相关性分析结果显示,肾功能不全组患者24 h平均血糖差值与Hb水平呈明显负相关(r=–0.377,P<0.001,图1C),而与ALB水平无明显相关(P=0.551)。
2.3 糖尿病合并肾功能不全患者24 h平均血糖优化评估模型 将HbA1c、Hb、年龄、糖尿病病程、eGFR及ALB纳入线性回归模型进行分析,其中年龄、糖尿病病程、eGFR及ALB予以排除(P>0.05),建立糖尿病合并肾功能不全患者的24 h平均血糖估算模型:平均血糖(mmol/L)=4.539+0.95×HbA1c-0.016×Hb(校正R2=0.829,P<0.001)。将校正前后24 h平均血糖值与OGTT估算24 h平均血糖差值进行对比,肾功能不全组患者24 h平均血糖差值校正后明显减小[(0.02±1.05) mmol/Lvs.(0.88±1.64) mmol/L,P<0.001](图1D)。
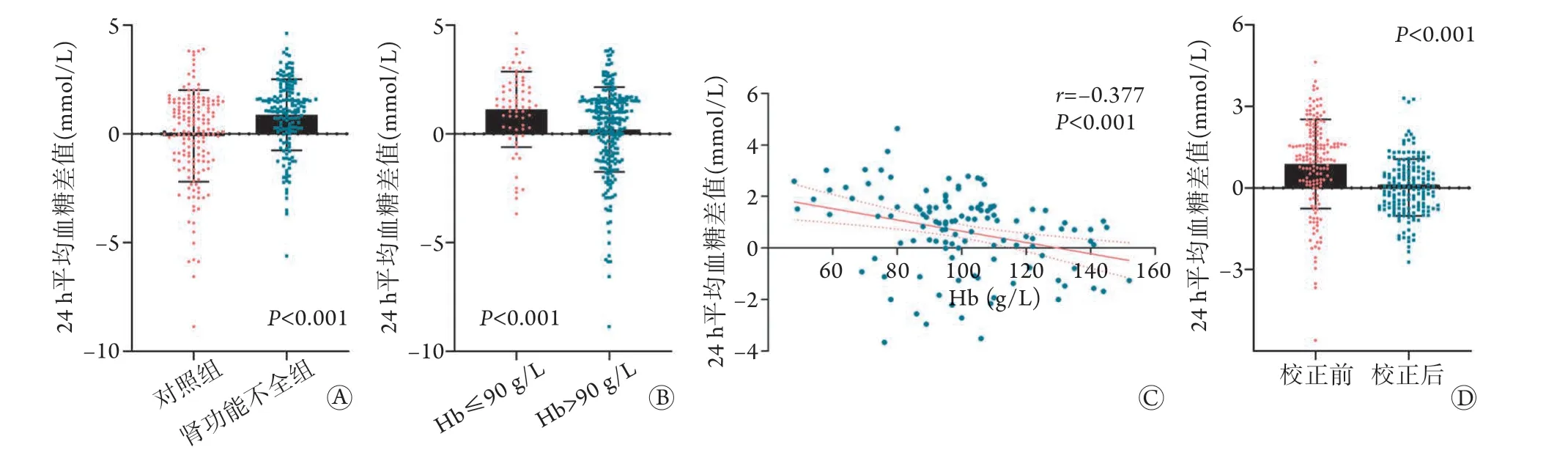
图1 HbA1c和OGTT两种方法估算的24 h平均血糖差值分析Fig.1 Analysis of the gap 24-hour average blood glucose levels estimated by HbA1c and OGTT
2.4 模型验证 验证群入组患者平均年龄62.7岁,男12例,女17例,糖尿病病程平均3年,FPG均值为6.90 mmol/L,餐后2 h血糖均值为14.35 mmol/L,HbA1c均值为7.26%,Hb均值为95.38 g/L,eGFR均值为44.93[ml/(min.1.73 m2)],得到的拟合优度指标RNL=0.830,表明该模型与实际24 h平均血糖拟合度较高。
3 讨 论
HbA1c是糖尿病患者长期血糖控制的重要监测指标,已被临床用于估算24 h平均血糖[7,15],而良好的血糖控制对预防糖尿病相关血管并发症的发生及延缓疾病进展具有重要意义。目前指南推荐对于>60岁的老年糖尿病患者,尤其是存在ESRD等并发症的情况下,为了更好地平衡低血糖风险与心血管获益之间的关系,建议将HbA1c控制在<8.5%水平(相当于平均血糖11.1 mmol/L)[4]。然而,上述评估方法主要基于贾伟平教授团队建立的国人HbA1c估算平均血糖的方法[7],其入组人群平均Scr水平为69.3 μmol/L,明显低于ESRD患者。多项研究表明,ESRD患者常常合并红细胞寿命缩短、Hb水平降低,从而明显影响HbA1c反映实际血糖水平的准确性[5,16]。本研究通过计算HbA1c估算平均血糖与实际检测血糖的差值,发现合并肾功能不全及Hb<90 g/L的糖尿病患者HbA1c估算24 h平均血糖差值明显增加。但上述结论并不适用于所有类型的贫血,尤其对于最常见的缺铁性贫血,由于红细胞寿命延长,进而导致HbA1c出现假性增高[17-18]。近期的一项系统评价同样证实,无论是否合并糖尿病,在对人群进行HbA1c评估及治疗前均应筛查并尽可能纠正贫血状态,尤其是在糖尿病患者中设定HbA1c控制目标时尤其要注意治疗前的贫血状态[19]。
糖尿病合并肾功能不全尤其是ESRD患者出现的肾性贫血是心脑血管事件的高危因素[19-20]。鉴于因贫血对HbA1c低估所致的控糖达标的假象,有学者提出了多项替代评估指标[5]。目前,糖化白蛋白作为ESRD合并糖尿病患者血糖替代控制目标的研究较多[8-9,21-22]。然而,ESRD患者同样容易合并由于肝硬化、肾病综合征及高脂血症等所致的低蛋白血症,从而影响糖化白蛋白测量的准确性。日本的一项研究针对合并ESRD的糖尿病患者纳入了糖化白蛋白、BMI及Hb指标,建立了应用糖化白蛋白估算HbA1c的公式[23],然而该研究中纳入的对象主要为透析患者,且合并明显的低蛋白血症,从而影响了糖化白蛋白对HbA1c的评估价值。本研究对合并肾功能不全患者HbA1c的影响因素进行分析,并未发现年龄、糖尿病病程、eGFR及ALB水平对HbA1c存在显著影响。虽然有研究发现年龄可影响HbA1c水平,每增长10岁,HbA1c水平即增加0.1%,但该结果主要为健康人群的研究,在糖尿病患者尤其是合并肾功能不全患者中,年龄的影响显著下降[24]。本研究通过综合考虑肾功能不全及Hb水平对HbA1c的影响,建立了糖尿病合并肾功能不全患者HbA1c估算平均血糖的校正模型,经校正后其对24 h平均血糖估算的偏差与校正前相比有所减小。
早期研究已经证实,过高的血糖水平可降低红细胞寿命,其机制为通过影响Na+-K+-ATP酶的活性而导致红细胞通透性及形态改变,最终使红细胞破坏[25]。合并肾功能不全患者降糖药物代谢过程的改变,以及并发症情况极易使血糖出现剧烈波动,同时持续高血糖状态导致的氧化应激、炎症反应、血脂异常、渗透压改变等同样会影响红细胞功能[26],使血糖与Hb的结合异常,进而导致HbA1c对患者血糖水平的评估发生偏差。目前,已有较多研究通过红细胞早期筛查指标进行血糖监测及糖尿病相关并发症的早期识别[26-28],这些指标是否能够对患者血糖控制情况进行有效预测仍需进一步临床验证。
综上所述,本研究通过纳入影响HbA1c的因素进行分析,建立了糖尿病合并肾功能不全患者HbA1c估算24 h平均血糖的校正模型,有助于临床上进一步制定合并肾功能不全患者的HbA1c控制标准,在优化血糖控制目标,进而改善患者预后、预防肾病进展中具有重要临床意义。但本研究为回顾性研究,样本量较小,且对糖尿病患者降糖药物的使用未进行规范,不能完全排除药物的潜在影响。后续需要对模型参数进一步优化,以提高预测的准确性,并广泛开展相关血糖预测试验进行验证。

