表皮生长因子甲基化与肺腺癌细胞对吉非替尼耐药的相关性研究
郭玲玲,何蕾,段凤英
(1.南昌大学附属人民医院呼吸内科;2.南昌大学第二附属医院呼吸内科,南昌330006)
2018 年有报告[1]显示肺癌是中国以及全世界发病率和死亡率最高的癌种。非小细胞肺癌占肺癌85%左右。多数非小细胞肺癌在确诊时已经丧失手术机会,目前的放化疗效果有限,且不良反应较大[2]。随着越来越多的肺癌驱动基因被发现,精准治疗是目前及未来肺癌治疗的方向。以吉非替尼、厄洛替尼为代表的表皮生长因子酪氨酸激酶抑制剂(Epidermal Growth Factor Receptor-tyrosine Kinase Inhibitors,EGFR-TKIs)是目前成功运用于非小细胞肺癌的分子靶向药物[3]。已被指南推荐应用于存在EGFR敏感突变的非小细胞肺癌的一线治疗,但随后发现的继发性和原发性耐药降低了其临床疗效[4]。
目前临床上多采用检测EGFR的突变来预测肺癌对EGFR-TKIs的敏感性。存在EGFR基因敏感突变的非小细胞肺癌对TKIs的敏感性达75%(多为19外显子的缺失及21外显子的L858R点突变),但在治疗的过程中或者治疗后大多数会发生继发性耐药。而大多数EGFR野生型非小细胞肺癌对EGFR-TKIs原发性耐药,但临床上仍发现大约10%的EGFR野生型的非小细胞肺癌对EGFR-TKIs敏感,另外有小部分存在EGFR敏感突变的非小细胞肺癌对EGFR-TKIs耐药[5-6]。这表明EGFR突变状态不是评价非小细胞肺癌对EGFR-TKIs是否耐药的唯一指标。越来越多的研究发现表观遗传学的甲基化参与了TKIs的耐药。本课题拟探讨EGFR基因启动子甲基化在肺腺癌细胞对吉非替尼原发及继发性耐药中的作用。
1 材料与方法
1.1 材料试剂 肺腺癌细胞株购自上海肺癌研究所:H1299(对吉非替尼原发耐药),H1975(T790M突变,对吉非替尼继发耐药),HCC827(19外显子敏感突变,对吉非替尼敏感);RPMI1640细胞培养液,10%胎牛血清购自美国Gibco公司;5-氮杂-2’-脱氧胞苷(5-aza-CdR)购自美国sigma公司;吉非替尼粉剂购自大连美仑生物技术有限公司,溶解于DMSO,制成实验相应浓度1000倍的溶液,分装保存于-20℃冰箱中备用,实验时用培养液稀释至目标浓度,使终溶液中DMSO体积分数低于0.1%。CCK8细胞增殖及细胞毒性检测试剂盒购自Biosharp公司;重亚硫酸盐DNA甲基化试剂盒购自Qiagen公司;DNA提取试剂盒购自上海天根化工有限公司;细胞凋亡检测试剂盒购自南京凯基生物。
1.2 方法
1.2.1 细胞培养 肺腺癌细胞株H1299、H1975、HCC827采用含有10%胎牛血清RPMI1640细胞培养液,于37℃培养箱中培养,次日换液,继续培养,每两天换液1次,待长满培养瓶后消化传代,待传到第3代,对数生长期细胞用于实验。
1.2.2 甲基化检测 肺腺癌细胞株H1299、H1975、HCC827培养至对数生长期后随机分为两组:A组:对照组(不加5-aza-CdR),B组:试验组(加入1μmol/L 5-aza-CdR处理),在第24 h、48 h、72 h 0.25%胰酶消化收集各组细胞,提区细胞DNA,进行甲基化修饰,之后根据MSP试剂盒的流程进行各组细胞EGFR甲基化的检测。EGFR甲基化引物:正义链TGTTTTTTCGCGTTTCGGTTCGCGC;反义链:CGTCTAAACGACGACGACCGCCG;产物150 bp;EGFR非甲基化引物:正义链:TGTTTTGTTTTT TTGTGTTTTGGTTTGTGT;反义链:CATCCAATCTA AACAACAACAACCACCA;产物150 bp。将PCR产物电泳,根据条带亮度,判断3组细胞5-aza-CdR的最佳去甲基化时间。
1.2.3 CCK-8测增殖抑制率 培养肺腺癌细胞株H1299、H1975、HCC827,至对数生长期后随机分为两组。A组:对照组(不加任何药物);B组:5-aza-CdR组(加入1μmol/L 5-aza-CdR,处理时间为最佳的去甲基化时间72 h);C组:吉非替尼组(加入1μmol/L的吉非替尼,作用时间同72 h);D组:联合处理组(1μmol/L 5-aza-CdR加1μmol/L的吉非替尼);采用CCK-8方法测各组细胞的增殖抑制率。
1.2.4 流式细胞技术测细胞凋亡率 分别取处于对数生长期,生长状态良好的H1299,H1975和HCC827细胞,用1640培养基调整细胞密度到3×105/mL,接入6孔板,每孔1 mL细胞悬液,37℃培养过夜;对细胞进行分组,A组:正常对照组;B组:吉非替尼处理组(加入的1μmol/L的吉非替尼);C组:5-aza-CdR处理组(加入1μmol/L的5-aza-CdR);D组:吉非替尼+5-aza-CdR联合处理组(加入1μmol/L吉非替尼和1μmol/L 5-aza-CdR)作用时间:72 h,收集细胞,1200 rpm,5 min离心,去上清,加PBS重悬细胞,按照AnnexinV-FITC/PI细胞凋亡检测试剂盒操作说明进行检测四组细胞的凋亡率。
2 结果
2.1 甲基化特异性PCR检测 H1299细胞(EGFR野生型,对吉非替尼原发耐药)EGFR启动子是高甲基化,给予5-aza-CdR处理的最佳去甲基化时间为72 h(见图1);H1975细胞(T790M突变,对吉非替尼获得性耐药)EGFR启动子为部分甲基化,甲基化程度低于原发耐药的H1299细胞,给予5-aza-CdR处理的最佳去甲基化时间为72 h(见图2);HCC827细胞(19外显子缺失突变,对吉非替尼敏感)EGFR启动子为非甲基化的,给予5-aza-CdR处理其启动子仍为非甲基化(见图3)。
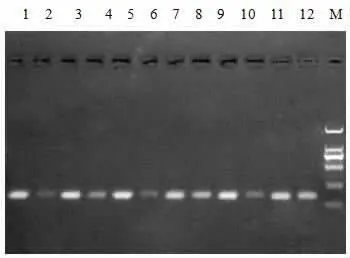
图1 为H1299EGFR启动子MSP结果:1.A组24 h M;2.A组24 h U;3.B组24 h M;4.B组24 h U;5.A组48 h M;6.A组48 h U;7.B组48 h M;8.B组48 h U;9.A组72 h M;10.A组72 h U;11.B组72 h M;12.B组72 h U;M:DL2000Ma rk(A组为对照组:不加任何药物;B组为5-a za-Cd R组:加入1μmol/L 5-a za-Cd R;M代表甲基化;U代表非甲基化)。
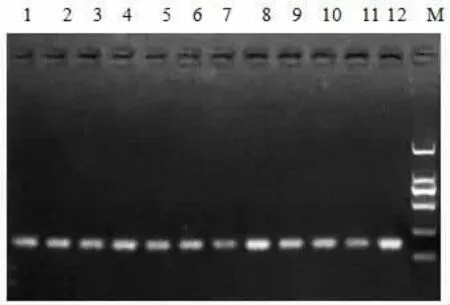
图2 为H1975EGFR启动子MSP结果:1.A组24 h M;2.A组24 h U;3.B组24 h M;4.B组24 h U;5.A组48 h M;6.A组48 h U;7.B组48 h M;8.B组48 h U;9.A组72 h M;10.A组72 h U;11.B组72 h M;12.B组72 h U;M:DL2000Ma rk(A组为对照组:不加任何药物;B组为5-a za-CdR组:加入1μmol/L 5-a za-Cd R;M代表甲基化;U代表非甲基化)。

图3 为HCC827细胞EGFR启动子MSP结果标注(A组为对照组:不加任何药物;B组为5-a za-Cd R组:加入1μmol/L 5-a za-Cd R;M代表甲基化;U代表非甲基化):1.A组24 h M;2.A组24 h U;3.B组24 h M;4.B组24 h U;5.A组48 h M;6.A组48 h U;7.B组48 h M;8.B组48 h U;9.A组72 h M;10.A组72 h U;11.B组72 h M;12.B组72 h U;M:DL2000Ma rk。
2.2 CCK-8测各组细胞的增殖抑制率 1μmol/L的5-aza-CdR和1μmol/L吉非替尼分别及联合处理H1299、H1975、HCC827细胞,72 h后CCK方法测定各组细胞的增殖抑制率,见表1。
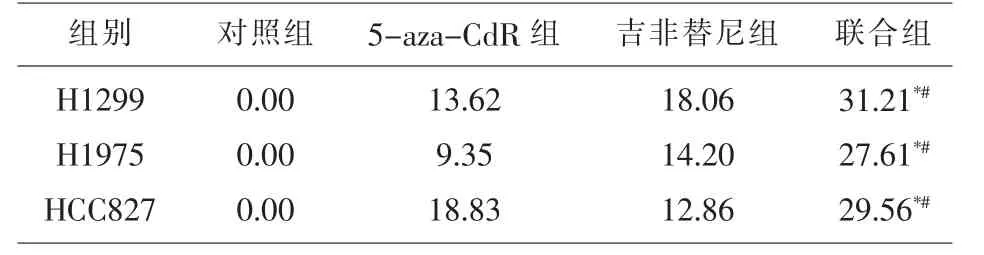
表1 CCK方法测各组细胞的增殖抑制率(%)
2.3 流式细胞技术测细胞凋亡率 按照AnnexinVFITC/PI细胞凋亡检测试剂盒操作说明进行操作测各组细胞的凋亡率,见表2。
3 讨论
甲基化是表观遗传学的常见形式。DNA甲基化是在DNA甲基转移酶(DNA Methyltrans--ferase DNMTs)的催化下由S-腺苷甲硫氨酸提供甲基将之转移到DNA的5’-胞嘧啶使之转变为5’-甲基胞嘧啶的过程[7]。越来越多的研究证实甲基化参与了许多基因的表达、转录,与多种药物的耐药相
关[8-9]。
目前已经证实部分肺腺癌患者的EGFR启动子存在着不同程度的甲基化。且临床发现单纯依靠EGFR基因突变的检测来预测肺腺癌患者是否对EGFR-TKIs敏感,存在一定的失败率。那么EGFR甲基化是否与肺腺癌对EGFR-TKIs的耐药相关,成为解决EGFR-TKIs耐药问题的一个突破点。强少盈等[10]通过检测肺癌术后病理标本发现EGFR敏感突变的肺癌患者均未发现甲基化,相反,未检测出敏感突变的肺癌标本存在较高的甲基化率,EGFR启动子的甲基化与EGFR突变之间存在明显相关性。孙俊杰等[11]研究6个不同的非小细胞肺癌细胞株,研究结果显示,同为19外显子敏感性突变,HCC827细胞对吉非替尼敏感,H1650细胞对吉非替尼不敏感;同为EGFR野生型,H358细胞较H1299、A549细胞对吉非替尼更敏感,甚至其敏感性超过19外显子突变的H1650细胞。随后作者通过甲基化特异性PCR、RT-PCR及Westernbolt检测发现EGFR基因启动子区高甲基化可以下调EGFR基因mRNA及蛋白的表达水平,从而有可能降低非小细胞肺癌对EGFR-TKIs(如吉非替尼)的敏感性,所以作者认为EGFR基因启动子甲基化可能参与了肺癌细胞对EGFR-TKIs的耐药。
5-氮杂-2’-脱氧胞苷(5-aza-CdR)是DNA甲基转移酶抑制剂,它能够抑制甲基转移酶的活性从而使DNA甲基化水平降低,从而使转录失活的基因再表达。那么5-aza-CdR能否降低肿瘤细胞EGFR启动子甲基化,从而提高EGFR基因的表达,改善肿瘤对EGFR-TKIs的耐药。早在2006年Alerto J[12]曾在乳腺癌细胞株CAMA1和MB453中发现其EGFR启动子区CpG甲基化分别为90%和30%~50%,作者采用RT-PCR及Western-blot分别检测正常乳腺细胞株及EGFR启动子非甲基化的和甲基化的细胞株,发现EGFR启动子甲基化的细胞株存在EGFRmRNA及蛋白水平的低表达或者不表达。接着作者采用甲基化转移酶抑制剂地西他滨作用于两个细胞株,72 h后,RT-PCR显示EGFR的mRNA表达增加。乳腺癌细胞株CAMA1和MB453均对EGFR-TKI药物吉非替尼相对耐药,采用地西他滨及吉非替尼联合处理后细胞凋亡增加,所以作者认为甲基化转移酶抑制剂和吉非替尼有协同作用。 遗憾的是国外没有甲基化转移酶抑制剂和EGFR-TKIs联合处理在肺癌中的研究,国内仅有2013年Li XY等[13]研究分别及联合采用吉非替尼及5-aza-CdR处理三个非小细胞肺癌细胞系H1650、H1299、PC-9,并采用甲基化特异性PCR(MSP)检测其EGFR启动子甲基化水平,结果发现EGFR启动子为非甲基化的PC-9对吉非替尼敏感,EGFR启动子高甲基化的H1650、H1299对吉非替尼耐药,之后使用5-aza-CdR逆转EGFR启动子高甲基化后可以提高吉非替尼对肿瘤细胞的抑制作用,诱导细胞凋亡。因此作者认为EGFR启动子高甲基化可能与非小细胞肺癌对TKIs耐药有关,降低EGFR甲基化也许可以逆转肺癌细胞对TKIs的耐药。徐姝等[14]采用采用甲基化转移酶抑制剂5-氮杂胞苷及吉非替尼分别及联合处理非小细胞肺癌细胞株H1650和H1299,发现联合处理组细胞的EGFR表达增加,细胞的凋亡增加。胡成平等[15]发现吉非替尼敏感细胞株PC9和耐药细胞株PC9/GR的EGFR启动子甲基化分别为59%和74%,但RT-PCR检测发现PC9/GR的EGFRmRNA表达水平高于PC9细胞,这与之前的多数研究不相符,可能表明甲基化不是影响EGFRmRNA表达的唯一原因,但是具体机制不太清楚。
那么EGFR启动子甲基化是否与肺腺癌细胞对吉非替尼原发性耐药及继发性耐药均相关,在原发性和继发性耐药中有无区别,以及EGFR启动子去甲基化后是否可以逆转肺癌细胞对吉非替尼的耐药呢?本研究采用甲基化转移酶抑制剂5-氮杂-2’-脱氧胞苷(5-aza-CdR)及吉非替尼,分别及联合处理肺腺癌细胞株H1299(原发耐药),H1975(T790M突变,继发耐药),HCC827(19外显子敏感突变)。通过甲基化特异性PCR检测发现原发性耐药的H1299细胞EGFR启动子存在高甲基化,继发性耐药的H1975细胞EGFR启动子为部分甲基化,甲基化程度低于原发耐药的H1299细胞。存在敏感突变的HCC827细胞EGFR启动子为非甲基化的,提示甲基化可能参与了肺腺癌细胞对吉非替尼的耐药,通过CCK-8法测定发现吉非替尼联合5-aza-CdR可以明显抑制肺腺癌细胞的增殖。进一步分析吉非替尼联合5-aza-CdR在改善肺腺癌细胞对EGFR-TKIs原发性及继发性耐药中区别,发现二者联合可以更好的抑制原发性耐药的H1299细胞的增殖,与继发性耐药相比差异具有统计学意义。采用流式细胞技术检测各组细胞凋亡率,发现联合治疗组可以促进H1299,H1975及HCC827三组细胞的凋亡,与单用吉非替尼组相比,差异有统计学意义。但三组之间差异无统计学意义。
总之本研究证实EGFR启动子区高甲基化可能参与了肺腺癌细胞对吉非替尼的原发性和继发性耐药。对EGFR基因启动子甲基化检测可能对预测肺腺癌对吉非替尼的疗效有一定的指导意义。5-aza-CdR联合吉非替尼可以部分改善肺腺癌细胞对吉非替尼的耐药,为未来解决肺腺癌对EGFR-TKIs耐药提供新的研发思路。

