211At及131I标记尼妥珠单抗的荷瘤小鼠体内治疗研究
刘葳豪,马 欢,李飞泽,李鸿岩,兰 图,廖家莉,秦 芝,刘 宁,杨远友
(1.四川大学 原子核科学技术研究所 辐射物理及技术教育部重点实验室,成都 610064;2.中国科学院近代物理研究所,兰州 730300;3.甘肃省同位素实验室,兰州 730000)
靶向放射性核素治疗(TRT)是一种新兴的癌症治疗手段,可将核素靶向病灶,具有同时消除原发肿瘤和转移性癌症的潜力,甚至是对传统诊断成像检测不到的病灶也同样具有疗效[1]。目前,放射性药物对于肿瘤的靶向治疗已经显示出巨大的潜力,除了用于甲状腺癌治疗的Na[131I]注射液以外,[223Ra]注射液(Xofigo)、177Lu-DOTATATE(LUTATHERA®)、90Y-Ibritumomab tiuxetan(90Y-替伊莫单抗)、177Lu-PSMA-617(Pluvicto)等放射性靶向治疗药物也先后批准上市,并取得了良好的临床效果[2-3]。
放射性治疗药物常利用α和β射线[4],131I作为β治疗最具代表的核素之一,半衰期为8.02 d,释放γ射线可用于SPECT显像,因而作为诊治一体化核素,在科学研究和临床治疗中获得广泛应用。1941年131I就被用于治疗甲亢和甲状腺癌[5],Na131I也是最早通过FDA批准上市的放射性药物。近年来,131I标记的苄基胍衍生物(131I-MIBG)在恶性嗜铬细胞瘤、成神经细胞瘤[6]、肾上腺肿瘤[7]的诊断和治疗也展现出了巨大应用潜力和临床转化价值。值得注意的是,131I的同卤族元素中211At也是备受关注的治疗核素,愈来愈多的研究表明,α核素更适合于散在性癌、微转移癌和不适合手术或外照射治疗的实体瘤及非实体肿瘤的治疗[8-9]。211At半衰期7.21 h,有足够长的时间进行标记,且同时与多种配合物的代谢周期相匹配[10-11];其传能线密度(LET)可达98.84 keV/μm,具有极强的细胞毒性[12];电子捕获衰变产生的能量为77~92 keV的X射线可用于211At和相关标记药物的质量控制,或进行SPECT显像[13]。131I和211At同属于放射性卤素,具有相似的化学性质,砹没有稳定的同位素,半衰期最长的为210At(T1/2=8.1 h),211At的标记研究大多以放射性碘(125I/131I)为基础。传统的211At标记方法也与碘的间标类似,主要以卤素脱金属的亲电取代反应为主。但是211At相关的标记药物的实际应用却全面落后于131I,到目前为止,还没有211At标记药物获准上市。
表皮生长因子受体(EGFR)在大多数实体肿瘤,包括乳腺癌、结肠癌、肺癌、胶质瘤、头颈部鳞状细胞癌等癌症中过度表达[14-15],被认为是最为理想的肿瘤诊断和治疗靶点之一。在众多靶向EGFR的载体中,尼妥珠单抗(Nimotuzumab)是一种具有特异靶向性的全人源化单克隆抗体,已经被用于多种恶性上皮肿瘤的临床治疗,并取得了十分积极的治疗效果[16-17]。因此,基于Nimotuzumab的多种放射性标记药物也在近年来引发了广泛关注[18-20]。在前期研究中,本课题组用正电子核素89Zr标记的Nimotuzumab,成功进行了荷U87MG胶质瘤裸鼠的PET/CT成像[21],充分证实了该载体具有良好的体内靶向性和肿瘤滞留能力,从而有望用于TRT。
本文拟采用间接标记法制备两种放射性标记药物131I-Nimotuzumab和211At-ATE-nimotuzumab,并对两种标记药物对荷U87MG胶质瘤裸鼠的治疗效果进行考察,对比同族的两种典型的核素治疗效果,以评价211At标记单克隆抗体在脑胶质瘤放射性免疫治疗中的潜力。
1 材料与方法
1.1 试剂与仪器
尼妥珠单抗(nimotuzumab):百泰生物药业有限公司;N-琥珀酰亚胺-3-(三甲基锡基)苯甲酸酯:多伦多化学研究公司;碘代琥珀酰亚胺:萨恩化学技术有限公司;L-抗坏血酸钠:大连美仑生物技术公司;PD-10脱盐柱:美国GE Healthcare公司;Na131I:成都中核高通同位素公司;U87MG(胶质瘤细胞):BNCC北纳生物公司;超滤管:德国Merck Millipore公司,10 kDa。
FH-603井型闪烁探头,FH463A自动定标器:北京核仪器厂;BS210S电子天平:德国Sartorius公司;恒温磁力搅拌器:上海亚荣生化仪器厂;PHS-3C精密pH计:上海精密科学仪器有限公司;冷冻高速离心机:湘仪离心机仪器有限公司;CRC-15R放射性活度计:美国CAPINTEC公司。
1.2 实验动物
68只Balb/c-nu裸鼠:(20±2) g,四周龄雌性,成都达硕实验动物有限公司。所有动物实验均按照四川大学动物福利与伦理委员会批准的方案进行。
2 实验方法
2.1 131I-ATE-nimotuzumab的制备
取3 μL 0.013 mol(摩尔量控制在蛋白摩尔量10倍)溶于氯仿中的N-琥珀酰亚胺-3-(三甲基锡基)苯甲酸酯(m-Me ATE),氮气吹干,加入20 μL DMSO重新溶解。再加入100 μL 50 mg/mL尼妥珠单抗,混匀。室温反应3 h。反应结束后,采用10 kDa的超滤管进行离心(正甩1次,14 000 g,10 min;反甩1次,1 000 g,2 min),以去除多余的偶联剂ATE。
取适量131I加入5 μL 0.03 mg/mLN-碘代琥珀酰亚胺(NIS),活化131I约1 min,探究不同量的免疫偶联物ATE-mAb和不同的反应时间对标记率的影响。最后加入5 μL抗坏血酸钠(2 mg/mL)去除NIS终止反应(5倍摩尔过量于NIS)。通过放射性薄层色谱层析法(TLC)分析标记率,展开剂体系为V(丙酮)∶V(水)=3∶1。标记混合物PD-10凝胶柱分离。通过TLC分析放化纯度,展开剂体系为V(丙酮)∶V(水)=3∶1。
2.2 211At制备
在四川大学CS-30回旋加速器上用28 MeV的15~20 mA的α粒子束轰击铋靶4 h,经由209Bi(α,2n)211At反应生成211At,通过蒸馏法制得211At[22]。
2.3 211At-ATE-nimotuzumab的制备
标记方法与131I-ATE-nimotuzumab方法类似。取蛋白摩尔量10倍左右的m-Me ATE与尼妥珠单抗进行偶联。反应结束后,采用超滤管进行纯化。在211At溶液中加入NIS,进行活化标记。再加入适量抗坏血酸钠去除NIS终止反应。通过TLC分析标记率,展开剂体系为V(丙酮)∶V(水)=3∶1。
2.4 131I/211At-ATE-nimotuzumab体外稳定性
取纯化后的标记药物131I/211At-ATE-nimotuzumab分别置于不同介质中:(1) 磷酸盐缓冲溶液(PBS,pH=7.6);(2) 胎牛血清(FBS)。室温下放置。分别于0、3、6、12、24 h取样,TLC分析不同时间点标记物的放化纯度,展开剂体系为V(丙酮)∶V(水)=3∶1。
2.5 细胞培养
U87MG胶质瘤细胞在添加10%FBS和1%青霉素/链霉素双抗PEST的DMEM中培养。细胞在37 ℃,二氧化碳含量5%的湿度空气培养箱里面生长传代。
2.6 肿瘤模型的建立
取处于生长对数期的U87MG细胞,在四周龄的雌性裸鼠左侧腋下皮下注射5.0×106个U87MG细胞,当肿瘤长半径达到5~8 mm(通常是接种后1至2周)时,进行筛选,选用肿瘤约为100 mm3的荷瘤小鼠进行体内治疗实验。所有涉及动物及其护理的实验程序均按照NIH指南进行。
2.7 荷瘤裸鼠的体内分布
将20只荷U87MG瘤裸鼠随机平均分为4组。每只荷瘤鼠通过瘤内单点注射100 μCi(10 μL)131I-ATE-nimotuzumab。待注射完成后3、6、12、24 h分别处死一组裸鼠,并解剖取其心、肝、脾、肺、肾、肠、胃、肌肉、骨、血、脑、肿瘤和甲状腺,称重并用定标器测各组织、器官的放射性计数。计算各组裸鼠器官组织的放射性摄取率(%ID/g)。组织的放射性摄取率(%ID/g)=[组织的计数/(注射药物的计数×组织的质量)]×100%。
2.8 荷瘤裸鼠的治疗
当荷瘤小鼠的肿瘤约为100 mm3时,每组6只小鼠通过瘤内单点注射100、200 μCi的131I-ATE-nimotuzumab;10、20 μCi的211At-ATE-nimotuzumab,对照小鼠分别注射相同体积的生理盐水,200 μCi131I或20 μCi211At溶液。隔天记录每只荷瘤小鼠肿瘤体积大小(长×宽=2 mm×0.5 mm),同时记录各组裸鼠的体重。当肿瘤直径达到15 mm,或者体重与正常体重相比减少量超过了20%,再或者观察到小鼠的身体健康受到明显影响,则用异氟烷麻醉小鼠后脱颈处死。解剖小鼠,将组织样品如小鼠的肾,肝和胃,固定在4%多聚甲醛中并用石蜡包埋,用于免疫组化病理学分析。使用单向方差分析和t检验比较平均值。P<0.05的值被认为具有统计学意义。
3 结果与分析
3.1 标记时间和前体用量对标记率的影响
使用不同比例的标记前体和反应时间标记的结果列于表1,结果表明,在比例为200 μCi/2 nmol时,标记率趋于饱和,可达(95.4±2.1)%,进一步增加前体用量标记率没有明显提升。标记时间10 min时标记率趋于饱和,延长标记时间不能提高标记率,反而会产生不必要的核素衰变损失。
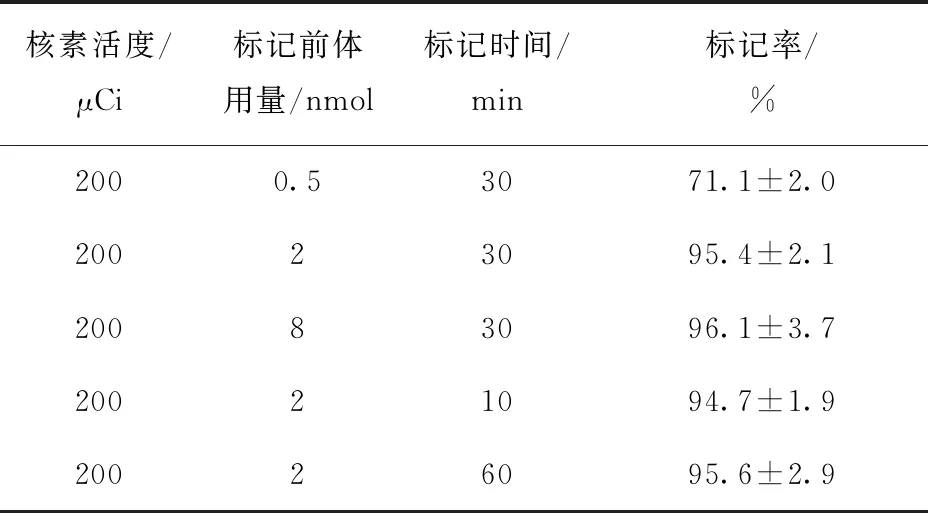
表1 不同标记前体用量和标记时间对标记率的影响Table 1 Effects of different conditions on the labelled rate
因为碘和砹同为卤族元素,化学性质具有相似之处,都可以形成碳卤键。基于优化后的131I标记尼妥珠单抗条件,进行211At对尼妥珠单抗的标记实验,标记率约95%。
3.2 131I/211At-ATE-nimotuzumab的体外稳定性
将纯化后的211At-ATE-nimotuzumab、131I-ATE-nimotuzumab分别置于PBS和FBS中,经过不同时间后对比其稳定性,结果如图1所示。211At-ATE-nimotuzumab在PBS中6 h内可以保持较好的稳定性,6 h后放化纯度明显降低,24 h在PBS中放化纯度为(81.5±2.7)%。211At-ATE-nimotuzumab在FBS中仍然能保持一定稳定性,但是在PBS中较差。相较而言131I-ATE-nimotuzumab的放化纯度在PBS中24 h大于90%,而在FBS中也大于80%。由此可知,在FBS中,211At-ATE-nimotuzumab和131I-ATE-nimotuzumab稳定性皆低于PBS中。因为211At为α核素,其衰变释放出α粒子,其反冲能可导致碳-砹键断裂,使核素逃逸,从而导致211At-ATE-nimotuzumab稳定性在FBS和PBS中均低于碘标记物。

图1 131I/211At-ATE-nimotuzumab在不同介质中放化纯度随时间的变化Fig.1 Changes in radiochemical purity of 131I/211At-ATE-nimotuzumab
3.3 荷瘤裸鼠的体内分布
瘤内注射131I-ATE-nimotuzumab后荷瘤裸鼠的体内分布情况如图2所示,131I-ATE-nimotuzumab在荷瘤鼠体内主要保留在肿瘤部位,放射性摄取率为(32.4±3.9)%ID·g-1(3 h)和(28.2±4.7)%ID·g-1(24 h),在24 h内仍然能够保持相当高的放射性摄取,进一步说明该药物确实具有特异性靶向U87MG肿瘤的能力。同时,体内分布也表明,该标记物主要通过肝脏、肾脏进行代谢,肝脏放射性摄取率为(6.9±2.3)%ID·g-1(3 h),肾脏放射性摄取率为(1.9±1.1)%ID·g-1(3 h)。值得注意的是,131I-ATE-nimotuzumab在荷瘤鼠体内3 h时,甲状腺和胃的摄取不可忽略,其放射性摄取率分别为(3.2±0.8)%ID·g-1和(2.5±1.3)%ID·g-1,因为甲状腺和胃是游离的碘容易聚集的器官,这也表明该标记化合物在动物体内存在一定的核素脱靶现象。相较而言,其他器官和组织的摄取较低,基本无明显变化。
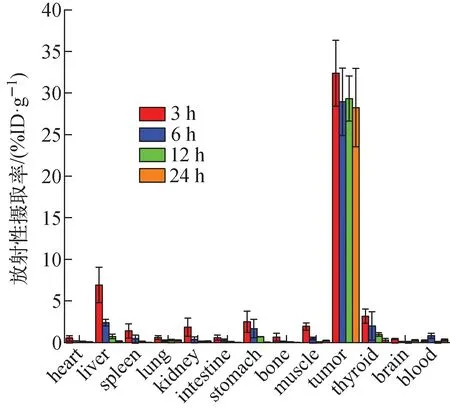
图2 瘤内注射131I-ATE-nimotuzumab的荷U87MG胶质瘤裸鼠的体内分布(n=4)Fig.2 In vivo distribution of U87MG glioma-bearing nude mice injected with 131I-ATE-nimotuzumab intratumorally (n=4)
3.4 131I/211At-ATE-nimotuzumab治疗荷瘤裸鼠
使用剂量梯度的100、200 μCi的131I-ATE-nimotuzumab和10、20 μCi的211At-ATE-nimotuzumab对荷瘤裸鼠进行治疗。从图3荷瘤小鼠体重变化可知,131I标记物处理的荷瘤小鼠在注射后体重略有下降,随后有所恢复,短期内未出现显著的体重减轻。随着存活时间的延长,各组荷瘤小鼠的肿瘤恢复生长,但是明显观察到注射标记物组荷瘤小鼠的肿瘤生长得到抑制,同时肿瘤生长呈现剂量依赖性。其中,注射剂量200 μCi131I-ATE-nimotuzumab对应的肿瘤生长最为缓慢。相较而言,对照组荷瘤小鼠(包括接受相同体积的生理盐水和200 μCi Na131I组的荷瘤小鼠)中观察到肿瘤生长最为快速,没有抑制效果,约12~14 d处死达标荷瘤小鼠。从存活曲线可见,200 μCi Na131I组中位生存时间为14 d,最高计量治疗组的生存时间为31.6 d。
211At-ATE-nimotuzumab瘤内注射治疗的各组荷瘤小鼠结果示于图4,由图4可知,各组注射后体重变化不大,随着肿瘤的增大小鼠体重有所下降。同时可以明显观察到注射标记物组荷瘤小鼠的肿瘤生长受到标记药物的抑制,呈现剂量依赖性。其中,注射剂量(20 μCi211At-ATE-nimotuzumab)对应的肿瘤生长最为缓慢。相较而言,对照组荷瘤小鼠(包括接受相同体积的盐水和20 μCi211At组的荷瘤小鼠)中观察到肿瘤生长迅速,中位生存期为15.5 d。但注射了游离砹组荷瘤小鼠的肿瘤生长也受到抑制,其中位生存期延长至21 d,相较而言,注射剂量20 μCi的211At-ATE-nimotuzumab组荷瘤小鼠中位生存时间最长为35 d,长于注射200 μCi131I-ATE-nimotuzumab组荷瘤小鼠的中位生存期。

a——各组荷瘤裸鼠的体重变化曲线;b——各组荷瘤裸鼠的肿瘤体积变化曲线;c——各组荷瘤裸鼠的生存率变化曲线图3 131I-ATE-nimotuzumab对荷胶质瘤裸鼠的治疗效果(标记药物治疗组与对照组之间存在明显差异,P<0.005)Fig.3 The therapeutic effect of 131I-ATE-nimotuzumab on glioma-bearing nude mice(There was a significant difference between the labelled drug treatment group and the control group, P<0.005)
为了评估131I/211At-ATE-nimotuzumab对荷瘤小鼠的辐射损伤,在治疗观察实验结束后,在24 h内对处死的荷瘤小鼠进行剖检,以进行肝、肾和胃的组织病理学分析(图5)。H&E染色,注射生理盐水,200 μCi131I-ATE-nimotuzumab,20 μCi211At-ATE-nimotuzumab组荷瘤小鼠。肝脏部位病理结果显示:各组肝小叶结构清晰,肝索排列规则,肝细胞质较为丰富,肝窦轻度扩张(图5中红色箭头);肾脏部位病理学分析显示各组肾髓质皮质分界清晰,肾小球毛细血管结构清晰,肾小管上皮细胞结构正常,未见明显炎症反应。胃部结构完整,固有层中可见排列紧密的大量管状腺,腺体结构清晰,细胞排列规则,各层未见明显异常。其中肝脏有轻微的肝窦扩张并无明显损伤,且与对照组一致,可能是由小鼠批次或者饲养环境导致。病理切片进一步说明瘤内注射给药,小鼠的内脏器官并无明显辐射损伤。

a——各组荷瘤裸鼠的体重变化曲线;b——各组荷瘤裸鼠的肿瘤体积变化曲线;c——各组荷瘤裸鼠的生存率变化曲线图4 211At-ATE-nimotuzumab对荷胶质瘤裸鼠的治疗效果(标记药物治疗组与对照组之间存在明显差异,P<0.005)Fig.4 The therapeutic effect of 131I-ATE-nimotuzumab on glioma-bearing nude mice(There was a significant difference between the labelled drug treatment group and the control group, P<0.005)

图5 胃、肝、肾组织病理学切片Fig.5 Histopathological sections of stomach, liver and kindney
根据核素性质,131I(T1/2=8.02 d,Eγ=364 keV和Eβ=606 keV),211At(T1/2=7.21 h,Eα=5.9 MeV),相较而言,211At衰变的射线具有更高的能量和较短的射程(55~80 μm),其传能线密度(LET)为80~100 keV/μm,与辐射治疗的最佳LET(100 keV/μm)非常接近,能直接打断DNA链,具有更强的辐射生物学效应[23]。同时131I释放的γ射线过高的能量对其治疗造成剂量限制,对其诊断造成过高背景等不利影响。尽管在治疗实验中,131I-ATE-nimotuzumab注射剂量更高且其稳定性更强,但是本文通过瘤内注射方式,有效的避免了体内循环到肿瘤摄取过程中不必要的核素脱靶,加上其射线能量特点差异等,最终导致治疗效果略逊于211At-ATE-nimotuzumab。
值得注意的是,由于211At半衰期短,与单克隆抗体的体内代谢周期不匹配,通过瘤内空腔内注射等方式更能减少体内循环时间,合理利用标记在单抗上的短半衰期核素,同时也作为巩固提高术后治疗效果的补充手段,与其他方式(手术,放疗)等协同作用。例如,美国杜克大学Zalutsky Michael等用211At标记了ch81C6,在18名脑瘤复发患者手术后的切除空腔里面进行了211At-ch81C6给药治疗,特定三种癌症患者的中位生存期明显延长[24]。因此本研究通过瘤内注射的方式也是进一步验证核素211At能够在放射性靶向研究中得到更多的应用,并为相关药物的临床前基础研究提供了重要参考。但是211At核素的研究发展仍然存在一定的限制,世界范围内能够产生28 MeV能量范围左右α粒子束流的加速器并不足以满足临床和研究的需求。现有标记方法还存在缺陷与不足,标记化合物的标记率和稳定性限制了其临床化的进程[25]。因此进一步实现211At的临床化进程还需要进行不断地摸索和探究。
4 结论
本文进行了131I/211At一步法标记Nimotuzumab的方法的研究,优化了标记方法,对比了131I/211At-ATE-nimotuzumab体外稳定性,在荷U87MG胶质瘤小鼠体内验证了131I/211At-ATE-nimotuzumab的治疗效果,发现两种标记物对荷瘤小鼠的肿瘤生长均有抑制效果呈剂量依赖性,同时延长了小鼠的生存时间,相比之下,注射剂量更低的211At-ATE-nimotuzumab的治疗效果优于131I-ATE-nimotuzumab。

