放射性治疗药物的发展现状与展望
高 洁,郑小北,王红亮,李建国,张 岚,杜 进
(1.中国原子能科学研究院,北京 102413;2.中国辐射防护研究院 国家原子能机构核技术(放射性药物非临床评价)研发中心 中核放射毒理与放射性药物临床前评价重点实验室 药物毒理与放射损伤药物山西省重点实验室,太原 030006;3.中国科学院上海应用物理研究所,上海 201800;4.上海深景医药科技有限公司,上海 201815;5.中国科学院大学,北京 100049;6.山西医科大学第一医院,太原 030001;7.中国同辐股份有限公司,北京 100089 )
放射性药物(radiopharmaceuticals)指用于临床诊断或治疗的放射性核素制剂或者其标记化合物,广泛应用于肿瘤诊疗、心肌显像、神经退行性疾病早期发现和炎症组织显像诊断等,是分子影像和精准医学的重要基石,为真正意义上的早期诊断及肿瘤治疗提供新方法和新手段,为预防医学、转化医学、个性化医学的实现提供可能的途径。其中,放射性治疗药物将放射核素与载体结合,利用放射性核素适宜的射线能量和在组织中的射程,选择性集中照射病变组织而避免正常组织受损并获得预期治疗效果。
1 已上市放射性治疗药物
目前国内外已上市的放射性治疗药物包括:来昔决南钐[153Sm]注射液(153Sm-EDTMP)、氯化锶[89Sr]注射液(89SrCl2)、氯化镭[223Ra]注射液(223RaCl2)、钇[90Y]玻璃微球注射液、钇[90Y]树脂微球注射液、钇[90Y]替伊莫单抗注射液、碘[131I]托西莫单抗注射液、碘[131I]美妥昔单抗注射液、碘[131I]化钠口服液(Na131I)、碘[131I]苄胍注射液(131I-MIBG)和177Lu-DOTATATE注射液。其中,钇[90Y]玻璃微球注射液和钇[90Y]树脂微球注射液两种药物在国内外的管理方式不同。在国外,钇[90Y]玻璃微球注射液和钇[90Y]树脂微球注射液作为医疗器械管理;在国内,钇[90Y]玻璃微球注射液和钇[90Y]树脂微球注射液作为药品管理。
1.1 来昔决南钐[153Sm]注射液
钐[153Sm]趋骨性极低,与骨组织不具备自然亲和力,但其与乙二胺四亚甲基膦酸(ethylene diamine tetramethylene phosphonic acid, EDTMP)螯合后可形成新的复合物,即153Sm-EDTMP,从而能获得较高的趋骨性,经静脉注入机体后能迅速与含羟基磷灰石的骨组织紧密结合,使得骨转移灶中恶性肿瘤细胞能持续暴露于较高辐射剂量的β射线下,达到局部控制或治疗的目的[1-4];同时利用其发射的γ射线进行早期治疗后显像,以便对骨转移灶的摄取选择性和靶向性进行评估,进而对治疗效果和预后进行预判以利于及时调整进一步的治疗方案。1997年美国FDA批准放射性钐乙二胺四亚甲基膦酸盐(153Sm-EDTMP)上市,用于恶性肿瘤骨转移的疼痛治疗。
153Sm-EDTMP在骨转移瘤患者体内的吸收率约为注射剂量的50%~65%,可在骨损伤处富集,浓度达正常骨组织的5倍以上。注射5 h后,血液中的残留量小于1%;8 h后,可被肾脏完全清除[5]。在治疗后1~4周患者疼痛减轻或缓解,可持续2~17周;副作用为会出现轻微的骨髓毒性,白细胞和血小板计数减少约10%~40%,但在6~8周内完全恢复正常水平[6-7]。
1.2 氯化锶[89Sr]注射液
锶[89Sr]与钙属同族元素,其代谢与钙相似,89SrCl2经静脉注射进入体内后,其取代钙离子被吸收入骨羟基磷灰石结晶,主要集中于骨骼系统,在身体其他组织器官的分布较少[8]。89SrCl2在正常骨的生物半衰期为14 d,在转移灶内的生物半衰期>50 d,其发射的β射线在治疗后的两个半衰期(约101 d)内释放量为75%。因此,89SrCl2治疗周期可每3~4个月1次。由于释放期较长,治疗效果一般在药物注射后7~20 d开始显现,且疼痛缓解较缓慢,治疗后骨髓缓解时间也相对较长。在报道的放疗起效时间中,最早为3 d,常见的为2~3周,疼痛缓解平均持续3~6个月。25%骨转移瘤患者的镇痛疗效无法持久,而5%~20%患者的疼痛症状可完全消失且不再复发[9-10]。研究数据显示,89SrCl2也可抑制骨转移瘤新发病灶的发生率,阻止病程进展,但无法明显提高患者的生存预期[6]。毒副作用为白细胞及血小板减少的骨髓抑制。通常,血小板较放疗前减少约30%,此效应在放疗后12~16周表现最为明显[11]。美国FDA从1993年起正式批准89SrCl2用于治疗骨转移瘤,主要用于减轻患者骨痛症状。与153Sm-EDTMP相比,89SrCl2具有给药剂量低、毒副作用小、疗效维持时间长等特点,目前临床应用更广泛。
1.3 氯化镭[223Ra]注射液
镭[223Ra]亲骨性高,将高浓度粒子非选择性照射于骨组织表面,即可准确投射入靶向治疗位点。与β粒子相比,α粒子每单位路径放射出的能量高达其1 500倍,这一高能量赋予了粒子可控性的骨细胞毒性。但这种高能特性也给正常骨组织带来无法准确预估的损伤风险[12-13]。223RaCl2可以模拟钙离子的特性而竞争性被骨组织摄取浓聚,注射1 h后骨骼吸收达峰值。静脉注射后,其血浆清除率极快,总骨吸收率约为注射剂量的40%~60%[14]。与多数亲骨放射性核素不同,223RaCl2主要通过胃肠道排泄,肾清除率少于10%[15]。据大量临床病例报道,223RaCl2的骨痛缓解作用最大达71%,常于治疗2周后显现,平均持续时间约为50 d。研究数据显示,在2年随访期间,没有证据表明存在长期毒性,且至少50 Bq/g的活度对骨碱性磷酸酶(ALP)、前列腺特异性抗原(PSA)水平、疼痛减轻和总生存率有显著的积极作用,总的来说,223RaCl2耐受性良好,没有观察到剂量限制的血液毒性[16-18]。223RaCl2(商品名:Xofigo)是首个获FDA批准用于常规临床使用的α粒子放射性药物。到目前为止,223RaCl2是唯一在用于肿瘤骨转移姑息性治疗的放射性药物中显示出提高患者预期寿命的能力[19]。
1.4 钇[90Y]微球注射液
钇[90Y]微球由放射性核素90Y和微球载体两部分组成。目前使用的90Y微球主要有两种:钇[90Y]玻璃微球(商品名:TheraSphere®)、钇[90Y]树脂微球(商品名:SIR-Spheres®)。两种微球主要在其组成、直径大小和放射性活度规格等方面有差异,TheraSphere®玻璃微球的直径约20~30 μm,放射性核素直接融合在玻璃基质中,比重约为3.6 g/mL,每个微球加载约2 500 Bq的剂量,剂量规格种类较多。SIR-Spheres®树脂微球直径约20~60 μm,放射性核素附着在树脂微球的表面,比重约为1.6 g/mL,每个微球加载50 Bq的剂量,且只有一种规格。
90Y微球治疗肿瘤的研究始于20世纪50年代,而用于治疗肝癌可追溯到20世纪60年代早期[20-21],1999年12月,FDA根据有限的临床数据通过人道主义器械豁免的方式批准90Y玻璃微球(商品名:TheraSphere®)在美国上市,适应症为不可手术切除的肝细胞癌,但需要每年递交临床使用报告。在积累了充分的循证医学证据后,90Y玻璃微球于2021年3月在美国正式获批,适应症同前。另一方面,90Y树脂微球(商品名:SIR-Spheres®)于2002年3月经FDA批准在美国上市,适应症为不可手术切除的结直肠癌肝转移,并于同年获得欧盟批准用于治疗不可手术切除的晚期肝脏恶性肿瘤。SIR-Spheres®已获得美国国立综合癌症网络(NCCN)、欧洲肿瘤内科学会指南(ESMO)等多个权威指南推荐用于治疗肝脏恶性肿瘤,纳入美国及欧洲等多地医保;并分别进入2019版的中国《原发性肝癌诊疗规范》和2018版《中国结直肠癌肝转移诊断和综合治疗指南》,临床需求明确。SIR-Spheres®树脂微球于2020年8月获国家药品监督管理局(NMPA)批准依据境外取得的临床实验资料申请上市,2020年11月获受理上市申请,2022年,SIR-Spheres®进口注册获批上市,用于经标准治疗失败的不可手术切除的结直肠癌肝转移患者的治疗,也是中国首个批准用于治疗结直肠癌肝转移灶的放射性栓塞药物产品。目前尚无大规模的随机对照研究比较玻璃微球和树脂微球的临床应用差异,小规模的研究结果表明[22]两种微球除了每次手术注射数量和载药的剂量不同外,在临床疗效方面并无明显差异。
国内对90Y微球的研发及临床应用可追溯至20世纪90年代,上海医科大学(现复旦大学)附属中山医院联合上海建筑材料工业学院、中国原子能科学研究院同位素研究所成功研制90Y玻璃微球,微球直径30~50 μm(平均35 μm),比重约为3.27 g/mL,初步临床实验证实了该90Y玻璃微球对于治疗原发性肝癌和结肠癌肝转移的可行性及安全性[23-24]。近年来,由国内机构自主研发的90Y炭微球以活性炭作为微球载体,直径20~45 μm,比重约为1.8 g/mL,每个微球加载约1 100 Bq的剂量,每瓶微球数量约为270~1 200万,有多种剂量规格。具有堆积密度低、比表面积大、吸附能力强、生物安全性良好的理化特性,但其安全性及有效性有待临床研究证实。
1.5 钇[90Y]替伊莫单抗注射液、碘[131I]托西莫单抗注射液
在淋巴瘤的放射免疫治疗中,最常用的单克隆抗体为抗CD20抗体或抗CD22抗体。常用的放射性物质包括碘-131(131I)或钇-90(90Y)。其中,131I和90Y两种核素的差异列于表1。
90Y-替伊莫单抗是由有效成分鼠源性抗CD20抗体Ibritumomab通过稳定的巯基共价键与连接螯合剂Tiuxetan化学结合并与90Y形成稳定的、具有严格构象的络合物。2002年,FDA批准90Y-替伊莫单抗(商品名:Zevalin)上市,用于复发的或顽固性低度恶性非霍奇金氏淋巴瘤患者的治疗,是第一个FDA批准的放射免疫治疗药物。与其他放射性同位素相比,90Y发射纯β射线,具有更强的射线能量;同时由于90Y不产生γ射线,对医护人员及患者家属非常安全。与利妥昔单抗(CD20单抗)相比,完全缓解率显著提高(80%对56%)[25]。主要不良反应为4度血小板减少,发生率为10%。此外,对利妥昔单抗耐药的非霍奇金淋巴瘤(NHL),使用替伊莫单抗治疗仍然有效。
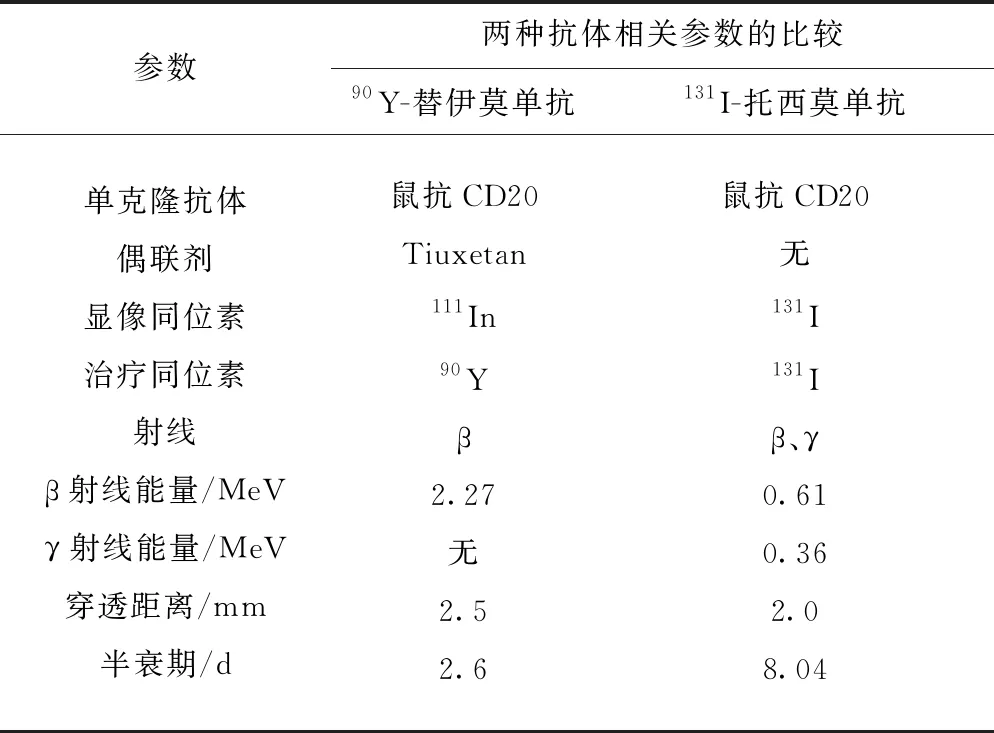
表1 90Y-替伊莫单抗和131I-托西莫单抗的比较Table 1 Comparison of 90Y-ibritumomab and 131I-tosimumab
131I-托西莫单抗(商品名:Bexxar)是放射性物质131I标记的抗CD20的鼠单克隆抗体,利用抗体将131I带至肿瘤细胞,利用131I杀死肿瘤细胞。2003年,FDA批准Bexxar(tositumomab 和碘-131标记tositumomab)用于治疗Rituximab单抗难治性且化疗后复发、CD20阳性、伴或不伴转化的滤泡型非霍奇金淋巴瘤(NHL)。Bexxar由葛兰素史克公司和Corixa公司联合开发。131I半衰期为8.04 d,发射β、γ射线。β射线用于杀伤肿瘤细胞,γ射线用来示踪显像。Bexxar的抗NHL反应平均可持续14个月,30%的患者体内完全检测不到癌细胞,在约10年的随访期间50%以上患者没有复发[26]。
使用131I具有以下优点:标记物性质稳定;标记方法多样、技术成熟,标记率高;既可以治疗又可以显像;临床使用时间长,经验丰富,相对价格低。其缺点主要包括需要封闭甲状腺、患者给药后的管理和对周围环境的放射性污染。在副作用方面,Zevalin和Bexxar均可引起与美罗华相似的输液反应,骨髓毒性也是其主要毒副反应。3度或4度白细胞减少和血小板减少较为常见,并常发生于治疗后5~7周,并在2~4周后恢复。约5%~7%接受Zevalin和Bexxar治疗的患者因感染需要住院治疗。少部分接受Zevalin和Bexxar治疗的患者可出现骨髓增生异常综合症和急性白血病,但这些患者接受过烷化剂治疗。研究还发现,若患者的骨髓受淋巴瘤侵犯越严重,则更多的放射性同位素聚集骨髓,从而对正常骨髓的损伤更大。因此,在使用Zevalin或Bexxar治疗前,必须仔细评价患者骨髓情况。淋巴瘤骨髓侵犯超过25%或发现骨髓功能不良者,不宜接受Zevalin或Bexxar治疗。
1.6 碘[131I]美妥昔单抗注射液
美妥昔单抗注射液(利卡汀)由单抗片段和131I相连接而成,是全球第一个用于治疗原发性肝癌的药物,也是我国第一个具有自主知识产权的抗体类药物[27]。该药物于2005年取得新药证书后,2007年通过国家药品监督管理局GMP认证,获准正式应用于临床治疗。该药以HAb18 F(ab′)2单克隆抗体片段为导向载体,利用其对肝癌细胞的高亲和力,将放射性同位素带到肝癌部位,利用β射线对肿瘤细胞近距离、长时间杀伤,从而特异性杀死肿瘤细胞而不伤及正常组织[28]。
肝癌约90%血供来源于肝动脉,通过肝动脉直接输入抗体可以最大程度保证抗体与抗原的结合率,故131I美妥昔单抗临床上多与TACE联合使用。TACE联合灌注131I美妥昔单抗有助于放射性核素靶向聚集于瘤内,使肿瘤内呈高浓度而血浆中呈低浓度,实现了正常组织的辐射安全,延长了核素在瘤内的滞留时间,保证射线吸收剂量的最大化,且化疗药物又兼有放射增敏作用,提高了内照射疗效,患者耐受性和安全性亦较高[29-31]。
1.7 碘[131I]化钠口服液
131I是治疗分化型甲状腺癌(DTC)的重要手段,131I治疗DTC一是采用131I清除术后残留的甲状腺组织,简称清甲;二是采用131I清除手术不能切除的DTC转移灶,简称清灶。DTC术后经131I治疗可以取得很好的疗效,能改善预后,包括延缓复发时间、降低复发率和减少远处转移等。与手术+TSH抑制治疗模式相比,手术+131I清甲+TSH抑制治疗模式使DTC的复发率和病死率明显降低。131I治疗后DTC患者的10年总体生存率为92.38%,其中,颈淋巴结转移组10年生存率为98.09%,肺转移组87.50%,骨转移组80.41%,因此,131I治疗可明显提高患者无复发生存率、无进展生存率和无疾病生存率。部分低危DTC患者并不能从清甲治疗中获益。
131I治疗有其局限性,DTC患者的发病年龄、病灶对131I的摄取和存留时间、辐射敏感性以及患者对131I多次治疗的不良反应等因素会影响治疗效果。131I对部分高危DTC的治疗作用有限,因为远处DTC转移或处于进展期的DTC细胞多数已发展为失分化状态,摄取和滞留131I的能力差。在治疗过程中,约有1/3的复发及转移性病灶发生失分化,DTC细胞钠/碘协同转运体(NIS)、Tg以及促甲状腺激素受体(TSHR)基因的表达下降,摄碘功能下降,甚至丧失。清甲剂量一般给予131I 1.11~3.7 GBq。多中心临床研究提示,对于非高危甲状腺全切DTC患者用1.11 GBq与3.7 GBq131I进行清甲治疗,两者疗效无明显差异。如颈部残留手术未切除的DTC组织、伴发颈部淋巴结或远处转移,但无法手术或患者拒绝手术的、全甲状腺切除术后不明原因血清Tg尤其是刺激性Tg水平升高者,清甲治疗同时应兼顾清灶治疗,131I剂量为3.7~7.4 GBq[32]。
1.8 碘[131I]苄胍注射液
131I-MIBG,中文名131I-间位碘代苄胍,商品名:Azedra,该药物由美国普罗基尼克斯制药(Progenics Pharmaceuticals, Inc)开发。碘苄胍是肾上腺素能神经递质去甲肾上腺素和放射性药物的芳烷基胍类似物。作为肾上腺素能神经元的阻断剂,可用于核医学诊断技术以及神经内分泌抗肿瘤治疗;作为放射性标记物,能定位肾上腺素组织,可用于鉴定肿瘤的位置,例如嗜铬细胞瘤和神经母细胞瘤。2018年7月30日,Azedra(Iobenguane I-131)被美国FDA批准用于治疗恶性、复发性或已经扩散并且不能通过手术切除的罕见肾上腺肿瘤(嗜铬细胞瘤)和副神经节瘤。Azedra(Iobenguane131I)适用于至少年满12岁的儿童和成人。
1.9 177Lu-DOTATATE注射液
镥[177Lu]粒子能量相对较低,在对病灶发生辐射作用时对骨髓抑制较轻[33]。2018年,FDA首次批准177Lu-DOTATATE(商品名:Lutathera)用于治疗生长抑素受体阳性的成人胃肠胰腺神经内分泌肿瘤(GEP-NETs)。
在一项Ⅲ期临床实验(NETTER-1:NCT01578239)中,177Lu-DOTATATE可以有效治疗进展期进行性的生长抑素受体阳性的肠道神经内分泌瘤(midgut neuroendocrine tumors)。该实验将229名肠道神经内分泌瘤患者随机分成2组,(1)177Lu-DOTATATE治疗组,116名。7.4 GBq(分4次静脉给药,每次1.85 GBq)和octreotide LAR 30mg肌肉注射,每8周1个疗程。(2) 对照组,113名。只给与octreotide LAR 60 mg,每4周1次。20个月时,无进展生存率(progression-free survival),177Lu-DOTATATE组为65.2%(95% CI,50.0~76.8),对照组为10.8%(95% CI,3.5~23.0);治疗反应率(response rate),177Lu-DOTATATE组为18%,对照组为3%;总体存活率(overall survival),177Lu-DOTATATE组死亡14名患者,对照组死亡26名患者[34]。
目前临床用放射性治疗药物列于表2。
2 研究阶段放射性治疗药物
2.1 镥[177Lu]标记治疗药物
受益于177Lu-DOTATATE、177Lu-PSMA等药物批准上市和良好临床前景,177Lu作为“明星治疗核素”,已在神经内分泌肿瘤、前列腺癌等恶性肿瘤疾病的临床靶向放射性治疗中取得了显著疗效。德国ITM公司作为全球无载体177Lu主要供应商占据全球主要市场,诺华医药也提出围绕177Lu构建全球商业渠道。令人欣喜的是,2019年底,中国工程物理研究院率先研发出具有自主知识产权的无载体177Lu产品,首次实现了无载体177Lu居里级国产化批量生产,单次生产能力提升每次至25 Ci,年生产能力实现千居里。同时,2021年,中核集团下属成都中核高通实现GMP级无载体177Lu商业供应,进一步支撑我国核药市场发展。截止目前,177Lu进口与国产并存,特别是国产177Lu规模化生产与临床应用极大地增强了放射性药物及核医学行业核素自主化的信心,显著促进了我国177Lu创新药物研发与转化进程。
本文撰写期间,2022年3月23日,诺华宣布177Lu-PSMA-617(Pluvicto®)获得FDA批准,用于治疗PSMA阳性的、经治疗进展的去势抵抗前列腺癌。同时,FDA批准68Ga-PSMA-11(Locametz®)作为PSMA阳性肿瘤的造影剂。以177Lu-PSMA-617为代表的分子探针在前列腺癌的靶向治疗中取得成功,其理化性质、药代动力学特性优异,较其他放射性核素标记的治疗探针有更好的有效性、安全性和易获得性,显示出了较好的临床价值和应用前景,但也存在一些局限[35-37]。德国核医学会发起的一项多中心临床研究显示,145例患者共进行了248个治疗周期,19例患者在观察期间死亡。在18名患者中发生3~4级血液毒性:分别有10%、4%和3%的患者经历贫血、血小板减少和白细胞减少。所有治疗结束后,患者的生化反应率达到45%,而单周期治疗后有40%的患者已经有反应。张心怡等研究证明[38],国产177Lu-PSMA-617标记简单易行,质量可控,相较于进口177Lu-PSMA-617,国产177Lu-PSMA-617减少了进口177Lu长时间运输不便,降低了使用成本,可更好地利用和发展国内177Lu核素资源,从而促进国产177Lu在肿瘤核素治疗方面的应用。此外,Xiaoxi Ling等[39]开发了一种新的PSMA靶向放射治疗剂CTT-1403,含有白蛋白结合基元,通过不可逆的PSMA抑制剂延长血液循环时间,临床前疗效和毒性表明该药物对人体安全有效。
新型特异性结合生长抑素受体(SSTR)拮抗剂如177Lu-DOTA-JR11显示了比SSTR激动剂对PRRT的潜在益处。Albrecht[40]等发现虽然拮抗剂DOTA-JR11在体外内化率要低得多,只有细胞结合活性的20%,因此与细胞核的辐射距离更高,177Lu-DOTA-JR11导致肿瘤细胞积累活性依赖性增加,G0/G1期细胞比例减少,而177Lu-DOTATATE的放射性不影响细胞周期。并且发现SSTR拮抗剂177Lu-DOTA-JR11相比标准激动剂,具有明显的细胞毒性治疗效果,导致显著减少活肿瘤组织,更明显的肿瘤生长延迟,体内更长的存活时间以及脆弱的G2/M细胞周期阶段的细胞积累。但是迄今为止,关于使用拮抗剂177Lu-DOTA-JR11的PRRT的临床前和临床研究尚未发表。
胃泌素释放肽受体(GRPR),也被称为炸弹蛋白受体亚型2,是一种G蛋白偶联受体,表达在各种器官,包括胃肠道和胰腺。177Lu-RM2作为一种GRPR拮抗剂在单独使用或联合雷帕霉素治疗GRPR表达的前列腺癌是一种很有前景的治疗策略[41]。Dalm[42]等选择NeoBOMB1进行进一步的研究,因为它对GRPR的亲和力有所提高。同时,该拮抗剂与DOTA螯合剂的耦合可以用不同的放射性核素进行标记[43],如68Ga(PET)、111In(SPECT)和177Lu(RIT),这使得NeoBOMB1的治疗成为可能。


2.2 钇[90Y]标记治疗药物
20世纪60年代陆续报道了肝脏放射性栓塞治疗[44-46],出现树脂微球、玻璃微球、炭微球等,其中90Y玻璃微球TheraSphere®和90Y树脂微球SIR-Spheres®获批上市。活性炭比重与树脂接近,具有堆积密度低、比表面积大、吸附性能强等特点,作为生物活性材料和辅料在医药领域内广泛应用[47]。近几年,国内成都纽瑞特医疗科技股份有限公司以树脂材料为原料,经高温炭化后获得了球形规整、粒径分布窄,密度适中(1.8 g/cm3)的炭微球,在溶液中分散均匀,溶出率低于0.1%,且对90Y具有高负载能力[48]。此外,2018年,远大医药有限公司收购90Y树脂微球SIR-Spheres®(澳洲Sirtex公司);2021年3月,波士顿科学与成都纽瑞特医疗科技股份有限公司达成商业合作,将90Y玻璃微球TheraSphere®引进国内本土化生产;同年9月,在海南博鳌乐城国际医疗旅游先行区以特许准入方式完成国内第一例90Y树脂微球肝癌治疗;同期,中国内地首例采用90Y玻璃微球治疗原发性肝癌的介入手术在东南大学附属中大医院完成。随着国内研究团队对90Y微球的研制,有自主产权的产品将很快进入到临床实验,不断丰富90Y微球的产品。
2.3 医用α核素治疗药物
相较于β核素,α核素具有较短的射程和较高的传能线密度值(LET),一般LET为80~100 keV/μm,与辐射治疗的最佳LET(100 keV/μm)非常接近;能量沉积发生在非常小的组织器官范围内,相对生物学效应(relative biological effectiveness, RBE)高,能引起DNA双链不可修复的断裂,表现出很强的细胞杀伤能力;引起的细胞毒性作用几乎和剂量率、细胞氧合状态和细胞周期无关,可以有效地杀死乏氧癌细胞;在软组织中的射程一般小于50~100 μm,仅相当于5~10个肿瘤细胞的直径。上述优势使得α核素在放射性核素治疗中更具吸引力,近年来α核素药物的研究取得了一定进展,特别是将α核素与对肿瘤细胞具有特异性亲和力的载体相结合,对微小肿瘤、散在性肿瘤和微小转移灶的靶向治疗显示出较好的应用前景。主要医用α核素列于表3。

表3 主要医用α核素一览表Table 3 List of α nuclide parameters
但是,靶向α药物进入临床应用还存在一些挑战性技术难点:(1) α核素的供应短缺,已经临床应用的223RaCl2和具有应用前景的225Ac、227Th均不足以满足全球常规临床使用,只有美国、德国、加拿大等少数国家能够生产或提供少量上述核素;(2) 缺乏一些适合α核素标记的双功能螯合剂,满足稳定螯合母体核素之外,还需稳定螯合α衰变过程中的多个子体核素;(3)α核素衰变时反冲能远大于核素与螯合剂之间的化学键能,容易导致TAT药物脱靶和子体核素体内的再分布。近十余年,除223Ra外,主要集中研究225Ac、227Th、212Pb/212Bi、213Bi和211At靶向药物,探讨其在神经内分泌肿瘤、前列腺癌、脑肿瘤、膀胱癌和白血病等方面的临床应用。得益于靶向小分子、多肽、单克隆抗体、蛋白药物等新型研发技术的快速发展,将α核素与对肿瘤细胞具有特异性亲和力的载体相结合,对微小肿瘤、散在性肿瘤和微小转移灶的靶向治疗显示出巨大的应用前景。按靶向性载体的类型大致分为小分子与多肽类,单克隆抗体与蛋白药物。
2.4 225Ac和227Th标记治疗药物
选用225Ac、227Th等半衰期较长的核素,以单克隆抗体为靶向载体的治疗药物研究日益受到重视。225Ac-抗CD33抗体(225Ac-lintuzumab)的临床Ⅰ/Ⅱ期研究显示治疗响应,与化疗药物联合应用缓解肿瘤进展。227Th-rituximab(利妥昔单抗)、227Th-trastuzumab(曲妥珠单抗)治疗人表皮生长因子受体2(HER2)阳性的卵巢癌和乳腺癌临床前研究,显示药物延长生存期。227Th-PSMA-TTC,钍-227由一个3,2-HOPO螯合剂共价连接到一个完全的人类PSMA靶向抗体组成此药物,此放射性标记化合物的免疫反应部分约为80%,并证实了在48 h内与PSMA靶点的稳定结合,在模拟PrCa转移到骨的小鼠模型中显示了显著的抗肿瘤疗效,支持其临床评估,目前I期实验正在mCRPC患者中进行[48]。227Th-aCD22-TTC延长了接受其治疗的总生存期,并且药物耐受性良好[50]。目前临床Ⅰ期研究评估了(227Th-aCD22-TTC)在CD22阳性复发/难治性B细胞非霍奇金淋巴瘤(R/R-NHL)患者中的作用。研究结果显示,227Th-aCD22-TTC(BAY1862864)在R/R-NHL患者中安全且耐受[51]。
2.5 212Pb/212Bi标记治疗药物
212Pb是一种很有潜力的医用同位素,半衰期很短(10.64 h),衰变产物(212Pb)释放出高LET粒子(E=8.78 MeV)[52]。212Pb经一次β衰变生成子体212Bi,212Bi再通过两条途径继续衰变释放α粒子,最终生成稳定的208Pb。212Pb作为212Bi的母体核素,充当212Bi的体内发生器,在体外和体内均体现显著效果。212Pb能够从224Ra(228Th的子体)的发生器通过阳离子交换树脂吸附与淋洗获得,反应溶液在室温下至少可储存48 h,为使用224Ra溶液发生器系统提供了3~4 d的运输时间窗口,有望成为新一代普及性的α医用核素。2005年,Olivier Couturier等[53]将212Pb-DOTAMTATE作用于神经内分泌肿瘤的裸鼠,结果显示,31周的研究结束后79%的裸鼠肿瘤消失,目前该产品alphamedixTM由Orano Med开展临床I期。2014年,Ruby F Meredith团队采用212Pb-TCMC-Trastuzumab(曲妥珠单抗)进行了人类表皮生长因子受体2阳性(HER2+)的卵巢癌、结肠癌和胰腺癌治疗的临床Ⅰ期实验[54],结果表明,治疗产生的毒性较小,治疗效果较好。2018年该团队再次对18例腹膜内转移的恶性肿瘤患者进行212Pb-TCMC-Trastuzumab灌注治疗,结果显示药物毒性小,治疗效果较好[55]。2017,Kasten等[56]用212Pb标记的单克隆抗体 mAb376.96,证实了212Pb-376.96治疗胰腺导管腺癌的可行性。同年,该课题组还开展了212Pb-376.96在ES-2和A2780CP20人卵巢癌移植瘤中的应用研究[57],结果均证实了TAT中212Pb的治疗效果。2020年,Stenberg团队利用224Ra/212Pb的液态介质快速生产标记药物212Pb-PSMA-617、212Pb-NG001以及224Ra标记药物[58],表明212Pb标记稳定有效,对标记物影响作用小,并且体外实验肿瘤治疗效果较好。
3 展望
截止目前,仅有十几种放射性治疗药物上市,主要集中在153Sm、89Sr、223Ra、90Y、131I和177Lu等核素,用于治疗癌症骨转移、肝癌、甲状腺癌等。近年来,随着靶向性配体的快速发展,以及新型医用核素广泛应用,放射性治疗药物在肿瘤治疗上显示出较大的潜力。因此,研发靶向性和特异性更好的放射性配体,以及具有临床应用前景核素的工程化研究将是后续发展方向。例如(1) 针对新型靶点研发筛选理化性质更佳的靶向性探针;(2) 针对225Ac和227Th等核素的供应短缺以及昂贵成本,临床使用受限,需要开发可以大规模生产的替代临床等级的α医用同位素。

