寡聚苯乙炔修饰RM26的177Lu标记和细胞内化研究
廖 伟,付华霞,2,李祥玉,2,阚文涛,杨 夏,王 静,赵 鹏,卓连刚,杨宇川,魏洪源
(1.中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900;2.西南医科大学附属医院 核医学科,四川 泸州 646000)
胃泌素释放肽受体(GRPR)广泛存在于多种肿瘤细胞中,在前列腺癌、肺癌、胃肠道癌中均显著表达[1-2]。放射性核素标记的靶向多肽可以与GRPR阳性的肿瘤细胞特异性结合,用于肿瘤的诊断和治疗[3-4]。近年来,一系列靶向GRPR的多肽用于显像研究,取得了良好的效果,但是基于GRPR识别的放射性治疗药物的研究则相对滞后。这是因为放射性治疗药物需要更长的药物滞留时间,更高的肿瘤组织比。药物的内化,既可以提高药物滞留时间,也可以使放射性核素更接近对放射性射线敏感的细胞核,从而提高细胞毒性,杀死癌细胞,因此内化对放射性治疗药物具有重要意义[5-8]。激动剂多肽可以完成细胞内化,但是激动剂存在副作用,限制了激动剂的使用[9-10]。虽然研究表明拮抗剂的特异性结合能力优于激动剂,但是拮抗剂多肽不能完成细胞内化,很少用于放射性治疗药物的研究[11-12]。为了利用拮抗剂优良的靶向特异性,同时提高细胞内化率,可以在拮抗剂上连接具有跨膜能力的基团,辅助完成药物的内化。跨膜多肽(CPP)是常用的跨膜基团,但存在体内不稳定、代谢快的缺点[13]。跨膜小分子不仅可以完成跨膜作用,也具有更好的稳定性。理论计算和实验都表明,寡聚苯乙炔(OPE)是一类具有良好跨膜能力的小分子[14-17],将OPE与拮抗剂通过化学键连接,同时连接配位基团,可以得到具有靶向、跨膜和放射性标记多功能一体的潜在放射性治疗药物前体。
RM26 (D-Phe-Gln-Trp-Ala-Val-Gly-His-Sta-Leu-NH2)是一种广泛应用于显像和治疗研究的GRPR拮抗剂,能特异性靶向前列腺癌细胞[18-20]。将RM26和OPE结合,可以得到具有良好亲和性和内化能力的药物前体。人前列腺癌细胞(PC3)是一种GRPR阳性的细胞系,广泛应用于GRPR阳性靶向研究,可以用于RM26及其衍生物的细胞内化研究[21-22]。
放射性核素的选择对放射性治疗药物的疗效和药代动力学也有重要意义。177Lu具有合适的β发射和γ发射能量和合适的半衰期,广泛应用于肿瘤的放射性诊断和治疗[23-24]。2018年,177Lu-DOTATATE获美国食品药品监督管理局(FDA)批准,用于肠道神经内分泌瘤治疗[25],显示了177Lu作为放射性治疗核素的巨大价值。
因此,将具有跨膜能力的OPE和具有特异靶向性的RM26结合,并连接NOTA基团,可以得到放射性治疗药物前体NOTA-OPE-1-RM26和NOTA-OPE-2-RM26。选择NOTA作为配体,可以用于177Lu、68Ga、Al18F等标记,以满足不同需求[26]。本文对标记化合物的PC3细胞亲和性、内化率和特异结合性进行研究,并讨论引入跨膜基团OPE提高拮抗剂药物细胞内化率的可行性。
1 实验材料
1.1 主要仪器
Agilent 1100高效液相色谱:美国安捷伦公司;CHA高效液相色谱-质谱联用仪:美国沃特世公司;PLC 2020液相色谱:美国吉尔森公司;Mini-Scan型TLC薄层放射性扫描仪:美国Bioscan公司;AE200电子天平:瑞士Ettler公司。
1.2 主要试剂
多肽RM26:成都凯捷多肽科技有限公司,纯度>95%;寡聚苯乙炔:根据文献[27]合成,经过1H NMR和13C NMR表征;177LuCl3:中国工程物理研究院核物理与化学研究所制备,核纯度>99.9%,放化纯度>99%,放射性浓度0.5 Ci/mL;p-NCS-Bn-NOTA:Macrocyclics,纯度>95%。其他试剂均为分析纯,从百灵威、阿拉丁公司购买。人前列腺癌细胞(PC3):ATCC提供。
2 实验方法
2.1 制备RM26多肽衍生物
NOTA-OPEs-RM26的合成路线示于图1。总体合成过程为,具有对称二酸结构的化合物Fmoc-L-β-谷氨酸-5-叔丁基酯1作为合成起始物,在三氟乙酸的作用下脱去叔丁基保护基,得到化合物2,然后使用二环己基碳二亚胺(DCC)和N-羟基琥珀酰亚胺(NHS)活化两个羧基,得到化合物3,接着分步加入RM26,寡聚苯乙炔OPE-1或OPE-2,哌啶,得到化合物4,最后加入p-NCS-Bn-NOTA,得到化合物5(图1)。产物NOTA-OPE-1-RM26和NOTA-OPE-2-RM26结构示于图2。
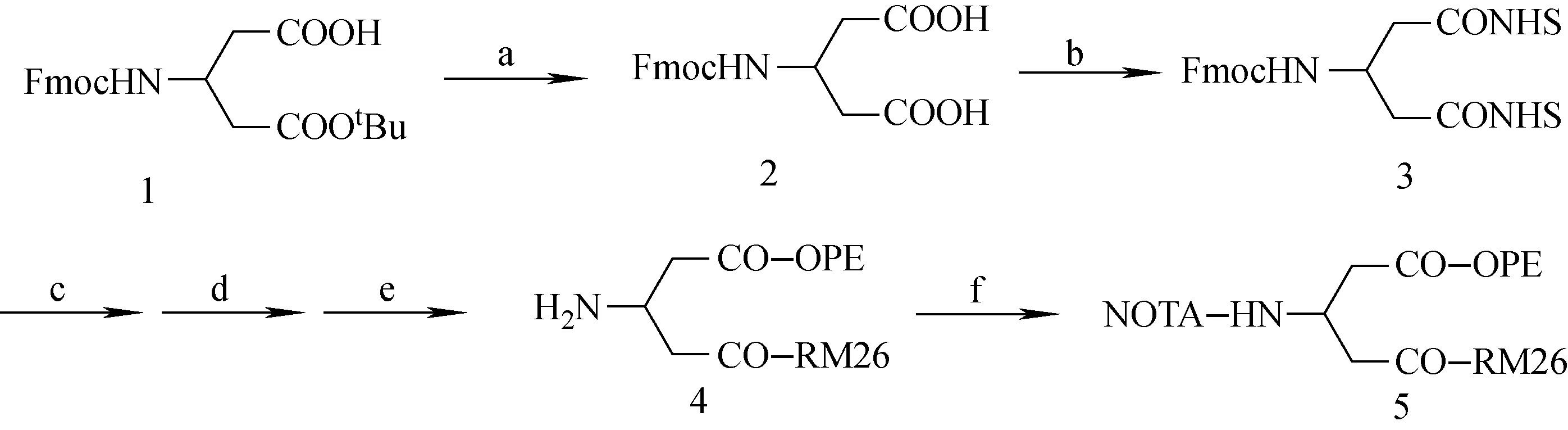
a——TFA, rt, 30 min; b——DCC, NHS, DMF, rt, 2 h;c—— RM26, DIPEA, DMF, rt, 8 h;d——OPE-1 or OPE-2, DMF, rt, 8 h;e——哌啶, DMF, rt, 3 h;f——p-NCS-Bn-NOTA, NEt3, DMF, rt, 2 h图1 NOTA-OPEs-RM26的合成Fig.1 Syntheses of NOTA-OPEs-RM26

图2 NOTA-OPE-1-RM26和NOTA-OPE-2-RM26结构示意图Fig.2 Structures of NOTA-OPE-1-RM26 and NOTA-OPE-2-RM26
2.1.1化合物2的合成 200 mg化合物1溶解在1 mL三氟乙酸中,室温搅拌30 min,减压旋蒸除去溶剂,得到化合物2。
2.1.2化合物3的合成 依次将化合物2(1 eq),DCC(2.1 eq),NHS(2.1 eq)溶解在N,N-二甲基甲酰胺(DMF)中,室温搅拌2 h,然后使用高效液相色谱分离,分离条件为:流动相为含0.1%三氟乙酸纯水和含0.1%三氟乙酸乙腈溶液,乙腈浓度0~30 min,20%~90%,流速:9 mL/min,得到化合物3。
2.1.3化合物4的合成 将化合物3(1 eq),RM26(0.9 eq)溶解在DMF中,加入二异丙基乙胺(DIPEA,10 eq),室温搅拌8 h;然后加入OPE-1或OPE-2(1 eq),室温搅拌8 h;最后加入哌啶(100 eq),继续室温搅拌3 h。反应结束后用HPLC分离样品,分离条件为:流动相为含0.1%三氟乙酸纯水和含0.1%三氟乙酸乙腈溶液,乙腈浓度为0~30 min,20%~50%,流速:1 mL/min,得到化合物4。
2.1.4化合物5的合成 将化合物4(1 eq),p-NCS-Bn-NOTA (1 eq)和三乙胺(10 eq)溶解在DMF中,室温搅拌2 h。反应结束后使用HPLC分离样品,分离条件为:流动相为含0.1%三氟乙酸纯水和含0.1%三氟乙酸乙腈溶液,乙腈浓度:0~30 min,25%~50%,流速:1 mL/min,得到化合物5。
2.2 细胞培养
前列腺癌细胞(PC3)在含10% 胎牛血清(fetal bovine serum, FBS)和1% 青链霉素混合液双抗(penicillin-streptomycin solution, PS)的高糖培养液(dulbecco’s modified eagle medium, DMEM)F12培养基(Ham’s F 12 nutrient medium) (1∶1)培养液中培养,温度37 ℃,CO2含量5%。
2.3 NOTA-OPEs-RM26的177Lu标记
将5 μL NOTA-RM26, NOTA-OPE-1-RM26或NOTA-OPE-2-RM26溶液(1 mmol/L)加入25 μL pH=5.5的醋酸钠缓冲溶液中,加入0.8 μL177LuCl3(24 MBq)溶液,金属浴80 ℃加热反应1 h。点板,以pH=5.5的柠檬酸溶液为展开体系,使用iTLC检测,并计算标记率。
2.4 177Lu-NOTA-OPEs-RM26体外稳定性
取5 μL标记好的177Lu-NOTA-OPE-1-RM26和177Lu-NOTA-OPE-2-RM26,分别使用10 μL生理盐水、高糖培养液、新生牛血清稀释,稀释液在室温保存,分别在2、4、48、72 h使用iTLC检测。
2.5 177Lu-NOTA-OPEs-RM26细胞内化
将177Lu-NOTA-RM26,177Lu-NOTA-OPE-1-RM26和177Lu-NOTA-OPE-2-RM26用细胞培养液稀释至9.07 kBq/mL。在6孔板中接种PC3细胞,每个孔接种4×104个细胞,然后在37 ℃和5% CO2条件下培养48 h,然后将培养液吸走,加入1 mL稀释好的177Lu-NOTA-RM26,177Lu-NOTA-OPE-1-RM26或177Lu-NOTA-OPE-2-RM26溶液,6孔板中37 ℃分别培养1、2、6、24 h。培养结束后,收集每个孔的培养液,并用0.8 mL PBS溶液清洗一次,合并培养液和清洗液,测量其放射性计数,作为细胞膜外放射性计数A外。冰浴冷却,加入预冷的1 mL pH=2.0的尿素溶液(含4 mol/L尿素和0.2 mol/L甘氨酸),冰浴静置5 min,收集清液,重复一次,将两次的尿素溶液合并,测量放射性计数,作为细胞膜放射性计数A膜。室温下加入1 mL 1 mol/L氢氧化钠溶液,静置30 min,收集液体,重复一次,将两次的氢氧化钠溶液合并,测量放射性计数,作为细胞膜内放射性计数A内。分别计算细胞膜和细胞内放射性摄取率。细胞膜放射性摄取率:U膜=A膜/(A外+A膜+A内);细胞内放射性摄取率:U内=A内/(A外+A膜+A内)。
2.6 177Lu-NOTA-OPEs-RM26细胞特异性结合
在6孔板中接种PC3细胞,每个孔接种4×104个细胞,在37 ℃和5% CO2条件下培养48 h后将培养液吸走,加入1 mL含1 000倍蛙皮素(bombesin, BBN)的培养液作为封闭剂[28],37 ℃培养30 min,将培养液吸走,加入1 mL含有1 000倍BBN和标记化合物(667 Bq/mL)的培养液,分别培养15、30、45 min,收集培养液,再用0.8 mL PBS清洗,合并两次液体,测量放射性计数;加入1 mL 1 mol/L氢氧化钠溶液,静置15 min,收集液体,重复一次,将两次的液体合并,测量放射性计数。
3 结果与讨论
3.1 NOTA-OPEs-RM26的制备
化合物1合成得到化合物3的总产率为23%,化合物3合成得到化合物4的产率为19%(OPE-1)和21%(OPE-2),最终产物NOTA-OPE-1-RM26和NOTA-OPE-2-RM26的产率为36%和41%。化合物纯度和结构通过高效液相质谱-质谱(LC-MS)验证(图3)。液相质谱结果表明,化合物的化学纯度大于95%。质谱采用ESI源离子化,检测得到一系列荷质比峰,与计算值相比,误差均小于0.5,确证了化合物结构(表1)。

a——NOTA-OPE-1-RM26;b——NOTA-OPE-2-RM26图3 LC-MS谱图Fig.3 LC-MS spectra of NOTA-OPE-1-RM26(a) and NOTA-OPE-2-RM26(b)

表1 NOTA-OPE-1-RM26和NOTA-OPE-2-RM26荷质比计算值与检测值Table 1 Calculated and detected specific charges of NOTA-OPE-1-RM26 and NOTA-OPE-2-RM26
3.2 NOTA-OPEs-RM26的标记
177Lu-NOTA-OPEs-RM26的放化纯度使用iTLC检测。展开剂为pH=5.5的柠檬酸溶液。Rf=[样品位置(min) -起始位置(0.3 min)]/总距离(0.7 min)。游离177LuRf为0.91,标记后化合物Rf接近0。检测结果表明,化合物177Lu-NOTA-OPE-1-RM26,177Lu-NOTA-OPE-2-RM26和177Lu-NOTA-RM26的标记率均大于99%(图4)。
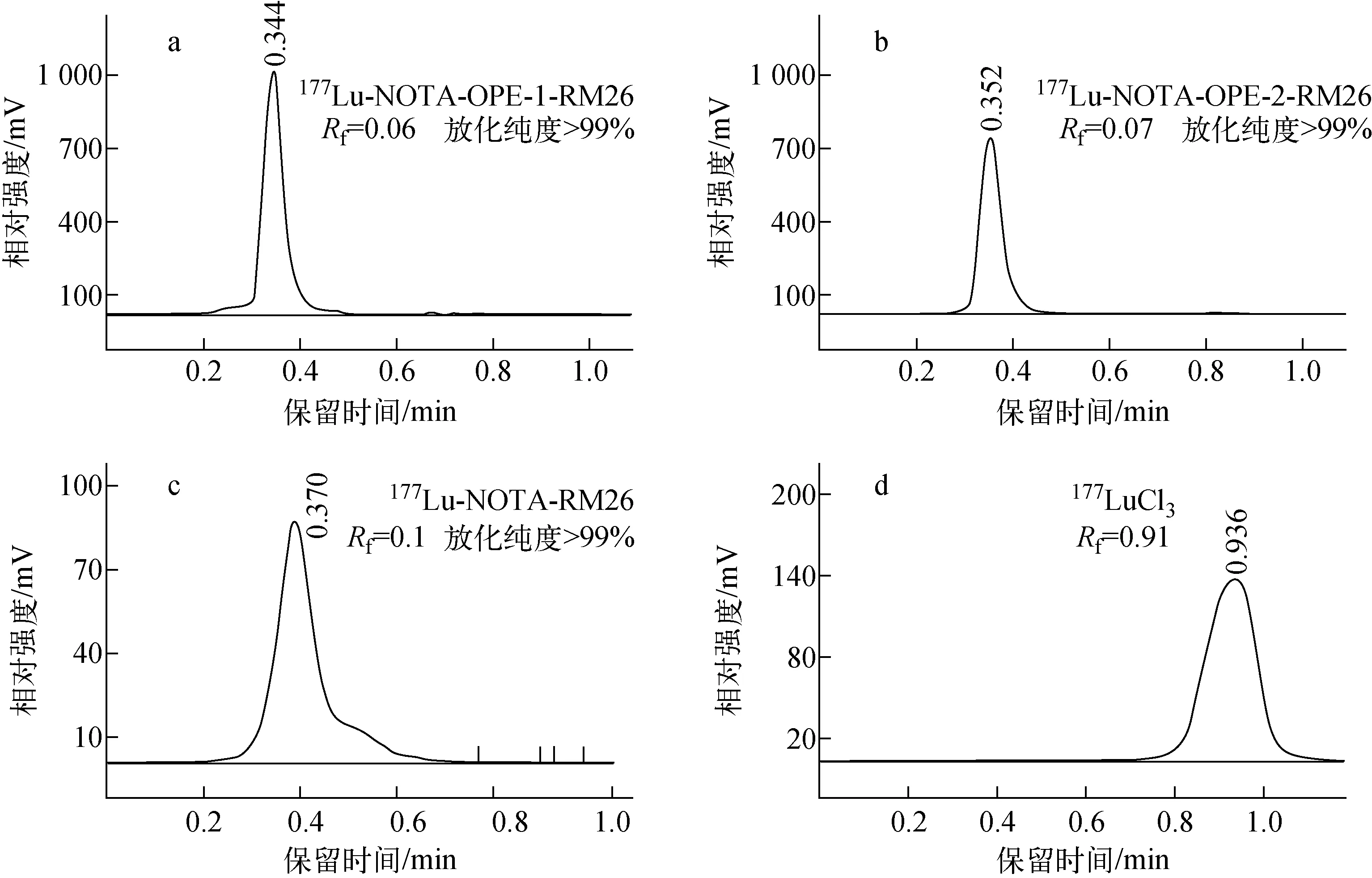
a——177Lu-NOTA-OPE-1-RM26;b——177Lu-NOTA-OPE-2-RM26;c——177Lu-NOTA-RM26;d——177LuCl3图4 iTLC谱图Fig.4 iTLC spectra
3.3 体外稳定性
化合物177Lu-NOTA-OPE-1-RM26,177Lu-NOTA-OPE-2-RM26和177Lu-NOTA-RM26在生理盐水、高糖培养液、新生牛血清中均稳定存在,经过72 h后,三种化合物的放化纯度均大于99%。
3.4 177Lu-NOTA-OPEs-RM26细胞内化
177Lu-NOTA-RM26的细胞膜表面吸收迅速达到最大值26%并逐渐降低到15%,而内化率则从1 h的5%逐渐上升到24 h的28%,总摄取率在6 h达到最大47%(图5a)。177Lu-NOTA-OPE-1-RM26的细胞膜表面吸收2 h达到最大值23%然后逐渐降低,24 h后为6%,而内化剂量逐渐升高,从1 h的5%增加到24 h的30%,总摄取在6 h达到最大41%(图5b)。177Lu-NOTA-OPE-2-RM26的细胞膜表面吸收在2 h达到最大值32%并逐渐降低到15%,而内化率从1 h的6%逐渐升到到39%,总摄取在6 h达到最大值55%(图5c)。

a——177Lu-NOTA-RM26;b——177Lu-NOTA-OPE-1-RM26;c—— 177Lu-NOTA-OPE-2-RM26图5 PC3细胞内化实验结果Fig.5 Cellular internalization of 177Lu-NOTA-RM26(a) , 177Lu-NOTA-OPE-1-RM26 (b) and 177Lu-NOTA-OPE-2-RM26 (c) to PC3 cells
比较三个化合物的吸收发现:1) 细胞膜表面的吸收迅速达到最大值然后逐渐下降;2) 内化剂量随着时间逐渐升高;3) 最大摄取量在6 h达到最大并基本保持稳定。实验结果表明,细胞膜表面的吸附是一个快速的过程,而化合物的内化则需要时间,因此在6 h后,细胞膜表面剂量降低,内化剂量升高,总剂量基本保持不变。引入OPE-1和OPE-2后,细胞内化率从28%分别提高到30%和39%,表明OPE-1稍微提高内化率,而OPE-2显著提高了内化率。OPE-2比OPE-1效果更好的可能原因是OPE-2含有3个叔胺基团,而OPE-1只有一个叔胺基团,而叔胺基团可逆的质子化/去质子化过程可以调节化合物的亲水/亲脂性,有助于提高化合物的跨膜能力[17]。引入OPE-1和OPE-2后,细胞总摄取从47%分别变化为41%和55%。引入OPE-1后,化合物溶解性下降,导致细胞表面吸附降低,从而细胞总摄取降低,而OPE-2具有更好的溶解性和内化能力,从而导致总摄取率提高。
3.5 细胞特异性结合
细胞特异性结合实验可以验证引入OPE是否改变了RM26的特异性结合能力。化合物经过BBN封闭后,177Lu-NOTA-RM26总摄取低于1.1%,而177Lu-NOTA-OPE-1-RM26和177Lu-NOTA-OPE-2-RM26的总摄取不高于2.1%和4.3%(图6)。经过BBN封闭后,177Lu-NOTA-OPE-1-RM26和177Lu-NOTA-OPE-2-RM26的细胞摄取率分别从41%和55%降低到2.1%和4.3%,说明引入OPE并没有改变RM26的特异性结合能力。

图6 177Lu-NOTA-RM26, 177Lu-NOTA-OPE-1-RM26和 177Lu-NOTA-OPE-2-RM26的PC3细胞特异性结合(1 000倍BBN作为封闭剂)Fig.6 Cellular binding affinity of 177Lu-NOTA-RM26, 177Lu-NOTA-OPE-1-RM26 and 177Lu-NOTA-OPE-2-RM26 to PC3 cells (1000-fold of BBN as the blocking agent)
4 结论
将具有跨膜能力的OPE与具有特异性结合的RM26结合,得到两种潜在放射性治疗药物前体NOTA-OPE-1-RM26和NOTA-OPE-2-RM26。其177Lu标记率均大于99%,并且标记物在生理盐水、高糖培养液、新生牛血清中稳定性良好。细胞内化实验表明,引入OPE-1稍微提高了化合物的内化率,引入OPE-2明显提高了化合物的内化率。引入OPE并没有改变RM26的特异性结合能力。结果表明,引入跨膜基团OPE有助于提高拮抗剂多肽的内化率,从而提高拮抗剂作为放射性治疗药物的疗效。

