α核素225Ac的制备及医学应用现状
赵紫宇,温 凯,马承伟,褚浩淼,段 菲,李 光,李忠勇
(原子高科股份有限公司,北京 102413)
相比于发射β粒子和俄歇电子的核素,α核素在放射性免疫和肿瘤治疗方面有着更大的应用潜力[1-2],原因在于其具有以下优势:高线性能量传递(LET,>100 keV/μm)和短组织射程(<100 μm),能够以低剂量照射正常组织而获得较高的癌细胞杀伤率[3-5]。靶向α治疗(targeted alpha therapy, TAT)是一种由标记有α核素的放射性药物组成的治疗方案,能够在靶点的有限区域内表现显著的细胞毒性效应,对其他健康组织和器官的有害辐射剂量较低[6-7]。
2013年,发射α粒子的放射性药物Xofigo(223RaCl2)获得美国FDA批准用于临床,但α核素标记的靶向TAT分子仍处于开发阶段。225Ac(T1/2=9.9 d,100%α衰变)是一种很有前景的TAT放射性核素[8],225Ac在相对较短的时间内衰变,可以发射4个α粒子和2个β粒子;225Ac/213Bi发生器能够产生衰变子体213Bi(T1/2=45.6 min),一些临床实验已经证明225Ac或213Bi放射性药物可有效地用于TAT新型肿瘤治疗和核医学诊断中[9-10]。225Ac的TAT药物主要包括225Ac标记的单克隆抗体和小分子靶向药物,目前多数药物处于Ⅰ期临床研究和临床前研究阶段,相关实验已经证明225Ac放射性药物用于TAT治疗的安全性[11]。
本文主要从放射性核素225Ac的性质、制备方法和标记药物的研究现状三个方面进行总结,希望能为225Ac的生产制备和应用提供参考。
1 225Ac的性质
1.1 225Ac的衰变特性
核素225Ac于1899年被Debierne首次发现,半衰期为9.9 d,发生α衰变(5.93 MeV,100%),通过4次α衰变和2次β衰变到稳定的209Bi,衰变链如图1所示。225Ac衰变期间发射的γ射线为其标记药物的体内分布显像提供可能[12-13];在衰变链中会产生六个主要的放射性核素子体,这些子体和225Ac均可对癌细胞进行有效杀伤。但是衰变时发射高能α粒子带给子核的反冲能量通常>100 keV,这导致子体核素可能从原始输送载体中脱离并在体内重新分布,损害非靶点健康组织并且造成治疗效果下降,所以225Ac及其衰变子体的靶向性成为一个挑战。同时,225Ac的衰变子体213Bi(T1/2=45.6 min),可以发射6 MeV α粒子,444 keV β粒子和440 keV γ光子,也是很有价值的TAT核素[14]。
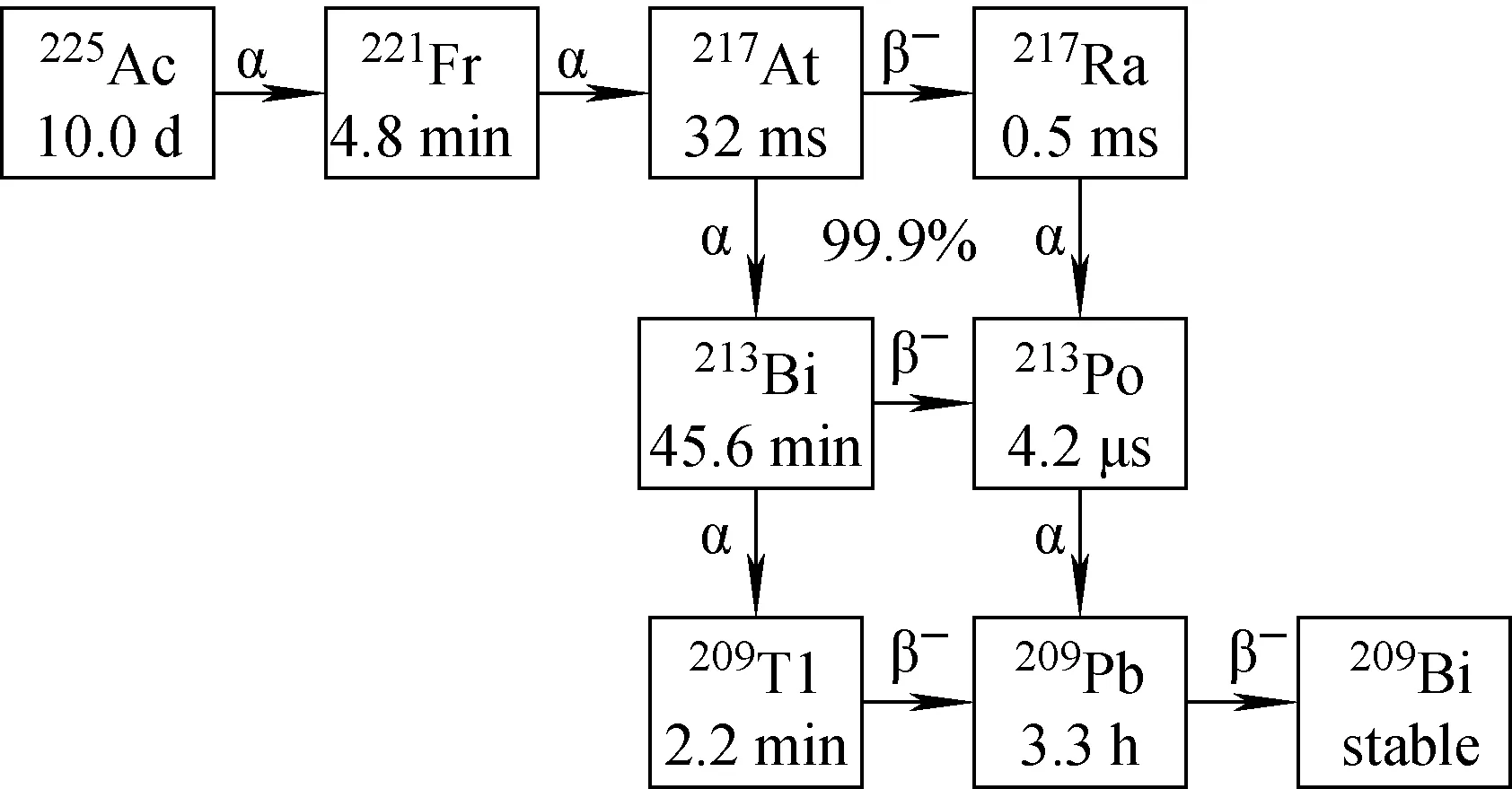
图1 225Ac的衰变链Fig.1 Decay chains of 225Ac
1.2 225Ac的化学性质
225Ac通常以+3价离子态存在,离子半径为112 pm;Ac3+的离子半径适合于大型多齿类螯合剂进行配位[15-16]。无螯合剂时,在溶液水解以[Ac(OH)3-x]x-形式存在;亚皮摩尔浓度即可形成放射性胶体,易吸附于反应容器表面[17]。当225Ac与靶向分子结合时,可直接用于核医学治疗。同时,225Ac-213Bi发生器制备子体核素213Bi,也可通过螯合剂与靶向分子结合,实现靶向治疗[18]。但由于目前225Ac的供应量有限,225Ac和213Bi在放射性治疗中的应用受到限制。
2 225Ac的制备
目前全球225Ac年产量不足74 GBq(2 Ci),价格为20~30万元/mCi,TAT的一次治疗量通常为2.5~7.4 MBq(0.08~0.2 mCi),每年产量仅可用于约1 000名患者的治疗,预计未来两年内需求量可达185~370 GBq(5~10 Ci)[19]。人们对于225Ac的关注已大幅提高,但225Ac规模化生产技术仍处于开发阶段。为缓解225Ac严重的供需矛盾,世界各国相继开展了225Ac的制备方法研究[20]。
基于反应堆的225Ac生产能力有限,目前制备225Ac主要有三类方法[20-22]:229Th/225Ac发生器、高能质子加速器辐照钍靶、加速器辐照镭靶。
2.1 229Th/225Ac发生器
自然获取225Ac的方式是通过核素233U的衰变(衰变链:233U→229Th→225Ra→225Ac),目前全球的225Ac主要是由233U衰变产生,由此制成的229Th/225Ac发生器可获得有限的225Ac[23]。233U来自于232Th的核燃料循环,来源为美国能源部熔融钍盐反应堆项目和俄罗斯的钍燃料研究反应堆项目[24-25]。229Th核素主要存量于世界三家实验室[22,25-26]:美国橡树岭国家实验室(ORNL)(5.55 GBq,150 mCi)、德国卡尔斯鲁厄超铀元素研究所(ITU)(1.7 GBq,46 mCi)、俄罗斯奥布宁斯克物理与动力工程研究所(IPPE)(5.55 GBq,150 mCi)。受不扩散核武器条约的限制,229Th的价格昂贵并且供不应求,这三家的库存不足以满足目前世界范围内225Ac放射性药物研发和临床研究的需要。
美国ORNL生产了世界上绝大部分225Ac。ORNL实验室225Ac的分离提纯是通过阴离子树脂MP1先后以硝酸、盐酸为淋洗液和阳离子树脂AG50W-X4以不同浓度的硝酸为淋洗液完成的,所得225Ac放射性核纯度为99.6%,杂质225Ra含量≤0.6%,229Th含量≤4×10-5%[25]。2005年德国ITU的Morgenstern等[27-28]报道了一种基于硝酸介质中离子交换、萃取色谱相结合从229Th中分离和纯化225Ac的方法,具体为用8 mol/L硝酸溶解233U,将滤液通过Dowex 1×8阴离子交换柱(100~200目),以降掉229Th和232Th杂质。在225Ac分离中,首先用UTEVA萃取色谱柱去除残留的痕量钍,再使用间苯二酚-乙醛预缩合树脂(RE树脂)以0.05mol/L硝酸为淋洗液,获得无载体225Ac。此方法制备的225Ac回收率超过95%,杂质229Th和233U含量低于0.009%,225Ra含量低于0.002%。另外,德国Apostolidis等[27]的研究表明,RE树脂比基于有机载体的树脂具有更强的耐辐射性能。
229Th发生器生产225Ac的优势是核素纯度较高,Ac同位素杂质含量低[20],但由于229Th(T1/2=7 340 a)的半衰期较长,衰变相对较慢,225Ac的供应量十分有限。因此开发225Ac的新型制备工艺成为研究热点。
2.2 加速器辐照钍靶
同位素生产需要使用稳定或天然存在且半衰期长的靶材料,由于225Ac的核子数小于绝大多数的锕系元素,只有少数稳定的核如232Th,226Ra可作为加速器辐照的靶材[22]用于光子、快中子,甚至质子辐照,且对束流的能量和强度等条件要求较高。其他潜在的靶材料如230Th、228Th、228Ac和228Ra,由于天然丰度较低难以实现实际应用[20]。
利用中能或者高能质子加速器(质子能量大于100 MeV和较高的束流强度)诱发232Th靶散裂反应制备225Ac,核反应为232Th(p,x)225Ac,是目前生产225Ac应用较广的方式。232Th不属于核裂变材料,天然丰度接近100%,适合作为靶材。通过散裂反应制备225Ac,232Th靶比238U靶密度高、熔点低,在高束流引起的高热负荷时使用更为安全,同时也避免易裂变产物239Pu和235U的产生[20]。
2.2.1钍靶的制备232Th靶材料可以选用natTh或者natThO2,natThO2一般通过钍盐氧化制得。2019年,加拿大TRIUMF[29]报道了一种天然钍箔靶,将钍箔(0.25 mm,美国IBI Labs)密封在两个Inconel®718(0.127 mm)合金窗内,再整体置于SS316组成的靶外框内,制成钍箔靶。靶件经过0.5 MPa的氦气压力测试未发现损坏,并通过机械和热力学模型评估了束流阈值。辐照后靶件均未出现翘曲、变色现象以及其他过热或机械应力的迹象。2021年,北京大学刘志博等[30]通过钍盐氧化法制备了natThO2靶,具体过程为首先将Th(NO3)4与H2C2O4的反应物在空气中600 ℃煅烧4 h以获得ThO2粉末;然后将ThO2粉末压实并用钛箔覆盖封装进入铌靶中(30 mm×2 mm,0.71 g/cm2)得到natThO2靶。
2.2.2钍靶的辐照 2014年,俄罗斯的Kalmykov等[31]在俄罗斯科学院核研究所(INR RAS)的直线加速器上辐照钍靶10 h,质子束流能量范围为90~141 MeV,束流强度达50 μA,225Ac的产量为0.59 GBq(EOB)。2016年,美国三大国家实验室以78~192 MeV进行了16次高能质子辐照天然钍靶的实验[32],连续辐照10 d,225Ac的产量为55.6 GBq(1.5 Ci)。2021年,中国原子能科学研究院(CIAE)[30]使用CYCIAE100高能强流加速器,以100 MeV 2 μA质子束流对natThO2靶进行辐照,获得了约22.2 MBq(0.6 mCi)的225Ac,实现了我国225Ac的首次加速器生产。
2.2.3225Ac的分离纯化 从232Th中分离225Ac通常使用离子交换树脂柱。2014年,美国的Fassbender等[18]通过组合离子色谱柱实现225Ac的核素分离。首先使用经预处理的阳离子树脂柱(AG 50W-X8,200~400目,H+)洗脱Th4+和大多数过渡金属阴离子如103Ru和95Zr。然后用DGA萃取色谱柱分离提纯225Ac,以6 mol/L盐酸的淋洗液洗脱223Ra和140Ba,用4 mol/L硝酸进一步去除残余的223Ra和140Ba;再用10 mol/L硝酸淋洗液从DGA柱中洗脱225Ac(>99%)。此方法中225Ac的回收率大于98%,溶液中无其他非锕元素,227Ac含量约为0.1%(EOB)。2016年,美国ORNL[32]进行225Ac分离纯化中仍然沿用了此方法,并优化分离流程,用pH=2的1 mol/L草酸替代柠檬酸作为螯合剂去除232Th和裂变产物,结果显示227Ac/225Ac比率为0.2%。2018年,美国的McAlister[33]报道了232Th靶散裂法分离纯化制备225Ac的方法,使用UTEVA阳离子交换树脂和DGA树脂柱组合实现镭和锕元素的分离。此方法中225Ac回收率>92%,杂质225Ra的去污系数>109。
2021年,刘志博等[30]使用HNO3和HF混合液加热溶解钍靶,蒸干后用0.5 mol/L柠檬酸溶液复溶。225Ac分离纯化通过离子交换色谱法三步完成:首先,AG50W-X8阳离子交换色谱法去除Th基体,用柠檬酸溶液作为淋洗液可以定量去除Th4+、高价离子阳离子以及其他碱金属离子;然后,用4 mol/L HNO3溶液洗脱DGA树脂柱除掉Ba2+和Ra2+;最后,在TRU树脂上用2 mol/L HNO3溶液作为淋洗液依次洗脱Ac3+、La3+和Ce3+。此方法中225Ac的回收率接近95%,225Ac放射性核纯度>99%。
综上,通过232Th制备225Ac具有以下优点:①232Th的放射性毒性较低;② 设施在制靶、辐照方面已完成验证;③ 制备工艺如分离纯化等较为完善。同时,存在以下缺点:① 全球可满足束流条件回旋加速器数量有限;② 伴随产生微量剧毒、长半衰期的227Ac核素(T1/2=21.8 a),与225Ac无法化学分离,因此对靶片、加速器参数和分离操作要求均较高。
2.3 加速器镭靶辐照
镭是一种化学性质活泼的金属,作为核反应靶材,较差的热性能限制了其可用的能量密度。镭元素的同位素226Ra是一种高放射性元素,其子体222Rn(T1/2=3.86 d)也具有放射性。由于226Ra靶的高辐射毒性、化学不稳定性及其子体222Rn气体的放射性,226Ra靶的制造、辐照、加工和回收均极为复杂。1996年,国际原子能机构(IAEA)制定了在长期地质储存库中处置226Ra源的指南[34],目前世界范围内226Ra存量仅有几公斤,新的226Ra可从当前铀矿开采的废物中提取。目前辐照镭靶制备225Ac的实际效果较好,主要有高能γ光子辐照和质子辐照制备两种方式。
2.3.1镭靶的制备 镭靶的制备主要有挥发法和封装法。2005年,澳大利亚的Apostolidis[35]等制备毫克级的226Ra靶:缓慢蒸发226RaCl2和BaCl2的稀盐酸溶液至银箔表面,其上覆盖另一张银箔,一并压制封装进银胶囊靶中。上述胶囊靶需要在0.1 mol/L盐酸溶液中100 ℃加热1 h以确保其机械稳定性和密封性;并且在辐照前监测Rn浓度确认靶密封性。2006年,俄罗斯JNR研究所Maslov等[36]将硫酸钡和硫酸镭(硝酸钡和硝酸镭亦可)封装进圆柱形铝靶制备镭靶。
2.3.2镭靶辐照 高能γ和质子辐照镭靶则分别需要电子加速器和质子加速器等设施。高能γ射线辐射226Ra靶[37]核反应为226Ra(γ,n)225Ra,经β衰变(T1/2=14.9 d)为225Ac。高能γ射线通常由25~30 MeV的电子加速器产生,在世界范围内有多个研究所和商业化公司利用电子加速器开展制备225Ac的研究[38-39]。2021年,加拿大Diamond等[39]利用电子加速器(25 MeV,20 kW)辐照10 d产生约148 GBq(4 Ci)的225Ra。此方法除镭靶的中子俘获可能导致227Ra迅速衰变为227Ac外,不会导致其他锕同位素的产生,以确保227Ac:225Ac的比率低至ppm级。
通过质子能量>16 MeV的低能医用回旋加速器轰击226Ra制备225Ac[23,35],核反应为226Ra(p,2n)225Ac,该反应在16.8 MeV处有反应截面峰值(710 mb)。2004年,德国Apostolidis等[35,39]初次验证226Ra(p,2n)225Ac反应途径生产225Ac的可行性。首先从慕尼黑理工大学放射化学研究所获得的226Ra靶,通过远程遥控制备镭靶,然后使用15.9 MeV,50 μA的质子束流辐照30.1 mg的226Ra靶45.3 h,225Ac产量可达484.7 MBq(13.1 mCi)。
2.3.3从镭靶中提取225Ac 辐照226Ra靶所产生的225Ra经β衰变为225Ac,18 d后225Ac约为225Ra活度的46%,此时225Ac的分离效果最佳,2005年德国ITU实验室Apostolidis等[35]通过两步树脂柱分离法实现225Ac和226Ra的分离。首先将226Ra靶溶解在0.01 mol/L盐酸中,使用二(2乙基己基)正磷酸(HDEHP)柱进行分离,淋洗液为0.1 moL/L盐酸除掉226Ra等杂质,再使用2 mol/L盐酸洗脱获得含225Ac的粗产物。第二步使用4,4′(5′)-二叔丁基环己基18-冠-6(冠醚)树脂(Sr树脂)去除残留量的镭及其子体,2 mol/L盐酸洗脱获得225Ac。同年Apostolidis等[40]继续报道了RE树脂柱分离法实现225Ac和225Ra的分离,淋洗液为4 mol/L硝酸洗脱去除225Ra,当淋洗液为0.05 mol/L硝酸时将吸附在RE树脂柱上的225Ac洗脱,225Ac放化纯度≥95%。
综上,实验表明辐照镭靶在225Ac的生产规模化和质量控制方面均可行。但是使用镭靶时需考虑以下问题:① 无论是旧存量还是通过铀矿尾矿获得226Ra,226Ra靶都需要不同于现有医用同位素的靶系统设施;②226Ra和其子体222Rn的监管和安全要求较高;③ 在辐照、加工和回收226Ra靶材过程中,面临着物流困难,比如226Ra的放射性子体222Rn及其子体的高能γ辐射的气体运输。虽然辐照镭靶生产225Ac潜力巨大,但是仍然面临安全性和设施成本等困难。
3 225Ac标记药物
3.1 常见双功能螯合剂
225Ac的离子半径较大,具有良好的配位能力,常见的螯合剂结构有1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(DOTA)、乙二胺四乙酸(EDTA)、N-[(R)-2-氨基-3-(4-硝基苯基)丙基]-反式(S,S)-环己烷-1,2-二胺-N,N,N′,N′,N′-五乙酸(CHX-A″-DTPA),1,4,7,10,13,16-六氮杂环十八烷-N,N′,N″,N‴,N″″,N‴″-六乙酸(HEHA)和3,6,9,15-四氮杂双环[9.3.1]十五烷-1(15),(PEPA)11,13-三烯-3,6,9-三乙酸(PCTA)等[41],具体结构示于图2。
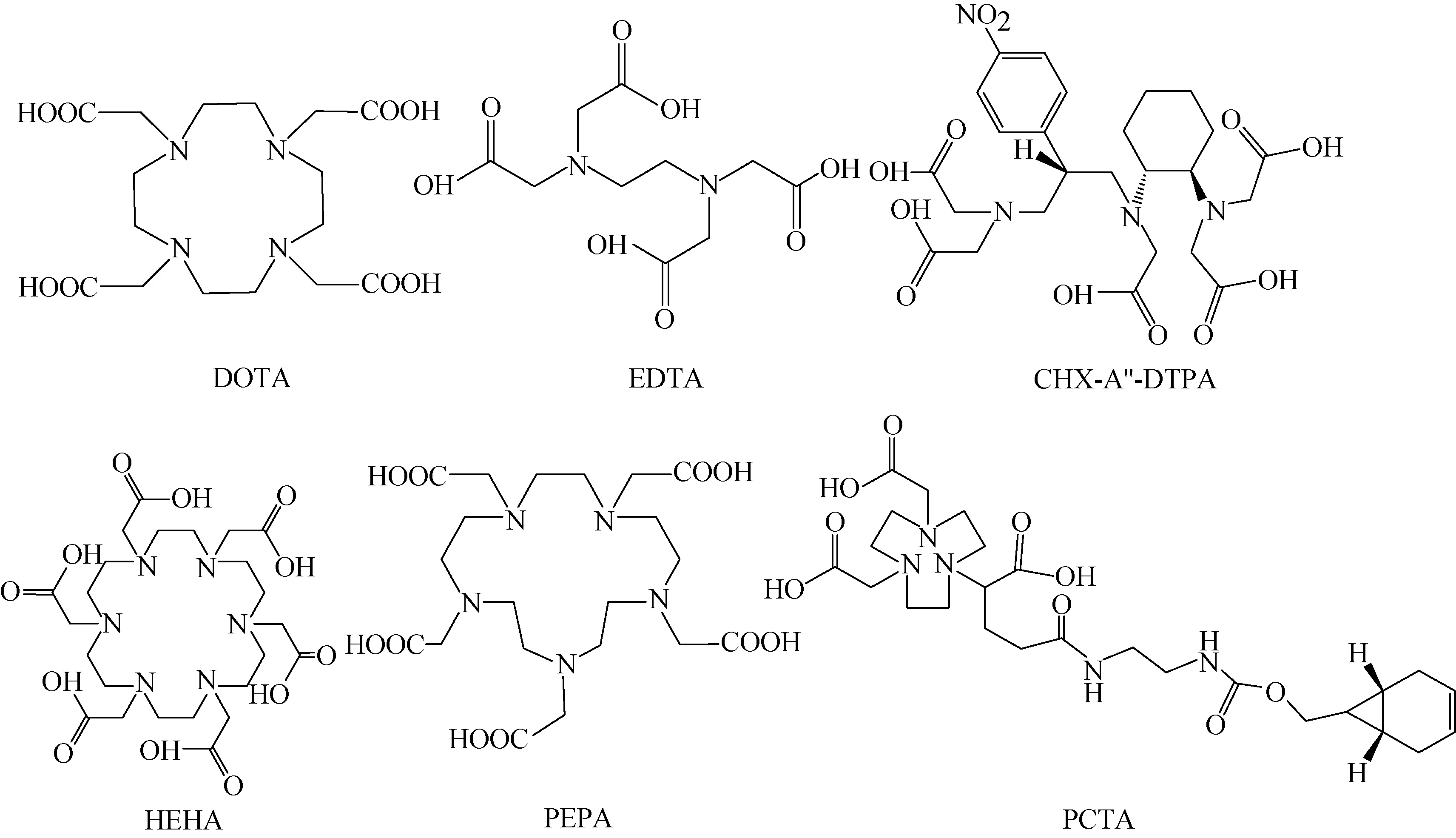
图2 225Ac标记用常见双功能螯合剂的结构Fig.2 Chemical structure of typical bifunctional chelators for 225Ac labeling
通过大环中的4个叔氨氮和4个长臂上的羧酸氧实现DOTA与金属离子的配位,它与225Ac形成的螯合物在体内相当稳定,并形成硫脲键牢固连接到抗体上[42]。DOTA具有热力学稳定性好、标记反应和生物靶向载体偶联反应快速、定量、条件温和,生成的标记物配位结构单一、明确等优势,因此DOTA目前仍然是225Ac双功能螯合剂的金标准[43]。DOTA螯合剂的商业化供应以及225Ac-DOTA配合物良好的血清稳定性使其成为目前开发最多的225Ac螯合剂。
放射性药物中通常标记方法是将双功能螯合剂与生物靶向载体先行偶联,再用放射性金属进行标记,这样容易对连有靶向载体的分子进行表征和靶向结合性质进行评价。为了提高标记率,标记过程通常需要升高温度和延长反应时间。为简化标记,需要设计并应用DOTA类螯合剂,以使225Ac标记化合物更稳定、反应条件更温和,其中异硫氰酸酯官能化的DOTA(DOTA-NCS)最为常用,螯合率可达93%[44]。Antczak等[45]发现基于硫醇的DOTA连接体(DOTA-SH)和基于肽的DOTA连接体(DOTA-G3FC)与225Ac螯合效果较好,螯合率可达95%~99%。其他螯合剂因为独特的分子结构和优异的药理活性,在某方面表现出更优于DOTA的性能,近年亦被开发,但大多数处于研究初始阶段。CHX-A″-DTPA主链中的二氨基环己基可进一步提高225Ac络合物的稳定性;HEHA具有比DOTA更大的十八元大环空腔,有十二个配位位点[46-47],螯合率95%。PCTA与225Ac螯合形成偶联物的螯合率接近100%,表现出比DOTA更高的亲和力。子体213Bi与PCTA呈现高亲和力结合,明显地减少从抗体上分解游离的225Ac及其子体,这对提高TAT药物疗效、降低毒性和延长产品有效期十分有效[48]。
3.2 225Ac标记的单抗药物
3.2.1225Ac-DOTA-lintuzumab Lintuzumab用于靶向HL60白血病具有较强特异性,Hagemann等[49]设计合成了225Ac-DOTA-lintuzumab(HuM195,即anti-CD33)的靶向分子已用于治疗白血病临床实验,处于临床Ⅰ期。225Ac-DOTA-lintuzumab在15 d后的损失<5%,显示出良好的体外稳定性;体内实验中患者的中位生存期为52~126 d,放射性毒性仅出现在225Ac的最高活性水平处,安全剂量约为3 μCi/kg[50]。
3.2.2225Ac-DOTA-trastuzumab 人类表皮生长因子2型(HER2)是治疗乳腺癌的重要靶点。依托于HER2靶向药物(如曲妥珠单抗、拉帕替尼、培妥珠单抗等)的放射性药物开发,是核医学治疗领域的一个重要方向[51-52]。225Ac-DOTA-trastuzumab在体外对过度表达HER2的肿瘤细胞中显示出良好的杀伤效果[51]。此药物在治疗人乳腺导管原位癌模型小鼠实验中,取得了较好的治疗效果[53],225Ac-DOTA-trastuzumab测定的免疫反应分数(IRF)高于80%,表明其与HER2受体完全结合,体外稳定性较好;225Ac在主要脏器中如肝脏、脾脏、肾脏和骨骼中均表现出高摄取,2 h内体内快速清除(<0.2%ID/g)。225Ac-DOTA-trastuzumab可以在不产生严重毒性的前提下,显著延长卵巢癌模型裸鼠的存活率,相关数学模型已经证实225Ac在抑制肿瘤生长和降低全身毒性方面优于177Lu[54]。
3.3 225Ac标记的多肽和小分子化合物
3.3.1225Ac-PSMA-617 前列腺特异性膜抗原(PSMA)是一种在前列腺癌细胞膜上过度表达的糖蛋白,前列腺癌细胞的PSMA表达是前列腺癌治疗和诊断的重要靶点[55]。
南非Mathias等[56]开展的关于225Ac-PSMA-617的临床实验中,73名转移去势抵抗性前列腺癌(mCRPC)患者总计接受了210周期的治疗(中位治疗周期=3,范围=1~8),其中82%的患者出现血清PSA下降且70%的患者出现PSA反应(血清PSA下降50%及以上),而177Lu-PSMA-617仅有43%的患者出现PSA反应,表明225Ac-PSMA-617具有良好的肿瘤治疗效果。比177Lu-PSMA有更好的肿瘤控制和生命延续效果。
研究表明,在PSA反应方面225Ac的临床应答率(70%)明显高于177Lu(34%~59%),原因在于α粒子(225Ac 100 keV/μm)比β粒子(177Lu 0.7 keV/μm)具有更高的线性能量传递。更高的线性能量传递又会使得225Ac的细胞杀伤对氧和血红蛋白水平的依赖性显著降低。所以在治疗过程中,决定治疗效果的是肿瘤对辐射的内在敏感性而不是病变数量[57]。225Ac-PSMA-617治疗的最主要毒性是唾液腺损伤[58],因为α粒子会损伤PSMA表达的器官和代谢相关的器官[59-60]。
3.3.2225Ac标记奥曲肽类化合物 神经内分泌肿瘤(NETs)是一种分布于身体大部分器官的肿瘤[61-62],大多数神经内分泌肿瘤(NETs)能够表达生长抑素受体(SSTR)。SSTR又可以与生长抑素(SST)结合从而被成功地靶向[63-64],奥曲肽是一种SST类似物,因此治疗NETs。
Chandrasekhar Bal等[65-66]使用225Ac-DOTATATE对177Lu-DOTATATE治疗难度大、生长抑素受体(SSTR)阳性、转移性胃肠胰腺神经内分泌肿瘤(GEP NETs)进行治疗研究,结果表明,多数患者症状缓解或者病情稳定,没有出现3/4级血液毒性、肾功能不全或肝毒性的现象。225Ac-DOTATATE治疗安全性高、副作用低且耗时短,这为无标准治疗方案的终末期GEP-NETs治疗增加了新的方案。
4 结论
225Ac是一种有应用前景的靶向α治疗核素,具有良好的核性质、适宜的半衰期和优异的化学性质,可标记单抗类、PSMA和奥曲肽类等多种药物分子以进行靶向放射性治疗。225Ac标记过程简单、操作方便,目前已有225Ac-DOTA-lintuzumab、225Ac-PSMA-617的标记药物成功地应用在白血病和恶性肿瘤的治疗中。225Ac作为靶向α治疗的放射性药物,与177Lu相比,治疗效果优异、毒性低、安全性好、有较好的医学应用前景。
本文对225Ac核素的制备方式和225Ac标记药物进行了总结。目前225Ac的制备主要有229Th/225Ac发生器、加速器辐照232Th靶和辐照镭靶三种方式,其中229Th有稀缺性和安全敏感性,而镭靶的辐射安全和工艺复杂问题,因而高能加速器辐照232Th最有可能实现225Ac的规模化生产。加速器辐照232Th制备225Ac工艺正在趋于成熟,一旦加速器制备225Ac实现规模化供应,225Ac在核医学的应用将进入黄金期。在未来的研究中,可以从制靶、辐照和分离纯化等多方面同时开展研究,早日实现医用级225Ac规模化生产和临床应用。

