藏族男性中年慢性高原病患者骨髓巨核细胞增殖、凋亡及相关蛋白的表达※
尹启超,耿 惠,马 婕,王生艳,郭 勇,崔 森#
(1.青海大学研究生院,青海 西宁 810016;2.青海大学附属医院,青海 西宁 810001)
有学者发现,慢性高原病(chronic mountain sickness,CMS)患者血小板水平偏低;又有报道称,随着海拔高度的增加和进驻高原时间的延长,血小板计数显著增加[1]。本研究拟通过监测藏族男性中年CMS患者外周血血小板数量及相关指标变化,进一步研究藏族男性中年CMS患者与藏族健康人群之间骨髓巨核细胞(megakaryocytes,MEG)增殖、凋亡变化及相关蛋白表达情况的差异。
1 材料与方法
1.1 主要试剂仪器
Annexin V-FITC/PI细胞凋亡检测试剂盒(BD公司,美国)、BD IntraSure Kit试剂盒(BD公司,美国);APC anti-human CD61、Brilliant Violet 421 anti-human CD41、FITC Anti-Bcl-2、PE Rabbit Anti- Active caspase-3、PE Anti-human CD110(C-MPL)、FITC Anti-bax(Biolegend公司,美国);细胞周期试剂盒(联科生物公司,中国)。全血细胞分析仪(迈瑞公司,中国);流式细胞仪(BD公司,美国)。
1.2 研究方法
1.2.1 研究对象及分组
研究对象:2021年1月至12月在青海省玉树市八一医院就诊的CMS患者及健康体检者近百例,按研究意图剔除影响本研究结果的干扰性病例,各组余8例,均为长期居住在海拔高于3000 m地区的藏族男性,两组间年龄(46.63±15.02 vs 49.63±16.27)和BMI(24.75±3.73 vs 25.11±1.93)均无统计学差异(P>0.05)。CMS患者以第六届国际高原医学和低氧生理学术大会(中国西宁,2004)推荐的CMS诊断标准确诊[2]。
分组:CMS患者8例,纳入CMS组;健康体检者8例,纳入CON组。
本研究获得青海大学附属医院伦理委员会认可。
1.2.2 主要分析指标选择
外周血血小板计数(platelet,PLT)、血小板压积(plateletcrit,PCT)、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)、大血小板比例(platelet-large cell ratio,P-LCR);MEG增殖率、凋亡率、C-MPL、Bax、Bcl-2、caspase-3。
1.2.3 标本采集
于早上8:00从肘静脉采集静脉血2 mL行外周血细胞学分析。选择髂后上棘为穿刺点,行骨髓穿刺术抽取骨髓液0.1~0.2 mL置玻片上,迅速制作涂片5~6张,以备细胞形态学观察,然后再抽吸骨髓液5~10 mL,装入含EDTA的真空采血管中用于流式检测。
1.2.4 骨髓单个核细胞中的MEG检测
流式管中加入100 μL抗凝骨髓、1 mL PBS,混匀后于室温孵育5 min,离心(300g,5min),弃上清,充分洗涤样本,重复2次。加入2 mL Lysing solution,静置10 min后离心(300g,5min)弃上清,加入2 mL PBS混匀、重悬、沉淀,离心(300g,5min)弃上清。每管加入BV421-CD41、APC-CD61抗体各5 μL,混匀后避光孵育20 min。细胞经PBS清洗后加入500 μL PBS重悬,使用流式细胞仪检测、计算骨髓单个核细胞(bone marrow mononuclear cells,BMMNCs)的CD41+、CD61+细胞比率。
1.2.5 巨核细胞增殖率检测
按照1.2.4所示方法孵育抗凝骨髓。加入Lysing solution去除红细胞,用BV421-CD41、APC-CD61染色处理。在清洗处理后的抗凝骨髓中加入1 mL DNA染色液和10 μL免疫染色通透液,振荡(涡旋,5~10s)混匀,在室温、避光条件下孵育30 min后使用流式细胞仪检测各时相MEG比例。
1.2.6 巨核细胞凋亡率检测
按照1.2.4所示方法孵育抗凝骨髓。加入Lysing solution去除红细胞,用BV421-CD41、APC-CD61染色处理。在清洗处理后的抗凝骨髓中加入200 μL Binding Buffer重悬、沉淀,加入5 μL Annexin V-FITC、10 μL PI,混匀,在室温、避光条件下孵育15 min,加入200 μL Binding Buffer,混匀后使用流式细胞仪检测MEG凋亡率。
1.2.7 巨核细胞TPO配体C-MPL表达水平检测
按照1.2.4所示方法孵育抗凝骨髓。加入Lysing solution去除红细胞,用BV421-CD41、APC-CD61染色处理。在清洗处理后的抗凝骨髓中加入5 μL PE-CD110(C-MPL),混匀,在室温、避光条件下孵育20 min。经PBS洗涤后使用500 μL PBS重悬细胞,混匀后使用流式细胞仪检测巨核细胞C-MPL表达水平。
1.2.8 巨核细胞中凋亡相关蛋白Bax、Bcl-2、caspase-3表达水平检测
抗凝骨髓按照1.2.4所示方法孵育。加入Lysing solution去除红细胞,用BV421-CD41、APC-CD61染色处理。在清洗处理后的抗凝骨髓中加入100 μL试剂A(BD IntraSure Kit),混匀,在室温避光条件下孵育5 min,加入2 mL Lysing solution,静置10 min后离心弃上清,加入50 μL试剂B(BD IntraSure Kit)充分混匀,然后分别加入FITC Anti-Bax、PE Rabbit Anti-Active Caspase-3、FITC Anti-Bcl-2抗体各5 μL,混匀,避光孵育20 min。细胞经PBS洗涤后使用500 μL PBS重悬,混匀后使用流式细胞仪检测巨核细胞Bax、Bcl-2、caspase-3表达水平。
1.2.9 统计学分析

2 结果
2.1 CMS患者外周血小板参数
外周血细胞学分析显示,CMS组外周血PLT[(180.38±46.01)×109/L]低于CON组[(249.63±51.39)×109/L](P<0.001),PCT[(0.17±0.03)%]低于CON组[(0.22±0.03)%],差异有统计学意义(P=0.004),P-LCR[(23.83±5.18)%],高于CON组[(17.89±10.34)%],差异有统计学意义(P=0.009),而MPV、PDW两组间接近临界值(P=0.054,P=0.072)。(表1)
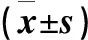
表1 CMS组和CON组外周血细胞学参数Table 1 Peripheral hematological parameter of CMS group and CON
2.2 CMS患者骨髓MEG增殖率及凋亡率
流式细胞术检测显示,CMS组MEG增殖率高于CON组(P=0.001)(图1),凋亡率低于CON组(P=0.002)(图2);而BMMNCs中的MEG比例在CMS组呈增高趋势,但两组间无显著性差异(P=0.585)(表2,图 3)。

图1 骨髓巨核细胞增殖率(%)

图2 骨髓巨核细胞凋亡率(%)

表2 CMS组和CON组骨髓MEG比例及增殖率和凋亡率Table 2 Proportion of MEG,proliferation rate and apoptosis rate in CMS group and CON

图3 BMMNCs中巨核细胞比例(%)
2.3 骨髓巨核细胞C-MPL及凋亡相关蛋白 Bax、Bcl-2、caspase-3表达水平
流式细胞术检测显示,CMS组骨髓MEG的C-MPL、Bax、Bcl-2及caspase-3表达水平在两组间均未发现显著性差异(均P>0.05)。(表3,图 4~7)
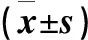
表3 CMS组和CON组骨髓巨核细胞C-MPL及凋亡相关蛋白表达水平Table 3 Expression levels of C-MPL and apoptosis-related proteins in MEG of CMS group and CON

图4 骨髓巨核细胞C-MPL表达水平(%)

图5 骨髓巨核细胞Bax表达水平(%)
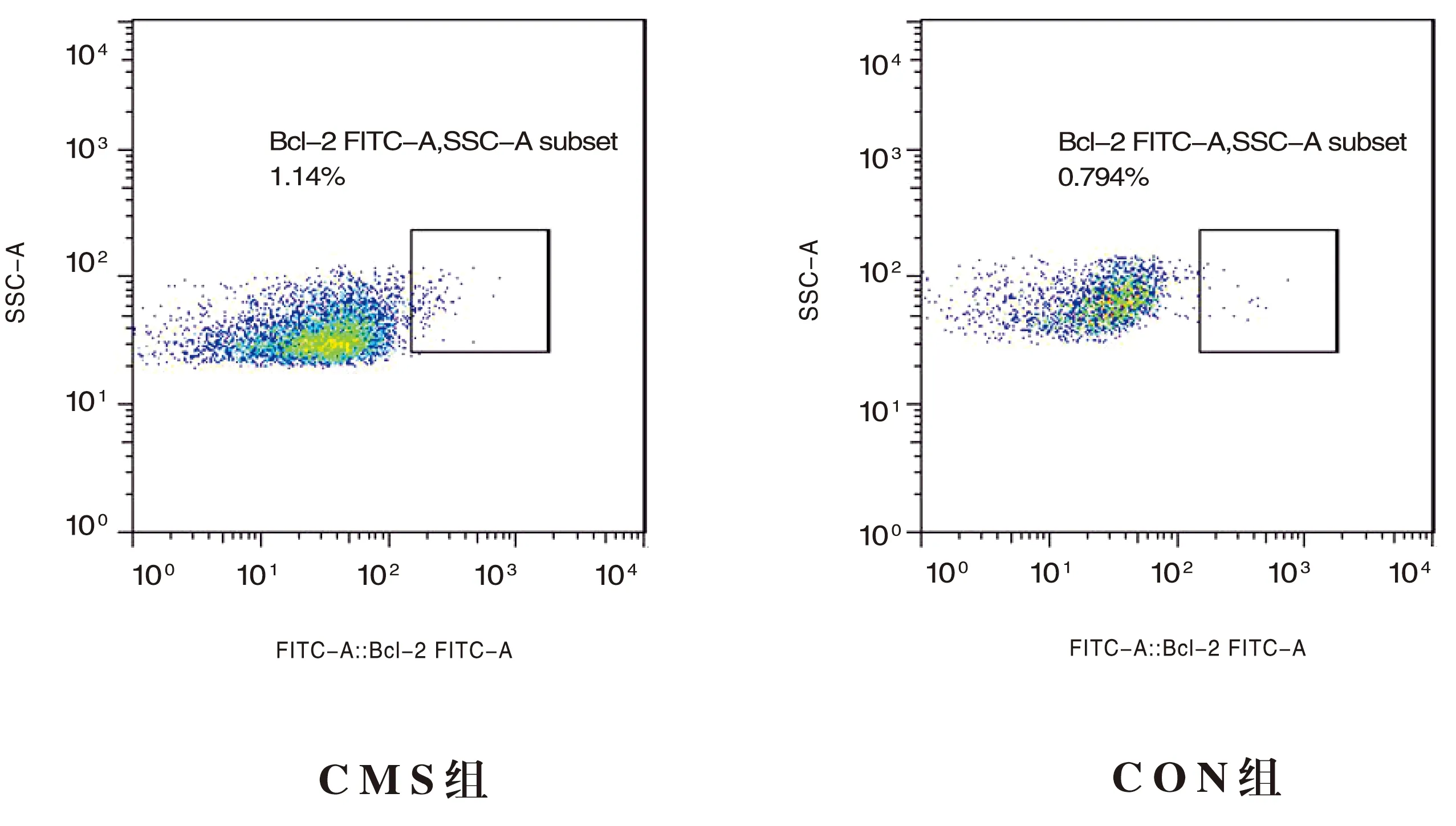
图6 骨髓巨核细胞Bcl-2表达水平(%)

图7 骨髓巨核细胞caspase-3表达水平(%)
3 讨论
本研究结果显示,藏族男性中年CMS患者外周血小板计数较藏族健康者减少,PCT降低,P-LCR升高,与罗朝忠、达娃等人报道的结果一致[3-7];MPV、PDW在两组间比较接近临界值,可能与观察样本量小有关。血小板的功能与血栓形成、血管收缩等密切相关,完全取决于黏附、聚集、变形与释放等生理活性。近年来的研究发现血小板在全身炎症性反应疾病、免疫疾病及肿瘤疾病的转归中发挥着重要作用[8-10],高原环境对血小板的生理活性和功能有一定的影响,低氧环境暴露下血小板聚集能力增强、活性增高[11,12],血小板的数量和功能改变均会导致凝血障碍性疾病及血栓性疾病的发生。既往研究报道高原环境引起血小板减少的原因包括:红系过度增殖及缺氧造成的血管内皮损伤,导致在循环中血小板破坏增加[4,13];红细胞和巨核细胞来自相同的巨核细胞-红系祖细胞(megakaryocytes-erythroid progenitors,MEP)[14],在高原环境下存在干细胞竞争分化,有限的MEP会优先向红系分化,出现周期性的血小板数量减少[15]。也有学者[16]认为长期低氧环境会造成MEG成熟障碍及成熟血小板的生成减少;还有报道认为高原人群脾指数较平原人大,脾大引起血小板破坏过多[17]。生理状态下细胞生成与死亡应保持动态平衡,而在CMS患者血小板减少机制中的MEG代谢如何变化,目前未见报道。本研究选择藏族男性中年CMS患者和藏族健康者进一步进行骨髓MEG增殖率、凋亡率的测定,旨在尽量消除遗传背景、习服时间和性别、年龄等因素的干扰。
MEG是血小板的前体细胞,经历了造血干细胞自我更新与分化,分化为巨核系祖细胞,进一步分化并增殖为成熟MEG,生成并释放血小板。成人MEG表达的CD41(integrinα-IIb)、CD61(integrin β3)、CD42b(glycoprotein Ibα)水平较一致[18]。CD41是区分MEG的重要标志物[14],CD61是MEG系特异性标记[19],所以我们在研究中选择了CD41、CD61。
目前已明确血小板的形成、释放与MEG凋亡密切相关:MEG凋亡减少导致血小板释放减少[20,21]。本研究测得两组间MEG凋亡率存在明显差异,CMS组较CON组低,表明MEG凋亡减少可能是血小板减少的部分机制。凋亡通路中存在众多的调控分子。细胞凋亡通路中caspase的激活,特别是caspase-3的激活,对细胞终末分化和促进凋亡至关重要[22,23]。凋亡抑制蛋白Bcl-2在早期MEG中表达,过量表达Bcl-2可以有效抑制前血小板的产生[24]。Bax是一种MEG凋亡所必需的内源性促凋亡蛋白。故本研究选择凋亡相关蛋白caspase-3、Bcl-2、Bax进行研究。
CMS组骨髓MEG增殖率较CON组高,可能是对血小板减少的一种代偿性调节。同时,在回顾性研究中发现,藏族CMS组PDW、P-LCR较藏族体检组高,反映了MEG新生血小板数量增加[25]。因为新生血小板具有更强的功能,所以血小板虽有一定数量的减少,但仍能保持基本功能,这也是机体的一种适应性变化。
血小板生成素(thrombopoietin,TPO)受体C-MPL是TPO的配体,在控制MEG生成、增殖、分化过程中起重要作用。C-MPL一方面通过与TPO结合,促进造血干/祖细胞和MEG增殖、分化,促进MEG成熟并产生血小板;另一方面又能通过血小板上的TPO结合位点,清除并使TPO代谢,从而维持血小板代谢平衡。黄菊等人研究发现免疫性血小板减少症患者多伴有内源性TPO不足,同时伴有C-MPL不足[26]。我们观察到CMS组C-MPL 表达水平较CON组高,但无统计学差异,说明高原环境下的C-MPL表达受诸多因素影响。
综上所述,在高原环境下,本研究组藏族男性中年CMS患者PLT较藏族健康者低;同时,MEG凋亡减少,可能是血小板减少的原因之一。另外,骨髓MEG增殖旺盛,可能是对血小板减少的一种代偿性反应。与汉族相关情形无差异。

