藏药德孜阳新醇提物对胃癌AGS细胞增殖与细胞周期的影响及作用机制探讨※
江亚惠,杨生玺,拉青才让,2,易 云,米云晟,赵延礼*
(1.青海大学,青海 西宁 810001;2.青海省海南藏族自治州藏医院,青海 海南 813000;3.长治医学院,山西 长治 046099)
藏药德孜阳新(DZYX)用于抗肿瘤效果明显,但作用机制不明。本研究通过探讨DZYX醇提物对人胃癌AGS细胞增殖与细胞周期的影响,初步明确可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验细胞
胃癌细胞系AGS购自武汉普诺赛公司。AGS细胞培养于含10%胎牛血清、1%青霉素-链霉素的DMEM培养基中(37℃,5% CO2),根据细胞生长情况,每2~3 d传代1次,取对数生长期细胞用于实验。
1.1.2 主要药物与试剂
藏药DZYX为青海省海南州藏医院产品;高糖DMEM培养基、胎牛血清为美国Corning公司产品;CCK-8试剂盒为上海翊圣生物科技有限公司产品(批号C6102030);细胞周期与细胞凋亡检测试剂盒为北京四正柏生物科技有限公司产品(批号20210705);EdU细胞增殖检测试剂盒为广州锐博生物科技有限公司产品;β-actin、Cyclin A、CDK2、p-mTOR、AKT、P-AKT为美国Cell Signaling Technology 公司产品。
1.1.3 主要仪器
Spectra Max Paradigm型多功能酶标仪为美国Molecular Devices公司产品;NovoCyte型流式细胞仪为美国艾森公司产品;xCELLigence RTCA DP型实时无标记细胞功能分析仪为美国Agilent公司产品;PowerPac Universal型电泳仪、Mini PROTEAN Tetra Cell型电泳槽为美国 Bio-Rad公司产品;EYELA旋转蒸发仪为上海爱朗仪器有限公司产品;Ti2-E型荧光显微镜为日本Nikon公司产品。
1.2 实验方法
1.2.1 DZYX醇提物的提取与配制
研磨DZYX丸剂,称取60 g DZYX粉末浸泡于95%乙醇中过夜,回流提取1 h,后浓缩,残余物经真空冷冻干燥得19.44 g粗提物。用DMSO溶解藏药DZYX醇粗提物并经0.22 μm滤膜过滤后配制成600 mg/mL的母液,储存(-20 ℃)备用。
1.2.2 细胞分组
设置对照组(含1‰二甲基亚砜)、DZYX组(含200、400、600μg/mL DZYX醇提物)、顺铂组(10μg/mL DDP)。
1.2.3 倒置显微镜观察
将AGS细胞接种于6孔板中(3.5×103/每孔),待细胞贴壁后,按照相应浓度加药,处理AGS细胞(24h,48h),观察AGS细胞数量变化并拍照记录。
1.2.4 细胞活性检测
将AGS细胞以5×103个/孔接种于96孔板,待细胞贴壁后,按照实验分组加药,分别培养24、48 h后,向每孔加入10 μL CCK-8溶液,避光孵育(37℃)1 h,用酶标仪测定450 nm处的吸光度值,实验重复3次。
细胞活力=[OD(加药组)-OD(空白组)]/[OD(溶剂对照组)-OD(空白组)]×100%
1.2.5 RTCA实时增殖曲线检测
消化收集对数期AGS细胞,调整细胞浓度为5×104个/mL,每孔加入100 μL细胞悬液,在超净台内静置30 min,放入RTCA Station,次日取出E-Plate 16板,更换含药培养基,监测胃癌细胞的动态生长增殖曲线。
1.2.6 EdU增殖水平检测
将AGS细胞接种于24孔板,待细胞贴壁后,加入不同浓度的DZYX醇提物,培养(37℃)24 h,根据EdU细胞增殖检测试剂盒说明书对AGS细胞进行EdU标记,细胞固化,Apollo染色及Hochest 333342染色后,在荧光显微镜下观察拍照并计算EdU阳性细胞数。
EdU阳性细胞数=[EdU阳性细胞数(绿色)/细胞总数(蓝色)]×100%。
1.2.7 流式细胞术结合PI单染检测
消化收集AGS细胞,离心(450×g)5 min,用预冷PBS洗涤1次,加入预冷的70%乙醇固定过夜(4℃)。次日,离心(450×g)5 min,去除70%乙醇,用预冷PBS洗涤,每管加入1 μL RNase A和5 μL PI混匀(低速涡旋),避光孵育15 min后上流式细胞仪检测。
1.2.8 Western blot检测
消化收集AGS细胞,使用蛋白裂解液提取细胞总蛋白,用BCA法测定蛋白浓度,蛋白样品在12%的SDS-PAGE电泳体系中分离后,转到0.22 μm PVDF膜上,用5%脱脂奶粉室温封闭1 h,加入β-actin、p-mTOR、p-AKT、AKT、Cyclin A、CDK2等抗体于室温孵育1 h,过夜(4℃),用TBST洗膜3次,加入二抗于室温孵育2 h,用TBST洗膜3次,每次10 min,将ECL化学发光液均匀铺到膜上置于化学发光系统中拍照。
1.3 统计学方法

2 结果
2.1 AGS细胞数量变化
倒置显微镜观察显示,与对照组比较,给予不同浓度DZYX醇提物作用后,AGS细胞数量均减少,具有浓度依赖性,且600 μg/mL组抑制增殖效果与顺铂组抑制效果接近。(图1)

图1 DZYX醇提物对AGS细胞数量的影响图(100×)
2.2 AGS细胞活性变化
结果显示,与对照组比较,随着DZYX醇提物浓度增加,各加药组的吸光度值明显下降,AGS细胞活力显著下降(P<0.01),且呈浓度依赖性,提示DZYX醇提物对AGS细胞的增殖具有抑制作用。(表1)
表1 DZYX醇提物对AGS细胞活性影响结果Table 1 Effects of DZYX ethanol extract on the activity of AGS
2.3 AGS细胞实时增殖曲线变化
经不同浓度DZYX醇提物作用后,AGS细胞增殖数量均低于对照组(P<0.01),且细胞增殖速度显著下降,随药物浓度增加,DZYX醇提物抑制AGS细胞增殖能力越强,提示DZYX醇提物对AGS细胞增殖具有抑制作用,且呈浓度依赖性。(图2,表2)
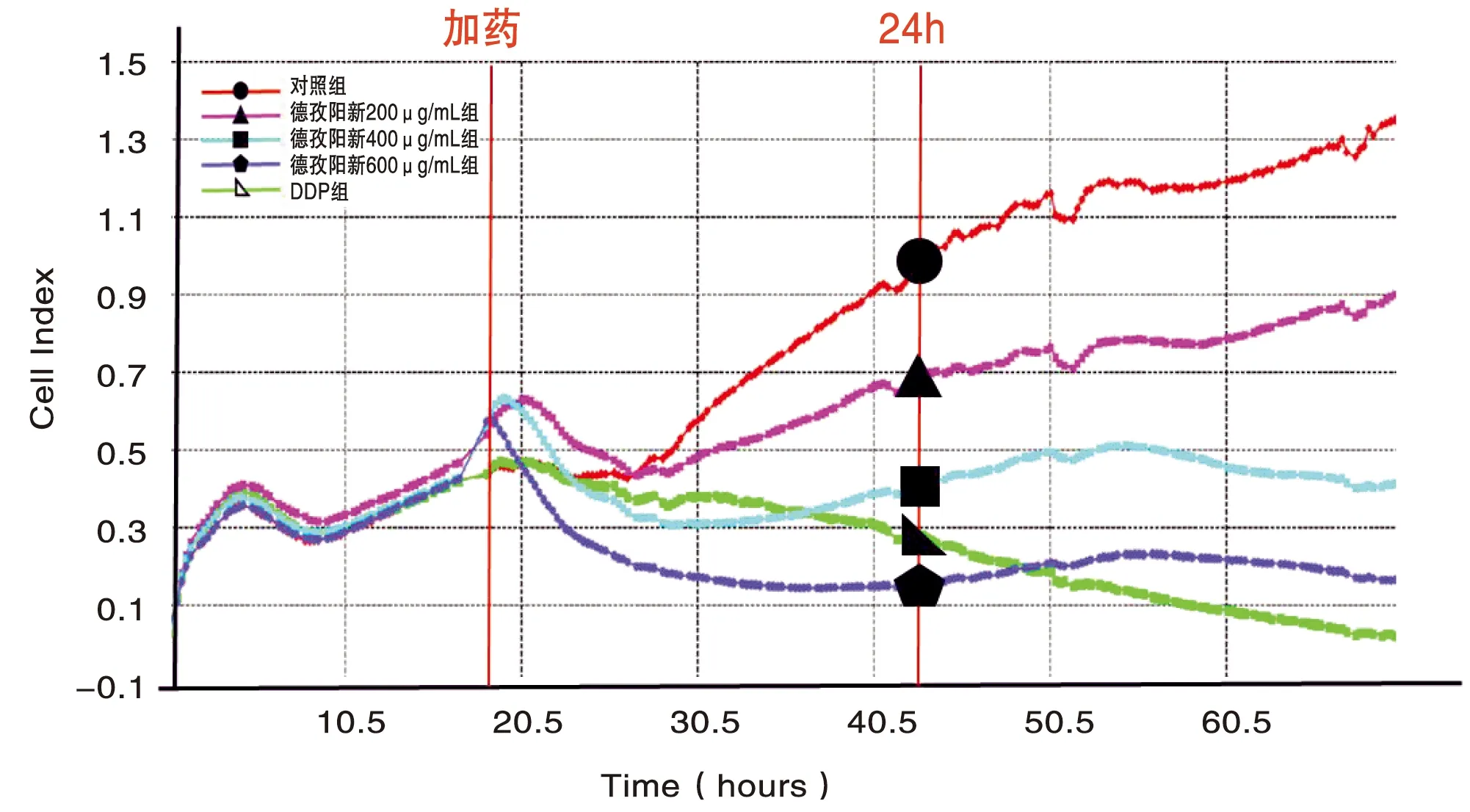
图2 AGS细胞实时增殖变化图

表2 RTCA实时增殖曲线定量分析结果Table 2 Quantitative analysis of RTCA real-time proliferation
2.4 AGS细胞增殖水平变化
为进一步研究DZYX醇提物对胃癌细胞增殖的影响,采用EdU掺入法检测DZYX醇提物作用下AGS细胞增殖水平,与对照组比较,DZYX醇提物作用下的AGS细胞中的EdU阳性细胞数所占比例明显降低,差异有统计学意义(P<0.05),且具有浓度依赖性,提示DZYX醇提物能够抑制AGS细胞的增殖。(图3)
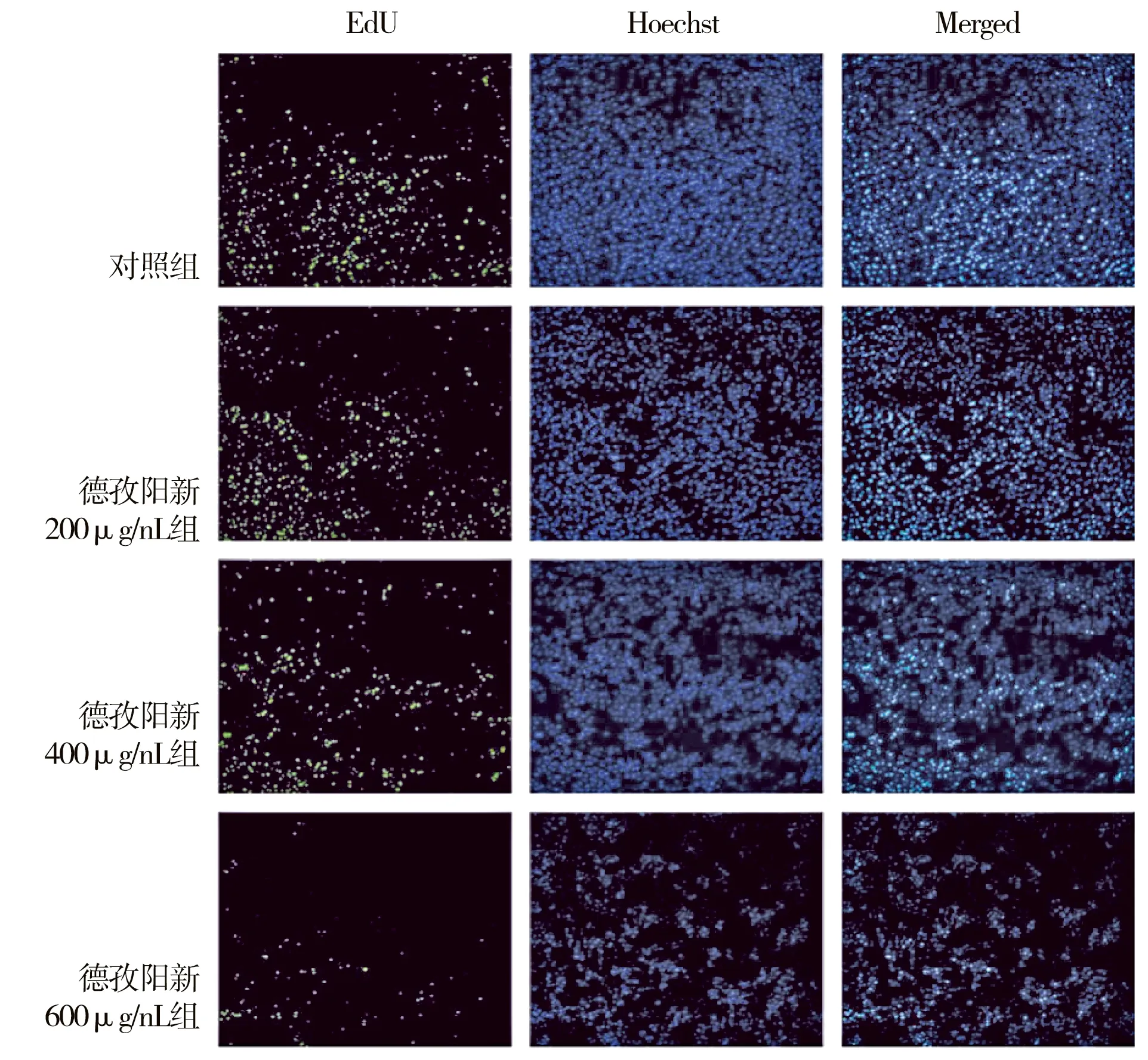
图3 EdU染色检测各组增殖情况(EdU染色,100×)

表3 EdU阳性细胞数
2.5 AGS细胞周期变化及周期蛋白Cyclin A、CDK2含量变化
与对照组比较,不同浓度DZYX醇提物作用胃癌AGS细胞24 h后,S期细胞所占比例显著增高,G2/M期细胞比例减少,差异有统计学意义(P<0.05)。(图4,表4)Western blot结果显示,与对照组比较,给予AGS细胞600 μg/mL DZYX醇提物(不同时间),可明显下调AGS细胞中与S期相关的蛋白Cyclin A、CDK2的表达水平,差异有统计学意义(P<0.05)。在药物作用12 h内,Cyclin A、CDK2的抑制效果显著,可能与两种蛋白在AGS细胞中的表达时间有关。提示DZYX醇提物可将AGS细胞阻滞在S期。(图5,表5)
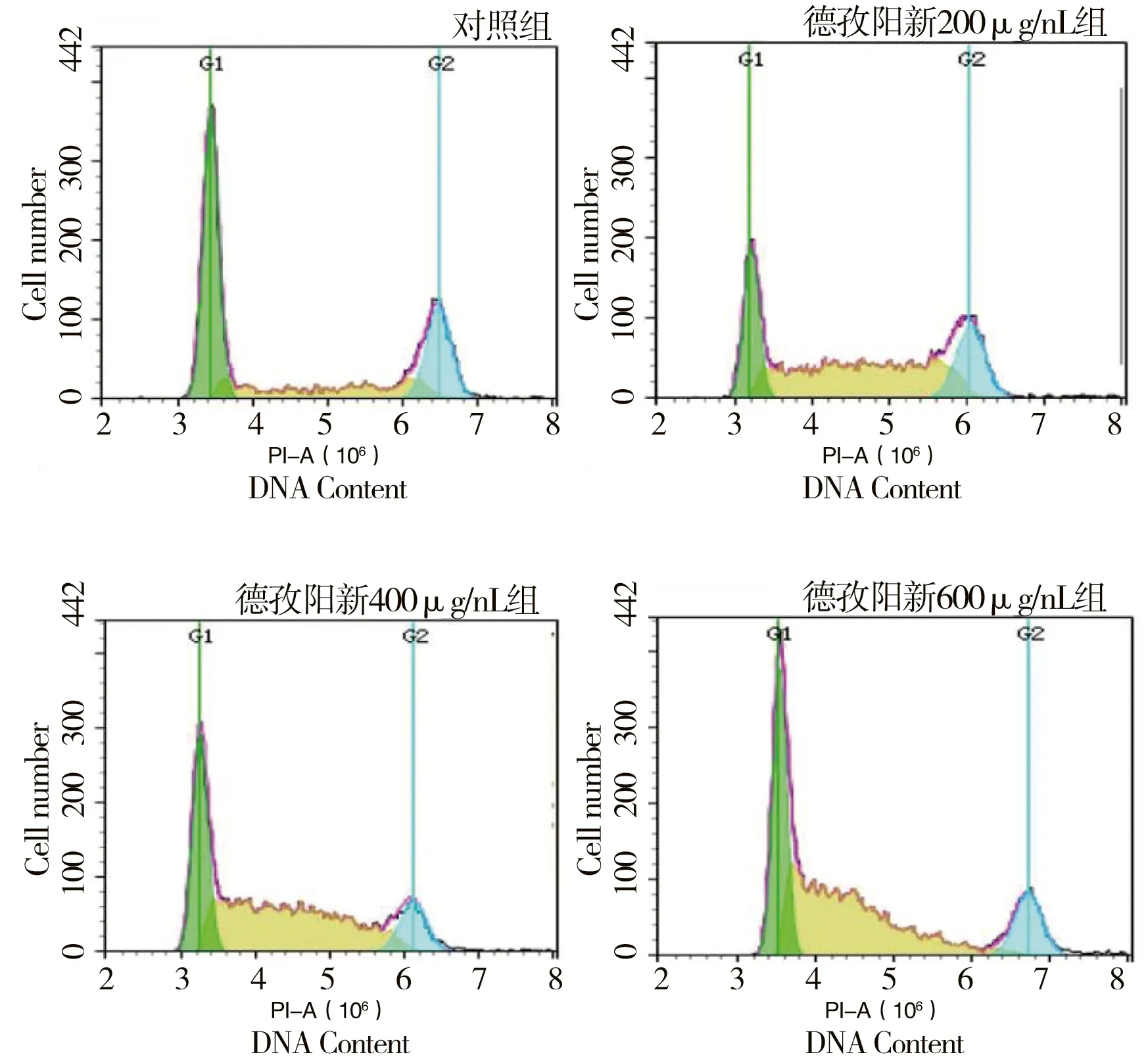
图4 DZYX醇提物对AGS细胞周期的影响图

表4 S期细胞所占比例

图5 DZYX对AGS细胞Cyclin A、CDK2蛋白表达的影响图

表5 Cyclin A和CDK2蛋白含量变化值Table 5 Variations of protein content of Cyclin A and
2.6 PI3K/AKT/mTOR通路蛋白p-mTOR、AKT、p-AKT含量变化
与对照组比较,在DZYX醇提物作用下,与增殖相关信号通路PI3K/AKT/mTOR相关蛋白p-mTOR的表达水平降低,p-AKT的表达降低,差异均具有统计学意义(P<0.05)。(图6,表6)
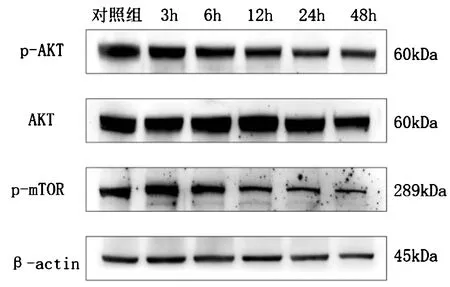
图6 DZYX醇提物对PI3K/AKT/mTOR通路蛋白的影响图

表6 p-AKT和p-mTOR蛋白含量变化值Table 6 Variations of protein content of p-AKT and
3 讨论
本研究显示,德孜阳新醇提物能抑制AGS细胞的增殖并影响细胞周期的分布,其作用机制可能与抑制PI3K/AKT/mTOR信号通路的激活有关。
DZYX由多种药物组成,研究证明由多味药材配伍而成的方剂作用靶点多,故作用机制难以阐明。金福安汤可通过诱导Kaiso上调抑制肺癌细胞H1650增殖和转移[1];解毒三根汤与PD-L1抑制剂联用能明显抑制结直肠癌细胞的迁移和侵袭[2];李明等发现黄连汤可下调CCNB1表达水平来抑制肝癌HCC细胞生长增殖[3];会厌逐瘀汤作用于喉癌LSCC细胞,可将细胞阻滞于G0/G1期并诱导其凋亡从而抑制喉癌的发展,具有抗肿瘤作用[4]。本研究通过采用CCK-8实验、EdU掺入实验和RTCA细胞实时监测实验观察DZYX醇提物对胃癌AGS细胞活性和增殖的影响,三种实验结果均证实不同浓度DZYX醇提物作用胃癌细胞,能抑制AGS细胞的增殖,且具有浓度依赖性,提示藏药DZYX能够抑制AGS细胞的增殖。
细胞周期紊乱是恶性肿瘤发生发展的重要原因[5]。细胞周期可分为G1(DNA合成前期)、S(DNA合成期)、G2(DNA合成后期)、M(有丝分裂期),并在细胞周期蛋白(cyclins)、细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinases in-hibitors,CKIs)、周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)等多种蛋白共同调控下驱动细胞周期循环[6,7]。其中任何一个阶段出现问题都可能导致细胞周期停止,因此阻滞细胞周期的关键部分可有效控制细胞增殖,具有潜在的抗癌作用。S期进行DNA的合成,Cyclin A与CDK2是调控S期的两个关键因子[8],细胞进入S期后激活CDK2和Cyclin A,二者结合形成Cyclin-CDK激酶复合物推动S期进程。细胞通过上调两种调控因子的表达来维持DNA合成,如果无法合成足够的Cyclin-CDK激酶复合物,就能阻碍DNA复制,将细胞阻滞于S期。本次研究发现,DZYX醇提物处理胃癌AGS细胞的结果显示,与Control组比较,不同浓度的加药组S期所占比例显著增加。同时Western blot结果证实,AGS细胞经药物作用后细胞周期蛋白Cyclin A、CDK2表达水平降低,Cyclin A、CDK2在细胞中的表达时间较早,12 h内药物对两种蛋白表达抑制效果极其明显,表明DZYX醇提物可能通过下调Cyclin A、CDK2蛋白表达,降低Cyclin-CDK激酶复合物合成,导致AGS细胞无法进行DNA复制,阻滞AGS细胞于S期。
PI3K/AKT/mTOR信号通路是调控细胞增殖重要信号通路,研究发现多种癌症中存在该通路的异常激活,有效抑制PI3K/AKT/mTOR信号通路中关键分子,对控制肿瘤的发生发展起到至关重要的作用。AKT又称为白激酶B(PKB),包括AKT1、AKT2和AKT3三种亚型,是PI3K/AKT/mTOR信号通路中的关键调控因子[9]。AKT的过度激活是恶性肿瘤的常见分子特征[10,11],活化后的AKT通过对多种细胞转录因子的调控,参与细胞的增殖、转移、侵袭及葡萄糖代谢等多种生理活动[12]。研究发现在肝癌、胰腺癌、胃癌、乳腺癌等多种肿瘤中均观察到AKT的激活与过表达[13-15],因此抑制AKT磷酸化是治疗恶性肿瘤的一个有效靶点。mTOR(哺乳动物雷帕霉素)是位于PI3K/AKT/mTOR信号通路下游的靶蛋白,可由AKT激活[16],在细胞生长代谢、细胞周期调控、蛋白翻译及自噬多种生物过程中发挥着关键作用[17]。检测PI3K/AKT/mTOR信号通路中p-AKT与p-mTOR的蛋白表达水平结果显示,DZYX醇提物可降低胃癌细胞中p-AKT、p-mTOR蛋白表达水平,说明DZYX醇提物可抑制AKT和mTOR的磷酸化,由此提示DZYX醇提物可能通过阻断PI3K/AKT/mTOR信号通路来抑制胃癌细胞的增殖。
综上所述,DZYX醇提物可抑制AGS细胞增殖并影响细胞周期的分布,其作用机制可能与抑制PI3K/AKT/mTOR信号通路的激活有关。

