安罗替尼联合注射用紫杉醇(白蛋白结合型)二线治疗晚期驱动基因阴性非小细胞肺癌的效果及安全性分析
张维薇 朱中山 黄橙


[摘要] 目的 探討安罗替尼、注射用紫杉醇(白蛋白结合型)联合应用于晚期驱动基因阴性非小细胞肺癌治疗期间所体现的应用价值,评估其治疗安全性、有效性。 方法 随机抽取2019年5月至2020年12月接受诊治的晚期驱动基因阴性非小细胞肺癌患者作为研究对象展开随机对照试验,纳选对象共82例,遵照随机数字表法将其分为两组,初步设定为对照组与观察组,所占比例均等,对照组于化疗期间单独应用紫杉醇(白蛋白结合型),观察组所采取的二线治疗方案为安罗替尼+紫杉醇(白蛋白结合型),比较两组临床效果,评估指标包含治疗有效率、治疗前后肺功能、不良反应发生率、免疫功能。 结果 以对照组评估结果为参照,观察组临床治疗有效率参数较高(P<0.05);治疗前,对照组、观察组用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、最大呼气流速(PEF)等肺功能指标比较,差异无统计学意义(P>0.05);治疗后,相较于对照组,观察组肺功能指标等参数明显较高,差异有统计学意义(P<0.05);两组患者不良反应发生率比较,差异无统计学意义(P>0.05);治疗后,与对照组比较,观察组患者的CD3+、CD4+、CD4+/CD8+各项免疫功能指标值较高,差异有统计学意义(P<0.05)。 结论 安罗替尼、注射用紫杉醇(白蛋白结合型)作为二线治疗方案联合应用于晚期驱动基因阴性非小细胞肺癌的安全性、有效性、可靠性较高,对改善患者肺功能水平具有积极意义,有利于提升机体免疫功能,具有较高的借鉴及推广价值。
[关键词] 安罗替尼;注射用紫杉醇(白蛋白结合型);二线治疗;晚期驱动基因阴性非小细胞肺癌
[中图分类号] R734.2 [文献标识码] B [文章编号] 1673-9701(2022)12-0079-04
[Abstract] Objective To investigate the safety and efficacy of anlotinib combined with paclitaxel for injection (albumin-bound) in second-line treatment of advanced driver gene-negative non-small cell lung cancer. Methods A total of 82 patients with advanced driver gene-negative non-small cell lung cancer diagnosed in our hospital from May 2019 to December 2020 were randomly selected as the study subjects. The selected subjects were divided into two groups according to the random number table and preliminarily set as the control group and the observation group, accounting for an equal proportion. The control group was treated with paclitaxel (albumin-bound) single-agent chemotherapy, while the observation group was treated with anlotinib + paclitaxel (albumin-bound). The clinical effects of two group′s were compared and evaluated. The evaluation indicators included the treatment efficiency, pulmonary function before and after treatment, probability of adverse reactions, and immune function. Results The effective rate of clinical treatment in the observation group was higher than that in the control group(P<0.05) Before treatment, there was no significant difference in forced vital capacity (FVC), forced expiratory volume in the first second (FEV1) and maximum expiratory flow rate (PEF) between the control group and the observation group(P>0.05). after treatment, compared with the control group,the parameters such as pulmonary function indexes in the observation group were significantly higher, and there was a significant difference in the comparison results(P<0.05).There was no statistical difference in the incidence of adverse reactions between the two groups(P>0.05); after treatment,compared with the control group,the CD3+,CD4+,CD4+/CD8+ immune function indicators in the observation group were higher, and the difference was statistically significant(P<0.05). Conclusion Anlotinib combined with paclitaxel for injection (albumin-bound) has high safety and efficacy in the second-line treatment of advanced driven gene-negative non-small cell lung cancer, which has positive significance for improving the pulmonary function of patients and can effectively improve the immune function of patients.It is worth learning and promoting.
[Key words] Anlotinib; Paclitaxel for injection (albumin-bound); Second-line therapy; Advanced driver gene-negative non-small cell lung cancer
据有关调查研究资料证实,2020年全球范围内肺癌属于死亡率最高的疾病类型,且肺癌于中国恶性肿瘤中的发病率及死亡率位居首位[1]。很多患者因发病后表现为驱动基因阴性,未能及早采取靶向治疗。晚期肺癌的一线治疗方案依然为含铂双药化疗,现阶段临床研究热点主要为化疗联合抗血管生成治疗[2]。临床上所应用的注射用紫杉醇采集新型工艺,对促进紫杉醇蓄积于肿瘤组织中、提高肺鳞癌患者化疗效果具有积极意义。安罗替尼可有效抑制血管内皮细胞生长因子和血小板衍生生长因子受体、干细胞因子受体,进而发挥抗肿瘤作用[3]。为明确安罗替尼+注射用紫杉醇(白蛋白结合型)于晚期驱动基因阴性非小细胞肺癌患者治疗期间的具体应用价值,本文展开对照研究,现报道如下。
1 资料与方法
1.1 一般资料
本次对照研究所筛选的研究对象均为确诊的晚期驱动基因阴性非小细胞肺癌患者,入院接受化疗时间为2019年5月至2020年12月,共82例,参照随机数字表法分组原则将符合研究需求患者分为两组,分别纳入对照组与观察组,每组各41例。对照组男32例,女9例,年龄47~83岁,平均(65.19±3.88)岁;观察组男29例,女12例,年龄48~82岁,平均(65.42±3.67)岁。两组的性别、年龄等基线资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:纳选对象研究期间所采取的一线化疗方案为含铂双药;采取头颅磁共振、胸腹部CT确诊,经全面评估患者全身至少存在可测量病灶1处;纳选对象临床症状及体征与美国癌症联合委员会第8版TNM分期诊断标准[4]中关于晚期驱动基因阴性非小细胞肺癌的相关描述相符合,且经病理学确诊;肿瘤组织经检查表皮生长因子受体敏感突变阴性。
排除标准:伴有精神障碍合并发生难以控制的高血压者;研究期间不能积极配合者;表现为凝血功能异常及血管侵犯者;具有咯血史,且时间达3个月以上者;呈现为中央空腔型鳞癌或伴随发生咯血,咯血量超过40 ml/d者;中途退出研究者。
1.2 方法
观察组治疗时口服应用盐酸安罗替尼胶囊,研究期间所用药物产自正大天晴药业集团股份有限公司,药物规格为12 mg×7粒/盒,国药准字H20180004,用药剂量设定为每天12 mg,在连续用药2周以后停药1周,1个治疗周期为21d。注射用紫杉醇(白蛋白结合型,石药集团欧意药业有限公司,国药准字H2018-3044,规格100 mg),用药剂量100 mg/m2,用药时间为患者化疗第1、8、15天,经静脉滴注用药,1个治疗周期为21d[5]。
对照组患者于化疗期间单独应用紫杉醇(白蛋白结合型),化疗方案与观察组一致,两组患者连续用药2个疗程。
1.3 观察指标及评价标准
临床效果评估:参照晚期驱动基因阴性非小细胞肺癌实体瘤疗效评价标准,显效即患者采取治疗措施后靶病灶消失,未出现新病灶;有效判定标准为患者采取对症支持治疗方案,患者病灶最大直径缩小幅度至少30%;无效则表示患者治疗前后病灶最大直径之和未见改善,还存在增加趋势[6]。治疗总有效率=(显效+有效)例数/总例数×100%。
肺功能水平评估:应用肺功能检测仪进行患者肺功能水平检测,评估内容包含用力肺活量(forced vital capacity,FVC)、第1秒用力呼气容积(forced expiratory volume in one second, FEV1)、最大呼气流速(peakexpiratoryflow,PEF)。
不良反应:统计两组患者于化疗期间发生的腹泻、腹痛、恶心、白细胞减少、呕吐、血小板减少等不良反应的发生率。
免疫功能:采集患者清晨血液样本检查其免疫功能水平,分离淋巴细胞,应用流式细胞仪进行免疫功能相关指标测定,监测内容包含CD3+、CD4+、CD4+/CD8+等各项免疫功能指标值。
1.4 统计学方法
采用SPSS 24.0统计学软件分析研究数值,其中连续性变量资料用(x±s)表示,采用t检验,组间差异应用重复测量方差比较;计数资料用[n(%)]表示,采用χ2检验,组间差异以非参数比较,P<0.05为差异有统计学意义。
2 结果
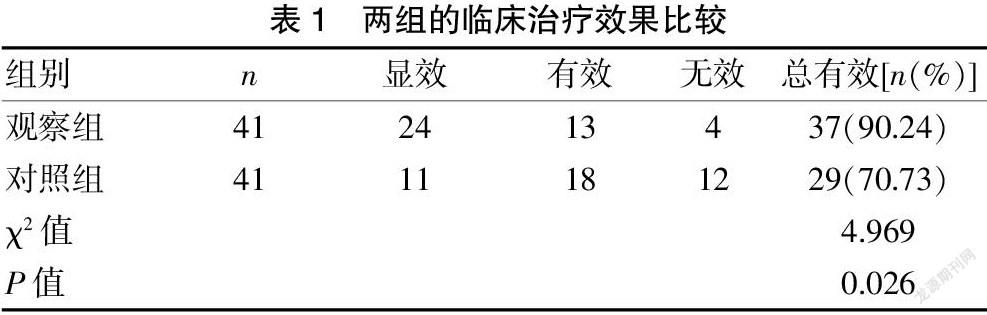
2.1 两组的临床治疗效果比较
对照组的临床治疗有效率为70.73%,观察组为90.24%,观察组的临床治疗有效率高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 两组的肺功能指标数值比较
治疗前,两组的FVC、FEV1、PEF比较,差异无统计学意义(P>0.05);治疗后,观察组的FVC、FEV1、PEF等肺功能指标高于对照组,差异有统计学意义(P<0.001)。见表2。
2.3 两组的不良反应发生率比较
两组的用药后不良反应总发生率比较,差异无统计学意义(P>0.05)。见表3。
2.4 两组的免疫功能指标比较
治疗前,两组的CD3+、CD4+、CD4+/CD8+比较,差异无统计学意义(P>0.05),治疗后,以对照组的评估结果为参照,观察组的CD3+、CD4+、CD4+/CD8+所得数值明显较高,组间数值比较,差异有统计学意义(P<0.05)。见表4。
3 讨论
现阶段,在靶向治疗、免疫治疗措施不断进步、发展的背景下,肺癌精准治疗模式在临床上初露锋芒,对应用一线治疗方案的晚期肺癌患者而言,二线治疗方案大多为单药化疗,所获得的实际治疗效果不够理想[7-8]。血管生成作为恶性肿瘤发生及发展的重要特征,于肿瘤疾病发展期间隶属于重要枢纽,现阶段抗血管药物、细胞毒性药物属于研究热点之一[9-10]。越来越多的研究资料显示,在恶性肿瘤治疗期间细胞毒性药物和抗血管药物具有确切效果,但用药期间存在蛋白尿、高血压、口腔黏膜及手足综合征等相关不良反应,病情发展至晚期的患者耐受性比較差,还需选择更好的治疗措施,经研究资料证实安罗替尼具有确切的抗肿瘤作用,对改善患者的临床症状及减轻经济负担具有确切效果[11]。
本研究中观察组的临床治疗有效率高于对照组(P<0.05);治疗前,两组的FVC、FEV1、PEF指标比较,差异无统计学意义(P>0.05);治疗后,观察组的FVC、FEV1、PEF均高于对照组(P<0.05);两组用药后不良反应发生率比较,差异无统计学意义(P>0.05),治疗前,两组的CD3+、CD4+、CD4+/CD8+比较,差异无统计学意义(P>0.05),治疗后,观察组的CD3+、CD4+、CD4+/CD8+均高于对照组,差异有统计学意义(P<0.05),分析原因如下:晚期驱动基因阴性非小细胞肺癌治疗期间单药化疗的有效率比较低,安罗替尼作为新型人表皮生长因子酪氨酸酶抑制剂的一种,其抗肿瘤血管生长作用较强,可抑制肿瘤生长,促使抗肿瘤病灶扩张,对改善患者肺部功能具有积极意义,在化疗期间具备较强的安全性,同时可有效控制化疗期间出现的呕吐、腹泻等症状,进而减轻化疗期间的疼痛症状,对缓解病情具有确切意义[12-13]。安罗替尼属于典型的多靶点酪氨酸激酶抑制剂,于实际应用期间抑制肿瘤细胞相关激酶,可产生胸腔积液靶点,在缓解患者临床症状方面具有确切效果[14]。紫杉醇(白蛋白结合型)属于典型的新型白蛋白溶剂型纳米紫杉醇,将人血白蛋白作为载体,可携带紫杉醇,晚期驱动基因阴性非小细胞肺癌患者于化疗期间应用此类药物可对细胞膜上小窝蛋白产生激活作用,经过血管内皮细胞将紫杉醇转运至肿瘤组织,属于恶性肿瘤的常用药物,效果理想[15]。安罗替尼、紫杉醇(白蛋白结合型)联合应用不仅具有理想的临床疗效,且安全性较高,突出耐受性好、高效及低毒的临床特点,无需采取激素预处理,可减轻患者的痛苦感。
综上所述,安罗替尼、注射用紫杉醇(白蛋白结合型)联合用于晚期驱动基因阴性非小细胞肺癌治疗期间作为二线治疗方案对改善免疫功能及肺功能具有積极意义,安全性较高,具有借鉴推广价值。
[参考文献]
[1] 张华丽,黄英莉.小白菊内酯对紫杉醇耐药非小细胞肺癌的细胞毒性及对HDACs抑制潜力[J].沈阳药科大学学报,2021,38(6):613-621.
[2] 储节胜,徐冠军,时毓,等.安罗替尼对非小细胞肺癌患者肺功能的影响及安全性分析[J].中国当代医药,2021, 28(17):100-102.
[3] 徐珊珊,施朕善,王强强,等.安罗替尼联合注射用紫杉醇(白蛋白结合型)二线治疗晚期驱动基因阴性非小细胞肺癌的效果及安全性分析[J].中国医药,2021,16(6):841-844.
[4] 顾宁宁,宋振鑫,王红梅,等.卡瑞利珠单抗联合白蛋白结合型紫杉醇三线及以上方案治疗晚期非小细胞肺癌患者的临床疗效及其预后的影响因素研究[J].实用心脑肺血管病杂志,2021,29(6):22-27,33.
[5] 陈维英,净卫娟,辛玉珍,等.帕博利珠单抗联合卡铂、白蛋白紫杉醇治疗晚期非小细胞肺癌的疗效及安全性[J].山东医药,2021,61(13):65-68.
[6] 罗秋育,李国文.安罗替尼二线治疗晚期非小细胞肺癌的临床效果[J].中国当代医药,2021,28(12):108-111.
[7] 马克骥,董南,张春生.恩度联合紫杉醇和顺铂化疗对非小细胞肺癌患者血清肿瘤标志物水平的影响[J].中国肿瘤临床与康复,2021,28(3):306-309.
[8] 余宏伟,张一斌,张璐,等.安罗替尼一线治疗晚期非小细胞肺癌的临床疗效分析[J].北方药学,2020,17(12):31-32.
[9] 刘佳,潘雪峰,郑国宝.甲磺酸阿帕替尼联合紫杉醇对晚期非小细胞肺癌疗效及对血清肿瘤标志物的影响[J].山西医药杂志,2021,50(5):784-786.
[10] 王璐,杨越,于晓丽,等.安罗替尼联合TP方案化疗治疗老年非小细胞肺癌的疗效及其对CA125、MALAT1水平的影响[J].药物评价研究,2021,44(3):582-586.
[11] 周云凤.紫杉醇联合卡铂治疗非小细胞肺癌的临床疗效及预后不良的影响因素分析[J].临床合理用药杂志,2021,14(3):51-53.
[12] 谢彦,王保庆.白蛋白结合型紫杉醇联合顺铂治疗晚期非小细胞肺癌的临床疗效[J].临床研究,2021,29(1):81-82.
[13] 冯继,潘娜,胡中舟,等.安罗替尼联合多西他赛二线治疗驱动基因阴性晚期非小细胞肺癌的临床疗效[J].癌症进展,2020,18(11):1141-1151.
[14] 张孟伟,谷俊娇,刘灿,等.安罗替尼一线治疗老年广泛期小细胞肺癌患者效果及安全性分析[J].肿瘤研究与临床,2021,33(7):541-543.
[15] 郭康.安罗替尼联合GP方案化疗对Ⅲb~Ⅳ期非小细胞肺癌患者疗效及生存质量的影响[J].实用医药杂志,2020,37(5):427-429.
(收稿日期:2021-08-03)

