小麦条锈菌实时荧光定量PCR检测方法的建立
刘耀霞,张学飞,闫佳会,姚 强,郭青云
(青海大学农林科学院,青海省农业有害生物综合治理重点实验室,农业农村部西宁作物有害生物科学观测实验站,青海 西宁 810016)
小麦是世界三大主要粮食作物之一,由条形柄锈菌小麦专化型(Pucciniastriiformisf.sp.tritici)引起的小麦条锈病是影响小麦优质高产的重要病害,小麦条锈病大流行时会造成一半以上产量损失甚至绝产[1-3]。因此,掌握小麦条锈菌的流行与传播并准确估计小麦潜育期叶片菌源量是综合防控条锈病的重要措施[4-6]。国内外学者利用实时荧光定量PCR(Quantitivate PCR,qPCR)技术快速检测马铃薯酸疮痂链霉菌[7]、黄瓜棒孢叶斑病菌[8]、葡萄霜霉病[9]、杨树枯萎病菌[10]、柑橘黄龙病[11]、葡萄蚕豆萎蔫病毒[12]、番茄细菌性斑点病菌[13]、油菜菌核病[14]及小麦条锈病等病害。初炳瑶等[15]利用qPCR技术检测了四川省多个小麦品系抗条锈病的差异。孔新宇等[16]利用qPCR技术定量检测天水市秦州区、陇南市礼县及平凉市庄浪县标记的小麦条锈菌越冬病株的菌源量。黄雪玲等[17]和Ma等[18]利用该技术得出小麦条锈菌基因表达水平的最适内参基因。潘娟娟等[19]、Fraaije等[20]利用该技术研究了小麦条锈菌生理小种CYR32潜育期的条锈菌菌源量。近年来,小麦条锈菌生理小种CYR34的流行范围逐年扩大,逐渐上升为优势小种[21],所以研究该生理小种潜育期菌源量有重要意义。本试验基于小麦条锈菌生理小种CYR34和小麦条锈菌延伸因子EF1引物,利用qPCR技术检测小麦条锈菌在小麦潜育期叶片菌源量,为早期预防大面积小麦条锈病提供了理论依据。
1 材料与方法
1.1 试验材料
(1)供试病原菌。小麦条锈菌生理小种CYR34(标样采自青海贵德、循化等地区,经单孢子堆分离和毒性鉴定得到生理小种CYR34)、小麦白粉菌(Blumeriagraminisf.sp.tritici)和小麦赤霉菌(Fusariumgraminarum)。以上病原菌均由青海省农业有害生物综合治理重点实验室提供。
(2)寄主植物。高感条锈病品种铭贤169,由青海省农业有害生物综合治理重点实验室提供。
1.2 试验试剂与仪器
(1)试验试剂。CTAB(100 mL 1 mol/L Tris HCl,pH 8.0,280 mL 5 mol/L NaCl,40 mL 0.5 mol/L EDTA,580 mL ddH2O);DNA提取液(氯仿:异戎醇=24∶1);异丙醇;75%乙醇;1 X TE溶液;EF1引物合成于上海生工生物工程股份有限公司。DL 500 DNA Marker、TaqTM、TB Green®Premix Ex TaqTM Ⅱ均购买于TaKaRa公司。
(2)试验仪器。DK-600A型电热恒温水槽,电子天平(1/1 000);NanoDropTM One超微量紫外分光光度计;eppendorf移液器;高速冷冻离心机ST 16R;Bio-Rad Thermal Cycler PCR仪;涡旋混合仪G560E;电泳仪DYCP-31DN;凝胶成像系统Champ Gel 6000;光照培养箱MLR-352H-PC;实时荧光定量PCR仪7500;TissueLyserⅡ组织破碎仪等。
1.3 试验方法
(1)样品DNA提取。采集的小麦条锈菌标样在室内接种扩繁,扩繁完成后进行毒性鉴定[22]。将条锈菌及接种后的叶片保存在冰箱用于提取DNA。利用分光光度计检测提取到的DNA浓度,并在-80℃冰箱中冷冻保存。

表1 小麦条锈菌引物
(2)引物筛选及特异性检测。所用小麦条锈菌引物见表1,EF1引物是小麦条锈菌延伸因子[23],PS1、PS2是利用条锈菌β-微管蛋白1基因(基因登录号:HM067998.1)序列设计的引物。常规PCR 25 μL反应体系为12.5 μL Ex Taq,各0.5 μL 10 μmol/L正反引物,0.5 μL模板DNA,11 μL ddH2O。常规PCR反应程序见表2。3%琼脂糖凝胶电泳(120 V,30 min)后用凝胶成像观察条带。qPCR 25 μL反应体系为12.5 μL TBGreen,各1 μL 10 μmol/L正反引物,0.4 μL ROX,1 μL模板DNA,9.1 μL ddH2O。qPCR反应程序见表3。观察电泳条带及熔解曲线,从而筛选引物。
(3)灵敏度检测。小麦条锈菌生理小种CYR34 DNA的原溶液浓度为1.05×108fg/μL,稀释后得到浓度分别为1.05×107、1.05×106、1.05×105、1.05×104、1.05×103、1.05×102和10.5 fg/μL的溶液。通过EF1引物进行常规PCR扩增和qPCR扩增,根据有无扩增片段和荧光信号值评价EF1引物对小麦条锈菌DNA的灵敏度。
(4)qPCR标准曲线的绘制。将小麦条锈菌生理小种CYR34的DNA初始浓度按10倍梯度稀释,并利用qPCR仪进行扩增后得到相应的CT值(每个反应管内荧光信号达到设定阈值时所经历的循环数),在Excel中建立qPCR标准曲线。
(5)样品验证检测。在光照培养箱MLR-352H-PC中栽培24盆铭贤169,每盆种10棵小麦幼苗。待小麦生长至2叶期,将条锈菌孢子悬浮液涂抹在第1片叶片正面,在接种室黑暗培养24 h后移至温室,培养温度为10~15 ℃。每隔24 h采样1次,直至出现病斑(第8天后),每次取约100 mg叶片,每个样品重复3次。将采集的样品保存在-80 ℃冰箱中。提取DNA前将叶片表面清洗干净,再利用CTAB方法提取小麦叶片gDNA,并进行qPCR扩增。应用所建立的qPCR标准曲线计算小麦潜育期叶片中的条锈菌菌源量。
2 结果与分析
2.1特异性引物筛选分别利用三组引物进行常规PCR扩增和qPCR扩增后,特异性引物筛选如图1,从图中可以看出EF1引物扩增出了单一的目的条。引物qPCR熔解曲线如图2所示,由图2可知引物EF1熔解曲线为单一的产物峰,而引物PS1和PS2扩增出现了多条片段,熔解曲线出现杂峰,产生其他非特异性荧光。因此,选用小麦条锈菌延伸因子EF1为本试验的引物。

图1 特异性引物筛选 Fig.1 Screening of specific primer
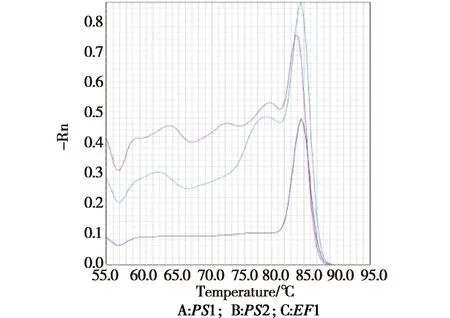
图2 引物qPCR 熔解曲线Fig.2 qPCR melting curves of primer
2.2引物特异性检验以ddH2O作为对照,利用EF1引物对小麦条锈菌、小麦白粉菌及小麦赤霉菌基因组DNA进行常规PCR扩增。EF1引物特异性检测结果如图3所示,由图3可知小麦条锈菌扩增出了特异性目的片段243 bp,阴性对照及其他病原菌均未扩增出片段。EF1引物qPCR熔解曲线如图4所示,从图中可以看出,进行qPCR扩增后熔解曲线未出现杂峰,扩增产物单一。说明EF1引物特异性良好,可以用于小麦条锈菌特异性检测。
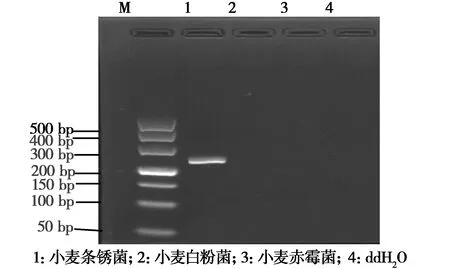
图3 EF1引物特异性检测结果Fig.3 Specificity detection of primer EF1

图4 EF1引物qPCR 熔解曲线Fig.4 qPCR melting curve of primer EF1
2.3引物灵敏度检测将小麦条锈菌gDNA的浓度进行梯度稀释后,分别用常规PCR和qPCR进行扩增。EF1引物对常规PCR有扩增,检测到最低条锈菌菌源量为1.05×104fg/μL,低于该浓度条锈菌无扩增条带(图5)。qPCR检测到的浓度最低值为1.05×102fg/μL,即qPCR检测灵敏度是常规PCR灵敏度的100倍(图6)。

图5 EF1引物常规PCR 灵敏度检测Fig.5 Sensitivity detection of ordinary PCR of primer EF1

图6 qPCR 灵敏度检测Fig.6 Sensitivity detection of qPCR
2.4qPCR标准曲线的建立将小麦条锈菌DNA的浓度进行10倍稀释,以不同倍数梯度稀释的gDNA为模板构建qPCR标准曲线。以循环数为Y轴,基因组DNA浓度的对数为X轴,绘制qPCR标准曲线后得出回归方程。小麦条锈菌标准曲线如图7所示,DNA拷贝数与CT值之间存在良好的线性关系:Y=-1.788 5x+27.681(R2=0.981 9,P<0.001)。

图7 小麦条锈菌标准曲线Fig.7 Standard curve of P.striiformis f. sp. tritici

图8 接种后小麦潜育期叶片菌源量Fig.8 Bacteria source quantity in wheat leaves during the incubation period after inoculation
2.5小麦潜育期叶片菌源量检测取接种后的小麦叶片进行qPCR检测,其菌源量如图8所示。接种后第1天条锈菌菌源量为0.01 ng,菌源量随着接种天数的增加不断增多;第9天叶片表面出现零星的夏孢子,停止取样,增长趋势呈指数型:Y=0.011e0.839x(R2=0.964 2),其中x是接种天数,Y是接种后的菌源量。接种后第8天检测到小麦叶片中的条锈菌菌源量达到约5.5 ng。
3 讨论与结论
通过qPCR技术建立小麦潜育期条锈菌菌源量检测体系可为预防小麦条锈病提供理论依据。Devadas等[24]与Wang等[25]利用遥感技术、红外光谱分析等技术检测到小麦条锈菌。潘娟娟等[19]通过应用特异性引物betaf/betar建立了qPCR检测体系,定量检测小麦叶片接种条锈菌后组织内的DNA变化,可以有效预测条锈菌在一定时间内的菌源量变化。
本试验基于小麦条锈菌生理小种CYR34和小麦条锈菌延伸因子EF1引物,利用qPCR技术快速准确检测小麦潜育期条锈菌菌源量,得出以下结论:(1)本研究建立了qPCR标准曲线,DNA拷贝数与CT值存在良好的线性关系,即Y=-1.788 5x+27.681(R2=0.981 9,P<0.001)。(2)本研究构建的qPCR检测体系的灵敏度是常规PCR的100倍,能够更早、更及时地检测病害。(3)在小麦叶片接种条锈菌后第1天应用qPCR检测体系检测到条锈菌,且第8天检测到小麦叶片中的条锈菌菌源量约为5.5 ng。

